miR-101-3p与膀胱癌细胞增殖、迁移、侵袭和顺铂敏感性的关系研究
崔伯阳,尺宝进,张赫岩,刘任功,刘 鹏,高 祥
(1.佳木斯大学,黑龙江 佳木斯150000;2.佳木斯大学附属第一医院 泌尿外科,黑龙江 佳木斯150000;3.齐齐哈尔市第一医院南院 泌尿外科,黑龙江 齐齐哈尔161000)
膀胱癌是起源于膀胱的恶性肿瘤,占我国泌尿生殖系肿瘤发病率的第一位,膀胱癌的病因复杂,目前对于膀胱癌发生发展机制的研究十分有限[1-2]。miR-101-3p能调节细胞的多种生物学活动,在肿瘤的生长、增殖、迁移、侵袭以及细胞凋亡进程中参与众多调控机制,具有抑癌的生物学作用[3]。基于此,本文着重讨论miR-101-3p同膀胱癌细胞增殖、迁移、侵袭和顺铂敏感性的关系,意在扩展膀胱癌的治疗思路。
1 材料与方法
1.1 材料
1.1.1研究对象 人膀胱癌细胞株(T24),购于上海弘顺生物科技有限公司。
1.1.2实验试剂 DMEM培养基,购于上海慧颖生物科技有限公司;胰蛋白酶(0.25%)、胎牛血清(10%)、CCK-8试剂,购于上海源叶生物科技有限公司;qPCR检测试剂,购于北京擎科生物科技有限公司;培养箱,购于上海新苗医疗器械有限公司;酶标仪购于山东恒美电子科技有限公司;显微镜购于郑州卓泰检测设备有限公司;Matrigel购于北京索莱宝科技有限公司;多聚甲醛溶液(4%),结晶紫染料,购于上海沪震实业有限公司;Transwell小室,购于北京优尼康生物科技有限公司;顺铂购于云南个旧生物药业有限公司;鼠抗人CDK4抗体、兔抗人Akt抗体、兔抗大鼠Bcl-2抗体,购于美国Bioworld公司。
1.2 方法
1.2.1细胞培养 将人膀胱癌细胞株置于细胞培养基内,培养基设置温度为37℃,含5%CO2,当细胞至80%融合度时,使用胰蛋白酶(0.25%)对细胞行消化处理(30s),添加含胎牛血清(10%)的细胞培养液,用于中和胰酶作用,同时依1:3传代。更换培养基时间为1天,取处于对数生长期的细胞用于进一步实验。
1.2.2细胞转染 将呈对数生长的细胞,采用胰酶配置为单细胞悬液,取适量溶液接种于培养皿上,并置于培养箱内过夜,处理完成的细胞分为对照组、上调miR-101-3p组、下调miR-101-3p组。对照组不做处理,其余两组转入超净操作台,加入Lipofectaminc2000,将其稀释至3%,混合均匀,室温孵育5 min,其中上、下调miR-101-3p组分别转染miR-101-3p mimics、miR-101-3p inhibitor,混合均匀,室温孵育5 min。将其转入培养皿内,放入培养箱,24 h后更换培养液,继续培养,进行后续分析实验。采用qRT-PCR实验表明上、下调miR-101-3p组miR-101-3p表达较对照组,分别升高、降低,则表明转染成功,本实验重复3次。
1.2.3CCK-8实验 将处理完成的膀胱癌细胞分别接种于96孔板(密度为2×103/ml),并设立3个复孔,同时额外设立阴性对照孔。首先饥饿细胞(即采用无血清培养基来培养)12 h,而后分别于处理后0 h、24 h、48 h、72 h对每个孔添加10 μl CCK-8(溶液,之后放进培养箱孵育(3 h),然后取出,使用酶标仪,调零阴性对照孔,参数设置完成后测量其在450 nm的吸光度,本实验重复3次。
1.2.4划痕实验 将膀胱癌细胞及转染组接种于6孔板,采用200 μl于6孔板背部划线进行垂直划痕,每孔间隔0.5~1 cm划一条,共划3条横线,使用无血清培养基继续对细胞进行培养,同时添加丝裂霉素抑制细胞分化。后将孔板放入培养箱(5%CO2、37℃)培养72 h,对划痕愈合情况使用显微镜进行观察,并依据分组,分别对培养24 h后的情况进行拍照,本实验重复3次。
1.2.5Transwell实验 利用Transwell实验来对细胞的侵袭能力进行评定。先于Transwell小室上方,铺盖一层Matrigel,之后在小室上方,每个孔内接种约20000个细胞,添加100μl无血清培养基,同时于下层添加800 μl胎牛血清培养基,培养24 h,随后使用PBS对上层细胞进行洗涤2次,下层细胞使用4%多聚甲醛溶液进行固定(20 min),随后,利用0.4%的结晶紫染料对细胞进行染色(10 min)。于显微镜下随机选择5个视野进行计数观察,本实验重复3次。
1.2.6顺铂敏感性检测 将膀胱癌细胞接种于孔板内,5×103/孔,置入培养基内,孵育过夜,通过0.5~1.5 μmol/L(梯度为0.1 μmol/L)顺铂培养基,培养48 h,后加入MTT试剂培养(4 h),吸取培养液,添加顺铂(100 μl),使用酶标仪测取570 nm波长隔空A值,绘制细胞活力-顺铂浓度曲线,依照曲线测定三组膀胱癌细胞的顺铂半数有效浓度,本实验重复3次。
1.2.7相关蛋白检测 使用Western-blot法检测CDK4、Akt、ICAM-1、MMP-9蛋白的表达量。取膀胱癌细胞,采用RIPA裂解液,从处理后的匀浆内,提取蛋白,用BCA法对蛋白浓度进行测定。通过SDS-PAGE电泳分离后,转至PVDF膜,并将其浸泡于脱脂牛奶中,室温密封4 h,加稀释后相关试剂,孵育过夜(4℃),加二抗,室温孵育60 min。ECL定影,凝胶成像系统拍照。β-actin为内参蛋白,目标蛋白同内参蛋白的比值,为蛋白的相对表达量,本实验重复3次。
1.3 统计学处理
2 结果
2.1 各组细胞增殖率对比
如表1所示,在第24、48、72 h时间段内,比较细胞增殖率情况,下调miR-101-3p组的细胞增殖率最高,上调miR-101-3p组的细胞增殖率低于对照组和下调miR-101-3p组,差异有统计学意义(P<0.05)。
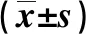
表1 各组细胞增殖率对比
2.2 各组细胞迁移数对比
如表2所示,在第24、48、72 h时间段内,比较细胞迁移数情况,对比对照组和下调miR-101-3p组,上调miR-101-3p组细胞迁移率数较少,对比对照组,下调miR-101-3p组细胞迁移个数较多,有统计学差异(P<0.05)。
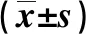
表2 各组细胞迁移数对比
2.3 各组细胞侵袭数对比
如表3所示,在第24、48、72 h时间段内,比较细胞侵袭数情况,3组相比,下调miR-101-3p组的细胞侵袭数多于上调组和对照组,且上调miR-101-3p组的细胞侵袭数最少,具有统计学差异(P<0.05)。
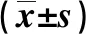
表3 各组细胞侵袭数对比
2.4 不同浓度顺铂对各组细胞的抑制情况
如表4所示,在不同浓度顺铂下,比较各细胞的抑制率,上调miR-101-3p组在不同顺铂浓度下对细胞的抑制率水平最高,下调组最低,有统计学差异(P<0.05)。
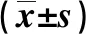
表4 不同浓度顺铂对各组细胞的抑制率
2.5 各组细胞相关蛋白相对表达量比较
如表5所示,3组对比,上调miR-101-3p组的CDK4、Akt、ICAM-1、MMP-9蛋白表达水平低于下调组和对照组,且下调miR-101-3p组的CDK4、Ak、ICAM-1、MMP-9t蛋白表达水平最高,差异有统计学意义(P<0.05)。
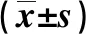
表5 各组细胞CDK4、Akt蛋白相对表达量比较
3 讨论
膀胱癌作为膀胱尿路上皮来源的恶性肿瘤,发病率和死亡率均较高[4]。目前已有研究表明,miR-101-3p在肝癌、胃癌、膀胱癌等多种肿瘤的发生起到了关键的作用[5]。
癌细胞具有无限制增生、接触抑制现象消失和远处转移的特点[6-8]。对于癌症是否出现恶化,可集中在对肿瘤细胞的增殖、迁移、侵袭研究中,上述能力越强,则表明癌症发展状况越严重[9]。本研究显示,上调miR-101-3p组癌细胞的增殖、迁移、侵袭能力均较其他两组低,充分说明上调miR-101-3p可能会减缓膀胱癌的进展。
临床化疗方案中,常使用顺铂作为主要药物,据临床经验,其治疗膀胱癌有效率可达50%~70%,但是随着化疗的大范围使用,癌细胞已出现获得性耐药[10-11]。相关研究表明[12],顺铂耐药情况的出现与细胞DNA损伤后的修复能力提升有关,且顺铂敏感度可通过体内相应指标含量的改变进行调节。本研究结果显示,上调miR-101-3p组顺铂敏感度高于对照组、及下调组,这一研究结果表明,上调miR-101-3p可能会提高膀胱癌细胞对顺铂的敏感度,提高相应患者的治疗效果。
Akt表达异常同众多恶性肿瘤的发生、发展及淋巴结的转移关系密切,CDK4、Akt表达的改变与调控细胞周期的过程出现失控具有相关性,高CDK4、Akt蛋白表达可使细胞周期失控,出现细胞增殖等的异常,导致其向癌细胞方向发展[13-15]。ICAM-1为细胞侵袭相关的代表蛋白,大部分侵袭性癌症ICAM-1mRNA均有较高水平表达[16-17]。MMP-9为与细胞迁移具有密切关系的蛋白,有实验尝试抑制转移灶MMP-9的表达,结果发现其增长缓慢[18]。相关研究表明[19-20],当肿瘤细胞呈现高迁移数、高侵袭数的状态时,其ICAM-1、MMP-9蛋白表达量均处于异常升高的水平。本研究在对3组研究对象进行观察时发现,上调miR-101-3p组癌细胞的CDK4、Akt、ICAM-1、MMP-9蛋白表达水平低于下调组和对照组,说明上调miR-101-3p可减少膀胱癌细胞的高迁移数、高侵袭数,对细胞周期可能起到正常的调控作用。
综上所述,上调miR-101-3p能够抑制CDK4、Akt、ICAM-1、MMP-9蛋白的表达,调控细胞周期,阻止膀胱癌细胞的增殖、迁移、侵袭,提高其顺铂敏感性,为对膀胱癌的治疗起到一定的理论依据。

