银鼓鱼肠道病原菌分离鉴定及药敏试验
陈攀,刘龙勋,沈华建,刘豫皖,林晨洁,黄海*
(1.海南热带海洋学院水产与生命学院,海南省热带海洋渔业资源保护与利用重点实验室,海南 三亚 572022;2.海南热带海洋学院海洋科学技术学院,海南 三亚 572022)
银鼓鱼(Selenotoca multifasciata),又名多纹钱蝶鱼,隶属于鲈形目(Perciformes)、金钱鱼科(Scatophagidae)、钱蝶鱼属(Selenotoca),广泛分布于印度尼西亚、泰国、大洋洲及我国东海南部至南海和北部湾的沿海、河口地区。其体表有多个黑色圆点,体色呈亮白色,兼具观赏和食用价值。该鱼具有生长速度快、广盐、广温、可进行混养和密养等特点,养殖前景广阔,深受养殖户欢迎[1]。但随着养殖规模的不断扩大、养殖密度的不断提高以及养殖环境的恶化等,银鼓鱼的病害日趋频发。车轮虫(Trichodina)病、淀粉卵甲藻(Amyloodinium ocellatum)病、吸虫(Trematoda)病、海豚链球菌(Streptococcus iniae)病等,均对其养殖造成了严重的危害[2-4]。
2021 年7 月,在海南陵水养殖基地发现银鼓鱼出现疑似肠道炎症,为了解银鼓鱼的致病原因,采集了患病银鼓鱼样本,对其进行了病原菌的分离、鉴定及药敏试验,旨在为该疾病的防控提供参考。
1 材料与方法
1.1 材料
试验鱼来自海南陵水德林诚信水产养殖有限公司。采集3 尾发病鱼,平均体质量为(75.1±2.2)g,平均体长为(21.1±0.47)cm。人工回归感染试验用鱼共约200 尾,平均体质量为(55.2±8.9)g,平均体长为(15.3±1.4)cm。带回实验室暂养于养殖桶中,水温为24~26 ℃,持续供氧,每天换1/3 水,暂养2 周。
1.2 试剂和仪器
AI6058027 桌面式超净台(苏净安泰有限公司)、DYY-8C 电泳仪(北京六一仪器厂)、革兰染色液(北京酷来搏科技有限公司)、生理生化鉴定盒(广东环凯生物科技有限公司)、牛肉浸膏(北京索莱宝科技有限公司)、胰蛋白胨(北京索莱宝科技有限公司)、琼脂粉(北京索莱宝科技有限公司)、药敏纸片(上海源叶生物科技有限公司)、TCBS 培养基(青岛高科技工业园淄博生物技术有限公司)、酵母浸膏(北京索莱宝科技有限公司)、比浊管(比克曼生物科技有限公司)、磁珠菌种保存管(青岛高科技工业园淄博生物技术有限公司)、细菌基因组提取试剂盒(天根生化科技有限公司)、琼脂糖(太阳马)。
1.3 病原菌的分离和纯化
将发病鱼置于超净工作台,先对鱼体消毒,然后用接种环在病灶组织中接菌,随后划线于普通肉汤营养固体培养基和TCBS 固体培养基上,倒置培养24 h 后,观察菌落生长情况;之后挑单菌落置于LB 液体培养基,振荡培养24 h 后,吸取菌液约0.2 mL 进行平板涂布;随后,挑取获得的单菌落,用固体培养基进行划线培养,并保存于4 ℃冰箱中,供长期试验;其余挑取部分单菌落,使用磁珠菌种保存管,置于-20 ℃冰箱保存。
1.4 人工回归感染试验
将菌株重新活化置于人工气候箱培养,然后从活化后的平板挑取单菌落,扩大培养24 h 后,将所获得的菌液于5 000 r/min 离心3 min 后,倒掉培养基,留下菌液沉淀,再倒入无菌生理盐水,重复以上步骤进行第2 次离心。离心结束后,参照麦氏比浊法进行调整,将菌液浓度调整为1.5×107、1.5×106、1.5×105、1.5×104、1.5×103cfu/mL。从养殖桶中随机选取180 尾健康活跃的银鼓鱼,放养于49 cm×34 cm×30 cm 水族箱中,每箱10 尾,持续供氧,暂养12 h。感染试验共分成6 组,5 组感染和1 组对照,每组3 个重复。采用腹腔注射法,感染组每尾注射0.2 mL 菌悬液,对照组每尾注射0.2 mL 灭菌生理盐水。在感染期间,每日换水1/3,正常投喂饵料,并进行日常残饵和粪便清理,随时观察记录银鼓鱼发病情况,将濒死的病鱼进行解剖,观察其病理症状并记录。随后用接种环挑取鱼体内明显病变组织,划线培养于TCBS,并与感染菌株进行对比,对菌株初步鉴定。
1.5 病原菌鉴定
1.5.1 形态学观察
将1.3 中分离纯化的菌株置于29 ℃人工气候箱恒温培养,待长成菌落后,观察记录菌落形态、干湿度、透明度、颜色、边缘、直径以及液体培养基生长情况等。随后在超净工作台上挑取些许菌落进行革兰染色镜检,观察病原菌染色结果及菌体形态特征。
1.5.2 病原菌生理生化试验
将固体培养基上的菌株接种进行液体培养,然后根据生化反应管操作说明书,分别接种至细菌生理生化微量鉴定管中进行测定,随后放置于29 ℃人工气候箱中,培养24 h,按照生化反应管说明书及《第八版伯杰氏细菌鉴定手册》比对结果,并记录。
1.5.3 16SrRNA 片段扩增及序列分析
在超净工作台中,从活化后的平板上挑取单菌落,采用细菌基因组提取试剂盒,提取菌株基因组DNA,提取步骤按照说明书。随后以细菌16S rRNA基因的通用引物作为引物(表1),以1 μL DNA 为模板进行扩增。PCR 扩增反应如下:95 ℃5 min;96 ℃20 s;62 ℃20 s;72 ℃30 s,循环35 次;72 ℃再延伸10 min。随后将3 μL PCR 产物进行1.0%的琼脂糖凝胶检测,观察条带大小。产物纯化根据磁珠纯化标准步骤,然后将纯化后的产物送至六合华大基因科技有限公司测序,将所获得序列结果于NCBI进行blast 比较,利用Mega7.0 采用邻接法进行菌株的系统发育树的构建。
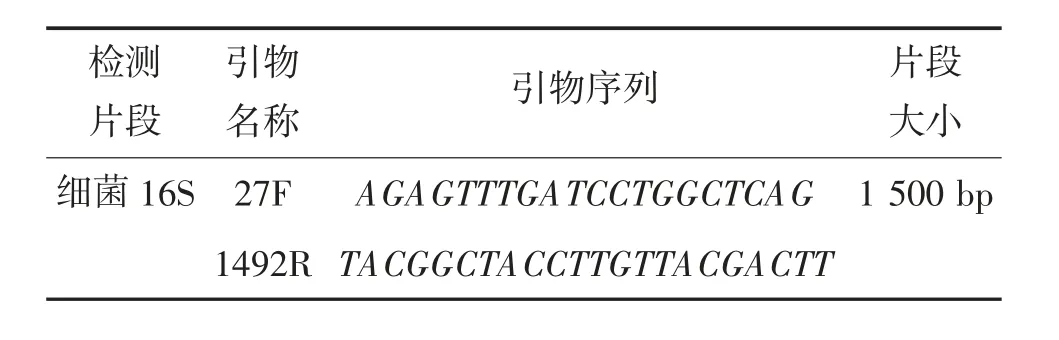
表1 引物信息
1.6 病原菌生长
用接种环挑取活化后的单菌落置于LB 液体培养基中,37 ℃、180 r/min 恒温摇床振荡培养。采用紫外分光光度计,测量菌液各时间段的吸光度值(OD),同时设置空白对照,最后以吸光度值作为纵坐标,生长时间作为横坐标,绘制菌株生长曲线。
1.7 药敏试验
将菌株进行划线培养12 h,然后再从平板中取单菌落进行液体培养,培养至菌株生长对数期,随后,取样制备菌悬液,用移液枪吸取0.2 mL 置于平板中央,用涂布器将菌液以逆时针方向进行涂布展开,然后将选择好的药敏片黏贴在含菌液的培养基表面,倒置培养1~2 d,随后取出测量其形成的抑菌圈的直径,并根据抑菌范围判断菌株对各类药物的敏感性。
2 结果与分析
2.1 病鱼症状
患病鱼体色正常,体表零星分布出血点,主要集中在背鳍、臀鳍和尾鳍基部。腹腔积水呈黄色;肝脏肿大,部分糜烂;胆囊颜色加深且肿胀;脾脏红肿;肾脏暗红;肠壁充血、弹性差,具有明显炎症且带有白便,见图1(a)(b)。
2.2 病原菌分离纯化及形态学观察
从病鱼肠道中分离出1 种优势病原菌株。划线培养1 d 后观察菌落,结果显示,菌落呈黄白色,卵圆、湿润、不透明,菌落边缘锯齿状,直径约1~2 mm,具一定运动性,在液体培养基上呈浑浊生长。菌体似杆状,革兰染色阴性,TCBS 显黄色,见图2(a)(b)(c)(d)。

图2 菌株形态观察
2.3 人工回归感染试验
试验组注射后,在1~2 d,个别鱼出现游泳迟钝、偶尔沉底、有明显溜边现象,与对照组相比,鱼体色明显暗淡;3~4 d,试验鱼变得更加不活跃,身体翻转、动作迟钝,喜趴于气石附近不动,进食缓慢,无食欲,个别鱼出现亢奋不安,不停探头;5~8 d,试验鱼大都出现沉底、翻边等异常行为,有些鱼出现胀腹现象,濒死的鱼除了鳍部有少量充血,其余无明显变化;9~11 d,出现上下游动频繁、上下打圈游动、食欲较差现象;12~14 d,多数鱼出现不游的情况,偶尔出现鱼体侧面与缸底平行游动倒翻沉底的现象,至14 d 累计死亡率为30.0%~66.6%。对照组无死亡。采用寇氏法计算出病原菌的半致死浓度为2.18×106cfu/mL,见图3。

图3 分离菌株感染银鼓鱼的试验结果
通过对每日濒死鱼体进行解剖观察,发现其症状基本一致,主要集中表现为鳃呈暗红色,肝、肾脏红肿,有部分糜烂,脾脏发肿,肠道扩张且肠道内有淡黄色液体,肠壁上略微充血,胆囊肿大且颜色加深,见图4(a)(b)(c)(d)。这些发病症状与原发病症基本一致。从病灶部位处接菌划线培养于TCBS,其与初次分离的菌株在形态和特征方面基本一致。

图4 回归感染银鼓鱼症状
2.4 病原菌的鉴定
2.4.1 生理生化试验
对照细菌生理生化试剂盒中的参考标准,分离菌对水杨素、蔗糖、精氨酸脱羧酶呈阳性且液化明胶,而对于蛋白胨水、赖氨酸脱羧酶和葡萄糖呈阴性(表2)。查阅《第八版伯杰氏细菌鉴定手册》,发现分离菌与肠弧菌属的生理生化特性类似,初步认定该菌株为肠弧菌属。

表2 生理生化的反应结果①
2.4.2 16SrRNA 片段扩增及序列分析
提取分离菌株DNA,进行电泳检测。结果显示,菌株条带清晰明亮,表明了试验过程中所提取菌株质量较好(图5)。对经PCR 扩增后的序列进行测序,得到基因序列片段长度为1 405 bp,随后采用NCBI网站中的blast 程序,对序列进行亲缘关系进行比对,结果表明,分离菌与黑肠弧菌(Enterovibrio nigricans)HG326496.1 的16S rRNA 基因序列相似性为99.0%,菌株序列同源性>99%的都是黑肠弧菌,序列号为JEMV1X63013。利用Mega7.0 软件扩增序列构建系统发育树,结果显示,分离菌与黑肠弧菌HG326496.1 聚类处于同一进化分支,并且与黑肠弧菌(MZ474660.1、MN785681.1、MN7856741.1、MN7856771.1)亲缘关系较近(图6),因此可确认此次分离菌株为黑肠弧菌。
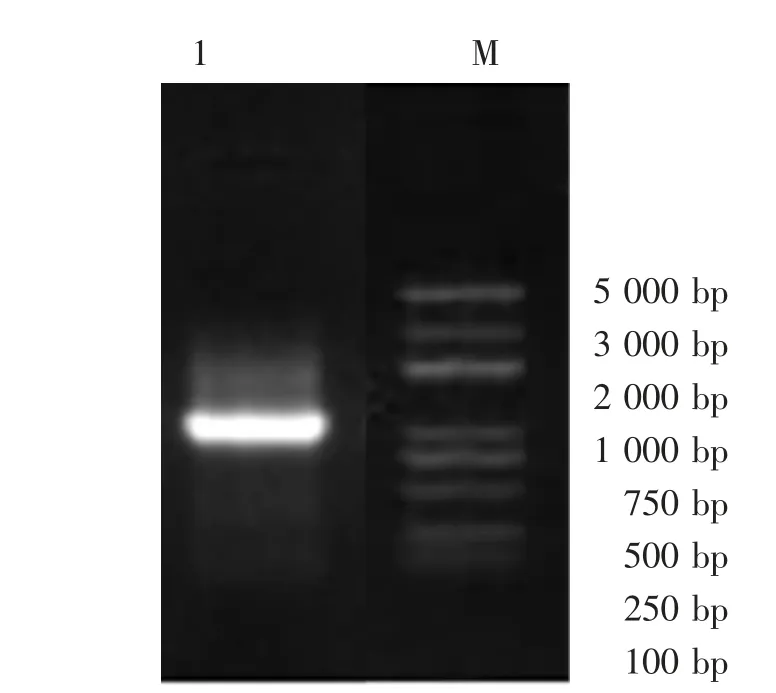
图5 分离菌琼脂糖电泳图
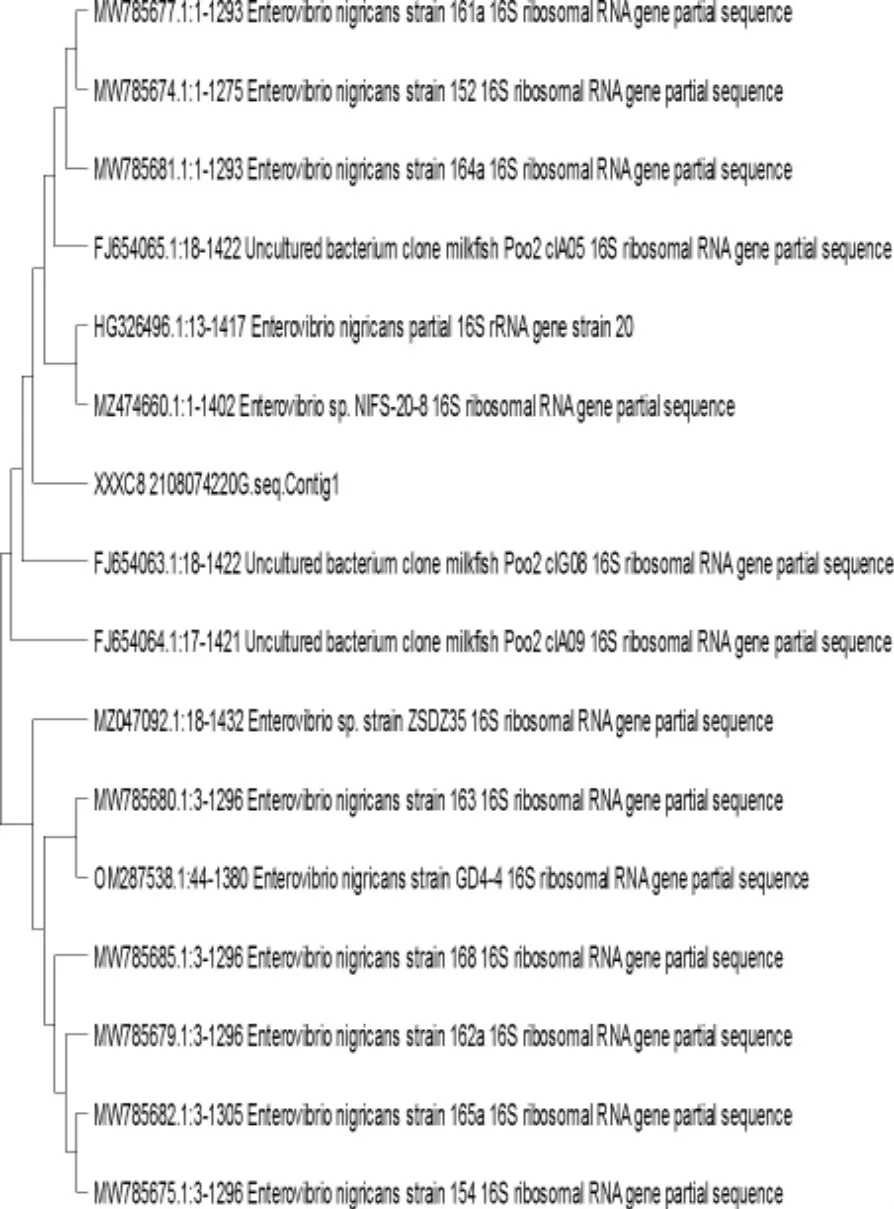
图6 分离菌株系统发育树
2.5 分离菌生长
将分离菌株连续培养9 h,结果表明,菌株自1 h就开始对数生长,2.5 h 对数期结束,并于3~6 h 内处于稳定期,6~9 h 内菌株则处在衰亡期(图7)。
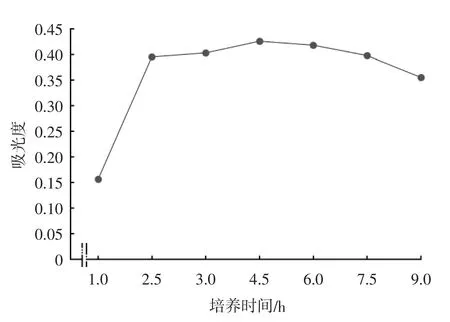
图7 分离菌生长曲线
2.6 药敏试验
21 种抗生素对分离病菌药敏试验结果表明(表3),菌珠对派啦西林、头孢派酮、强力霉素、链霉素、万古霉素、庆大霉素、氟苯尼考、环丙沙星、米诺环素、卡那霉素、四环素高度敏感,而对于诺氟沙星、羧苄西林、苯唑西林、复方新诺明、头孢克肟、头孢吡肟、氨苄西林、青霉素、头孢呋辛和甲氧苄氨嘧啶表现为不敏感。
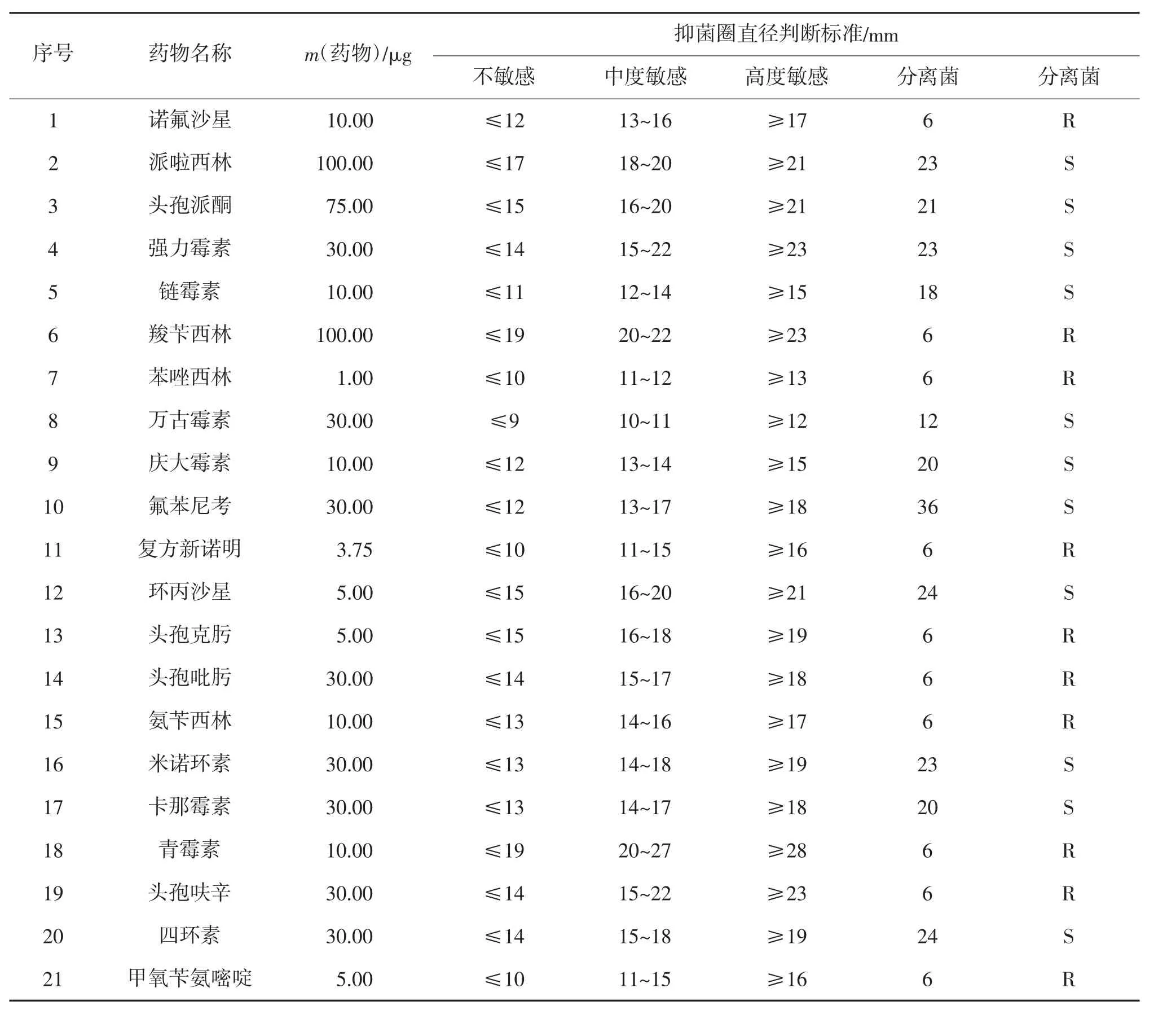
表3 菌株对药物的敏感性①
3 讨论
鱼类肠炎病是养殖过程中发生频率及死亡率均较高的疾病,伴有发病速度快、病程短等特点,时常对养殖企业造成较为严重的经济损失[5]。目前,较多文献报道显示,导致鱼类患肠炎病的致病病原主要为肠型点状气单胞菌、发光致病杆菌、霍乱弧菌、鲨鱼弧菌、哈维氏弧菌,副溶血弧菌、肠道黏孢子等[6-11]。主要表现为食欲不振或不进食、精神萎靡不振、活动异常、体质减弱。解剖后发现,各脏器均有不同程度出血和充血,肠管出血较为明显并伴有明显的炎症,后肠充满黄色黏液,肝脏出现明显病变。本试验从患病银鼓鱼肠道内分离出致病菌,通过形态学、生理生化和16SrRNA 序列分析方法,确认该菌为黑肠弧菌。人工回感试验表明,黑肠弧菌可导致健康银鼓鱼发病死亡。病理解剖发现,其感染症状与原发病症极为相似,表现为肝、肾脏红肿,肠壁上充血等症状,与刘德建等[12]和杨移斌[13]所描述的鱼体肠道炎症相似,确认该菌可导致鱼体肠道发炎。且其他的病理症状除了与原发病症相似外,也与陈翠珍等[14]从牙鲆肠道中分离出弧菌感染病症类似。至14 d 累积死亡率为30.0%~66.6%,初步判断其具有一定致病力。
黑肠弧菌(E. nigricans),隶属于肠弧菌属,目前关于该菌的国内外报道较少,主要集中在该菌分类地位[15-18]。Pascual 等[15]指出,黑肠弧菌在系统发育上与卡尔文弧菌属有亲缘关系。目前国内外未见黑肠弧菌在鱼类感染致病方面的报道。本试验首次发现黑肠弧菌可引发银鼓鱼肠炎病,初步确认其为导致原发病症的主要致病菌。
为筛选黑肠弧菌的敏感药物,方便相应养殖企业进行施药治疗。本试验采用K-B 纸片扩散法进行药敏试验,发现其对派啦西林、头孢派酮等11 种抗生素高度敏感,而对诺氟沙星等10 种抗生素不敏感。根据药物敏感程度和养殖企业的使用成本,建议使用氟苯尼考和派啦西林对银鼓鱼肠炎进行治疗。此外中草药在治疗肠炎病方面应用普遍且效果较好,如黄柏、黄芩、黄连、五倍子、槐花、穿心莲、大蒜素、松枝叶、菖蒲、板蓝根和大黄等[19-22]。中草药具有低毒、无害、不易产生耐药性等优点[23],并且施用方便,深受广大养殖户的喜爱。在治疗时,也需注意给药剂量。一般鱼类在出现肠道发炎时,其摄食量会大大降低,如果按照单位饵料质量计算用药量,极易导致内服药投喂量不足,造成治疗效果较差[24]。因而需根据发病鱼的体质量来确定给药量,再依据其日摄食量多少,制成药饵投喂。总之,在疾病的防治过程中,对于药物的选择和施用量方面,要依据“三效”(高效、速效、长效)、“三小”(毒性小、副作用小、剂量小)和“无三致“(无致畸、无致癌、无致突变)的原则,保证药物的使用绿色高效,促进健康养殖。

