可见光促进三组分合成C3-芳甲基取代的咪唑并[1,2-a]吡啶衍生物
张玉凤, 张 杰*,王天骏, 黄雨聪, 李玉秀, 刘 平.
(1. 江苏农牧科技职业学院 动物药学院,江苏 泰州 225300; 2. 南京师范大学 化学与材料科学学院,江苏 南京 210023)
在诸多存在于药物结构的氮杂环中,咪唑并[1,2-a]吡啶占据重要的地位,并引起有机化学家和药物化学家们极大的兴趣[1]。咪唑并[1,2-a]吡啶可在多个位点进行结构修饰或官能团化,尤其是在C3结构修饰或官能团化,包括C—C键、C—N键、C—P键、C—S键、C—Br键和C—Cl键的构建。此外,该类杂环为骨架的化合物表现出丰富多样的药理活性,如抗真菌、抗炎、抗病毒、退热和抗肿瘤活性等[2]。其中,C3-芳甲基取代的咪唑并[1,2-a]吡啶衍生物作为一个重要分支备受关注。该类化合物的合成主要有以下4种方法:(1)芳基乙炔/2-氨基吡啶衍生物/芳基甲醛三组分反应[3];(2)芳基乙炔/芳基甲酰甲酸/2-氨基吡啶衍生物/三组分反应[4];(3)芳基甲酰甲酸/2-氨基吡啶衍生物/芳基丙炔酸三组分反应[5];(4)3-碘-2-芳基咪唑并[1,2-a]吡啶与甲苯偶联分反应[6]。这4种合成方法虽能成功构建C3-芳甲基取代的咪唑并[1,2-a]吡啶衍生物,但也存在一些不足,如反应所需的催化剂需要预先制备,反应过程中需要惰性气体保护以及反应温度较高等。
近年来,可见光促进合成方向的蓬勃发展,给自由基化学插上了腾飞的翅膀[7-8]。其中自由基对氮杂不饱和键的加成串联环化反应已成为高效构建氮杂环化合物的主要途径之一[9],尤其是自由基对异氰和氰基的加成串联环化策略[10-12]。相比之下,自由基对亚胺加成串联环化的反应报道较少,主要原因是亚胺的C=N键相对惰性。2015年,PUNTA课题组[13]研究发现Lewis酸能够与亚胺发生配位作用提高C=N键的反应活性,从而有利于接受自由基的进攻。
基于此,本文利用2-氨基吡啶衍生物和芳基甲醛为原料,芳基溴乙炔为自由基前体,在可见光促进和Lewis酸协同作用下,无需额外添加光催化剂,通过自由基对亚胺的加成串联环化反应,在温和条件下合成C3-芳甲基取代的咪唑并[1,2-a]吡啶衍生物(4)。合成路线如图1所示。
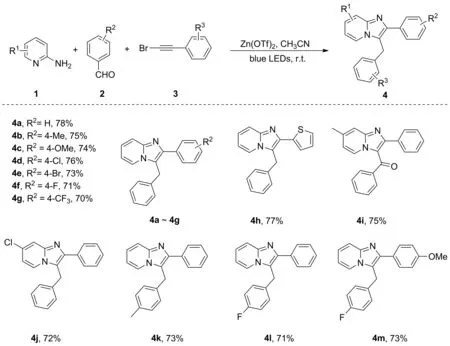
图1 三组分合成C3-芳甲基取代的咪唑并[1,2-a]吡啶衍生物
1 实验部分
1.1 仪器与试剂
ARX-400型核磁共振仪(CDCl3为溶剂,TMS为内标);Orbitrap Exploris 480型高分辨质谱仪;RCT-basic型磁力搅拌器;Kessil型蓝色LEDs灯;欧莱博(olabo)RD-1型熔点仪。
2-氨基吡啶衍生物、芳基甲醛,上海皓鸿生物医药科技有限公司;芳基溴乙炔,嘉兴市艾森化工有限公司;三氟甲磺酸锌,上海长根化学科技有限公司;碳酸钾,上海麦克林生化科技股份有限公司;乙腈,南京化学试剂股份有限公司。所用试剂均为市售分析纯。
1.2 C3-芳甲基取代的咪唑并[1,2-a]吡啶衍生物(4a~4m)的合成
将0.20 mmol 2-氨基吡啶1、 0.20 mmol芳基甲醛2、 0.40 mmol芳基溴乙炔3、 0.08 mmol Zn(OTf)2分别加入到25 mL反应瓶中,以5 mL乙腈为溶剂,在蓝色LED灯照射下,室温搅拌反应12 h。反应完毕后,向反应体系中加入10 mL饱和食盐水,用二氯甲烷(3×5 mL)萃取,合并有机相后,减压浓缩得到粗品,再经过柱层析分离纯化(洗脱剂:石油醚 ∶乙酸乙酯=4 ∶1,V∶V)得到目标产物4a~4m。
3-苯基-2-苯基-咪唑并[1,2-a]吡啶(4a): 白色固体,产率78%, m.p.118~120 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.79(d,J=6.9 Hz, 2H), 7.75~7.69(m, 2H), 7.45~7.41(m, 2H), 7.39~7.24(m, 5H), 7.23~7.10(m, 4H), 6.75(t,J=7.0 Hz, 1H), 4.51(s, 2H);13C NMR(CDCl3, 100 MHz)δ: 144.6, 143.6, 136.6, 134.0, 129.1, 128.7, 128.4, 128.3, 127.7, 127.0, 124.7, 123.5, 117.7, 117.4, 112.4, 29.9; HR-MS(ESI)m/z: Calcd for C20H17N2{[M+H]+}285.1387, found 285.1389。
3-苯基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶(4b): 白色固体,产率75%, m.p.160~162 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.73(d,J=9.1 Hz, 2H), 7.68(d,J=8.1 Hz, 5H), 7.29~7.25(m, 6H), 7.15~7.13(m,J=7.0 Hz, 3H), 6.70(t,J=6.3 Hz, 2H), 4.47(s, 2H), 2.38(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 144.7, 143.7, 137.6, 136.8, 131.2, 129.4, 129.0, 128.2, 127.7, 126.9, 124.5, 123.5, 117.5, 117.3, 112.4, 29.8, 21.3; HR-MS(ESI)m/z: Calcd for C21H19N2{[M+H]+}299.1543, found 299.1544。
3-苯基-2-(4-甲氧基苯基)咪唑并[1,2-a]吡啶(4c): 白色液体,产率74%;1H NMR(CDCl3, 400 MHz)δ: 7.76(d,J=8.2 Hz, 2H), 7.71~7.69(m, 2H), 7.31~7.26(m, 4H), 7.22~7.12(m, 4H), 6.96(d,J=7.7 Hz, 2H), 6.75~6.72(m, 1H), 4.68(s, 2H), 3.83(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 159.5, 144.5, 136.6, 129.5, 129.1, 127.0, 126.2, 123.4, 117.1, 114.2, 112.6, 55.3, 29.8; HR-MS(ESI)m/z: Calcd for C21H19N2O{[M+H]+}315.1492, found 315.1496。
3-苯基-2-(4-氯苯基)咪唑并[1,2-a]吡啶(4d): 白色固体,产率76%, m.p.145~147 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.72~7.67(m, 4H), 7.38(d,J=8.5 Hz, 2H), 7.30~7.24(m, 3H), 7.18~7.15(m, 1H), 7.11(d,J=6.9 Hz, 2H), 6.72~6.68(m, 1H), 4.44(s, 2H);13C NMR(CDCl3, 100 MHz)δ: 144.9, 142.9, 136.5, 133.7, 133.0, 129.4, 128.9, 127.7, 127.1, 124.5, 123.4, 117.9, 117.5, 112.4, 29.8; HR-MS(ESI)m/z: Calcd for C20H16ClN2{[M+H]+}319.0997, found 319.1001。
3-苯基-2-(4-溴苯基)咪唑并[1,2-a]吡啶(4e): 白色固体,产率73%, m.p.161~143 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.70~7.64(m, 4H), 7.54(d,J=8.5 Hz, 2H), 7.31~7.25(m, 3H), 7.20~7.17(m, 1H), 7.10(s,J=6.9 Hz, 2H), 6.73~6.69(m, 1H), 4.45(s, 2H);13C NMR(CDCl3, 100 MHz)δ: 145.0, 143.0, 136.5, 133.5, 131.8, 129.7, 129.1, 127.7, 127.1, 124.5, 123.4, 121.9, 117.9, 117.6, 112.4, 29.8; HR-MS(ESI)m/z: Calcd for C20H16BrN2{[M+H]+}363.0492, found 363.0495。
3-苯基-2-(4-氟苯基)咪唑并[1,2-a]吡啶(4f): 黄色固体,产率71%, m.p.123~125 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.74~7.65(m, 4H), 7.28~7.22(m, 3H), 7.16~7.14(m, 1H), 7.10~7.06(m, 4H), 6.68~6.65(m, 1H), 4.42(s, 2H);13C NMR(CDCl3, 100 MHz)δ: 163.8, 144.8, 143.1, 136.6, 130.6, 129.9, 129.8, 129.1, 127.6, 127.4, 124.5, 123.4, 117.4, 1015.7, 112.4, 29.7; HR-MS(ESI)m/z: Calcd for C20H16FN2{[M+H]+}303.1293, found 303.1294。
3-苯基-2-(4-三氟甲基苯基)咪唑并[1,2-a]吡啶(4g): 白色固体,产率72%,m.p.163~165 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.90(d,J=6.9 Hz, 1H), 7.67(d,J=9.1 Hz, 2H), 7.46~7.39(m, 1H), 7.34~7.32(m, 1H), 7.28(d,J=7.4 Hz, 3H), 7.14(d,J=7.1 Hz, 2H), 7.12~7.08(m, 2H), 6.73(d,J=0.9 Hz, 1H), 4.48(s, 2H);13C NMR(CDCl3, 100 MHz)δ: 145.0, 142.4, 136.3,129.2, 128.3, 127.6, 127.2, 125.6, 124.9, 123.5, 118.6, 117.7, 112.7, 29.8; HR-MS(ESI)m/z: Calcd for C21H16F3N2{[M+H]+}353.1261, found 353.1263。
3-苯基-2-(2-噻吩基)咪唑并[1,2-a]吡啶(4h): 黄色液体,产率77%;1H NMR(CDCl3, 400 MHz)δ: 7.72(d,J=6.9 Hz, 1H), 7.66(d,J=9.1 Hz, 2H), 7.41~7.40(m, 1H), 7.35~7.34(m, 1H), 7.27~7.23(m, 3H), 7.17~7.15(m, 3H), 7.10~7.09(m, 1H), 6.73~6.69(m, 1H), 4.54(s, 2H);13C NMR(CDCl3, 100 MHz)δ: 144.8, 138.5, 137.5, 136.4, 129.0, 127.8, 127.0, 125.6, 124.6, 124.6, 123.2, 117.4, 112.4, 29.9; HR-MS(ESI)m/z: Calcd for C18H15N2S{[M+H]+}291.0951, found 291.0952。
3-苯基-7-甲基-2-苯基咪唑并[1,2-a]吡啶(4i): 白色固体,产率75%, m.p.144~146 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.77~7.74(m, 2H), 7.55(d,J=6.5 Hz, 1H), 7.53~7.36(m, 4H), 7.34~7.20(m, 4H), 7.11(d,J=7.0 Hz, 2H), 6.53~6.51(m, 1H), 4.40(s, 2H), 2.35(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 145.1, 143.0, 136.8, 136.0, 133.9, 129.5, 129.1,128.7, 127.8, 127.7, 126.9, 122.7, 117.2, 115.6, 115.3, 29.7, 21.3; HR-MS(ESI)m/z: Calcd for C21H19N2{[M+H]+}299.1543, found 299.1545。
3-苯基-7-氯-2-苯基咪唑并[1,2-a]吡啶(4j): 黄色固体,产率72%, m.p.143~143 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.77(d,J=7.1 Hz, 2H), 7.65(d,J=1.6 Hz, 1H), 7.55(d,J=7.3 Hz, 1H), 7.41(t,J=7.4 Hz, 2H), 7.34(d,J=7.1 Hz, 1H), 7.39~7.25(m, 3H), 7.10(d,J=6.9 Hz, 2H ), 6.64(dd,J=7.3 Hz, 2.0 Hz, 1H), 4.43(s, 2H);13C NMR(CDCl3, 100 MHz)δ: 148.6, 145.1, 136.1, 133.9, 129.2, 128.1, 127.6, 127.2, 123.6, 118.9, 117.8, 112.8, 29.8; HR-MS(ESI)m/z: Calcd for C20H16ClN2{[M+H]+}319.0997, found 319.0999。
3-(4-甲基苯基)-2-苯基咪唑并[1,2-a]吡啶(4k): 白色固体,产率73%, m.p.124~126 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.80(d,J=7.2 Hz, 2H), 7.77~7.66(m, 2H), 7.43(t,J=7.5 Hz, 2H), 7.34(t,J=7.4 Hz, 1H), 7.19~7.14(m, 1H), 7.11(d,J=7.8 Hz, 2H), 7.02(d,J=7.9 Hz, 2H), 6.68(t,J=6.8 Hz, 1H), 4.44(s, 2H), 2.32(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 144.8, 143.9, 136.6, 134.4, 133.6, 129.8, 128.7, 128.3, 127.8, 127.6, 124.3, 123.5, 118.0, 117.5, 112.3, 29.5, 21.1; HR-MS(ESI)m/z: Calcd for C21H19N2{[M+H]+}299.1543, found 299.1547。
3-(4-氟苯基)-2-苯基咪唑并[1,2-a]吡啶(4l): 黄色液体,产率71%,1H NMR(CDCl3, 400 MHz)δ: 7.86~7.79(m, 2H), 7.72(d,J=6.8 Hz, 1H), 7.41(d,J=7.5 Hz, 7.34~7.29(m, 1H), 7.18~7.12(m, 1H), 7.10~7.05(m, 2H), 6.98(t,J=8.6 Hz, 2H), 6.76~6.73(m, 1H), 4.43(s, 2H);13C NMR(CDCl3, 100 MHz)δ: 160.6, 144.7, 143.6, 132.1, 129.1, 128.8, 127.9, 124.9, 123.3, 117.6, 117.4, 115.9, 112.7, 29.0; HR-MS(ESI)m/z: Calcd for C20H16FN2{[M+H]+}303.1293, found 303.1296。
3-(4-氟苯基)-2-(4-甲氧基苯基)-咪唑并[1,2-a]吡啶(4m): 黄色固体,产率73%,m.p.141~143 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.79~7.66(m, 4H), 7.32~7.25(m, 1H), 7.08(dd,J=8.3 Hz, 5.5 Hz, 2H), 6.99~6.95(m, 4H), 6.75(t,J=6.1 Hz, 1H), 4.43(s, 2H), 3.83(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 163.1, 160.6, 159.5, 144.7, 143.7, 132.3, 129.4, 129.2, 129.1, 126.5, 124.5, 117.3, 116.8, 116.1, 115.8, 114.2, 112.4, 55.3, 29.1; HR-MS(ESI)m/z: Calcd for C21H18FN2O{[M+H]+}333.1398, found 333.1401。
唑吡坦: 类黄色固体,产率68%, m.p.190~192 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.93(s, 1H), 7.52~7.49(m, 3H), 7.22(d,J=7.8 Hz, 2H), 7.03(dd,J=9.2 Hz, 1.7 Hz, 1H), 4.03(s, 2H), 2.92(s, 3H), 2.88(s, 3H), 2.36(s, 3H)2.30(s, 3H);13C NMR(CDCl3, 100 MHz)δ: 167.9, 143.5, 142.9, 137.3, 131.0, 129.1, 128.1, 127.6, 121.9, 121.8, 116.0, 113.5, 37.3, 35.6, 29.8, 21.0, 18.2; HR-MS(ESI)m/z: Calcd for C19H22N3O{[M+H]+}308.1758, found 308.1761。
2 结果与讨论
2.1 合成条件优化
以生成4a的反应为模板,对反应条件进行优化。最初,以TiCl4为路易斯酸、Ru(bpy)3Cl2为光促进剂、K2CO3为碱、蓝色LED灯为光源、乙腈为溶剂,室温反应,以54%的分离产率得到目标产物4a。为了进一步提高反应产率,按照单一变量原则,分别对各参数进行优化。首先对光促进剂的种类和用量进行考察,结果见表1。与Ru(bpy)3Cl2、 Ir(ppy)2(dtbbpy)PF6、 Ru(phen)3Cl2和Eosin Y相比,当fac-Ir(ppy)3为光促进剂时,反应效果较好。但是值得关注的是,反应在不加光促进剂时,也能顺利进行,并且此时4a的产率可达67%,推测苯基溴乙炔的碳溴键键能较弱,仅在光照条件下就能发生均裂。接着对路易斯酸的种类和用量进行考察,在本反应中,路易斯酸的作用是活化亚胺。结果表明,当选择Zn(OTf)2为路易斯酸时,对C=N键的活化效果最好,4a的产率最高,为74%,并且Zn(OTf)2的最适用量为0.08 mmol 。若反应体系中不加路易斯酸,则无目标产物生成。然后对碱进行考察,包括无机碱和有机碱。值得注意的是,反应在不加碱的情况下,也能顺利进行,且对应4a的产率为78%。通过对系列溶剂的考察,发现乙腈为反应的最适溶剂。在对反应底物的投料比进行优化时,发现当1a、2a和3a的物质的量之比为1∶1∶2时,反应效果最佳。在对反应气体氛围考察时发现,该反应在空气氛围下进行较为适合,惰性气体的保护并不利于4a产率的提高。最后对不同种类的光源进行考察,可以看出蓝光为该反应的最适光源,并且在没有光照时,反应不能发生。

表1 合成条件优化a
2.2 底物拓展
首先,对芳基甲醛衍生物2进行拓展,R2为给电子基(甲基2b和甲氧基2c)或吸电子基(卤素2d~2f和三氟甲基2g)时,反应都能顺利完成,目标产物产率为70%~78%。此外,2-噻吩甲醛2h也适用于反应。接着,对2-氨基吡啶衍生物1进行考察,当吡啶环4-位R1基团为甲基1i或者氯取代基1j时,对应目标产物4i和4j的产率分别为75%和72%。然后,对芳基溴乙炔3进行拓展,发现取代基R3电子效应的不同,并没有影响反应的正常进行。对于当R2和R3同时含有取代基时,反应也能很好地兼容,可以以73%的产率得到4m。
2.3 唑吡坦的一步合成应用
以5-甲基-2-氨基吡啶(1n)、 4-甲基苯甲醛(2b)、 3-溴-N,N-二甲基-2-丙炔酰胺(5)为原料,在最适反应条件下,可以一步合成治疗失眠症的药物分子唑吡坦,产率68%(图2)。
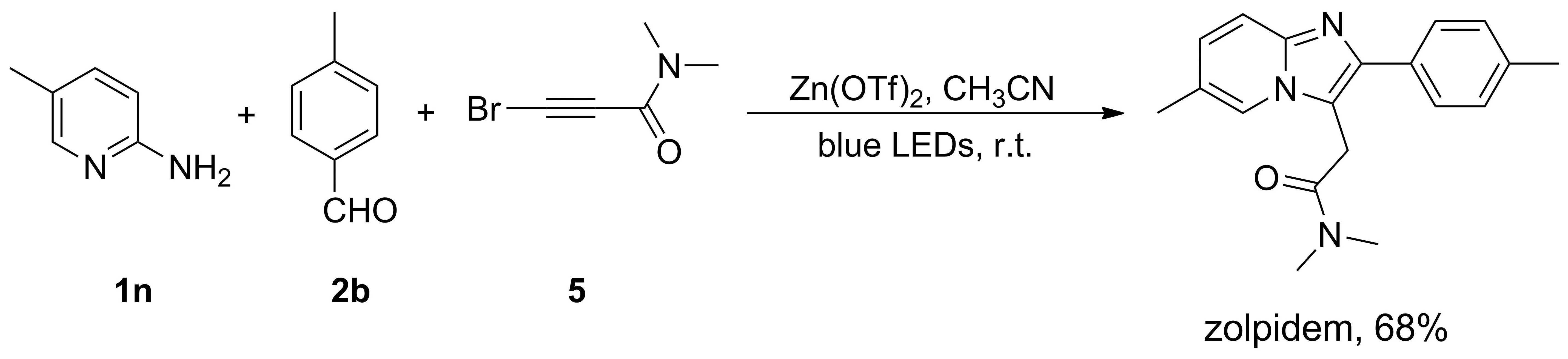
图2 一步合成唑吡坦
2.4 反应机理研究
在最适反应条件下,向反应体系中加入自由基捕获剂TEMPO或BHT,发现无产物4a生成,通过液质检测,捕获到了溴自由基与TEMPO的加合物。接着,将亚胺7与苯基溴乙炔3a在最适条件下反应,生成4a,产率71%,推测反应过程中可能涉及亚胺7的生成。最后,在不加路易斯酸的情况下,亚胺7与苯基溴乙炔在最适条件下反应不能生成4a,说明路易斯酸对亚胺的活化是本反应的关键(图3)。
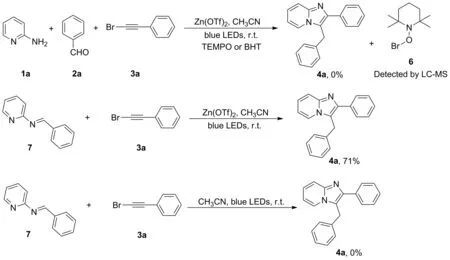
图3 反应机理探究实验
结合反应机理探究实验和相关文献报道[13-15],对该三组分串联反应的机理做了如图4所示的推测:2-氨基吡啶1a和苯甲醛2a缩合得到亚胺7,同时,苯基溴乙炔在可见光促进下生成炔基自由基8。接着,炔基自由基8进攻被路易斯酸活化的亚胺C=N键生成自由基中间体9,再经过异构化、环化生成自由基11,自由基11通过氢迁移得到更稳定的自由基中间体12,最后脱氢得到4a(图4)。
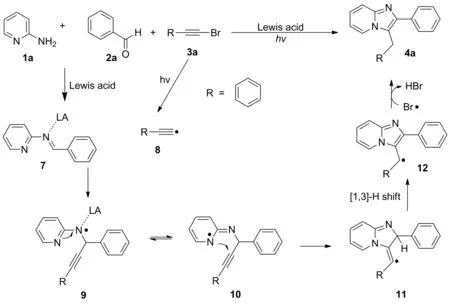
图4 反应的可能机理
本研究发展了一种自由基对亚胺C=N键的插入串联环化反应策略,无需额外添加光催化剂,在可见光促进与路易斯酸协同作用下,通过三组分串联反应高效合成了C3-芳甲基取代的咪唑并[1,2-a]吡啶衍生物。该方法为唑吡坦的快速合成提供了新途径。

