电流密度、温度、阴极孔隙率和N2溶解度因子对Li-N2电池放电性能的影响
赵旭东,薛红涛,2,汤富领,2
(1.兰州理工大学 材料科学与工程学院,甘肃 兰州 730050;2.兰州理工大学 有色金属先进加工与再利用国家重点实验室,甘肃 兰州 730050)
0 引言
碱金属离子电池是具有大容量高比能量的二次电池系统,其中金属-气体电池应用潜力巨大,备受研究者关注[1]。近年来,在Li-O2电池基础上,Li,Na,Al等金属-气体电池迅速发展[2],涌现出一批具有良好性能和应用前景的新型金属-气体电池,如Li-CO2[3],Na-CO2[4],Al-N2和Li-N2电池[5,6]。张新波提出的Li-N2电池是一种新型电池体系,它不仅可以作为储能装置,而且为电化学可逆固氮提供了新思路,不足之处是,虽然Li-N2电池的理论容量可高达2 311 mAh/g,但它的理论电压仅为0.54 V[6]。一方面,低电压限制了其在电化学储能方面的实际应用;另一方面,作为一种新型电化学固氮装置,其还需要进一步深入研究。若能提高电池理论电压,兼顾电化学储能和电化学固氮两方面的性能,该电池将有广阔的应用前景。该电池体系被提出后,很多研究者对其进行了一系列改良,如通过添加石墨烯或Mo2C纳米粒子来改进电极体系,以进行固氮并实现更好的稳定性和电化学过程[7,8]。尽管研究人员在Li-N2电池方面进行了大量研究工作,但对电池材料-性能相关性的全面研究很少,尤其是用数值模拟的方法探究放电过程及其影响因素等方面的研究。
数值模拟作为一种研究手段,它既可以和试验手段互为支撑,又可以在一定的数据基础之上做预测性研究,因此,其在各个领域应用广泛。有研究者通过数值模拟优化了光伏电池的风冷方案和太阳能光伏外遮阳结构等[9,10],均取得了理想的模拟结果。鉴于数值模拟有此优势,本文在Li-O2电池模拟基础上[11],以锂金属为负极,多孔碳电极为正极,电解液以参数(Li+扩散系数、Li+在电解质中的电导率、Li+迁移数、Li+在电解质中的初始浓度)形式定义,构建一维Li-N2电池模型。在此模型基础上,探究放电电流密度、温度、阴极孔隙率以及电解液中的N2溶解度因子等因素对电池电压和容量的影响。
1 模拟方法
1.1 电池模型建立
建立一维Li-N2电池模型,经网格剖分后的模型如图1所示。该电池体系以金属锂为负极,由于金属锂负极上的反应比多孔碳正极上的氧化还原反应速率更快,且电极过电势小,因此可忽略其电极厚度对电池反应的影响,将其在模型中简化为点;正极总长度为0.75 mm,隔膜长度为0.05 mm[12];网格设置采用用户控制网络,几何模型网格的最大单元为0.008 mm。
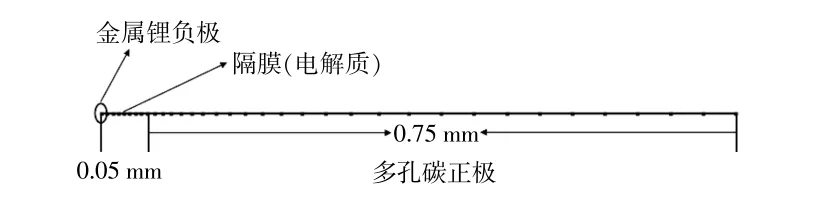
图1 Li-N2电池模拟模型示意图Fig.1 Schematic diagram of Li-N2 battery simulation model
1.2 模型中的一些假设
常温常压下的电极反应方程[6]为
计算中做3个假设:1)电池充放电过程无副反应,主要放电产物为Li3N;2)物质传递过程只考虑多孔介质传质,由于被输运的N2粒子为电中性的,则电迁移效果为零;3)空气中的其他气体成分不参与电极反应且不会使电极中毒。
1.3 电极动力学
在Li-N2电池系统中,由于阴极和阳极在电极反应过程中的作用不同,为此定义不同的反应动力学方程。阴极定义为多孔电极,主要是放电产物成核和生长的场所,同时也是电池的导电网络。在放电过程中,阴极发生式(2)所示的电极反应,电极反应动力学由加入浓度修饰项的Butler-Volmer方程描述。
式中:jc为局部转移电流密度,A/m2;i0为交换电流密度,A/m2;CR和CO分别为还原物和氧化物的表达式,其中包含方程(5)表示的电化学反应速率常数k(m/s);αa和αc为对称因子,取值均为0.5;n是参与反应的电子数;F为法拉第常数;ηc为阴极反应过电位,V;A为指前因子;Ea为反应活化能,kJ/mol;φs为固相电势,V;φl为液相电势,V;Δφs,film为Li3N形成后表面膜电阻增加引起的电压降,V;Eeq为平衡电位,V。
阳极定义为金属锂,电极反应动力学用Butler-Volmer方程描述。
式中:ja为电极交换电流密度,A/m2;ηa为阳极反应过电位,V。
1.4 物质输运
Li-N2电池模型中涉及的物质输运主要包括阴极侧N2转移和扩散、整个体系中的Li+输运以及反应产物Li3N的形成。Li+和N2的传输和转移可由式(8)进行描述。
式中:Jl为电极横截面上物种l的平均摩尔通量,mol/m2;Dl为经Bruggeman模型修正后的物种l的有效扩散系数,m2/s;cl为物种l的浓度,mol/L;il为电解质中的电流密度,A/m2;tl+为物种l的离子迁移数。
在电极反应过程中,N2以分子形式直接扩散到多孔电极中并参与反应,N2的离子迁移数为零。
电化学反应产物Li3N在多孔电极液相中的浓度变化可用方程(9)进行描述。
式中:εl和a分别为多孔电极孔隙率和活性比表面积;iloc为局部电流密度,A/m2;t为时间,s;cmax,Li3N为Li3N在电解液中的最大溶解度,mol/L;cLi3N为Li3N在电流溶液中的浓度,mol/L。
电化学反应过程中,当电极反应产物的积累量大于其在电解液中的最大溶解度时,电极反应产物(Li3N)将在多孔电极侧沉积成薄膜。在这个过程中,用式(10)来描述沉积在多孔电极中的固体Li3N的浓度cs,Li3N变化。
电化学反应过程中,电荷平衡、气体以及离子扩散系数的校正参考文献[11]。研究体系中固相和液相之间电荷守恒且为零,由式(11)进行描述。气体以及离子在多孔电极和隔膜中的有效传递属性通过Bruggeman模型进行修正[11]。
式中:il和i2分别为电极电流密度和电解质电流密度,A/m2;Dx(x=Li+,N2)为Li+或N2的扩散系数;ε为多孔电极的孔隙率;κ和σ分别为电解质和多孔电极的电导率,S/m。
1.5 仿真初始参数
需要说明的是,本研究采用控制变量法探讨各种因素对Li-N2电池放电电压和容量、阴极孔隙率和氮气分布曲线的影响,每个模拟项目中仅改变一个变量,其他变量保持初始值不变。电解质中的初始电位和初始Li+浓度分别为0 V和1 000 mol/m3,正极初始电势为室温下氮还原反应平衡电位(0.54 V);多孔电极属性在“锂离子电池”物理场接口下的子节点“多孔电极”中定义,根据锂空气电池仿真经验,初始孔隙率定义为0.73[13],电解液中的初始N2溶解度因子为0.40,环境温度为300 K,在标准大气压下大气中的N2占比约为78%,可得大气中的N2浓度约为35.3 mol/m3。
2 结果与讨论
2.1 放电电压和容量
电池最初为满充状态,在一定的放电截止电压(0.28 V)下,探究电池放电电流密度i、阴极孔隙率、温度T以及N2溶解度因子对Li-N2电池电压-容量的影响,结果如图2所示。从图2(a)可以看出:无论在何种放电电流密度下,电池电压在放电初期均会有明显的压降,之后在一定电压范围内保持不变,即存在平台电压;当放电电流密度从0.05 mA/cm2增加到0.50 mA/cm2时,放电电压和容量分别从0.54 V和2 012 mAh/g下降到了0.39 V和1 028 mAh/g;当放电电流密度为0.50 mA/cm2时,电池放电电压和容量均最小。这是因为电池放电过程会产生极化导致电压降,且放电电流密度增大时,内部化学反应无法彻底进行,导致电池放电不完全,故而电池电压和容量在大放电电流密度下均减小。电化学过程中的极化主要来自3个方面:活化极化、欧姆极化和浓差极化,放电的不同阶段通常由一种或多种极化支配。

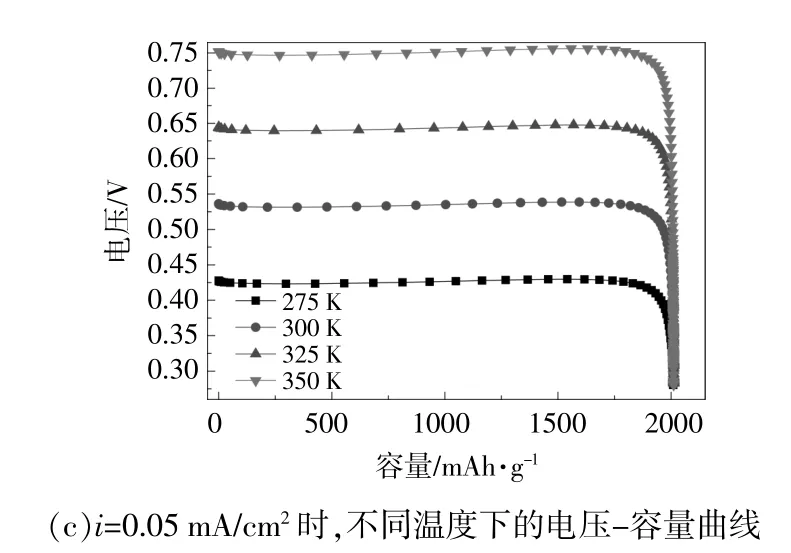
图2 温度对Li-N2电池电压-容量的影响曲线Fig.2 The temperature effects on the voltage-capacity of Li-N2 battery
从图2(b)可以看出,当温度为350 K,放电电流密度从0.50 mA/cm2降至0.05 mA/cm2时,电池电压从0.59 V上升到0.75 V。从图2(c)可以看出,当电池以0.05 mA/cm2的电流密度放电时,初始温度为275 K,温度变化步长为25 K时,随着温度的升高,电池电压从0.42 V上升到0.75 V,但容量基本保持不变。这主要是因为,当温度升高时,电池内部更容易发生活化反应,导致正极化学当量数增加[14],导致阴极平衡电位E(模型中设定金属Li的平衡电位为0,此时阴极平衡电位即为电池电动势)增加;随着温度的升高,离子扩散速率增加,导致阻抗降低。式(15)可以解释为什么在这种情况下电池电压会随着温度的升高而升高。
式中:E为电池电动势,V;R为电池中所有阻抗的等效电阻,Ω;I为通过电池的电流,A。
在275,300,325,350 K的温度下模拟计算得到的平衡电位分别为0.43,0.54,0.64,0.75 V。其中,当温度T=300 K时,化学反应方程式(6Li+N2=2Li3N)的吉布斯自由能变化为ΔG=-308.3 kJ/mol[15]。根据式(16),此时E为0.54 V,数值与模拟计算结果一致。
阴极孔隙率和N2溶解因子对Li-N2电池电压-容量影响如图3所示。
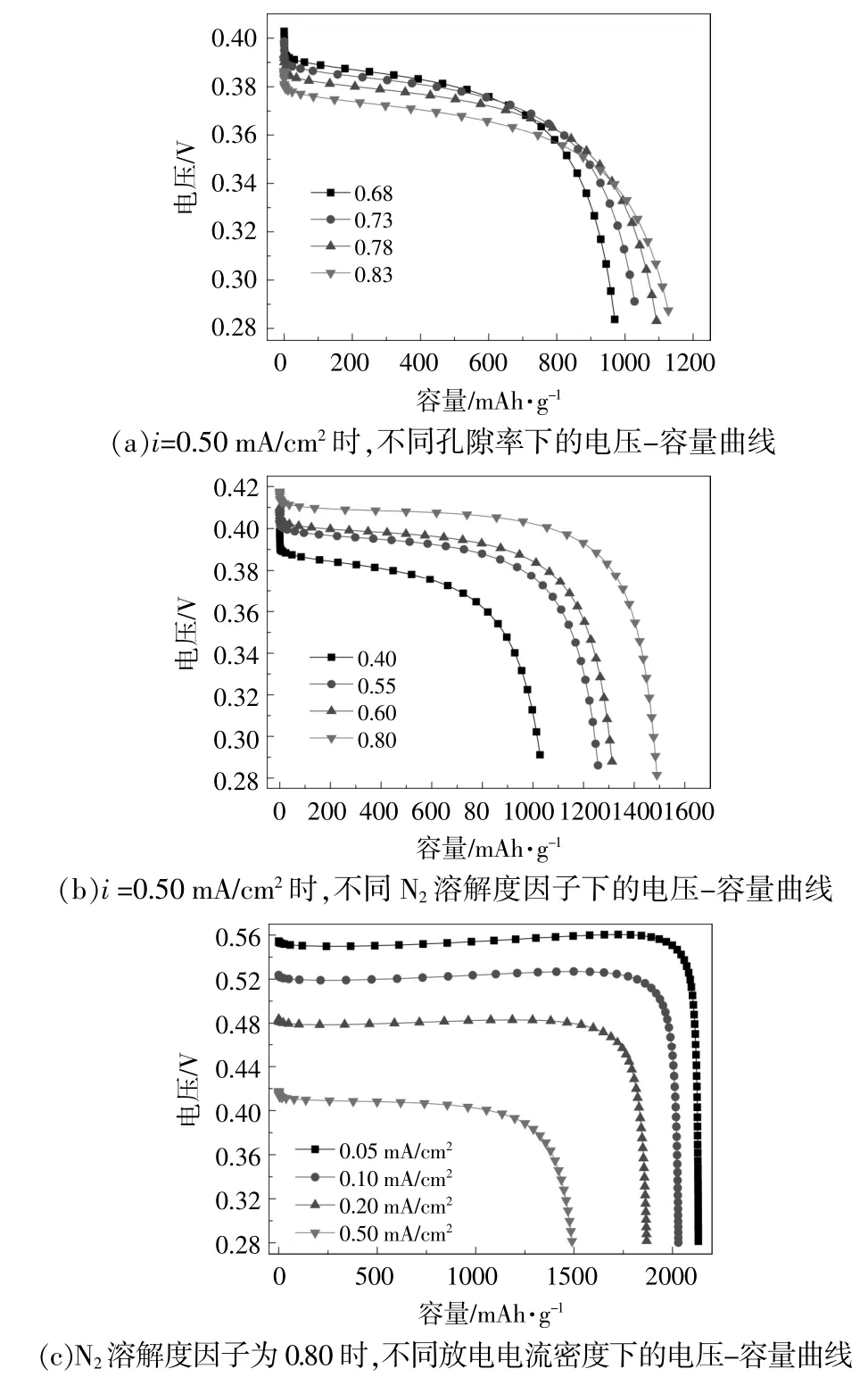
图3 阴极孔隙率、N2溶解因子和放电电流密度对Li-N2电池电压-容量的影响Fig.3 Cathode porosity and N2 solubility effects on the voltage-capacity of Li-N2 battery
从图3(a)可以看出,随着电极初始孔隙率从0.68增加到0.83时,平台电压略有下降,但电池容量略有增加,这和文献[16]得出的结果相一致。这是因为多孔电极的孔隙是电极反应产物沉积和生长的地方,当初始孔隙率增加时,正极容纳放电产物的能力增强,从而导致电池容量增加。由式(17)可知,电池理论容量C与参与反应电子数n和产物摩尔质量M有关。在金属-气体电池中,M通常被归一化为多孔电极质量。在该电池体系中,当孔隙率增加时,多孔电极的重量减小,即式(17)中M值减小,这也可以解释为什么孔隙率增加时电池容量增加。
从图3(b)可以看出,当N2溶解度因子增加(溶解在电解液中参与电极反应的活性物质增加)时,电池容量和电压也相应增加。通过比较图2(a)和图3(c)可以发现,在其他条件不变的情况下仅改变N2溶解度因子时,N2溶解因子增加对电池容量影响较显著(约增加60%),但电压只是略有调整。
2.2 阴极电极孔隙率
阴极孔隙率变化会影响电池容量和放电电压,其根本原因是孔隙率的变化会影响放电产物的沉积和生长位点,且孔隙率变化也会影响多孔隙电极的质量。放电电流密度、温度和N2溶解度因子对阴极孔隙率的影响如图4所示。
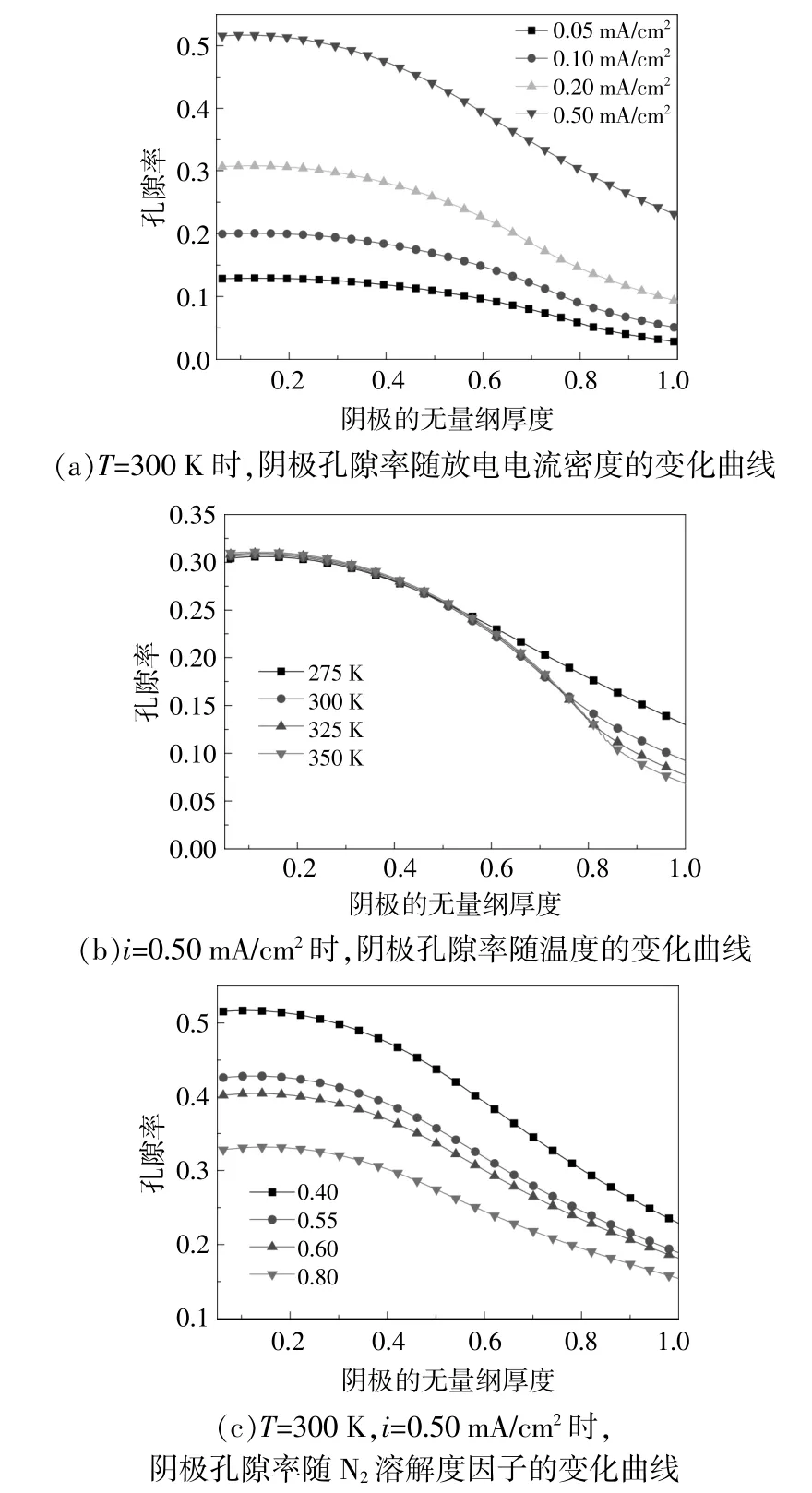
图4 放电电流密度、温度以及N2溶解度因子影响下的阴极孔隙率变化曲线Fig.4 Variation curves of cathode porosity under the influence of discharge current density,temperature and N2 solubility factor
由于Li+在体系中的扩散速率远大于N2(DLi+=2.11×10-9m2/s>DN2=7×10-10m2/s)[13],所以放电产物Li3N在多孔电极供氮侧沉积;电池放电完成后,多孔电极孔隙率在隔膜侧分布较高,供氮侧刚好出现相反的分布趋势。从图4(a)可以看出,随着放电电流密度的增大,阴极孔隙率随之增大,这是因为电池在低放电电流密度下比在高放电电流密度下放电更完全,由此产生更多放电产物且整体孔隙率更低。结合图2(c)和图4(b)可以看出,温度对电池容量的影响很小,温度升高除了使电池的电化学反应平衡向生成物一侧移动,导致电极供氮侧孔隙率降低外,电池的总体孔隙率分布在不同温度下基本不变。从图4(c)可以看出,当电解液中的N2溶解度因子较高时,电池放电完成后的电极整体孔隙率较低,这意味着产生更多的放电产物,类似于电池在高N2溶解度因子下具有更高的容量。电池放电过程中孔隙率的变化主要是放电产物Li3N在多孔电极上的沉积引起的,因此,当电池放电完成时,放电产物Li3N的体积分数分布与孔隙率分布相反。
2.3 阴极N2浓度分布
当电池在一定的截止电压下完全放电时,电池中会残留未参加电极反应的N2,结合阴极孔隙率分布变化,分析该状态下的N2浓度分布,有助于了解电极反应过程中放电产物的沉积位置。放电电流密度、温度、阴极孔隙率以及N2溶解度因子对阴极中N2浓度分布的影响如图5所示。


图5 放电电流密度、温度、阴极孔隙率以及N2溶解度因子对阴极中N2浓度分布的影响Fig.5 The influence of discharge current density,temperature,cathode porosity and N2 solubility factor on the distribution of N2 concentration in the cathode
从图5可以看出:不同影响因素下的N2浓度的变化趋势基本一致;当以较小的电流密度放电时,阴极会产生更多的放电产物,并且它们主要沉积在阴极供氮侧,阻塞氮扩散通道,导致阴极隔膜侧的N2浓度为零;电极内部的N2浓度随着温度的升高依次减小,这与之前讨论的化学反应平衡随温度升高而移动有关;当孔隙率以0.05为步长从0.68增加到0.83时,此时有更多的位点和孔隙沉积放电产物并容纳N2,导致体系中的N2浓度增加;N2溶解度因子仅通过影响电解液中的可溶性N2含量来影响放电产物输出,当N2溶解度因子不同时,只有供氮侧电极末端的N2浓度发生显着变化,且N2浓度随着N2溶解度因子的增加而增加。
3 结论
本文基于一维电池模型,讨论了放电电流密度、温度、孔隙率和N2溶解度因子对Li-N2电池放电性能的影响。仿真结果表明:Li-N2电池在较低放电电流密度、较高温度、较高孔隙率以及较高N2溶解度因子下具有更好的性能;N2浓度分布主要受阴极孔隙率影响,受N2溶解度因子影响较小;放电产物Li3N的沉积是引起孔隙率变化的主要原因,电池放电完成后,多孔电极孔隙率越低,意味着孔隙被更多Li3N占据,电池容量越大。

