UPF1影响AU565乳腺癌细胞侵袭、迁移及EMT的机制*
张金标 苏轲 徐睿 张天伟 陈冰
(淄博一四八医院,山东 淄博 255300)
信使核糖核酸(Messenger ribonucleic acid,mRNA)是携带遗传信息,并能指导蛋白质合成的一类单链RNA分子。近年随着对其研究的深入,发现无义介导的mRNA降解(Nonsense-mediated mRNA decay,NMD)参与细胞周期和细胞凋亡调节,可能是参与多种恶性肿瘤发生和发展[1]。上游移码蛋白1(Up-frameshift 1,UPF1)是NMD途径的关键因子,其过度磷酸化可促进mRNA降解[2]。既往相关报道显示,UPF1在乳腺癌组织中表达明显上调[3],但其对乳腺癌细胞生物行为以及机制尚未完全明确。上皮间充质转化(Epithelial mesenchymal transformation,EMT)在肿瘤发生和发展过程中有重要作用,是肿瘤转移的标志性事件[4]。近年研究发现,阻断NMD途径有可能成为肿瘤治疗的新方向[5]。乳腺癌作为威胁女性健康的主要恶性肿瘤,虽早期筛查和治疗手段均不断提高,但死亡率居高不下[6-7]。故进一步明确乳腺癌发病机制,寻求更多的治疗靶点,对患者预后以及疾病认识具有重要价值。
1 材料与方法
1.1 材料
1.1.1 细胞与组织 人乳腺癌细胞系AU565及人乳腺上皮细胞系DU4475购于上海宾穗生物科技有限公司。新鲜冰冻乳腺癌组织及正常乳腺组织取自2021年9月—2022年3月本院乳腺切除术43例乳腺癌患者,术前均未进行化疗、放疗或免疫治疗等。
1.1.2 主要试剂与仪器 DMEM培养基:北京伊塔生物科技有限公司。山羊抗人UPF1多克隆抗体:美国Santa Cruz。生物素化山羊抗兔IgG:上海延慕实业有限公司。DAB显色试剂盒(20×)、BCA试剂盒:上海吉至生化科技有限公司。FITC荧光标记二抗:北京博尔西科技有限公司。缓冲甘油封片剂:上海抚生实业有限公司。siRNA-UPF1:上海吉玛制药技术有限公司。E-candherin抗体、Vimentin抗体、N-cadherin抗体:美国Abcam公司。Akt抗体、辣根过氧化物酶标记羊抗兔IgG、逆转录试剂盒:上海优宁维生物科技股份有限公司。mTOR抗体、β-actin抗体、GAPDH抗体:上海爱必信生物科技有限公司。p-Akt抗体:上海晅科生物科技有限公司。p-mTOR抗体:上海翌圣生物科技股份有限公司。2.5%结晶紫甲醇溶液:北京百奥莱博科技有限公司。超敏ECL化学发光试剂盒:上海源叶生物科技有限公司。无菌PBS溶液、10×TBST溶液(pH8.0):上海恒斐生物科技有限公司。激光共聚焦扫描显微镜:德国Leica公司。凝胶成像系统:美国Bio-Rad公司。StepOnePlus实时PCR系统:美国ABI公司。倒置显微镜:日本Olympus公司。
1.2 方法
1.2.1 免疫组织化学法(Immunohistochemical,IHC) 新鲜冰冻乳腺癌组织及正常乳腺组织制备石蜡块后,置于二甲苯中脱蜡,梯度乙醇脱水,PBS溶液清洗3次;H2O2溶液室温灭活内源性酶10 min,蒸馏水冲洗3次;切片浸入0.01M枸橼酸盐缓冲液中,高压反应3 min,冷却20 min后,PBS溶液冲洗3次;滴加5%BSA封闭液,室温反应10 min,甩去多余液体;滴加山羊抗人UPF1多克隆抗体(1∶300),4 ℃过夜;PBS溶液冲洗3次,每次2 min;滴加生物素化山羊抗兔IgG(1∶100),37 ℃反应30 min;PBS溶液冲洗3次,每次2 min;滴加辣根过氧化物酶标记链酶卵白素(1∶100),37 ℃水浴30 min;PBS溶液冲洗3次,每次2 min;DAB法显色,镜下观察显色情况;蒸馏水冲洗,苏木素复染2 min,依次经梯度脱水、透明、封片后,镜下观察,细胞质和/或核上出现棕黄色、棕褐色颗粒即为阳性细胞;Image Pro Plus 6.0软件分析图像,每个切片随机选取3个不重叠视野,测量阳性细胞吸光度(Absorbance,A)值。
1.2.2 激光共聚焦扫描显微镜法(Laser scanning confocal microscope,LSCM) 制备细胞玻片,放入盖片染缸中,PBS溶液振荡洗涤5 min;吹干,滴加山羊抗人UPF1多克隆抗体,湿盒内4 ℃过夜孵育;PBS溶液冲洗3次,每次5 min;吹干,滴加FITC荧光标记二抗,37 ℃反应40 min;PBS溶液冲洗3次,每次3 min;缓冲甘油封片剂封片,激光共聚焦扫描显微镜观察荧光信号,Confocal Sofware软件分析图像,黄绿色荧光为阳性信号,随机选取10个视野,视野中随机再选取10个阳性表达细胞,计算单个阳性表达细胞中10个光学切片荧光强度(Fluorescence intensity,FI)。
1.2.3 UPF1小干扰RNA(Small interfering RNA,siRNA)转染 胰酶消化细胞,将AU565细胞分为siRNA-NC组和siRNA-UPF1组;转染前1 d将细胞接种于96孔板内,37 ℃、5%CO2培养箱内培养24 h;细胞融合度达80%时,参照Lipofectamine 2000转染试剂盒说明书操作,分别将siRNA-NC和siRNA-UPF1转染至细胞,置于不含血清及抗生素的DMEM高糖培养基内培养4~6 h;弃去旧培养基,更换含血清及抗生素的DMEM高糖培养基,继续培养24~48 h,收集细胞悬液进行后续实验。
1.2.4 蛋白免疫印迹实验(Western boltting,WB) 转染48h后,RIPA法裂解细胞提取总蛋白,BCA法测定蛋白浓度;取蛋白样品进行8%SDS-PAGE电泳,电泳结束后湿法转至PVDF膜;5%脱脂牛奶封闭2h,TBST溶液冲洗2次;滴加UPF1抗体、E-钙黏蛋白(E-candherin)抗体、波形蛋白(Vimentin)抗体、N-钙黏蛋白(N-cadherin)抗体、磷酸化-Akt(p-Akt)抗体、p-mTOR抗体、Akt抗体、mTOR抗体(1∶1000),4 ℃过夜孵育;TBST溶液冲洗3次,加入辣根过氧化物酶标记羊抗兔IgG(1∶5000),室温反应1 h;TBST溶液冲洗3次,ECL剂发光,凝胶成像系统显影,Image J软件分析蛋白条带。
1.2.5 实时荧光定量聚合酶链式反应(Real-time quantitative polymerase chain reaction,qPCR) 转染48 h后,TRIzol法提取细胞总RNA,测定浓度和纯度;以总RNA为模板将其逆转录为cDNA,StepOnePlus实时PCR系统进行PCR反应,每个样本设置3个复孔,以2-△△Ct法计算转录物相对表达水平。UPF1上游引物5'-CTGCAACGGACGTGGAAATAC-3',下游引物5'-ACAGCCGCAGTTGTAGCAC-3',GAPDH上游引物5'-ATATGTCAAAAATTGGAAT-3',下游引物5'-GCTTAATCTTTAGATTGAAT-3'。
1.2.6 Transwell侵袭实验 提前1 d配置基质胶,均匀铺于Transwell下室;转染48 h后,取对数生长期细胞,胰酶消化,置于无血清的DMEM完全培养基中,调整细胞浓度为2×105个/mL;取200 μL细胞悬液于Transwell上室,700 μL的DMEM完全培养基置于Transwell下室;24 h后,结晶紫甲醇溶液染色10 min,PBS溶液洗去残留液体;倒置显微镜下(20×)观察拍照,每个室取上、下、左、右、中5个视野计数侵入细胞数,取平均值,计算细胞穿膜率。
1.2.7 划痕实验 转染48 h后,取对数生长期细胞;Marker笔在6孔板底部画横线,每孔至少穿过5条线,每条线间距保持一致;以4×105个/孔接种于6孔板内,待细胞铺满板底后,使用20 μL枪头垂直于板底直线划痕,PBS溶液冲洗细胞2~3次,去除划下细胞;更换新的无血清培养基,37 ℃、5%CO2培养箱内培养;分别于0 h、24 h取出细胞,显微镜下观察并拍照,随机选取5个视野,20×下计数迁移细胞数,取平均值,计算细胞迁移率。
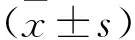
2 结果
2.1 乳腺癌组织及正常乳腺组织中UPF1表达 UPF1在乳腺癌组织细胞浆和细胞核内均有表达,呈棕黄色或棕褐色颗粒。乳腺癌组织UPF1的A值显著高于正常乳腺组织(P<0.05),见图1。
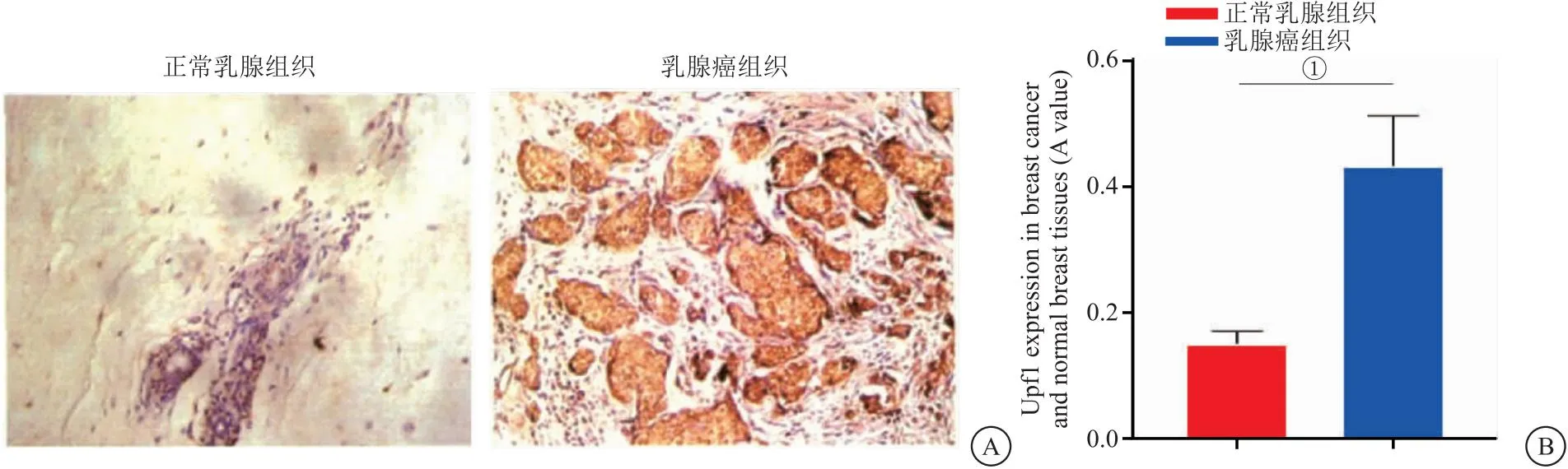
图1 乳腺癌组织及正常乳腺组织中UPF1表达(IHC,×200)
2.2 AU565细胞及DU4475细胞中UPF1表达 UPF1在AU565细胞中有绿色荧光表达。AU565细胞UPF1荧光强度显著大于DU4475细胞,差异有统计学意义(P<0.05),见图2。
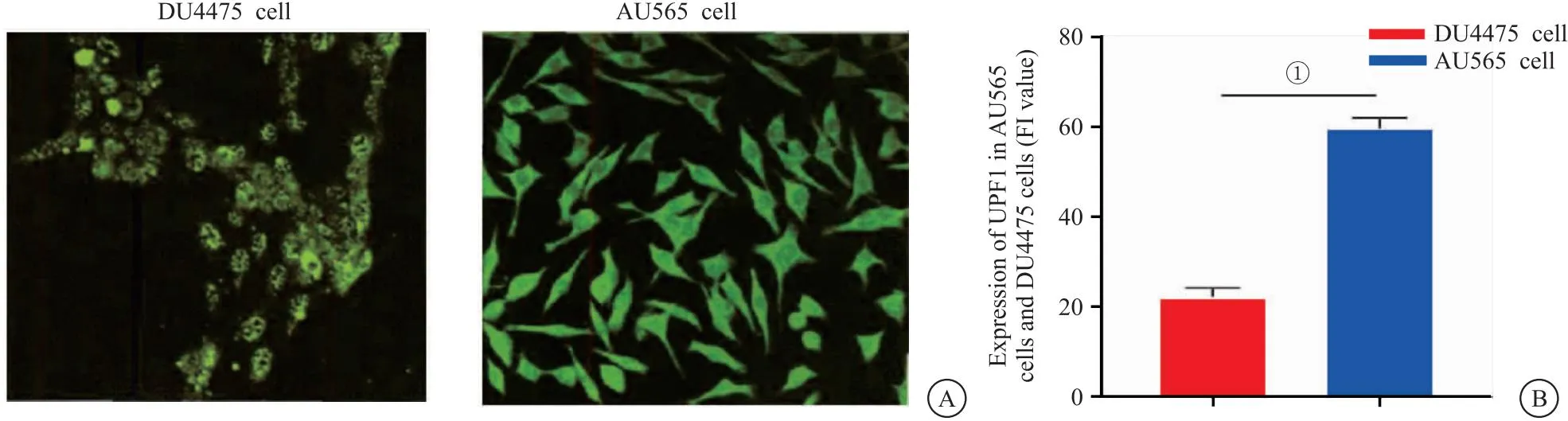
图2 AU565细胞及DU4475细胞中UPF1表达(LSCM,×200)
2.3 转染siRNA-UPF1对AU565细胞中UPF1表达的影响 与siRNA-NC组比较,转染siRNA-UPF1后AU565细胞中UPF1蛋白及mRNA表达水平均显著降低(P<0.05),见图3。
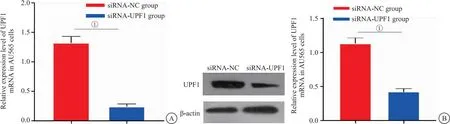
图3 转染siRNA-UPF1对AU565细胞中UPF1表达的影响
2.4 沉默UPF1对AU565细胞侵袭能力的影响 Transwell侵袭实验结果显示,与siRNA-NC组比较,转染siRNA-UPF1后AU565细胞穿膜率显著增加(P<0.05),见图4。
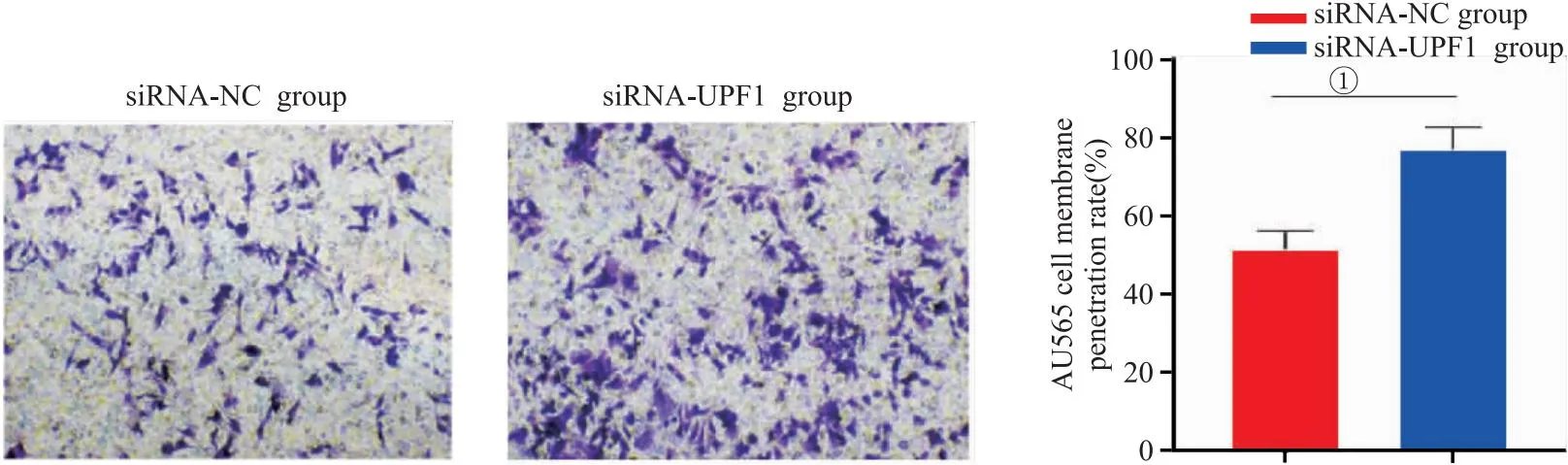
图4 沉默UPF1对AU565细胞侵袭能力的影响(200×)
2.5 沉默UPF1对AU565细胞迁移能力的影响 划痕实验结果显示,与siRNA-NC组比较,转染siRNA-UPF1后AU565细胞迁移率显著增加(P<0.05),见图5。
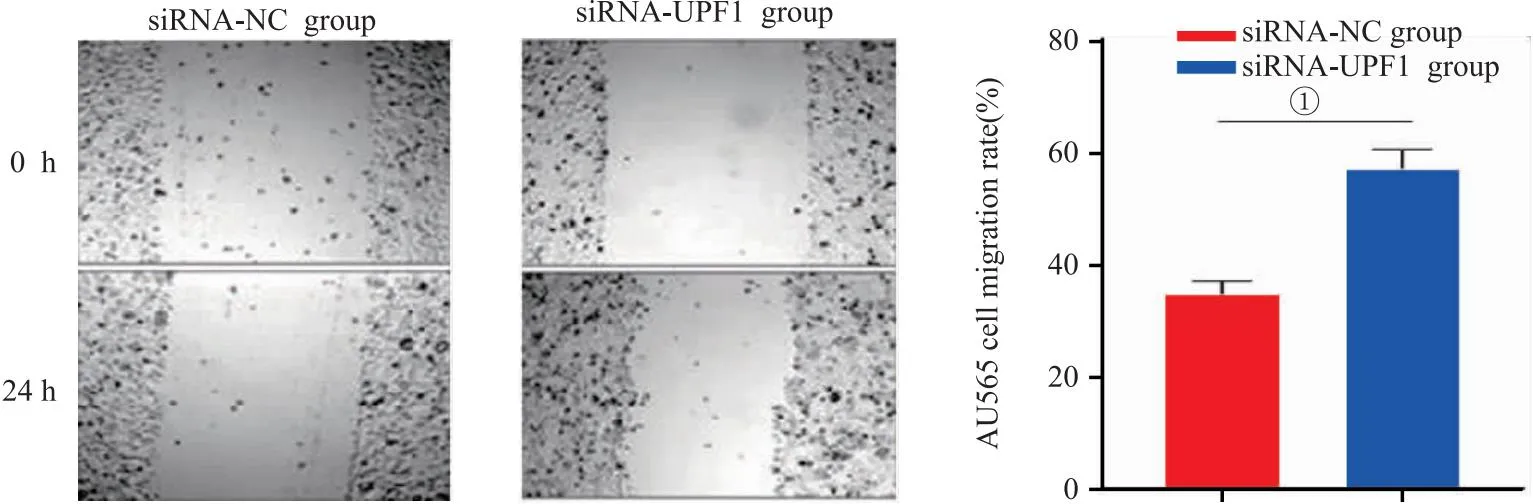
图5 沉默UPF1对AU565细胞迁移能力的影响(200×)
2.6 沉默UPF1对AU565细胞EMT相关蛋白表达的影响 转染siRNA-UPF1后AU565细胞E-candherin蛋白表达水平显著降低,Vimentin和N-cadherin蛋白表达水平显著升高(P<0.05),见图6。
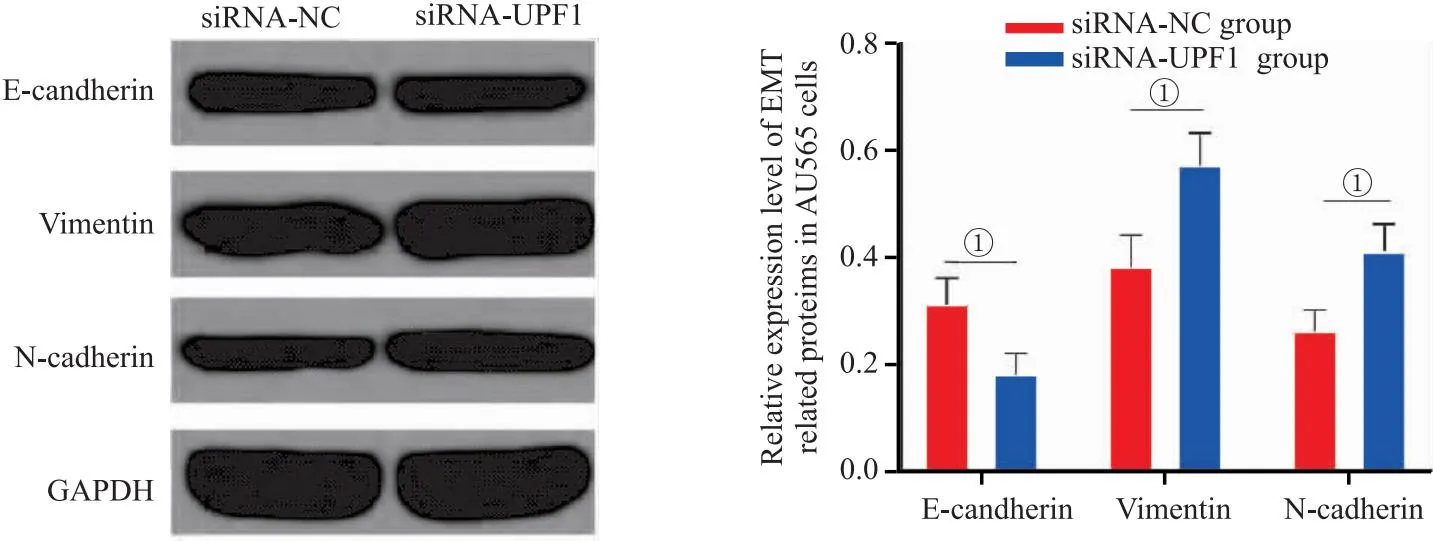
图6 沉默UPF1对AU565细胞EMT相关蛋白表达的影响
2.7 沉默UPF1对AU565细胞Akt/mTOR信号通路的影响 与siRNA-NC组比较,转染siRNA-UPF1后AU565细胞p-Akt和p-mTOR水平显著升高(P<0.05),见图7。
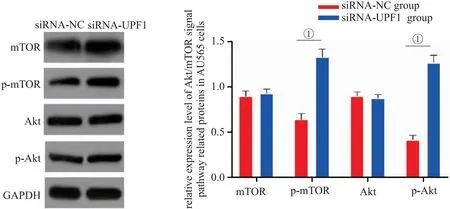
图7 沉默UPF1对AU565细胞Akt/mTOR信号通路的影响
3 讨论
2022年最新全国癌症统计数据显示,乳腺癌发病率和死亡率均位居女性恶性肿瘤首位[8-9]。转录因子的异常改变是恶性肿瘤最常见驱动因素之一[10],其中mRNA的加工在调控基因表达中具有重要作用[11]。NMD是真核细胞中监控RNA的重要机制,可通过识别并降解提前终止密码子,进而减少因截短型蛋白累积对细胞产生的毒性作用[12]。有研究认为,抑制NMD可能会使肿瘤中某些基因表达上调,而上调的基因或许在肿瘤发生发展中发挥抑癌基因作用[13]。报道显示,某些基因突变导致的翻译提前终止可引发NMD,NMD途径降解了提前终止翻译密码子的mRNA,产生的有害蛋白质可参与乳腺癌的发生[14]。
UPF1具有RNA依赖性解旋酶和ATP酶活性的蛋白分子,是目前研究较为清楚的NMD途径依赖因子,同时还参与了多种RNA结合蛋白介导的功能多样mRNA衰变途径[15-16]。研究发现,UPF1在不同恶性肿瘤中可分别发挥抑癌作用和促癌作用[17-18]。本研究分别采用IHC法和LSCM法检测乳腺癌组织及乳腺癌细胞中UPF1表达发现,UPF1在乳腺癌组织及乳腺癌AU565细胞中表达均显著上调,符合以往研究结果[19],提示乳腺癌中NMD过程可能被激活。由此本研究考虑沉默UPF1是否可对乳腺癌发生发展起到抑癌作用。采用siRNA技术构建UPF1低表达的重组AU565细胞,结果发现,转染siRNA-UPF1后AU565细胞中UPF1蛋白及mRNA表达水平均显著降低,提示UPF1低表达模型构建成功。观察沉默UPF1对AU565细胞侵袭和迁移能力影响发现,转染siRNA-UPF1后AU565细胞穿膜率和细胞迁移率均显著增加,UPF1表达的下调并没有起到预想的抑癌作用,那么上调UPF1表达发挥抑癌还是促癌作用,还待后续实验进一步探讨。EMT是肿瘤细胞发生侵袭和转移的关键步骤[20],其中E-candherin为抑EMT的分子标志物,Vimentin和N-cadherin为促EMT的分子标志物。本研究结果显示,转染siRNA-UPF1后AU565细胞E-candherin蛋白表达水平显著降低,Vimentin和N-cadherin蛋白表达水平显著升高,提示沉默UPF1可诱导EMT发生,表明UPF1可能通过调控EMT参与乳腺癌的侵袭和转移,与以往研究报道基本一致[21]。蛋白激酶B/哺乳动物雷帕霉素靶蛋白(Protein kinase B/ mammalian target of rapamycin,Akt/mTOR)通路是肿瘤发生发展中传统途径之一。研究显示,Akt/mTOR通路的异常激活,促进了乳腺癌细胞的侵袭与迁移,并诱导EMT的发生,参与肿瘤发生发展[22]。本研究结果显示,转染siRNA-UPF1后AU565细胞p-Akt和p-mTOR水平显著升高,提示下调UPF1后,促进了Akt和mTOR磷酸化,激活Akt/mTOR通路,进而参与乳腺癌细胞侵袭、迁移以及EMT过程,抑制NMD途径,符合以往研究结果[23-24]。
4 结论
UPF1在乳腺癌中表达上调,但沉默UPF1可能通过激活Akt/mTOR通路传导,促进乳腺癌细胞AU565的侵袭和迁移,并诱导EMT发生。后续还将探讨上调UPF1表达对乳腺癌细胞增殖、侵袭等生物学行为的影响,以进一步探讨UPF1在乳腺癌发生发展中的作用,为临床治疗提供更多可靠依据。

