急性脑梗死后吉兰-巴雷综合征一例报告并文献复习
李明月,周颖
吉兰-巴雷综合征(GBS)是一类免疫介导的急性炎性周围神经病,目前病因并不十分明确,且存在多种诱发因素,近年来不断有GBS 谱系疾病或GBS 变异型的报道,这同时也加大了诊断的难度,容易误诊。临床上,急性脑梗死后的GBS 较罕见,国内外较少有相关病例报道,急性脑梗死的临床症状易将GBS 的临床症状掩盖及混淆,导致误诊。有文献表明急性脑梗死可能是GBS 的触发因素[1],现已证实,一些炎症细胞因子介导的途径同时存在于GBS 和缺血性脑血管病中[2],但此类文献报道较少。本文回顾了1例急性脑梗死患者在急性期继发GBS 的诊治经过,并结合国内外文献复习,探讨急性脑梗死继发GBS 的相关特点,以及脑血管病与神经免疫疾病之间的关系,提高临床医生对此病的认知,从而避免误诊及漏诊。
1 资料与方法
1.1 病例资料 患者,男,49 岁,因“突发左侧肢体乏力6 d”入院。患者6 d 前(2017-04-27)无明显诱因突发左侧肢体乏力,偶有饮水呛咳,伴有头晕、恶心,无呕吐,无明显视物旋转、吞咽困难、意识障碍,无畏寒发热、咽痛、鼻塞、流涕、咳嗽、咳痰、腹痛、腹泻等。既往:体健,否认高血压、糖尿病、冠心病等病史。近期无疫苗接种史。长期吸烟、饮酒史。入院体查:BP 130/85 mmHg(1 mmHg=0.133 kPa),神清语利,左侧鼻唇沟变浅,口角稍偏右,伸舌偏左,余颅神经(-),左上肢肌力3 级,左下肢肌力4+级,左侧肢体肌张力低,右侧肢体肌力、肌张力大致正常,左侧指鼻试验、跟膝胫试验欠稳准,双侧肢体深浅感觉大致正常,左侧肢体腱反射(+),左侧巴氏征(+)。NIHSS 评分3 分。辅助检查:糖化血红蛋白9.0%,空腹血糖7.78 mmol/L;红细胞沉降率21 mm/h;输血前检查均(-);三酰甘油4.62 mmol/L,提示高脂血症;风湿三项示:C 反应蛋白21.7 mg/L;二便常规、肝肾功能大致正常。胸片示:心肺未见明显异常。头颅MRI+DWI 示:考虑右侧基底节、放射冠区急性脑梗死。心脏彩超示:二尖瓣轻度返流;颈部血管彩超示:双侧颈动脉内膜增厚。腹部彩超示:前列腺增大并钙化。根据患者的临床表现及磁共振检查结果,诊断急性脑梗死(右侧基底节、放射冠区)。予以抗血小板聚集、调脂保护血管内膜、调控血糖、清除氧自由基、改善循环等对症支持治疗。入院后第15 天(发病后21 d)患者症状好转出院,当时可下床行走,左上肢肌力4 级,左下肢肌力5-级。2017-05-18 患者出现右侧肢体麻木乏力,自觉左侧肢体肌力较前稍差,再次入院治疗。第2 次入院体查:BP 150/96 mmHg;神清语利,左侧鼻唇沟变浅,口角稍向右歪,伸舌偏左,余颅神经(-),右侧肢体肌力4-级,左上肢肌力3 级,左下肢肌力4 级,右侧肌张力减低,左侧肌张力正常,右侧腱反射减弱,左侧腱反射正常,右侧Babinski 征可疑阳性,左侧Babinski 征阳性。NIHSS 评分6 分。因不除外再发脑梗死及进展性脑梗死,予以复查头颅DWI,头颅DWI 显示除上次右侧基底节区新发脑梗死,未见新发脑梗死病灶。此时患者四肢肌力下降,考虑四肢软瘫,结合患者近期食欲差、有受凉史,不除外低钾周期性麻痹、GBS、颈髓型颈椎病。脑脊液压力正常;脑脊液常规:潘氏实验弱阳性(±),颜色无色,性状浑浊,无凝块,细胞计数50×106/L,白细胞数20×106/L;脑脊液生化:腺苷脱氨酶0.2 U/L,葡萄糖5.24 mmol/L,乳酸脱氢酶34.7 U/L,氯125.3 mmol/L,蛋白质236.1 mg/dL;脑脊液细菌涂片结果未找到G-菌或G+菌;墨汁染色(-);抗酸染色(-);复查血常规、CRP、甲功五项、心肌酶、血沉、电解质、肾功能等指标均正常。颈椎+胸椎MRI 示:考虑颈椎退行性改变,C4~5、C5~6椎间盘轻度膨出;胸椎MR平扫未见明显异常。肌电图示双胫神经运动传导波幅减低,速度正常范围;双腓总神经运动传导末端潜伏期延长、速度减慢,右侧波幅减低;右正中神经传导末端潜伏期偏长、波幅减低,速度正常范围;双腓肠神经、右正中神经、尺神经感觉传导正常;右正中神经F 波未引出;双胫神经F 波潜伏期延长,出现率正常;胫神经H 反射潜伏期延长;结论示上下肢周围神经损害(运动纤维轴索损害为重)。根据上述检查结果,排除低钾周期性麻痹、颈髓型颈椎病、糖尿病性周围神经病变、低钾周期性麻痹,诊断为GBS,予以“免疫球蛋白”冲击治疗,治疗过程中症状仍有加重,四肢肌力2 级,免疫球蛋白冲击治疗结束后,辅以康复治疗,患者症状逐渐缓解,出院时查体示双上肢肌力3 级,双下肢肌力4 级,出院后定期随访复查。
1.2 方法 检索中国知网、万方、维普中文数据库及Pubmed、Embase 报道的急性脑梗死合并GBS的病例(检索时间为1998-01-01 至2023-09-30),得到急性脑梗死后合并GBS 的相关病例报道,总结分析急性脑梗死与GBS 相继发生的可能机制。采用描述性统计学方法对临床表现、辅助检查、诊治情况进行分析。
2 结果
目前文献报道过许多表现为急性脑梗死临床症状的GBS,但是急性脑梗死后合并GBS 的相关文献报道较少。
国内外文献报道中共检索出急性脑梗死后合并GBS 的相关病例9 例[1,3-10],见表1。临床表现:女性4 例(44.44%),男性5 例(55.56%),起病年龄为44~74 岁,平均年龄58 岁。症状:9 例患者均先有脑梗死的症状,磁共振或CT 提示急性脑梗死,随后或同时合并四肢周围神经损害;其中2 例有上呼吸道感染病史;1 例合并2 型糖尿病。治疗方案:9 例报告中2 例接受了重组人组织型纤溶酶原激活物(rt-PA)溶栓,其中1 例接受了手术治疗,5 例接受免疫球蛋白冲击治疗,3 例接受了激素治疗,3 例接受了血浆置换治疗。预后情况:7 例经治疗后好转,1 例无改善,1 例死亡。
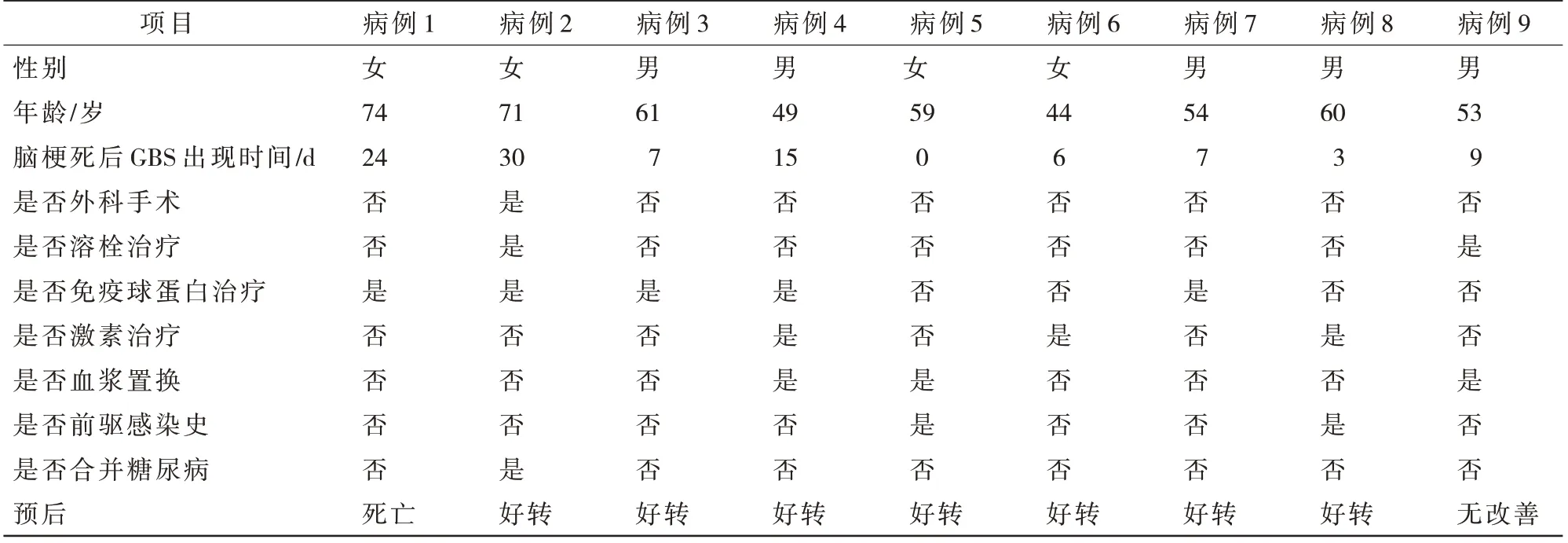
表1 文献报道的9 例急性脑梗死继发GBS 患者的临床资料
3 讨论
GBS 是一类免疫介导的急性炎性周围神经病,临床特征为急性起病,临床症状多在2 周左右达到高峰,表现为多发神经根及周围神经损害,常有脑脊液蛋白-细胞分离现象,多呈单时相自限性病程,静脉注射免疫球蛋白和血浆置换治疗有效。GBS 在任何年龄、季节均可发病。GBS 分为经典型与变异型,经典型GBS 主要表现为对称性肢体瘫痪,腱反射受损,伴或不伴感觉异常,变异型GBS 表现差异大,通常只出现局部症状,因此又称为局限性GBS,目前认识尚不足[11]。对于GBS 的病因,目前尚未完全明确,主要认为与感染、免疫接种、手术、外伤、移植、淋巴瘤和自身免疫性疾病如系统性红斑狼疮等有关[12]。
本例患者在急性脑梗死治疗期间未使用神经节苷酯药物,脑梗死后21 d 出现症状加重,表现为四肢运动及感觉障碍,在完善一系列检查后排除了低钾周期性麻痹、卒中进展或再发脑梗死、卒中后焦虑抑郁、颈髓型颈椎病等,通过脑脊液蛋白-细胞分离现象及肌电图示上下肢周围神经损害(运动纤维轴索损害为重)明确GBS 诊断。急性脑梗死与GBS 都是神经系统疾病,前者主要累及中枢神经,后者主要累及周围神经,两者的临床症状可以相互混淆,但两者之间的关系却不明确[13-14]。根据近期文献报道,脑梗死继发GBS 可能有几种机制:①1 例COVID-19 患者同时有中枢神经及周围神经病变,即同时存在急性脑梗死及GBS,两者同时存在的原因可能与COVID-19 感染后全身炎症反应失衡、血管收缩功能障碍和使用免疫球蛋白有关[6]。这也就是说明,两者可能都是机体感染后的并发症。②在既往文献中,仅2 例有前驱感染症状,大部分无感染病史,这也说明脑梗死可能是导致GBS 的直接诱发因素。急性脑梗死或继发梗死灶出血后,血脑屏障的破坏导致神经碎片的免疫成分(包括髓鞘相关蛋白)释放到血液循环中,诱导产生抗髓鞘抗体,进而导致神经病变[14]。此外,有研究表明梗死患者感染并发症的发生率较高,且梗死急性期存在外周血中淋巴细胞亚群比例及免疫因子含量的改变,脑梗死后可能存在免疫抑制现象;外周血中部分淋巴细胞亚群与免疫因子的改变与脑梗死相关感染并发症的发生可能有关[15]。③某些治疗脑梗死的药物可能导致了GBS:文献报道部分营养神经的药物含有外源性神经节苷脂类似神经纤维上的神经节苷脂分子结构,可能诱导机体产生神经节苷脂抗体,从而诱发了抗体与补体等体内其他免疫分子参与的自身免疫反应,导致神经纤维受损[16-17]。此外,文献报道2 例急性脑梗死患者,经rt-PA 静脉溶栓并给予脑梗死对症治疗后继发GBS,其间无感染史,1 例给予丙种球蛋白治疗后好转,1 例给予血浆置换治疗后无改善,故认为rt-PA 可能为GBS 的一种触发因素[3-10]。
综上所述,急性脑梗死后继发GBS 是临床上很罕见的情况,其具体的发生机制目前尚不明确,脑梗死可能是触发GBS 的一个诱发因素,且自身免疫反应及相关细胞因子在其中发挥着重要作用,后期研究需进一步明确两者之间的关系。其次,这一病例应该提醒临床医生,在急性脑梗死患者诊治过程中,需加强周围神经系统损害的筛查,特别是当患者诉四肢麻木乏力时,需考虑GBS,早期识别、减少误诊、积极治疗可以防止病情进展,改善预后。

