基于全谱非靶向代谢组学技术的川芎不同部位代谢物深度解析
李若诗 丁海燕 杜 华 黄 凤 连 艳 刘晓芬 蒋桂华,4,* 尹显梅,*
(1成都中医药大学药学院,西南特色中药资源国家重点实验室,四川 成都 611137;2成都中医药大学本草基因组学研究院,四川 成都 611137;3重庆市中医院,重庆 400021;4成都中医药大学民族医药学院,四川 成都 611137)
药材川芎为伞形科植物川芎(Ligusticum chuanxiongHort.)的干燥根茎,是著名的川产道地药材,性温,味辛,归肝、胆、心包经,具有活血行气、祛风止痛的功效[1],多用于治疗胸痹心痛、胸胁刺痛、跌扑损伤、月经不调等[2-4],在四川地区种植面积稳定在9 万亩(6 000 hm2),占全国栽培产量90%以上,在云南、贵州等地区也有少量分布[5]。川芎地上部分嫩叶可作为菜食用或泡茶饮用,用于头痛、风湿痹痛和预防心脑血管疾病等[6]。
目前对川芎资源利用主要集中在川芎的根茎,而有研究结果表明,川芎地上部分化合物类型丰富[7-9],挥发油中的苯酞类化合物质量分数占38.95%[10],绿原酸、3,5-O-二咖啡酰奎宁酸和藁本内酯含量在5—6月均处于较高水平[11]。谭玉柱等[12]对川芎地上部分进行质量评价,结果显示不同产区的川芎茎叶具有较好的指纹图谱相似性,且地上部分占全株鲜重75%以上,资源量丰富,也具有开发潜力。由于川芎中多种活性成分具有重要的药效学价值,而目前对川芎化学成分分析大多使用单一的检测技术,如气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)[13-14]、高效液相色谱-质谱联用(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS)[15]、高效液相色谱(high-performance liquid chromatography,HPLC)[16]、薄层扫描[17]、核磁共振(nuclear magnetic resonance,NMR)[18]、超快速液相色谱(ultra fast liquid chromatograph,UFLC)[19]等,由于技术的局限性,单一的技术往往只能检测到某类或某几类成分。目前,通过多质谱联用的全谱非靶向代谢组学可以更加全面而深入地进行代谢物分析,且已用于番茄[20]、茶[21]、葫芦巴属[22]、姜黄属[23]等植物的代谢物分析。为了进一步挖掘川芎资源、提高资源利用率,本研究基于全谱非靶向代谢组学对川芎根茎、茎、叶三个主要组织部位的代谢物进行分析,并全面评估不同代谢物在川芎不同组织部位的分布格局,旨在为川芎资源的合理利用提供参考依据。
1 材料与方法
1.1 材料与试剂
川芎样品于2022年6月采自四川省都江堰市石羊镇高品质川芎生态种植科研示范基地种质资源圃,经成都中医药大学蒋桂华教授鉴定为伞形科植物川芎(LigusticumchuanxiongHort.)的新鲜植株。共收集川芎20 株,去掉泥沙后分为根茎、茎、叶三个部分,各设置6个重复,于50 ℃烘干后备用,样品保存于成都中医药大学中药标本馆。
洋川芎内酯I、洋川芎内酯H、阿魏酸松柏酯、藁本内酯、欧当归内酯A、洋川芎内酯A,购自成都曼思特生物科技有限公司,批号分别为MUST-21083105、MUST-22080607、MUST-22021903、MUST-22072108、MUST-22070810、MUST-21090718,纯度分别为99.43%、99.39%、98.94%、97.04%、98.38%、定性;水为娃哈哈(杭州)纯净水;甲醇、乙腈、甲酸、正己烷均为色谱纯,购自德国Merck 公司;氯化钠为分析纯,购自中国国药集团(上海)。
1.2 仪器与试剂
BP121S十万分之一电子天平,赛多利斯科学仪器有限公司(北京);恒温鼓风干燥箱,上海琅玕实验设备有限公司;TD5A-WS 型台式高速离心机,湖南湘仪实验仪器开发有限公司;高速组织研磨仪,上海净信事业发展有限公司;ExionLC™ AD 超高效液相色谱(UPLC),美国SCIEX公司;Applied Biosystems 4500 QTRAP串联质谱(tandem mass spectrometry,MS/MS),美国SCIEX公司;7890B-7000D 气相色谱-质谱联用仪(GC-MS/MS),美国安捷伦公司;PLA RSI 120 全自动顶空固相微提取,瑞士CTC Analytics公司。
1.3 供试品制备
1.3.1 HPLC 供试品制备 取1.1 节得到的样品,粉碎后过二号筛(24 目)。称取粉末1 g 置于具塞锥形瓶中,精密加入25 mL 甲醇,称定质量,超声处理1 h(功率400 W、频率50 kHz),冷却至室温,再次称定,用甲醇补足减失的质量后摇匀,微孔滤膜(0.22 µm)过滤。
1.3.2 标准品溶液制备 精密称取洋川芎内酯I、洋川芎内酯H、阿魏酸松柏酯、藁本内酯、欧当归内酯A、洋川芎内酯A对照品适量,加甲醇溶解并定容,制成浓度分别为0.068、0.060、0.096、0.011、0.021 mg·mL-1的混合对照品溶液备用,其中洋川芎内酯A仅作定性使用。
1.3.3 LC-MS 供试品制备 参考文献[24]进行,将剩余干燥川芎样品粉末混合后,根茎、茎、叶各称取1 份50 mg 样本粉末,加入-20 ℃预冷的70%甲醇水内标提取液1 200 µL,静置提取3 h(每隔30 min 涡30 s)后12 000 r·min-1离心3 min,取上清用0.22 µm 微孔滤膜过滤备用。
1.3.4 GC-MS 供试品制备 取混合后干燥川芎样品粉末根茎、茎、叶各1 份50 mg 于顶空瓶中,分别加入饱和NaCl溶液1 000 µL、50 µg·mL-1内标溶液10 µL于全自动顶空固相微提取(headspace solid phase microextraction,HS-SPME)进行样品提取。
1.4 HPLC色谱分析[25]
1.4.1 色谱条件 wondasil C18-WR 柱(4.6 mm×250 mm,5 µm,日本岛津公司);流动相以0.1%磷酸-水为流动相A,甲醇为流动相B 进行梯度洗脱(0~10 min,42%~55%B;10~30 min,55~70%B;30~40 min,70%~80%B;40~45 min,80%B);柱温30 ℃;流速:1 mL·min-1;检测波长:280 nm;进样量:20 µL。
1.4.2 含量计算 用标准曲线分别计算洋川芎内酯I、洋川芎内酯H、阿魏酸松柏酯、藁本内酯、欧当归内酯A的含量:
Y=115.150X-65.450 (R2=0.999 8)
Y=88.693X+286.430 (R2=0.999 0)
Y=38.428X+91.096 (R2=0.999 3)
Y=55.272X-46.158 (R2=0.999 8)
Y=63.699X+18.421 (R2=0.999 8) 。
1.5 LC-MS分析
1.5.1 LC 色谱条件 LC 分析所用色谱柱为SB-C18(1.8 µm,2.1 mm×100 mm,德国Agilent 公司);0.1%甲酸水(A)-0.1%甲酸乙腈(B)梯度洗脱(0~9 min,5%~95%B;9~10 min,95%B;10~11 min,95%~5%B;11~14 min 5% B);流速0.35 mL·min-1;柱温40 ℃;进样量2 µL。
1.5.2 质谱条件 设置电喷雾离子源(electrospray ionization,ESI)温度500 ℃;离子喷雾电压(ion spray voltage,IS)5 500 V(正离子模式)/-4 500 V(负离子模式);离子源气体Ⅰ(ion source gas Ⅰ,GSⅠ)344.378 kPa,气体Ⅱ(ion source gas Ⅱ,GSⅡ)413.685 kPa,气帘气(curtain gas,CUR)172.369 kPa碰撞诱导电离参数设置为高。数据采集使用QTRAP 6500+的分段多反应监测模式(multiple reaction monitoring,MRM)模式,分子量扫描范围50~1 200,碰撞气体(氮气)设置为中等。分析在迈维代谢公司(湖北武汉)进行,检索数据库为该公司自建数据库(metware database,MWDB),根据二级谱信息进行物质定性,分析时去除无关的碎片离子的重复信号。
1.6 GC-MS分析
1.6.1 HS-SPME 萃取条件 进样前将萃取头在萃取头调节模块(Fiber Conditioning Station)中250 ℃下老化5 min。将供试品溶液在60 ℃恒温条件下,振荡5 min后,取120 µm DVB/CWR/PDMS 萃取头插入样品顶空瓶,顶空萃取15 min,250 ℃下解析5 min,然后进行GCMS分离鉴定。
1.6.2 质谱条件 DB-5MS毛细管柱(30 m×0.25 mm×0.25 µm,美国Agilent J&W Scientific 公司),载气为高纯氦气,恒流流速1.2 mL·min-1,进样口温度250 ℃,不分流进样,溶剂延迟3.5 min。程序升温:40 ℃保持3.5 min,以10 ℃·min-1升至100 ℃,再以7 ℃·min-1升至180 ℃,最后以25 ℃·min-1升至280 ℃,保持5 min。离子源温度230 ℃,四级杆温度150 ℃,质谱接口温度280 ℃,电子能量70 eV,扫描方式为选择离子检测模式(selected ion monitoring,SIM),定性定量离子精准扫描[26]GC-MS/MS分析在迈维代谢公司(湖北武汉)进行。
1.7 数据分析
采用SIMCA 14.0软件对6批川芎指纹图谱中的活性成分进行主成分分析(principal component analysis,PCA)和偏最小二乘法分析(orthogonal partial least squares discrimination analysis,OPLS-DA)。
通过软件Analyst 1.6.3 处理质谱数据。LC-MS平台获得代谢物定量利用三重四级杆质谱的MRM 分析完成,用MultiQuant 3.03 软件打开样本下机质谱文件,进行色谱峰的积分和校正工作。GC-MS 平台通过MassHunter 软件处理质谱分析后的下机原始数据,用于定性定量分析。对代谢组的定性定量的数据采用R软件(www.r-project.org/)的内置统计prcomp 函数对数据进行自动标度化(unit variance scaling,UV)处理,对代谢物不同样本间的积累模式进行层次聚类分析(hierarchical cluster analysis,HCA)、PCA 和OPLS-DA分析。选取fold change≥2 和fold change≤0.5 的代谢物为差异代谢物。利用Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库对差异代谢物进行注释[27]。
2 结果与分析
2.1 川芎中主要活性成分含量分析
洋川芎内酯I、洋川芎内酯H、阿魏酸松柏酯、藁本内酯、欧当归内酯A 的含量测定结果见表1、图1。结果显示,川芎中各活性成分含量多数存在根茎中高于茎、叶的情况,但所有样品中均未检测到洋川芎内酯H。洋川芎内酯A 在根茎中均存在,但在茎、叶中含量较少。川芎茎、叶的成分和含量更为相似,活性成分的总含量为0.676%~2.113%,而川芎根茎中的成分含量则存在较大的个体差异,活性成分的总含量范围波动较大,为5.234%~12.460%。从PCA 和OPLC 分析结果(图1-B、C)可以看出川芎地上部分的成分和含量更为相似,且可以聚为一类,而川芎根茎中的成分含量则存在较大的个体差异活性。

表1 川芎不同部位活性成分含量Table 1 The content of active ingredients in different parts of L.chuanxiong/%
2.2 川芎的代谢组结果分析
2.2.1 川芎的全谱非靶向代谢组结果分析 川芎的全谱非靶向代谢分析结果表明,川芎根茎、茎、叶共检出2 942个代谢物,去重后为2 891个代谢物,分为32类(图2-B、表2),并对代谢物进行热度分析(图2-A)。其中,大于100 种代谢物的10 类分别为氨基酸及其衍生物387个、萜类311个、酚酸类247个、酯类205个、杂环化合物199 个、脂质187 个、有机酸169 个、醇和胺类119 个、酮类119 个、黄酮类117 个,共占化合物总数的76.79%。川芎中代谢物总丰度为茎(2.16×1010)>叶(2.10×1010)>根茎(2.09×1010)。
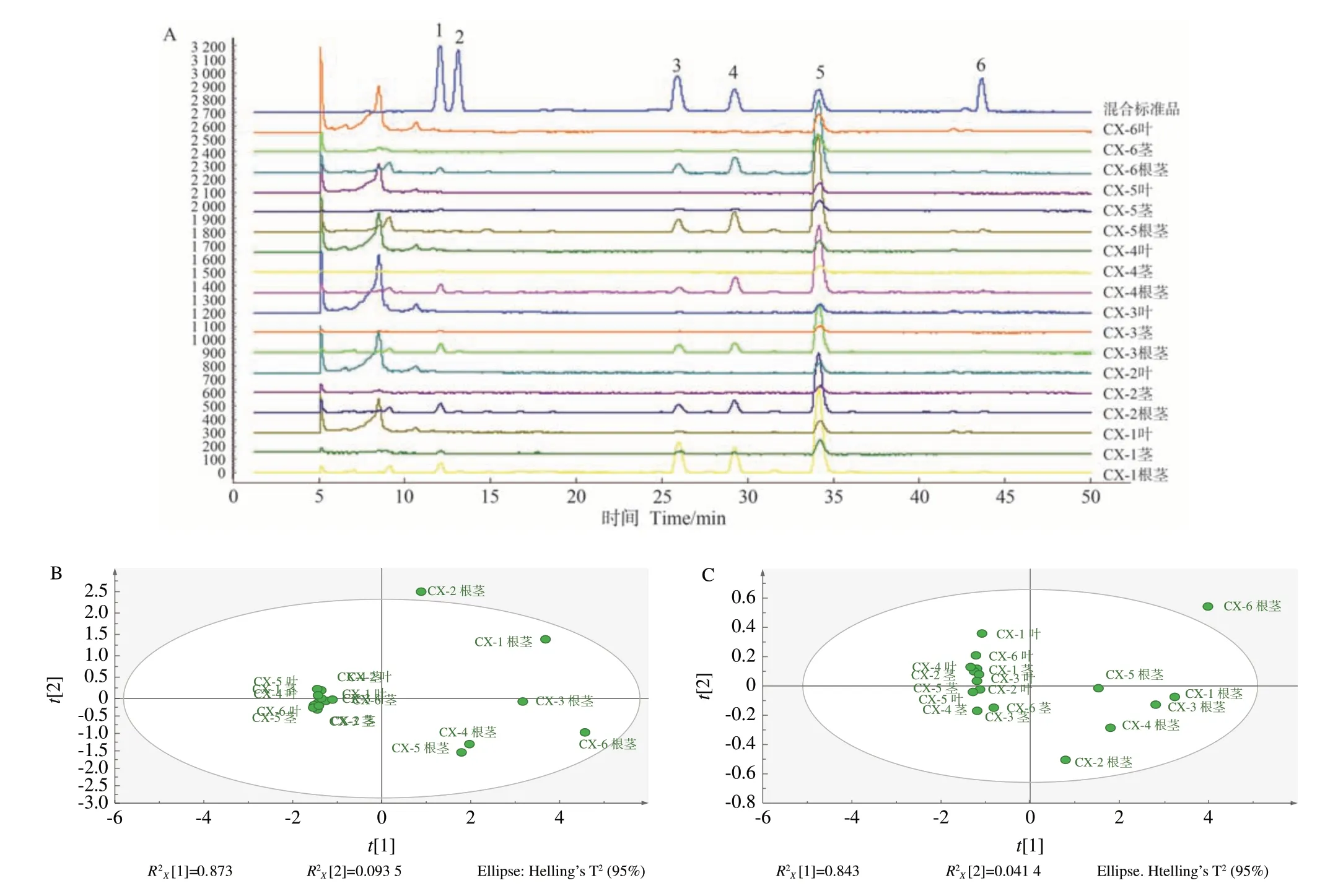
图 1 川芎不同部位的HPLC分析Fig.1 HPLC analysis of different parts of L.chuanxiong

图2 LC-MS和GC-MS的川芎代谢物检测结果比较分析Fig.2 Classification and analysis of metabolites of L.chuanxiong on different platforms
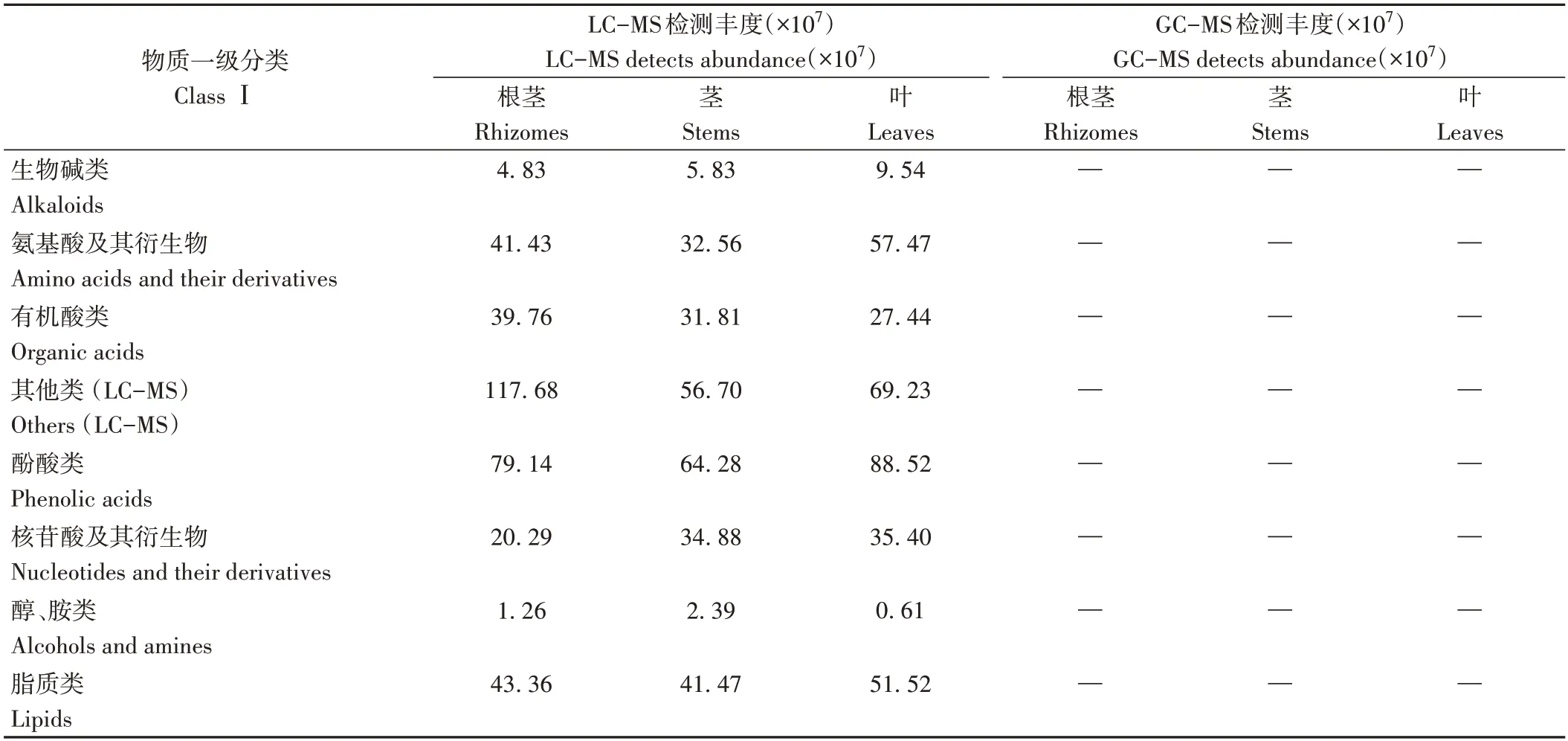
表2 川芎不同平台检测的代谢物种类丰度Table 2 Metabolites abundance in different platform of L.chuanxiong
LC-MS 平台检出18 类共1 726 个代谢物(图2-C、表2),化合物分子量范围为61.05~1 088.50,以各种类总丰度1×108为筛选条件,氨基酸及其衍生物、有机酸类、其他类、酚酸类、核苷酸及其衍生物在川芎中均表现出较高的丰度,此外,根中的脂质类化合物丰度较高,叶中脂质类、木脂素和香豆素类、萜类、黄酮类化合物丰度较高。其他类成分中符合筛选条件的为根茎中的糖类(6.41×108)、苯酞类(1.82×108)、糖及醇类(1.49×108);茎中的糖类(3.31×108);叶中的糖类(3.43×108)、苯酞类(1.16×108)。GC-MS 平台检出16 类共1 216 个代谢物(图2-D、表2),化合物分子量范围在68.037~316.24,以1×109为筛选条件筛选出丰度较高的化合物种类,萜类、杂环化合物、酯类在川芎中表现出较高的丰度,此外,烃类在根茎、茎中丰度较高,酮类在叶中丰度较高。
两个平台共同检出代谢物有51 个(图2-B),主要分布在LC-MS 平台的酚酸类等6 类,GC-MS 平台的萜类等9类中,分子量范围为94.19~226.23,均为极性或弱极性化合物。
2.2.2 基于LC-MS 的川芎不同部位代谢物差异分析 分别对不同部位LC-MS 检测丰度大于3×107的物质进行分析(电子附表1),结果表明,根茎中丰度较高的化合物有26 个,在其他类(糖类、苯酞类)中有9 个,其中丰度最高的是肌醇半乳糖苷(其他类、糖类)(1.24×108)。茎中丰度较高的化合物有15 个,在核苷酸及其衍生物有4 个,丰度最高的是N-(1-脱氧-1-果糖基)亮氨酸(核苷酸及其衍生物)(1.30×108)。叶中丰度较高的有27个化合物,其中酚酸类有6个,丰度最高的是槲皮素3-(6''-乙酰基葡萄糖苷)(黄酮类)(1.51×108)。川芎中主要活性成分川芎嗪、阿魏酸、阿魏酸松柏酯、藁本内酯、丁基苯酞、洋川芎内酯A、H、I均在川芎不同部位差异积累,存在根茎>茎>叶的趋势,表明川芎中有效成分的合成和积累主要发生在川芎根茎中。
2.2.3 基于GC-MS 的川芎不同部位代谢物差异分析 分别对不同部位GC-MS 检测丰度大于2×108的物质进行分析(电子附表2),根茎中丰度较高的代谢物有21个,其中萜类有5 个,丰度最高的是乙硫苯威砜-苯酚(酚类)(8.08×108)。茎中丰度较高的代谢物有20 个,其中萜类有11 个,丰度最高的为4-甲基-1-(1-甲基乙基)-双环[3.1.0]己-2-烯(烃类)(9.02×108)。叶中丰度较高的代谢物有22 个,其中萜类有15 个,丰度最高的是樟脑(萜类)(6.78×108)。
2.3 川芎的差异代谢物分析
2.3.1 显著差异代谢物分析 对以上数据进行整合分析,共筛选出川芎不同部位2 471种差异代谢物,由韦恩图可知,根茎与茎中筛选到显著差异代谢物1 683个,根茎与叶中筛选到显著差异代谢物2 054个,茎与叶中筛选到显著差异代谢物1 844个,根茎、茎、叶共有差异代谢物891种(图3)。

图3 川芎中差异代谢物的韦恩图Fig.3 Venn diagram of chemical constituents in L.chuanxiong
川芎根茎、茎、叶差异代谢物的总丰度如表3所示,为根茎1.66×1010≈茎1.67×1010>叶1.58×1010,基于LC-MS 检测到丰度较高的种类为氨基酸及其衍生物、有机酸类、其他类、酚酸类、核苷酸及其衍生物、脂质,其他类成分中丰度较高的为糖类(根茎中6.41×108、茎中3.31×108、叶中3.43×108)、苯酞类(根茎中1.82×108、叶中1.16×108)、糖及醇类(根茎中1.49×108)。基于GC-MS 检测平台检测到丰度较高的种类为杂环化合物、萜类,此外,醌类和烃类在根茎、茎中丰度较高,酮类在叶中丰度较高。

表3 川芎不同平台差异代谢物种类丰度Table 3 Differential metabolite speciese abundance in different platform of L.chuanxiong
对川芎不同部位差异代谢物进行OPLS-DA 分析,代谢物的差异倍数条形图和含量差异动态分布图如图4所示。根茎与茎中筛选到显著差异代谢物1 683个,上调代谢物826个,幅度最大的代谢物是1,3-丁二醇;下调代谢物857 个,幅度最大的代谢物是苯甲酸乙酯(图4-A、D)。根茎与叶中筛选到显著差异代谢物2 054 个,其中上调代谢物899 个,幅度最大的物质为4-(2,6,6-三甲基-1,3-环己二烯-1-基)-2-丁酮;下调代谢物1 155 个,幅度最大的物质为(E)-α-佛手柑(图4-B、E)。茎与叶中筛选到显著差异代谢物1 844个,其中上调代谢物864 个,幅度最大的是Asp-His-Phe-Asp;下调代谢物980 个,下调幅度最大的是(E)-α-佛手柑(图4-C、F)。
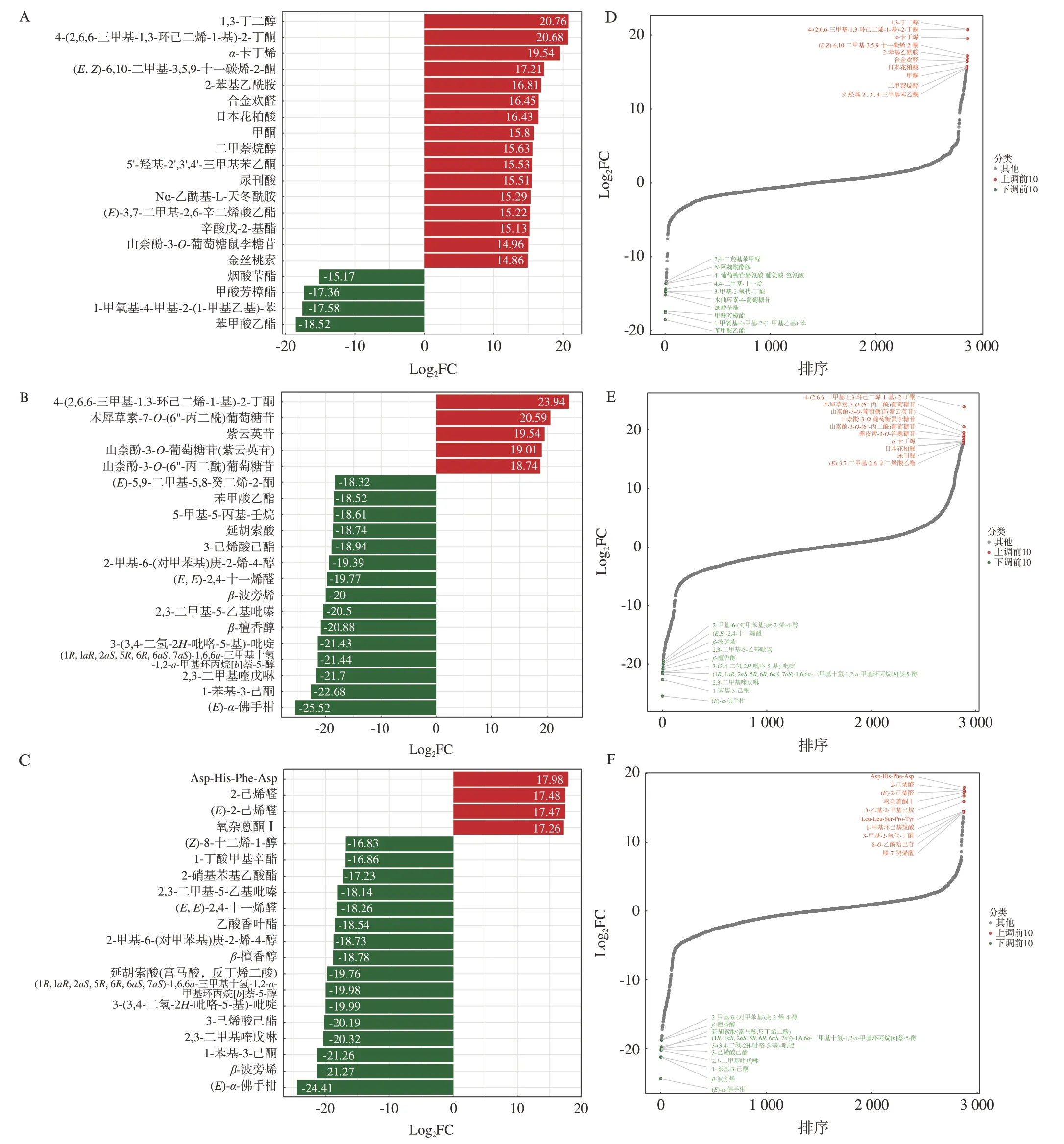
图4 川芎根茎与茎、叶差异倍数最大的20种代谢物(A~C)和代谢物含量差异动态分布图(D~F)Fig.4 20 metabolites with the largest up-regulated and down-regulated ratios(A-C)and dynamic distribution of metabolite content differences(D-F)between rhizome and stem and leaf of L.chuanxiong
川芎中活性成分川芎嗪、阿魏酸、藁本内酯、洋川芎内酯A、H、I、O、P 等,均为川芎根茎与叶、根茎与茎、茎与叶的差异代谢物且呈下调趋势,而少数代谢物如欧当归内酯A、Z-蒿本内酯二聚体E-232等,则在根茎与茎、根茎与叶、茎与叶中上调。此外,丁基苯酞、洋川芎内酯G、川芎萘呋内酯、阿魏酸松柏酯等代谢物在根茎丰度较高(电子附表3)。
2.3.2 差异代谢物KEGG 分析 利用川芎不同部位的差异代谢物进行KEGG 通路富集和相关通路差异丰度比较结果如图5所示,有479、477、478个代谢物被分别注释到川芎根茎与茎、根茎与叶、茎与叶的差异代谢物中相应代谢通路中。其中次生代谢产物的生物合成途径涉及339 代谢物、119 个差异代谢物,包括氨基酸及其衍生物、有机酸类、酚酸类、酯类等多种化合物,是涉及代谢物最多的途径。此外,氨基酸的生物合成、ATP 结合盒(ATP-binding cassette,ABC)转运途径、辅助因子的生物合成、苯丙素类生物合成均涉及差异代谢物20 种以上,可以作为川芎不同部位产生化学成分差异的主要研究途径。

图5 KEGG差异富集气泡图(A~C)和差异丰度得分图(D~F)Fig.5 Bubble map of KEGG differential enrichment(A-C)and differential Abundance Score of KEGG differential enrichment(D-F)
3 讨论
化学成分是药用植物资源开发和可持续利用的物质基础,在本研究中,HPLC 分析结果表明,川芎中活性成分为根茎大于茎、叶,但各部位构成的成分相似。本研究进一步在全谱非靶向代谢组学中,LC-MS 检出1 726 个代谢物,GC-MS 检出1 216 个代谢物,其中仅有51 个共同检出的极性或弱极性的代谢物,表明不同的检测平台对化合物检出的适用范围不同,LC-MS 平台检测分子量范围更大、适用于极性化合物,GC-MS平台检测适用于非极性、小分子化合物,因此,多质谱联用的全谱非靶向代谢组学方法能够明显提升代谢组学检测的覆盖度,对代谢物深入分析具有明显优势。本研究通过全谱非靶向代谢组学共检出32 类2 891 个代谢物,其中氨基酸及其衍生物、萜类、酚酸类、酯类在各部位中均为主要的代谢物,川芎中根茎、茎、叶中化学成分种类相似、含量差异较大,川芎根茎中氮类化合物、酚类和其他类(糖类、内酯类)化合物高于茎与叶;茎中醇、胺类和醚类高于根茎与叶;叶中萜类、黄酮类、酮类、木质素和香豆素类、酚酸类高于根茎与茎。
在中药材的生产加工中产生的非药用部位大多被丢弃,而中药生产过程的副产物及非药用部位废弃物多富含具有增强免疫力、抗菌消炎、助消化及具有营养功能的资源性物质,因此对其进行科学分级管理和精细化利用,已经成为现代研究的迫切问题[28-29]。在川芎各产地均以根茎为主产物,且川芎地上部分产业化程度低、药用利用较少,造成较大资源浪费。目前,已有研究报道表明,川芎地上部分不具有毒性,安全性高,具有活血、镇咳、舒张心脑血管、抗氧化等作用[30-31],本研究结果表明,川芎的地上部分(茎、叶)含有川芎嗪、阿魏酸、藁本内酯等成分,且萜类、黄酮类等活性成分含量高于根茎,具有开发为保健品、饲料添加剂等产品的利用潜力,能够进一步提高川芎资源的精细化利用率,以促进川芎产业的多元化绿色发展。
4 结论
本研究采用LC-MS 和GC-MS 的全谱非靶向代谢组学,对川芎不同部位的代谢物进行研究,并探究了其积累规律及差异性。结果表明,相较于单一平台的代谢组学,全谱非靶向代谢组学能更全面地反映出川芎中不同种类的代谢物。川芎的根茎、茎、叶中均含有不同的高丰度化合物种类,根茎中富集含氮化合物、酚类、其他类,茎中的醇、胺类、醚类高度富集,叶中的萜类、酮类、黄酮类高度富集,且上述化学成分差异与次生代谢产物的生物合成等途径密切相关。

电子附表1 LC-MS检测根茎、茎、叶中代谢物中高丰度的代谢物质Electronic Tables 1 Metabolites with high abundances in rhizomes,stems and leaves detected by LC-MS

