神经生长因子及其受体在高原牦牛与平原黄牛端脑中的比较分析
吴亚娟 杜晓华,* 刘 霞 郑丽平 刘珊珊
(1甘肃农业大学动物医学院,甘肃 兰州 730070;2甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
神经生长因子(nerve growth factor,NGF)是神经营养因子家族中最早被发现的成员之一[1],是一种分泌型糖蛋白,主要通过与高亲和力受体酪氨酸蛋白激酶A(tyrosine protein kinase A,TrkA)结合调节神经元的生长发育、存活及再生[2]。有研究表明,当中枢神经系统发生缺血性脑损伤时,NGF 与其受体TrkA 可通过表达上调对受损组织或细胞进行修复,对机体发挥神经保护作用,同时也在维持神经系统的动态平衡中发挥着重要作用[3-4],此外,NGF 可通过刺激血管内皮生长因子和其他血管活性因子促进血管生成,增加供氧量对缺氧神经元进行保护[5-6]。有研究显示,当NGF 及其受体TrkA 异常表达时,在临床上常引发糖尿病[7-9]、抑郁症[10]以及阿尔茨海默症[11-12]等疾病。
端脑又称大脑,是脑组织中占比最大、结构最复杂的部分[13]。其大脑皮质在机体认知、情绪、感觉及运动方面发挥着重要作用,海马则在情绪处理及记忆方面起着重要作用。有研究证实,哺乳动物大脑中的皮层和海马,功能一旦受损,就会出现癫痫、抑郁以及精神分裂症等多种神经系统疾病[14]。牦牛(Bosgrunniens)因生存环境的特殊性形成了独有的低氧适应机制,研究发现,因缺氧引起脑功能紊乱时,NGF可促进神经胶质细胞增殖对缺氧进行抵抗[14]。同时,NGF 通过表达上调激活受体TrkA,构成NGF-TrkA 调控系统,在大脑缺血缺氧方面发挥内源性神经保护作用[15]。目前,有关NGF 及其受体TrkA 在牛属动物体内的研究仍局限于水牛和牦牛的生殖器官,以及牦牛的心、肝、脾、肺、肾等部位[16-17],而在牦牛中枢神经系统器官和组织中的研究尚鲜见报道。
鉴于此,本研究以高原牦牛脑组织为研究对象,针对其端脑部位,采用免疫组织化学技术(immunohistochemistry,IHC)、实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)以及蛋白免疫印迹技术(Western Blot,WB)对NGF 及其受体TrkA 在牦牛端脑各区的分布及表达特征进行研究,并与平原黄牛比较,旨在探讨NGF和TrkA在牦牛端脑不同区域分布规律、表达水平与低氧环境之间的关联,为进一步探究牦牛适应高原低氧环境提供理论依据。
1 材料与方法
1.1 试验样品的选取
于甘肃省甘南藏族自治州合作市及河南省郑州市某屠宰场,分别随机选取5 头健康的成年甘南牦牛与南阳黄牛,其中牦牛所处区域平均海拔高度为2 960 m,黄牛所处区域平均海拔高度为108 m,待屠宰后迅速开颅取出完整的脑组织,并分区采集端脑组织样品,包括大脑皮质(额叶皮质、颞叶皮质、顶叶皮质及枕叶皮质)、大脑白质、海马及胼胝体等组织,分别投入液氮和4%多聚甲醛中保存备用。
1.2 主要试剂与仪器
TriQuick Reagent 总RNA 提取试剂,兰州科宝生物科技有限公司;Evo M-MLV 反转录试剂盒,湖南艾科瑞生物工程有限公司;神经生长因子多克隆抗体(rabbit anti-NGF polyclonal antibody,DF6061),江苏亲科生物研究中心有限公司;酪氨酸蛋白激酶受体A多克隆抗体(rabbit anti-TrkA polyclonal antibody,bs-0193R)、β-肌动蛋白(内参对照)多克隆抗体[rabbit anti-β-Actin(Loading Control)polyclonal antibody,bs-0061R]、二抗辣根过氧化物酶标记的羊抗兔IgG HRP(goat anti-rabbit Ig G/HRP,bs-0295G-HRP),北京博奥森生物技术有限公司;链霉卵白素—生物素法检测(streptavidin peroxidase,SP)试剂盒,北京中杉金桥生物技术有限公司;增强型HRP-二氨基联苯胺(diaminobenzidine,DAB)底物显色试剂盒,北京天根生化科技有限公司;增强型化学超敏发光液(enhanced-chemiluminescence,ECL),北京索莱宝科技有限公司。LightCycler96 PCR 仪,德国瑞士Roche 公司;冷冻型高通量组织研磨仪,宁波新芝生物公司。
1.3 试验方法
1.3.1 IHC 染色定位 将包埋好的石蜡块用切片机切成厚度为4 µm的切片,经展片、捻片及烘片处理后,放置于切片架上依次经二甲苯、苯酒(二甲苯与无水酒精配比为1∶1)、无水酒精、95%酒精、80%酒精进行脱蜡复水,后用磷酸盐缓冲液(phosphate buffer solution,PBS)冲洗,再将切片架放入已沸腾的柠檬酸盐缓冲液中进行抗原修复处理,并依次滴加内源性过氧化物酶阻断剂和山羊血清工作液进行阻断封闭,随后滴加以1∶100 稀释好的NGF 与TrkA 一抗,置于4 ℃冰箱过夜孵育,其中部分组织用PBS 以代替一抗,作为阴性对照,再依次滴加生物素标记山羊抗兔IgG 和辣根酶标记链霉卵白素工作液,37 ℃孵育,洗涤后滴加现配的DAB 显色液进行显色观察,待出现黄棕色时立即终止,后经常规脱水透明后用中性树胶封片,晾干后用光学显微镜观察拍照并留存备用。
1.3.2 qRT-PCR 检测 将冻存于液氮中的端脑组织迅速取出置于冰盒上,分别称取约0.2 g左右的组织样品于5 mL 离心管中,加入TriQuick Reagent 总RNA 提取试剂后置于提前预冷的高通量组织研磨仪中充分研磨后,进行常规的分离沉淀操作。将提取得到的总RNA经测浓度后依次进行定量,根据Evo M-MLV 反转录试剂盒的操作步骤进行cDNA 反转录,并进行qRTPCR,反应体系20 µL:SYBR High-Sensitivy qPCR SuperMix 10 µL、0.2 µmol·mL-1上下游引物各1 µL、300 ng·µL-1模板cDNA 1 µL、ddH2O 7 µL。反应程序:50 ℃预热2 min;95 ℃预变性1 min;95 ℃变性20 s,60 ℃退火45 s,40个循环。每个样品重复3次,结果取平均值,采用2-ΔΔCt定量分析法计算NGF和TrkA基因的相对表达量。根据NCBI 已有的牦牛NGF(NM_001099362.1)、牦牛TrkA(XM_024989929.1)、牦牛β-actin内参基因(NM_173979.3)序列,利用Primer Premier 5.0 软件设计引物,由上海生物工程股份有限公司合成,引物信息见表1。
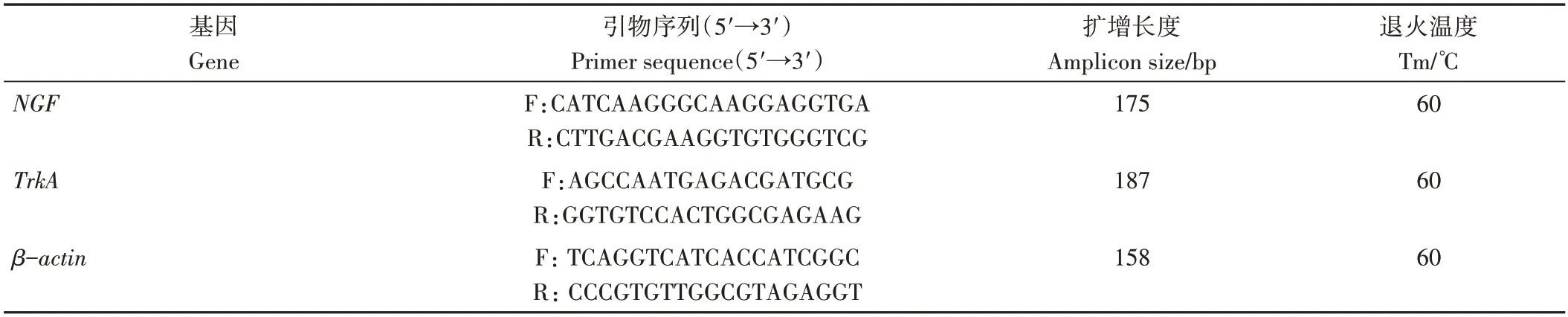
表1 qRT-PCR引物信息Table 1 Information for qRT-PCR primers
1.3.3 WB 检测 将冻存于液氮中的端脑组织迅速取出置于冰盒上,分别称取约0.2 g的组织样品于5 mL离心管中,加入RIPA 组织快速裂解液(RIPA lysis buffer)置于已预冷的高通量组织研磨仪中充分研磨,经冰浴裂解及离心后,取120 µL上清液,与40 µL 4×蛋白上样缓冲液混合,放置于金属浴中95 ℃变性10 min,冷却至室温,经聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gelelectrophoresis,SDS-PAGE)后根据指示标记(marker)切胶转膜,用5%脱脂奶粉室温封闭2 h,接着加入以1∶700 稀释的NGF 与TrkA 一抗,β-actin 则以1∶3 000 稀释,4 ℃过夜孵育,磷酸盐吐温缓冲液(phosphate buffered solution+Tween-20,PBST)洗涤后加入以1∶5 000 稀释的二抗,室温孵育2 h,PBST缓冲液充分洗涤,用ECL 在化学发光成像系统中曝光,获取蛋白条带。
1.4 数据统计分析
使用SPSS 20.0 软件对NGF和TrkA基因与其蛋白相对表达结果进行单因素方差分析(ANOVA),所有数据均采用“平均值±标准差(Mean ± SD)”表示,并采用GraphPad Prism 5.0进行绘图。
2 结果与分析
2.1 IHC染色定位结果
2.1.1 NGF 及其受体TrkA 蛋白在牦牛端脑不同区域中的表达与分布 经免疫组织化学染色检测发现(图1),NGF 和TrkA 阳性细胞在牦牛端脑中的分布及定位趋势一致。在额叶皮质、颞叶皮质、顶叶皮质及枕叶皮质构成的大脑皮质区域中,NGF 和TrkA 蛋白主要在马丁诺提(Martinotti)细胞、颗粒细胞的胞质以及神经胶质细胞中表达;大脑白质中,NGF 和TrkA 蛋白主要在神经胶质细胞中表达;海马中,NGF 和TrkA 蛋白主要在锥体细胞层中表达,在多型细胞层和分子细胞层少量表达;胼胝体中,NGF 和TrkA 蛋白主要定位于多型细胞胞质和神经胶质细胞。其中,阴性对照均无免疫阳性表达。
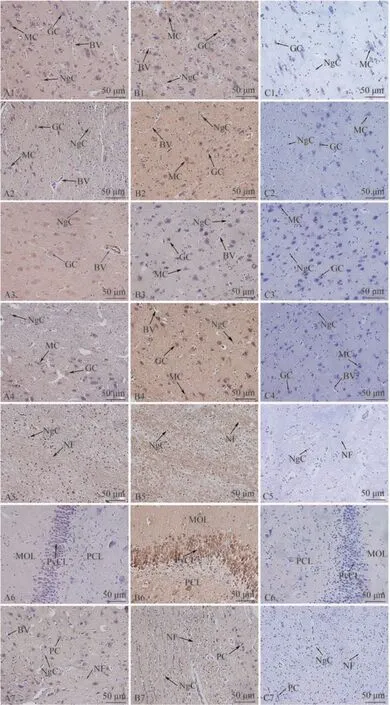
图1 牦牛端脑不同区域中NGF和TrkA蛋白分布Fig.1 Distribution of NGF and TrkA proteins in different regions of the yaks telencephalon
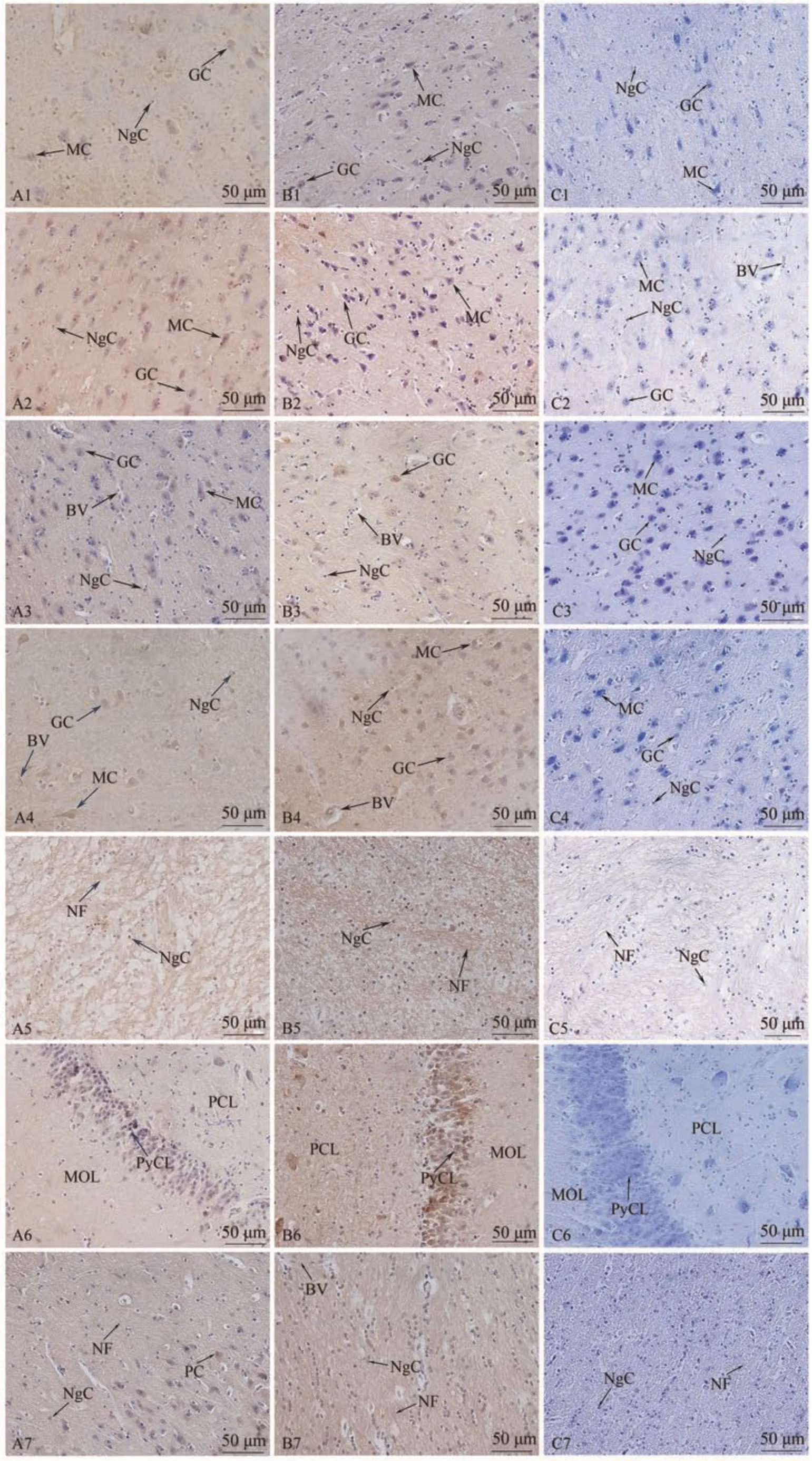
图2 黄牛端脑不同区域中NGF和TrkA蛋白分布Fig.2 Distribution of NGF and TrkA proteins in different regions of the cattles telencephalon
2.1.2 NGF 及其受体TrkA 蛋白在黄牛端脑不同区域中的表达与分布 经免疫组织化学染色检测发现,与牦牛相似,NGF 和TrkA 阳性细胞在黄牛端脑中的分布及定位趋势一致。大脑皮质各区域中,NGF 和TrkA 蛋白主要在Martinotti 细胞、颗粒细胞胞质以及神经胶质细胞中表达;大脑白质中,NGF 和TrkA 蛋白则主要在神经胶质细胞中表达;海马中,NGF 和TrkA 蛋白主要在锥体细胞层中表达,在多型细胞层和分子细胞层少量表达;胼胝体中,NGF 和TrkA 蛋白主要定位于多型细胞胞质和神经胶质细胞。其中,阴性对照均无免疫阳性表达。
2.1.3 NGF 及其受体TrkA 蛋白在牦牛与黄牛端脑中表达与分布的比较结果 NGF 和TrkA 蛋白在牦牛端脑各区域中的分布及定位趋势与黄牛基本一致,但二者在端脑各区域中的免疫阳性反应强度整体为牦牛强于黄牛(图1、2)。
2.2 qRT-PCR检测结果
经qRT-PCR 检测发现,牦牛端脑内NGFmRNA在顶叶皮质和颞叶皮质中表达量最高,且显著高于其他组织(P<0.05),其次分别为枕叶皮质、额叶皮质、海马、胼胝体和大脑白质,除顶叶皮质与颞叶皮质差异不显著外,其余区域间表达差异显著(P<0.05,图3);黄牛端脑内NGFmRNA 在额叶皮质中表达量最高,显著高于其他组织(P<0.05),其次分别为顶叶皮质、枕叶皮质、颞叶皮质、海马、大脑白质、胼胝体,其中海马与大脑白质之间差异不显著,其余区域间表达差异显著(P<0.05,图3)。NGFmRNA 仅在额叶皮质、枕叶皮质及大脑白质中的表达量为牦牛低于黄牛或与黄牛无显著差异,而在其余区域中表达量均为牦牛显著高于黄牛。
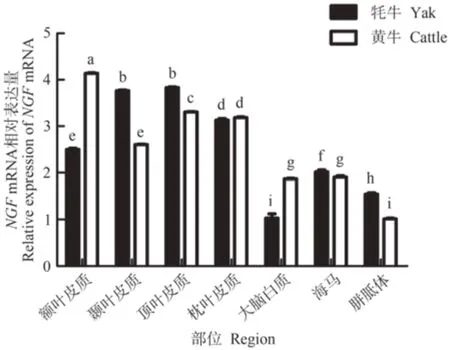
图3 牦牛与黄牛端脑不同区域中NGF基因的表达情况Fig.3 The expression of NGF gene in different regions of the yaks and cattles telencephalon
牦牛端脑内TrkAmRNA 在海马中表达量最高,且显著高于其他组织(P<0.05),其次分别为顶叶皮质、枕叶皮质、胼胝体、颞叶皮质、额叶皮质和大脑白质,其中除胼胝体与颞叶皮质之间表达不显著外,其余区域间表达差异均显著(P<0.05,图4);在黄牛顶叶皮质和海马中表达量最高,显著高于其他组织(P<0.05),其次分别为枕叶皮质、胼胝体、颞叶皮质、额叶皮质、大脑白质,其中顶叶皮质和海马之间差异不显著,其余区域间表达差异显著(P<0.05,图4)。TrkAmRNA 仅在大脑白质中表达量为牦牛与黄牛无显著差异,其余区域中表达量均为牦牛显著高于黄牛。
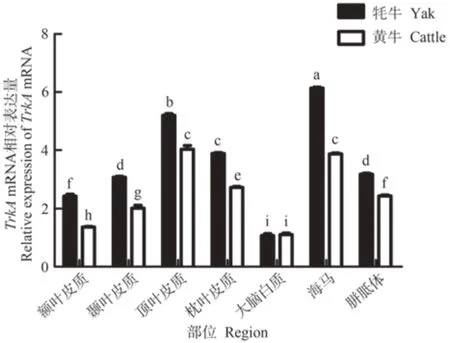
图4 牦牛与黄牛端脑不同区域中TrkA基因表达情况Fig.4 The expression of TrkA gene in different regions of the yaks and cattles telencephalon
2.3 WB检测结果
经WB 检测发现,牦牛端脑内NGF 蛋白在顶叶皮质中表达量最高,且显著高于其他组织(P<0.05),其次为颞叶皮质、枕叶皮质、额叶皮质、海马、胼胝体、大脑白质,其中胼胝体和大脑白质之间差异不显著,其余区域间表达差异显著(P<0.05,图5);在黄牛额叶皮质和顶叶皮质中表达量最高,显著高于其他组织(P<0.05),其次分别为枕叶皮质、颞叶皮质、海马、大脑白质、胼胝体,其中额叶皮质与顶叶皮质、颞叶皮质与海马之间表达差异不显著,其余区域间表达差异均显著(P<0.05,图5)。与黄牛相比,NGF 蛋白在大脑白质中的表达量为牦牛低于黄牛,其他区域中表达量均为牦牛显著高于黄牛。
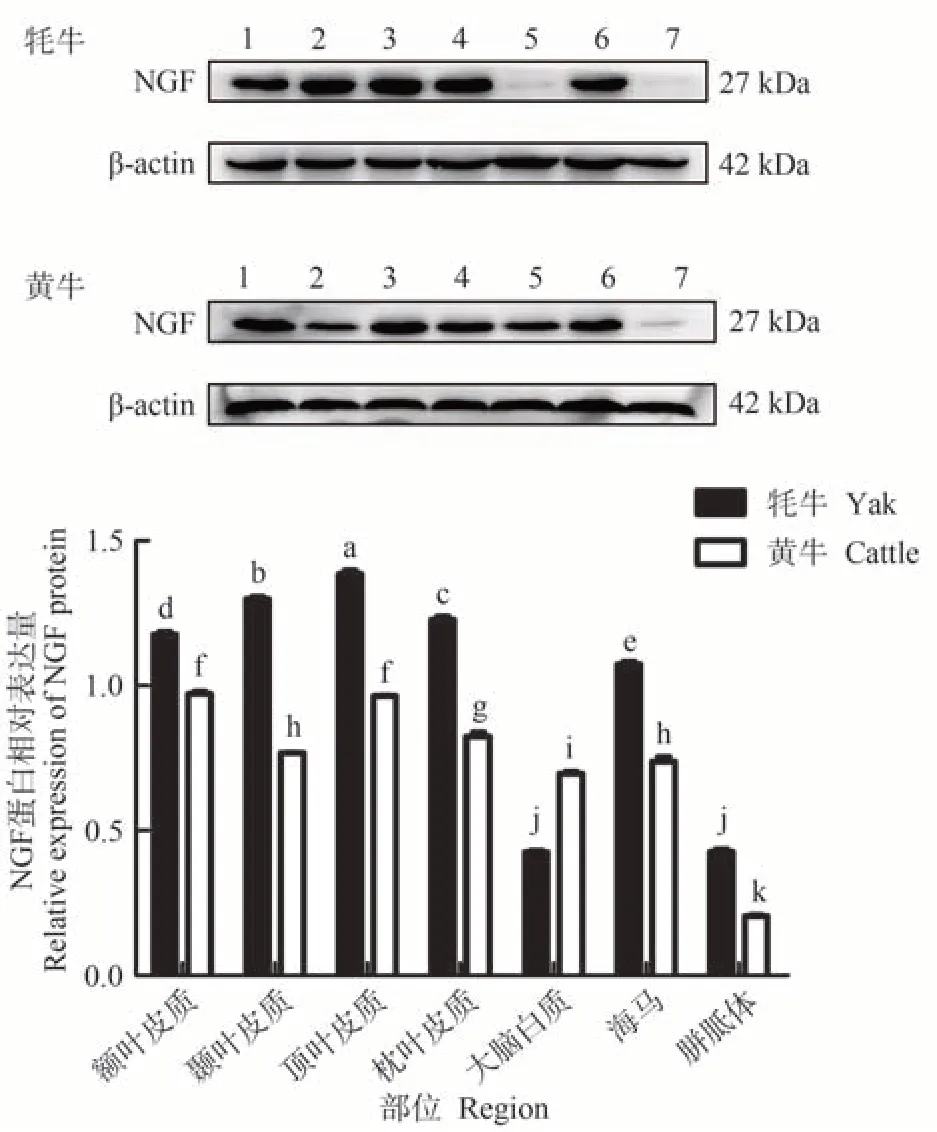
图5 牦牛与黄牛端脑不同区域中NGF蛋白表达情况Fig.5 Expression of NGF protein in different regions of the yaks and cattles telencephalon
牦牛端脑内TrkA 蛋白在海马中表达量最高,且显著高于其他组织(P<0.05),其次分别为顶叶皮质、枕叶皮质、胼胝体、颞叶皮质、额叶皮质、大脑白质,且彼此之间表达差异显著(P<0.05,图6);在黄牛海马中表达量亦为最高,也显著高于其他组织(P<0.05),其次依次为额叶皮质、顶叶皮质、枕叶皮质、大脑白质、胼胝体、颞叶皮质,其中枕叶皮质与大脑白质之间无显著差异,其余区域间表达差异显著(P<0.05,图6)。与黄牛相比,TrkA 蛋白在额叶皮质和大脑白质表达量为牦牛低于黄牛,在枕叶皮质中表达量与黄牛间差异不显著,其余区域中表达量均为牦牛显著高于黄牛。
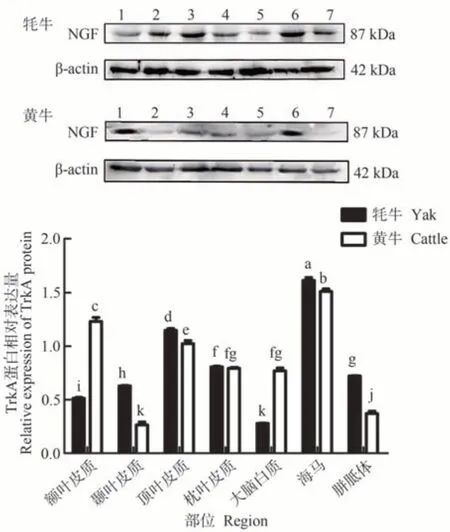
图6 牦牛与黄牛端脑不同区域中TrkA蛋白表达情况Fig.6 Expression of TrkA protein in different regions of the yaks and cattles telencephalon
3 讨论
NGF 存在于中枢神经系统中,通过结合高亲和力受体TrkA 可激活与神经元存活和分化相关的下游通路[18],参与协调神经内分泌及昼夜节律性活动[16,19-20],且广泛分布在中枢神经系统的基底前脑、皮质及海马区域[21-22],这与本研究中NGF和TrkAmRNA 及蛋白在牦牛与黄牛端脑不同区域均有表达的结果一致,表明NGF 和TrkA 在端脑各区域对睡眠及觉醒等生理活动具有重要的调控作用。此外,Liu 等[23]通过研究发现,NGF 在正常大脑各区域中广泛分布,但在大脑皮质和海马中明显高表达,与本研究NGF 在牦牛与黄牛大脑皮质和海马中高表达的结果一致,由此推测其高表达与NGF 自分泌途径激活有关,通过上调NGF 的表达量去维持大脑皮质和海马涉及情绪认知及学习记忆相关功能的正常运行。Sofroniew 等[3]研究发现,NGF 表达受缺血缺氧影响而上调。本研究结果发现,除了大脑白质外,NGF 在牦牛端脑其他区域中表达水平显著高于黄牛,推测上述结果与牦牛的低氧适应性有关,即牦牛能够通过上调NGF 表达量以增强端脑组织对低氧的耐受性。此外,本研究发现NGF 在牦牛端脑的皮质区域中表达量最高,其次为海马,这与黄英[24]对I125-NGF在缺氧新生鼠脑内的吸收分布研究中的描述不一致,推测这种差异与动物机体缺氧周期有关,对于长期处于低氧状态的牦牛,内源性NGF 可能在其端脑各部的神经通路中相互联动,以维持端脑各区域的稳态平衡。
TrkA 是由原癌基因酪氨酸蛋白激酶编码的一种可跨膜蛋白,是NGF 的功能性受体[25],NGF 通过与膜受体TrkA 结合在胞内磷酸化,继而激活并发挥生物学活性[26]。有研究表明,NGF及其受体TrkA的表达在中枢神经系统中同步升高,可以有效改善机体的记忆和认知功能[27],结合本研究结果发现,两种因子在端脑部分区域中表达的同步性可能也与改善机体记忆及认知有关。此外,本研究发现,NGF在牦牛端脑的皮质区域中表达量最高,TrkA 在牦牛海马中表达量最高;而杨传红等[28]关于内源性NGF 在缺血性老年大鼠部分脑区及小脑中的表达研究中发现,在中枢神经系统中对缺血敏感的区域是海马、大脑皮质以及小脑蒲肯野细胞,提示大脑皮质和海马是牦牛端脑组织中对低氧最为敏感的区域。牦牛与黄牛相比,TrkAmRNA 除了在牦牛大脑白质中表达量与黄牛无差异之外,在其他区域中表达量均显著高于黄牛;TrkA 蛋白则在枕叶皮质中表达量与黄牛无差异,在额叶皮质和大脑白质中表达量均低于黄牛,在其他区域表达量显著高于黄牛,推测这可能与TrkA 受体膜表面运输通路有关,以网络蛋白依赖的内吞途径进入胞质的TrkA 蛋白与溶酶体结合后被降解[29],进而导致TrkAmRNA 和蛋白表达具有差异。
免疫组化结果显示,NGF在大脑皮质、海马及胼胝体各区域主要分布在神经元胞质中,大脑白质中NGF主要分布在神经胶质细胞中,这与前人的研究结果一致[30-31],说明NGF和TrkA对端脑的神经保护作用主要依赖于以上神经元及神经胶质细胞的存活去维持中枢神经系统的内环境稳定,同时也参与神经系统抗损伤过程。TrkA 蛋白在牦牛与黄牛端脑中的分布与定位特征与NGF 蛋白相似,提示二者可能在功能上具有协同性。此外,有研究表明,NGF阳性表达随脑缺血时长而增强[32],本研究发现,牦牛端脑各区中NGF 和TrkA蛋白免疫阳性反应强度整体强于黄牛,推测这一现象可能与牦牛低氧适应性有关,在长期的低氧刺激下,上述细胞被激活并大量产生NGF,进而诱导受体TrkA 磷酸化,及时纠正因低氧所导致的脑功能紊乱,协同对端脑各区域进行神经保护作用。
4 结论
本研究在成年牦牛与黄牛端脑组织中检测了NGF及其受体TrkA的表达和分布。结果表明,NGF和TrkA主要依赖于端脑组织中的神经元及神经胶质细胞发挥内源性神经保护作用同时经牦牛与黄牛对比研究发现,NGF 和TrkA 除了共同参与调控动物机体正常的生理活动之外,在受到低氧刺激时,也可通过表达上调以增强牦牛端脑组织对低氧的耐受性。

