苹果B型细胞分裂素响应因子MdARR11对干旱胁迫的抗性分析
徐苏蕊 赵文哲 巩星遥 李 玲,* 肖 伟,*
(1山东农业大学园艺科学与工程学院,山东 泰安 271018;2山东果蔬优质高效生产协同创新中心,山东 泰安 271018)
细胞分裂素(cytokinin,CTK)作为植物生长发育过程中不可或缺的经典激素之一,在植物中的信号传导由双组分系统(two-component system,TCS)介导[1]。在拟南芥中,该系统包括细胞分裂素受体组氨酸激酶(Arabidopsis histidine kinase,AHK)、组氨酸磷酸转移蛋白(Arabidopsis histidine phosphotransfer protein,AHP)以及A 型和B 型反应调节因子(Arabidopsis response regulator,ARR)[2-3]。目前研究表明,细胞分裂素的合成、运输及信号传导均受干旱胁迫的影响[4]。
B 型ARRs 作为细胞分裂素信号转导的正响应因子,在调控植物生长过程中发挥作用。模式植物拟南芥(Arabidopsisthaliana)突变体arr1、arr2、arr10和arr12中均表现为分生障碍和芽再生能力降低[4-6]。研究表明,三重突变体arr1、10、12对细胞分裂素不敏感,且生长受到明显抑制[7-8]。同时arr1、10、12能够激活WUS的表达并抑制生长素生物合成基因YUCCAs(YUCs)的表达,从而控制芽再生[9]。随后在其他植物中也证实了ARRs能够参与调控植物生长,如RR13能在杨树(PopulusL.)韧皮部特异性表达,刺激形成层活性的非细胞自主调节[10]。相关研究表明,ARRs能够在调控根系发育过程中发挥作用。ARR12能够与PLT(PLETHORA)发生拮抗作用,影响拟南芥根系分生组织的发育[11]。ARR16和ARR17能够在CTK介导的拟南芥根系促水反应中发挥重要作用[12]。CcRR5通过与克莱门氏小柑橘(C.clementina)中的CcRR14和蔗糖非发酵-1-相关蛋白激酶2(sucrose nonfermenting-1-related protein kinases 2)相关基因CcSnRK2s相互作用,调控根的形态发生[13]。同时,ARRs 也能够在调控花发育及配子体中发挥作用。ARR10、12、18作用于CKI1 的下游以维持雌配子体的极性[14]。MdRRB11能够正向参与CTK对苹果花的诱导[15]。此外,B型ARRs还参与了植物对非生物胁迫响应的应答。TaARR1能够增强小麦(TriticumaestivumL.)对氮的吸收和同化[16]。B 型细胞分裂素的响应因子ARR1、10、12与有丝分裂原蛋白激酶(mitogen-activated protein kinase)相关蛋白MPK3/6 互作,促进自身磷酸化从而负调控植物耐盐性[17]。拟南芥arr1、10、12突变体具有明显的抗旱表型[18]。arr1、11、12三重突变体通过拮抗ABA信号通路,调节植物对干旱胁迫的响应[19]。但在苹果中,ARR11如何参与非生物胁迫响应仍鲜有报道。
干旱胁迫是农业生产上面临的主要逆境胁迫[20]。苹果作为我国农业的支柱产业之一,干旱胁迫通过影响果树的生长发育,降低果实的产量和品质,严重制约我国苹果产业的发展,增强苹果对干旱胁迫的耐受性对苹果产业的发展具有重要意义。因此,本研究通过聚合酶链式反应(polymerase chain reaction,PCR)扩增技术获得MdARR11基因,对比MdARR11与拟南芥等8种不同物种ARR11蛋白序列,分析MdARR11基因在嘎拉苹果不同组织相对表达量,进一步研究干旱处理(20%PEG6000)下MdARR11基因在嘎拉3 苹果中的表达水平。通过遗传转化,获得了过表达MdARR11苹果愈伤组织,并对MdARR11进行抗旱性鉴定,旨在进一步探索B 型细胞分裂素响应因子MdARR11 参与干旱胁迫响应的机理,从而为筛选抗旱品种提供理论参考。
1 材料与方法
1.1 试验材料
组织特异性表达分析的材料为十年生嘎拉苹果(MalusdomesticaBorkh.cv.Gala)树,取自山东农业大学国家苹果工程技术中心果树试验站。干旱处理的苹果材料为嘎拉3 苹果组培苗;愈伤材料为王林(Malus domesticaBorkh.Orin)苹果愈伤组织,均为山东农业大学园艺科学与工程学院设施果树实验室保存。遗传转化过程中使用的大肠杆菌DH5α 感受态细胞、农杆菌GV4404菌株均购于上海唯地生物技术有限公司。
1.2 试验方法
1.2.1MdARR11的克隆与进化树的构建 从GDR(https://www.rosaceae.org/)比对获得序列号为MD13G1108300 的基因序列,将其命名为MdARR11。根据互补脱氧核糖核酸(complementary DNA,cDS)序列,以嘎拉3 苹果cDNA 为模板,设计特异引物(表1),PCR 扩增获得MdARR11基因全长序列。PCR反应体系为25 µL:2×Phanta®Master Mix 12.5 µL,cDNA 2.5 µL,10 µmol·L-1上下游引物各1 µL,蒸馏水补至25 µL。PCR 反应程序为:95 ℃预变性3 min;95 ℃变性30 s;60~65 ℃退火20 s;72 ℃延伸2 min,34 个循环;72 ℃终延伸5 min。对PCR 结果进行电泳检测,然后用DNA 回收试剂盒(北京天根)对电泳产物进行回收。从NCBI数据库(http://www.ncbi.nlm.nih.gov/BLAST/)中比对并下载MdARR11的同源基因。使用MEGA 7.0软件构建进化树。

表1 引物信息Table 1 Primer information
1.2.2 MdARR11的理化性质及蛋白结构分析 使用ExPASy 网站(https://web.expasy.org/compute_pi/)分析MdARR11的理化性质。使用NCBI CD-Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析MdARR11 的蛋白结构域。使用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)检测MdARR11的顺式作用元件。
1.2.3 过表达载体构建和苹果愈伤组织遗传转化 将1.2.1 中得到的目的基因连接过表达载体pBI121::GFP,转化DH5α 感受态细胞,PCR 鉴定阳性克隆单菌落,送生工生物工程(上海)股份有限公司进行测序。得到的质粒转化农杆菌GV4404,将继代10 d左右长势良好的苹果愈伤组织与转化好的农杆菌在室温孵育20 min,用无菌纱布过滤、无菌滤纸吸干愈伤组织表面的菌液,后平铺在无抗继代板上,25 ℃黑暗培养3 d。然后将愈伤组织转移至抗性继代板(继代培养基+100 mg·L-1卡那霉素+250 mg·L-1头孢霉素),PCR验证阳性转基因愈伤组织,后将得到的转基因愈伤组织在抗性继代板继代2代以上,用于后续试验。
1.2.4 组织特异性及干旱胁迫试验设计 取十年生嘎拉苹果的根、茎、叶、花、果皮和果肉,所取样品置于液氮速冻,后储存在-80 ℃超低温冰箱备用。取继代培养1 个月左右生长状态良好且长势一致的嘎拉3 苹果组培苗用于生根处理[MS培养基+1 mg·L-1吲哚-3-乙酸(indole-3-acetic acid,IAA),pH 值为5.8~6.0],使用含有20%聚乙二醇6000(PEG6000)的Hoagland营养液水培处理组培苗,于0、1、3、6、9、12、24 h后取幼嫩叶片置于液氮速冻,提取RNA进行反转录。利用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)对MdARR11进行干旱处理的表达水平分析。将继代培养15 d左右生长状态良好、长势一致的野生型及过表达愈伤组织团成大小一致的小球。以继代培养基(MS 培养基+1.5 mg·L-12,4-D+0.4 mg·L-16-BA)作为对照,处理组在继代培养基中加入6% PEG6000。25 ℃条件下黑暗培养15 d,取样拍照。所有材料至少取3个重复。
1.2.5 RNA 的提取及qRT-PCR 分析 使用RNAprep Pure 总RNA 提取试剂盒[天根生化科技(北京)有限公司]提取嘎拉苹果不同组织、嘎拉3苹果叶片以及愈伤组织总RNA。
以提取的RNA 为模板,用HiScript Ⅱ 1st Strand cDNA Synthesis Kit(+gDNA wiper)试剂盒(南京诺唯赞生物科技股份有限公司)进行反转录,以MdActin(GenBank:CN938024)作为内参(表1),使用Ultra SYBR One Step RT-qPCR Kit 试剂盒(江苏康为世纪生物科技股份有限公司)进行实时荧光定量qRT-PCR 分析,最后采用Ct(2-ΔΔCT)法分析数据。
1.2.6 生理指标的测定 用电导率仪测定苹果愈伤组织的相对电导率;采用硫代巴比妥酸法测量丙二醛(malonaldehyde,MDA)的含量[21];使用考马斯亮兰G-250 法检测可溶性蛋白的含量[22];使用酸性茚三酮法检测游离脯氨酸的含量[22];采用相应试剂盒(苏州科铭生物科技有限公司)分别测定超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)的活性。
1.3 数据处理
每组试验至少进行3 个生物学重复,数据统计进行3 次重复。采用Excel 2016 进行数据处理,采用GraphPad Prism 6.01进行作图,采用SPSS 25对数据进行显著性和差异性分析(P<0.05)。
2 结果与分析
2.1 MdARR11的克隆及同源性分析
以苹果嘎拉3 的cDNA 为模板,设计引物(表1)进行PCR 扩增,获得一条长度为2 248 bp 的MdARR11基因片段。
图1 MdARR11基因PCR扩增Fig.1 PCR production of MdARR11
为研究MdARR11 的亲缘关系,将苹果MdARR11的蛋白序列与白梨(Pyrusbretschneideri)、拟南芥(Arabidopsisthaliana)、月季(Rosachinensis)、野草莓亚种(Fragariavescasubsp.Vesca)、桃(Prunuspersica)、甜杏(Prunusdulcis)、甜樱桃(Prunusavium)、野大豆(Glycinesoja)8 种不同物种的ARR11 的蛋白序列以及拟南芥AtARR11同源基因AtARR1、ARR10、ARR12的蛋白序列进行比对分析并构建进化树。由图2 可知,苹果MdARR11与白梨PbARR11的亲缘关系最近。

图2 苹果MdARR11与其同源基因的进化树分析Fig.2 Phylogenetic tree analysis of MdARR11 in apple and its homologous genes
2.2 MdARR11蛋白结构以及启动子顺式作用元件分析
用ExPASy 对MdARR11进行理化性质分析,结果显示MdARR11 编码613 个氨基酸,相对分子量为68 726.21 kDa,等电点为5.85。对MdARR11蛋白的保守结构域分析,发现在第19~133 位含有1 个typeBARR-like 磷酸接收结构域(receiver domain,REC),第198~251 位含有一个MYB-like DNA 结合域(图3),表明MdARR11属于B 型细胞分裂素响应因子。将MdARR11 与白梨、拟南芥等不同物种的ARR11 氨基酸序列进行比对进一步确定,结果如图4所示。

图3 MdARR11蛋白的保守结构域Fig.3 Conserved domains of MdARR11 protein

图4 MdARR11与不同物种的ARR11氨基酸序列比对Fig.4 Comparison of amino acid sequences between MdARR11 and different species of ARR11
使用PlantCARE 分析MdARR11转录起始位点上游1 500 bp 序列中的顺式作用元件,发现该基因启动子包含脱落酸响应元件、光响应元件,还包括厌氧诱导、低温响应和干旱诱导等胁迫应答元件(表2)。推测MdARR11可能参与植物生长发育、干旱胁迫等反应。

表2 MdARR11启动子的区域顺式作用元件Table 2 The cis-acting elements in promoters of MdARR11
2.3 MdARR11对干旱胁迫的响应
为了验证MdARR11是否响应干旱胁迫,使用20%PEG6000模拟干旱处理嘎拉3苹果幼苗。qRT-PCR 分析结果表明,干旱处理后,MdARR11基因表达水平受到抑制,呈现先降低后升高趋势(图5)。在处理6 h 后MdARR11基因表达水平达到最低值,与0 h 相比差异显著,随着PEG 处理时间的延长,MdARR11基因表达水平逐渐恢复,但仍显著低于0 h。以上结果表明MdARR11响应干旱胁迫。
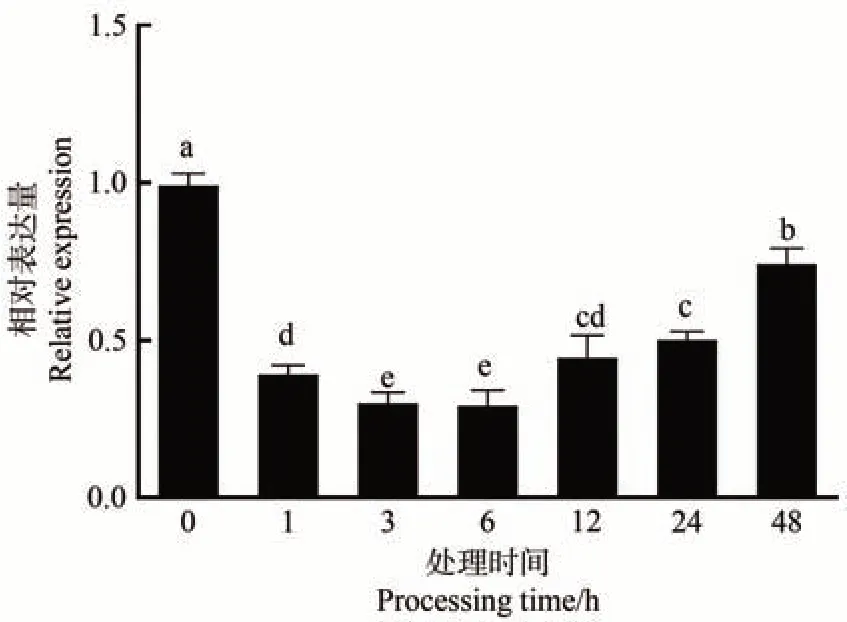
图5 MdARR11对干旱胁迫的响应模式Fig.5 The expression patterns of MdARR11 under drought stress
2.4 MdARR11表达模式分析
利用qRT-PCR 分析MdARR11在嘎拉苹果不同组织中的表达水平,结果表明,MdARR11基因在嘎拉苹果不同组织中均能检测到表达,其中在茎中表达量最高,在果皮和果肉中的表达量次之,在根中表达量最低(图6)。以上结果表明,MdARR11可能通过多种器官的协同作用参与干旱胁迫。

图6 MdARR11在苹果不同组织中的表达分析Fig.6 Expression analysis of MdARR11 in different tissues of apple
2.5 MdARR11转基因苹果愈伤组织的鉴定
为了进一步探究MdARR11在干旱胁迫中的作用,构建过表达载体MdARR11-pBI121-GFP,通过农杆菌介导法侵染苹果愈伤组织,获得了过表达MdARR11苹果愈伤组织。PCR 结果表明,在过表达愈伤组织中检测到目的条带(图7-A),而在野生型愈伤组织中未见目的基因条带。qRT-PCR 结果表明,过表达愈伤组织中MdARR11基因的相对表达量与野生型相比差异极显著,其MdARR11基因的表达量是野生型愈伤的7.62倍(图7-B)。以上结果表明,MdARR11-pBI121-GFP 成功转入愈伤组织中。

图7 MdARR11转基因苹果愈伤DNA鉴定和定量检验Fig.7 Identification and quantitative testing of MdARR11 in transgenic apple calli
2.6 干旱胁迫下MdARR11 转基因愈伤中渗透调节物质和膜脂过氧化产物含量的变化
选择继代培养后10 d生长状态良好且大小一致的转基因和野生型愈伤组织转到新的继代培养基上作为对照组,转移到含有6% PEG6000 的继代培养基上作为处理组,25 ℃下黑暗培养12 d。PEG 模拟干旱胁迫下,转基因和野生型愈伤组织的生长均受到抑制,其中转基因愈伤组织的生长势明显弱于野生型(图8-A),鲜重显著低于WT(图8-B);脯氨酸和可溶性蛋白的积累量极显著低于WT(图8-E、F),而相对电导率和MDA 的含量显著或极显著高于WT(图8-C、D)。上述结果表明,过表达MdARR11会加重干旱胁迫造成的脂膜过氧化损伤,同时减少渗透调节物质的积累。

图8 干旱胁迫处理WT和MdARR11转基因苹果愈伤Fig.8 WT and transgenic MdARR11 apple calli under drought stress
2.7 干旱胁迫下MdARR11 转基因愈伤中抗氧化酶活性的变化
当植物受到干旱胁迫时,体内活性氧含量增加,细胞膜通透性发生改变,从而导致细胞损伤。抗氧化酶系统可以有效清除活性氧并维持其动态平衡,减少活性氧对细胞的损伤。本研究为了检测干旱胁迫下活性氧的积累情况,测定了转基因愈伤组织在干旱条件下抗氧化酶活性的变化。结果表明,干旱处理后抗氧化酶的活性显著提升,其中过表达MdARR11愈伤组织中SOD、POD、CAT 的活性极显著低于野生型(图9)。以上结果表明,MdARR11降低了抗氧化酶的活性,减少了对ROS 的清除,增强了愈伤组织对干旱胁迫的敏感性。由此可知,MdARR11在苹果愈伤组织干旱胁迫响应中可能起到负调节作用。
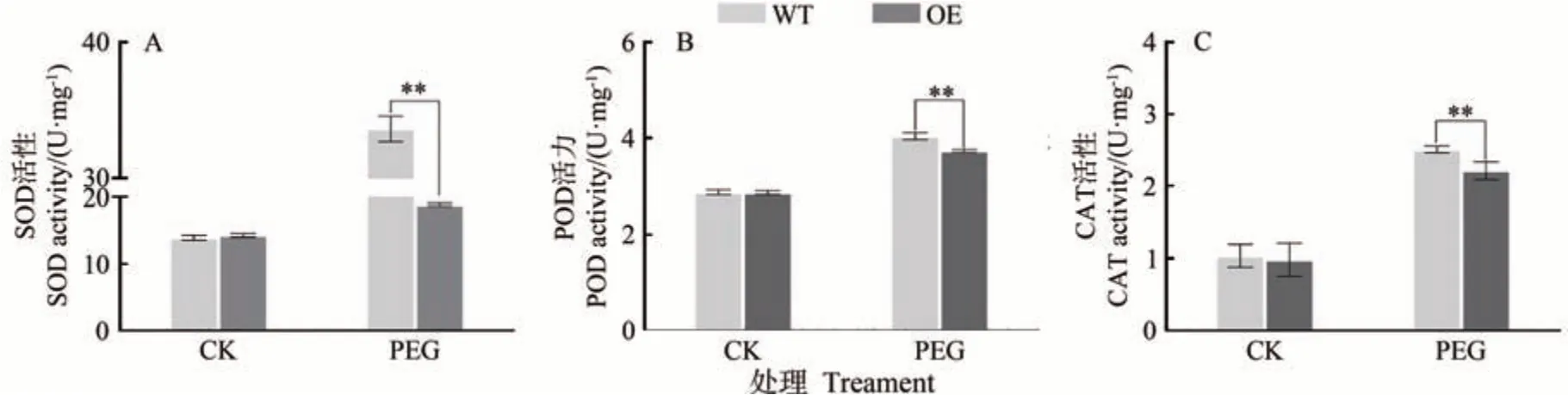
图9 干旱胁迫下WT和MdARR11转基因苹果愈伤抗氧化酶活性Fig.9 Activity of antioxidant enzymes in WT and MdARR11 transgenic apple callus under drought
3 讨论
细胞分裂素响应因子是细胞分裂素信号转导的重要组成部分。研究发现,ARRs在调控植物生长发育和响应非生物胁迫[16-19]中发挥重要作用。本试验通过克隆MdARR11基因并对干旱胁迫下MdARR11基因的生物学功能进行了相关研究。结果表明,当遭受干旱胁迫时,MdARR11基因的过表达降低了苹果愈伤组织的耐旱性。
拟南芥中AtARR11主要通过与同源基因ARR1、ARR12之间形成功能冗余,调控细胞分裂素信号与ABA 信号产生拮抗,负向调控植物的抗旱性[18]。本研究中,进化树分析表明苹果MdARR11与白梨PbARR11的亲缘关系最近,而与拟南芥AtARR11 亲缘关系较远。这表明,MdARR11 的功能可能与PbARR11 相似。推测MdARR11可能通过与互作蛋白的相互作用增强其在干旱胁迫中的功能,从而负调控植物抗旱性。但关于MdARR11基因的调控通路及作用机制还需进一步的研究。
细胞分裂素响应调节因子由于C端结构不同可分为A、B、C三类。其中,B型ARRs除了含有信号接受域外还在C末端含有一个DNA 结合域。在嘎啦3苹果中克隆得到一个长度为2 248 bp、编码613个氨基酸的基因MdARR11。氨基酸序列对比分析发现,MdARR11与PbARR11、AtARR11都含有type-B-REC 结构域,C 端都含有一个MYB-like的DNA结合域,表明它们属于B型细胞分裂素响应因子,这暗示着MdARR11可能在干旱胁迫中同样发挥重要作用。
TaRR1在小麦的根和叶中表达量最高[16],有助于调节氮的吸收和同化作用。VlRR5在葡萄(VitisviniferaL.)的茎中高表达,有助于提高葡萄坐果率[23]。在本研究中,MdARR11在苹果不同组织器官中都有表达,但在茎中表达量最高,说明MdARR11可能有助于调节营养器官发育。不同物种间组织特异性表达差异可能是由于小麦为草本植物,茎部不发达,根和叶作为重要营养器官发挥作用,而苹果、葡萄分别为木本、木质藤本植物,茎部较发达,根茎叶等器官均发挥重要作用。
干旱是影响植物生长发育的重要环境因素[20]。在拟南芥中干旱胁迫能够诱导A 型ARR 基因ARR5、ARR15、ARR22基因的表达[24],而B 型ARR 基因ARR1、ARR10、ARR12的表达量受到干旱胁迫抑制[18]。在本研究中,通过分析MdARR11转录起始位点上游1 500 bp序列中的顺式作用元件,发现该基因启动子包含多个如ARE、MBS等参与厌氧诱导和干旱胁迫的顺式元件,推测该基因的表达可能受上述环境因素的影响。使用20% PEG6000 模拟干旱处理苹果苗,qRT-PCR 分析结果表明MdARR11基因的表达受干旱胁迫抑制,验证了MdARR11响应干旱胁迫。干旱胁迫下CKs 的含量下降[25],参与CKs合成的基因IPT下调而参与降解的CKX基因上调[26],表明CKs 是干旱胁迫的负调节因子。在本研究中,苹果愈伤组织在6% PEG6000 处理后长势明显变弱,其中过表达MdARR11愈伤组织的长势弱于野生型。这些结果表明,MdARR11可能负调控苹果愈伤组织对干旱胁迫的抗性。
干旱胁迫能够引起渗透胁迫、脂膜过氧化,使细胞膜被破坏,植物不能从外界吸收水分最终导致死亡。植物在干旱胁迫下会积累一些渗透调节物质[27],从而增加胞内溶质增强细胞吸水或保水能力[28]。MDA 作为膜脂过氧化产物,能够直接导致细胞膜和酶的损伤,其含量高低能够直接反映细胞质膜过氧化水平。本研究发现,干旱处理后过表达MdARR11苹果愈伤相对电导率和MDA 的含量均高于野生型;而脯氨酸和可溶性蛋白的积累量均低于野生型。结果表明,MdARR11可以通过减少渗透调节物质的积累和加重细胞膜的脂膜过氧化程度,从而降低愈伤组织对干旱胁迫的抗性。
干旱胁迫会促进植物体内产生大量ROS,导致植株氧化损伤[20]。当植物受到干旱胁迫时,POD、SOD、CAT 的活性增加,三者协同作用抑制ROS 产生,从而抑制干旱引起的脂膜过氧化损伤,最终达到提高植物的抗逆性的目的[29-30]。本研究发现,干旱处理后SOD、POD、CAT 抗氧化酶的活性显著高于对照,在处理组中过表达MdARR11愈伤组织抗氧化酶的活性明显低于野生型。结果表明MdARR11能够通过降低抗氧化酶的活性,减少对ROS 的清除从而降低愈伤组织对干旱胁迫的抗性。
4 结论
本研究通过克隆MdARR11基因,构建过表达载体并遗传转化苹果愈伤组织,在PEG6000 模拟干旱胁迫下研究MdARR11基因功能。结果表明,MdARR11能够通过降低脯氨酸和可溶性蛋白的积累量,提高MDA 的积累量以及SOD、POD、CAT 抗氧化酶的活性,降低苹果愈伤组织对干旱胁迫的耐受性。

