植物促生微生物对枫香叶色素组成和根际微生物群落的影响*
吴祝华 宋 娟 朱树林 赵 邢 杨学祥 任嘉红 陈凤毛
(1.南京林业大学 南京 210037;2.湖州师范学院 湖州 313000;3.江苏省句容市磨盘山林场 句容 212445;4.江苏省句容市句容林场 句容 212424;5.长治学院生物科学与技术系 长治 046011)
植物促生微生物 ( plant growth promoting microbes,PGPM)可通过直接或间接作用促进植物生长并维系植物健康(Msimbiraet al., 2020)。PGPM 直接促生作用是指通过固氮、解磷和铁螯合等机制增强土壤中养分元素的有效性,或提高细胞分裂素、生长素和乙烯等植物激素的含量;间接促生作用是指通过竞争机制减少或抑制病原物生长改变土壤微生物群落,从而激活植物防御机制,提高植物抗逆性(Waniet al., 2019)。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是一类重要的PGPM,在全球范围内均有分布(Williset al., 2013)。AMF-宿主植物-土壤之间通过AMF 的菌丝网进行交流,不仅可以在宿主植物群体间,甚至可以在宿主植物和其他植物之间形成庞大的联接网络,使得营养物质和水分在植物群体间得到充分利用(Chenet al., 2018)。AMF 还可通过外部菌丝体释放的分泌物与其他土壤微生物进行互作,促进植物对矿物质元素(氮、磷、钾等)的吸收;提高宿主植物对部分病原菌(链霉菌、黄单胞菌、白粉菌等)的防御;增强宿主植物对干旱、盐和温度等非生物胁迫的抗性(Chenet al., 2018)。前期研究表明摩西斗管囊霉(Funneliformis mosseae)能够提高植物的耐胁迫性,增强植物幼苗中超氧化物歧化酶(superoxide dismutase,SOD)活性,促进幼苗生长(Song,et al.,2010)
枫香(Liquidambar formosana)是我国重要的乡土彩叶树种,树干通直,枝叶繁茂,秋季叶色绚丽;其木材质地坚硬,结构均匀,且抗压、耐腐蚀,是制造家具、农具、乐器、胶合板和包装材料等的理想用材(江聂等, 2008)。枫香树冠高大,落叶量大,可增加土壤有机质含量、优化土壤结构、改善林地生境,因此也具有重要的生态价值。加强对枫香的栽培管理,对发展阔叶树人工造林、开发乡土树种具有重要意义。
有关枫香根际微生物,前人研究表明,天然林中枫香根际可形成丛枝菌根,根际土壤中的AMF 孢子多样性丰富,球囊霉属为优势菌群(宋娟等,2021);从枫香根际土壤中分离和鉴定了有效解磷菌黏质沙雷氏菌 (Serratia marcescenssubsp.marcescens)与争论产碱菌(Variovorax paradoxus),且均显示出良好的溶磷特性(宋娟等,2020 ;Ting,et al., 2010)。关于枫香叶色变化的研究目前主要集中于枫香转色期其叶色变化与环境之间的关系方面(王冬雪 等, 2019), 而接种PGPM 对枫香叶色呈现与根际微生物群落的影响研究,目前鲜见报道。
本研究利用在枫香根际接种PGPM 优良菌株黏质沙雷氏菌NJ2D 与摩西斗管囊霉BJ04,研究PGPM对土壤理化性质和枫香叶色的影响;并利用高通量Illumina MiSeq 技术,研究不同微生物菌株处理下枫香林土壤的微生物PGPM 群落组成结构和多样性特征,以了解施加外源PGPM 对宿主植物根际土壤中微生物群落聚集的影响,从而改善土壤质量并促进彩叶树种叶色呈现,为微生物菌肥的研制提供参考。
1 材料与方法
1.1 试验区概况
研究区位于江苏省句容市句容林场(119°14'57.76"E, 32°5' 06.40"N),该地为典型的亚热带季风气候。年均气温15.1 ℃,平均相对湿度78%,年均降水量1 018.6 mm,年均日照时间2 116 h,土壤类型为酸性棕壤。
1.2 供试材料和培养基
本研究所用解磷菌黏质沙雷氏菌(菌株NJ2D)由笔者前期分离自南京中山陵天然枫香林根际土样中,菌株保藏号为CCTCC M 2012261,保存于南京林业大学林草学院森林保护实验室。摩西斗管囊霉(菌株BJ04)由中国北京市农林科学院植物营养与资源研究所提供。枫香为句容林场长势一致、生长健壮的7 年生枫香苗。使用前需将-20 ℃的甘油保存菌在牛肉膏蛋白胨(NA)固体培养基上活化培养3 次。
1.3 试验设计与土样采集
对枫香进行单接菌(NJ2D、BJ04)与双接菌(NJ2D+BJ04)处理。将NJ2D 菌株活化后接种到牛肉膏蛋白胨培养基,30 ℃,160 r·min-1振荡培养24 h 制成发酵液。将发酵液离心5 min(4 ℃,6 000 r·min-1),用无菌生理盐水润洗菌体2~3 次后,再用无菌生理盐水调节菌悬液,制成菌剂菌体浓度约为7×10~8×108cfu·mL-1,备用。将准备好的NJ2D、BJ04 菌剂分别采用灌根法和直接施加菌剂法施入,NJ2D 菌悬液与BJ04 菌剂分别按每株100 g 施用量施于枫香根部附近,然后覆土、浇水,统一管理。设4 个处理,分别为:单接种NJ2D、单接种BJ04、双接种NJ2D+BJ04(各施100g·株-1,共施200g·株-1)和空白对照(CK),每个处理20 个重复。处理2 个月后,每个处理设3 个重复,采集枫香根际(地表下15~25 cm 深) 的土壤0.5 kg,采集样品分别装入自封袋并做好标记,筛除植物残枝、石头等杂质后,置于低温保存箱送至实验室。其中一部分土样保存在-80 ℃超低温箱,用于微生物测序分析(保存时间不超过3 天),另一部分土样风干后保存在4 ℃冰箱,用于土壤理化性质测定。
1.4 土壤理化性质测定
土样风干后过2 mm 孔径的土壤筛,用于测定土壤理化性质。使用pH 计(Mettler Toledo,美国) 测定土壤pH (Xionget al., 2015)。采用抗坏血酸—钼蓝法测定有效磷含量(Olsen, 1954)。土样在550 ℃下燃烧后,对有机质含量进行测定(Rosellet al., 2001)。使用凯氏定氮法测定全氮含量(Pageet al., 1982)。通过将新鲜土样在105 ℃下烘干,用质量分析法测定土壤含水率(Denget al., 2016)。采用氢氧化钠熔融—钼锑比色法测定土壤全磷含量(Renet al., 2016)。使用酸溶解原子吸收法(原子吸收光谱仪,Thermo Fisher Scientific,美国)测量土壤全钾含量。
1.5 叶色参数的测定
于2021 年11 月下旬枫香叶色充分显色(树叶叶色基本一致)之时,选择天气晴朗之日进行叶色参数测定。每处理随机选择3 单株,每株树采摘充分显色叶3 片。叶色参数采用全自动测色仪CM-2300D (广东柯尼卡美能达公司)测定,每处理测定9 枚叶片,在每片叶正面中脉两侧进行测定,记录表征叶片颜色的L*、a*、b* 值,其中,L* 表示光泽明亮度,L* 值越大,亮度越高;a* 值表示红绿色差,a* 值越大,红色越深,a* 值越小,绿色越深;b* 值表示黄蓝色差,b* 值越大,黄色越深,b* 值越小,蓝色越深。
1.6 叶绿素、类胡萝卜素和花青素含量的测定
枫香叶片叶绿素a、叶绿素b 和类胡萝卜素含量的测定采用Porrade 等(1989)的方法,花青素含量测定采用Colanero 等(2018)的方法。
1.7 土壤DNA 提取、PCR 和Illumina 测序
选用 MoBio PowerMax Soil DNA isolation kit(MoBio Laboratories,Inc.,美国)试剂盒提取土壤微生物基因总DNA。将提取的总DNA 用于细菌和丛枝菌根真菌群落的分析。真菌18S 核糖体RNA 基因通过巢式PCR 反应扩增。第1 轮扩增引物为:F, 5′-GC ATATCAATAAGCGGAGGA-3′; R, 5′_-GTCGTTTAA AGCCATTACGTC-3′。第2 轮PCR 扩增引物引物为:F,5′_-TTGAAAGGGAAACGATTGAAGT-3′ ;R,5′-_TAC GTCAACATCCTTAACGAA-3′。 细菌 16S rRNA 基因扩增引物为338 F(5′- ACTCCTACGGGAGGCAGC AG-3′)和 806 R(5′-GGACTACHVGGGTWTCTAAT-3′)(Caporasoet al., 2012)。这些引物均包含特有的一组8个核苷酸的条形码序列。PCR 扩增体系为:12.5 uL 2×TaqPlus Master Mix,3 uL BSA(2 ng·μL-1),1uL 上下游引物和30 ng DNA 模版。PCR 重复3 次,16S V3、V4和18S(ITS1、ITS2)的PCR 扩增程序条件如下:94 ℃5 min,30 个循环,94 ℃ 30 s,50 ℃ 30 s,和72 ℃ 60 s;72 ℃ 7 min 4 ℃保存。而AMF PCR 扩增分为2 个步骤,第1 轮PCR 反应程序为94 ℃ 5 min;94 ℃ 5 s,58 ℃ 6 s,72 ℃ 10 s,30 个循环;72 ℃ 7 min。第2 轮PCR 反应程序为94 ℃ 5 min;94 ℃ 5 s, 58 ℃ 6 s,72 ℃ 10 s,30 个循环;72 ℃ 7 min。获得的PCR 产物进行1%(质量分数)琼脂糖凝胶电泳后,使用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences)凝胶回收试剂盒纯化,切胶回收PCR 产物。将每个样品等比例混合后,利用Illumina公司Miseq PE300 平台进行测序(艾维可生物科技有限公司,中国)。
1.8 数据分析
使用QIIME( Version 1.8,http://qiime.org)(Caporasoet al., 2012)去除< 200 bp 片段和低质量序列(average quality scores < 20 reads)获得高质量的细菌、真菌序列。使用UPARSE 根据97%的相似度对所有样本进行聚类(Edgar, 2013),并利用UCHIME 软件鉴定并去除嵌合体序列。使用(Silva)数据库(Release128 http://www.arb-silva.de)进行细菌物种注释(Quastet al., 2012)。另外,使用UNITE 数据库(Release7.0 http://unite.ut.ee/index.php)对真菌进行分类(Kõljalget al., 2013)。利用QIIME(V1.8, http://qiime.org/)计算出可用于分析物种复杂性的Alpha 多样性指数,包括Chao、Shannon 和observed species 指数。使用one-way ANOVA、Excel 2007 和SPSS 17.0 进行数据统计分析以及真菌群落、细菌群落与土壤环境因子和叶色素含量间的Pearson 相关性分析。利用R 软件(V 4.0.5)进行韦恩图和功能的热图作图。利用linear discriminant analysis effect size(LefSe)分析方法设定显著差异的线性判别式分析(line discriminant analysis, LDA)值为4.0,寻找不同处理间丰度差异显著物种。其他基础绘图运用Origin 2018 绘制。利用Canoco(Version 4.5)软件对环境因子和微生物群落多样性进行主成分(PCA)分析。利用psych R 包对复杂微生物群落中的共生模式进行网络分析,在Cytoscape 软件(V 3.6.1)中进行可视化操作。
2 结果与分析
2.1 促生微生物对枫香根际土壤理化性质的影响
处理组与对照枫香根际土样全氮、全磷和全钾含量见表1。与对照(CK)相比,NJ2D、BJ04 和NJ2D+BJ04 处理的枫香苗根际土壤全氮、全磷、有机质、有效磷含量、含水率和pH 均显著提高(P< 0.05)。与CK 和其他处理组相比,NJ2D+BJ04 处理枫香根际的土壤全氮、有机质含量和土壤含水率均显著提高 (P<0.05)。BJ04 处理的枫香根际土壤全钾和有效磷含量均显著高于其他各处理组(P< 0.05)。此外,NJ2D 处理的枫香苗根际土壤pH 显著高于其他各处理(P<0.05)。以上结果说明,接种菌剂 NJ2D、BJ04 可以有效提高土壤养分,以双接种效果最好。
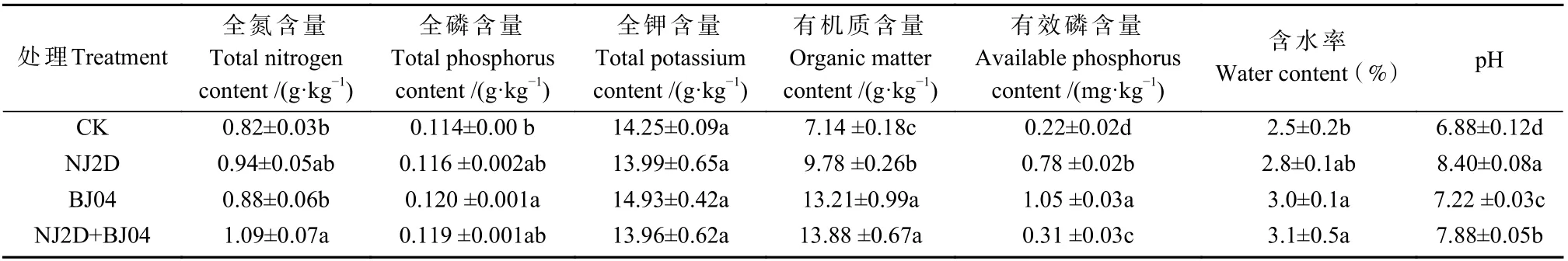
表1 促生微生物对枫香根际土壤理化性质的影响(n=3)①Tab.1 Soil physicochemical properties in the rhizosphere of Liquidambar formosana grown in field soil as affected by the inoculated microorganism
2.2 促生微生物对枫香叶色表型参数的影响
不同接菌处理枫香的叶色参数变化见图1。不同处理之间,枫香叶片的光泽明亮度L* 值呈明显变化( “+”表示偏明亮,“-”表示偏暗),单接种 NJ2D处理枫香苗的L*逐渐提高,并达到最大值。相反,单接种 BJ04 处理枫香苗的L*值较CK 则显著降低(P<0.05)(图1b)。与 CK 相比,枫香叶片的色相红绿色差a*值(“+”表示偏红,“-”表示偏绿)在接菌处理后呈现明显下降趋势(图1c)。单接种 BJ04 和双接种NJ2D+BJ04 处理枫香苗的b* 值(“+”表示偏黄,“-”表示偏蓝),与CK 相比呈现显著下降的趋势,表明CK 组和单接种NJ2D 处理组的b*值较高,枫香叶色变黄的程度加深(图1d)。以上结果表明,菌剂NJ2D、BJ04 对枫香叶色表型参数产生了显著影响。
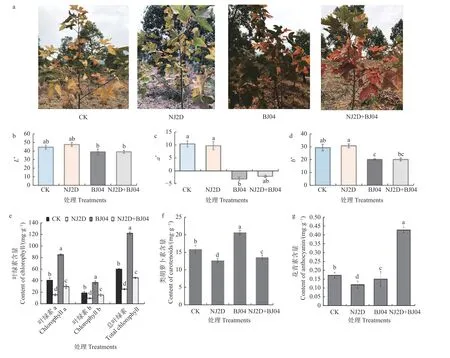
图1 接种促生菌对枫香叶色变化与叶片色素含量的影响Fig.1 Leaf color and pigments of L.formosana affected by the inoculated microorganism
接种NJ2D、BJ04 还对枫香叶片叶绿素含量产生不同程度的影响(图1e)。与CK 相比, NJ2D 和NJ2D+BJ04 处理枫香的叶绿素a、叶绿素b、总叶绿素值显著降低(P< 0.05);单接种BJ04 则显著提高了枫香叶片的叶绿素a、叶绿素b 和总叶绿素含量(P< 0.05)(图1e);此外,单接种BJ04 可显著提高枫香叶片中的类胡萝卜素含量(图1f);单接种NJ2D 和接种NJ2D+BJ04 处理的类胡萝卜素含量分别下降了20.15% 和14.67%(图1f);双接种NJ2D+BJ04 的枫香叶片中花青素含量较对照组显著增加(P< 0.05),而单接种 NJ2D、BJ04 菌剂的枫香叶片中花青素含量较对照CK 显著降低(P< 0.05)(图1g)。
2.3 促生微生物对枫香根际微生物多样性的影响
采用Illumina MiSeq 对CK 和处理组枫香根际土壤样品测序共获得2 界、36 门 、98 纲 、140 目 、296科、482 属、1 380 种的土壤细菌,及1 纲、3 目、3 科、9 属、68 种的土壤AMF。高通量测序结果(图2a)显示,NJ2D、BJ04、NJ2D+BJ04 和CK 之间共有OTUs 个数为2 731 个;CK、NJ2D、BJ04 和NJ2D+BJ04 特有OTUs 分别有385、261、242 和151 个。此外,由图2c可以看出,对照组和处理组共有OTUs 为204 个;CK、BJ04、NJ2D、NJ2D+BJ04 各处理组特有OTUs 分别有8、6、1、6 个。处理后,特有OTUs 减少了,可能是接种微生物增进了功能菌群,减少了无关菌种数群。
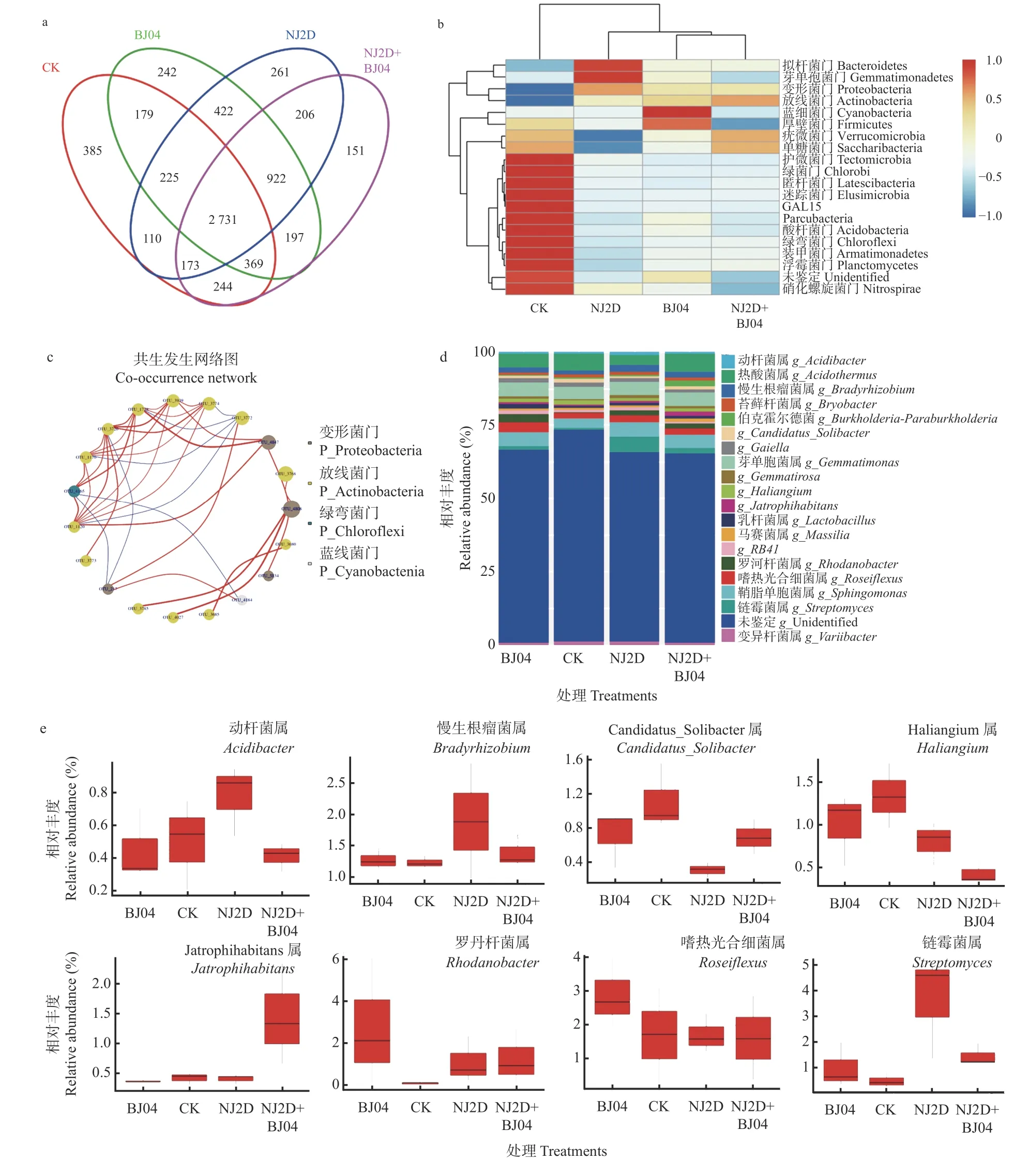
图2 接种促生菌对枫香根际土壤细菌多样性的影响Fig.2 The soil bacterial diversity in L.formosana rhizosphere affected by the inoculated microorganism
对照与处理组枫香根际微生物多样性见表2。NJ2D、BJ04 和NJ2D+BJ04 处理枫香的Chao1 多样性指数值相似,而CK 组显著低于处理组(P< 0.05)。此外,CK 组的Shannon 多样性指数也最小。而对于AMF,根际Chao1 指数最高的是CK ,表明CK 组枫香根际的群落丰富度指数较处理组大。Shannon 指数最高的是BJ04 组,最低的是NJ2D 组,表明BJ04 组根际AMF 的群落多样性最大,NJ2D 组际AMF 的群落多样性最小。
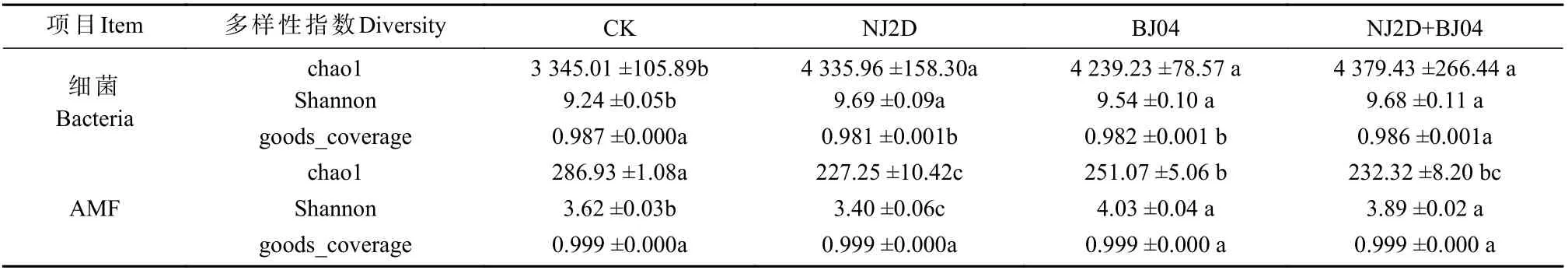
表2 枫香根际土壤微生物多样性指数Tab.2 Diversity index of the soil microbes in the rhizosphere under L.formosana relative to variety
2.4 促生微生物对枫香根际微生物群落结构的影响
枫香根际土壤细菌在门水平的丰度分析如图2所示,相对丰度排在前5 位的是放线菌门(Actinobacteria,29.77%~35.72%)、变形菌门(Proteobacteria,24.74%~35.30%)、绿弯菌门(Chloroflexi,6.38%~15.68%)、酸杆菌门(Acidobacteria,6.49%~10.77%)和芽单胞菌门(Gemmatimonadetes,6.08%~9.45%)。其中,与CK 相比,NJ2D、BJ04 和NJ2D+BJ04 处理组中的变形菌门和放线菌门的相对丰度明显升高。在NJ2D 处理组中芽单胞菌门和拟杆菌门(Bacteroidetes)的丰度相对较高(图2b),而蓝细菌门(Cyanobacteria)和厚壁菌门(Firmicutes)为BJ04 处理组中的主要门。此外,疣微菌门(Verrucomicrobia)和Saccharibacteria 菌门主要出现在NJ2D+BJ04 中。最后,与处理组相比,CK 组群落中的酸杆菌门、绿弯菌门和浮霉菌门(Planctomycetes)的相对丰度最高(图2b)。
进一步分析和比较属水平上的细菌、AMF 的相对丰度值(图2d、2e、3a、3b)。枫香根际细菌属(图2d)主要包括热酸菌属(Acidothermus,2.45%~4.97%)、芽单胞菌属(Gemmatimonas,3.15%~3.79%)、鞘氨醇单胞菌属(Sphingomonas,2.72%~3.71%)、嗜热光合细菌属(Roseiflexus, 1.64%~2.57%)和慢生根瘤菌属(Bradyrhizobium,1.24%~1.57%)。单接种NJ2D 处理组中,链霉菌属(Streptomyces,3.70%)和慢生根瘤菌属(1.57%)为优势属(图2e)。而单接种BJ04 处理组中嗜热光合细菌属(2.57%)和罗河杆菌属(Rhodanobacter,2.12%)为优势属。双接种NJ2D+BJ04 处理组中,Jatrophihabitans(1.53%)为优势属,而Haliangium属(0.76%)的相对丰度值低于其他各处理组(图2e)。从AMF 属水平上看(图3a),枫香根际AMF 的优势属为球囊霉属(Glomus,18.37%~43.25%)、根生囊霉属(Rhizophagus,2.37%~11.37%)、多氏囊霉属(Dominikia,1.52%~6.67%)、 卡氏囊霉属(Kamienskia,4.57%~0.02%)、巨孢囊霉属(Gigaspora,1.51%~0.02%)、硬囊霉属(Sclerocystis,0.59%~0.01%)和近明球囊霉属(Claroideoglomus,0.460%~0.001%)。其中,球囊霉属(43.25%)和卡氏囊霉属(2.14%)在CK 组中的相对丰度较高,而多氏囊霉属在双接种NJ2D+BJ04 处理组中的相对丰度(6.67%)较高(图 3b)。综上可以看出,不同处理条件下枫香根际土壤样品中的细菌、AMF组成较为相似,但其相对丰度值之间存有较大差异。
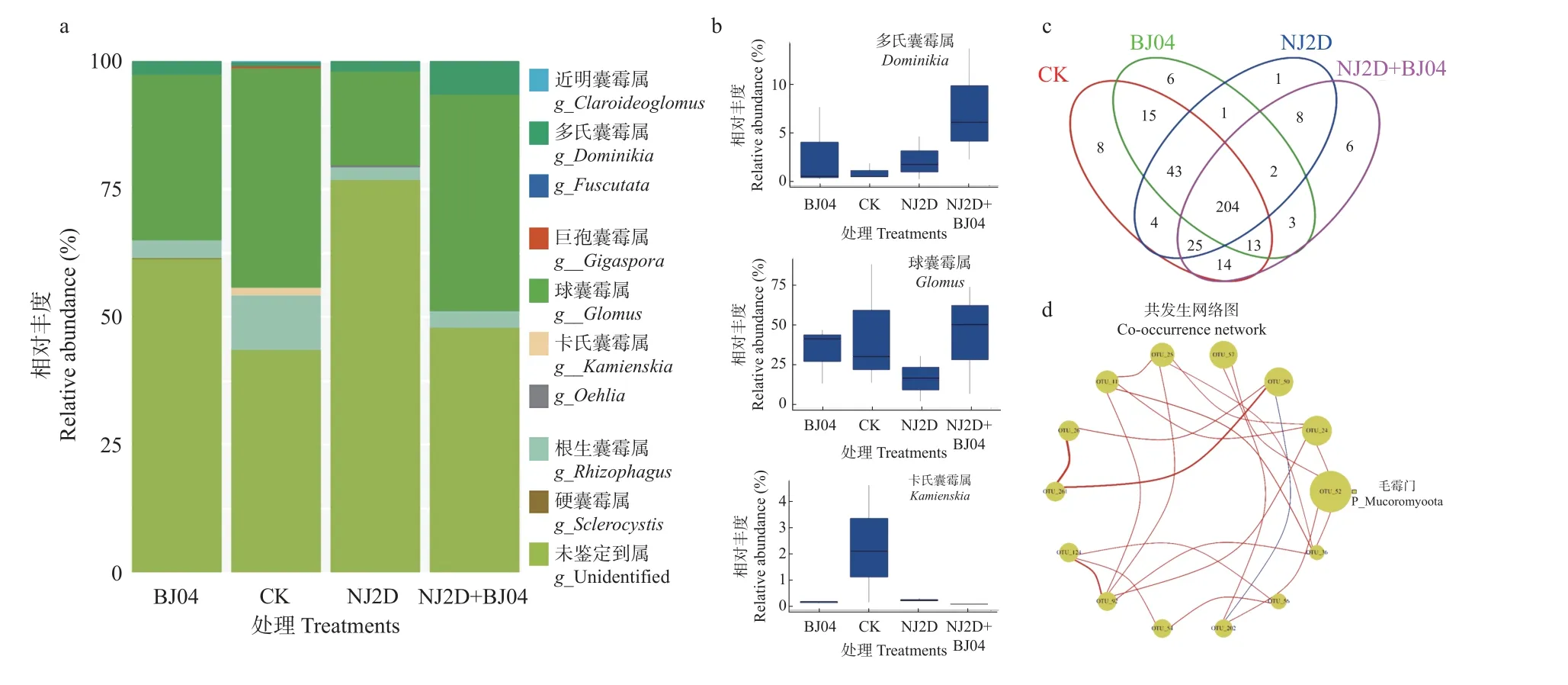
图3 接种促生菌对枫香根际土壤AMF 多样性的影响Fig.3 The soil AMF diversity in the rhizosphere of L.formosana affected by the inoculated microorganism
为进一步分析不同处理下细菌菌群的差异。通过LefSe 分析对细菌物种相对丰度进行比较。根据线性判别式分析(line discriminant analysis, LDA)计算结果来判断差异显著性的高低,LDA 的值越高,差异显著性越高,对LDA ≥ 3 的细菌进行分析(图4a),找出组间具有显著差异的物种(Biomarker)。单接种NJ2D处理枫香苗根际共有11 个特征细菌,分别是红螺菌科(Rhodospirillaceae)、假诺卡氏菌属(Pseudonocardia)、g__Pseudolabrys、f_288_2、根瘤菌科(Rhizobiaceae)、溶杆菌属(Lysobacter)、根瘤菌属(Rhizobium)、莫拉菌科(Moraxellaceae)、橙色杆孢囊菌(Virgisporangium)、g_Pedomicorbium、百脉根根瘤菌(s_Rhizobium_etli)。单接种BJ04 的枫香苗根际特征细菌为f_Acidimicrobiaceae。双接种NJ2D+BJ04 的枫香苗根际特征细菌为g_Caenimonas(图4a)。
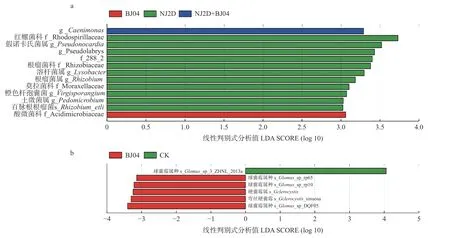
图4 不同接菌处理下枫香根际细菌(a)和真菌(b)的差异性分析Fig.4 Difference in bacterial (a) and fungal (b) populations in the rhizosphere of L.formosana under different inoculation conditions
利用LefSe 对不同处理下真菌菌群的差异进行分析,发现6 个差异丰富的分类学分支(a= 0.01,LDA Score ≥ 3.0)(图4b),可以找出组间具有显著差异的物种(biomarker),以及显著影响组间差异性的物种或群落。由图4 中可知,单接种BJ04 枫香苗根际的差异物种主要为球囊霉属种(s_Glomus_sp_rp65、s_Glomus_sp_rp10 与s_Glomus_ sp_DQF05),硬囊霉属、弯丝硬囊霉属(s_Sclerocystis_sinupsa)。而CK 组中只有1 个特征真菌为球囊霉属的s_Glomus_sp_3_ZHNL_2013a。单接种NJ2D 和双接种NJ2D+BJ04的枫香根际真菌群落组间无显著差异物种(图4b)。
2.5 土壤理化性质、叶色素与微生物多样性的相关性分析
人工接种微生物会影响微生物的组成和分布,通过主成分分析(principal component analysis,PCA)检验土壤理化性质、叶色素与细菌群落的相关性,结果(图5a)中红色射线表示土壤性质和叶色素,箭头的长度代表的是其影响程度,射线间的夹角代表相关程度。图中第1 坐标轴解释了细菌群落组成和土壤性质、叶色素间总变异的37.45%,第2 坐标轴解释了细菌群落组成和土壤性质、叶色素间总变异的48.96%。分别基于这2 种距离使用置换多元方差分析(PERMANOVA),进行999 次置换后发现,研究区样品两两之间均有着显著差异(P< 0.05)。图中单接种BJ04 处理组与双接种NJ2D+BJ04 处理组细菌群落组成相似度较高,而单接NJ2D 处理组与BJ04 处理组的细菌群落结构相似(图5a)。此外,CK 组与双接种NJ2D+BJ04 处理组细菌群落结构在PCA 图中的位置比较分散,距离较远。NJ2D、BJ04 的接种处理使得枫香根际的细菌群落组成发生了变化,说明NJ2D、BJ04 会对枫香根际的细菌群落产生影响。另外,PCA 结果(图5a)表明,土壤pH、TP 和AP 含量与单接种NJ2D 处理组的细菌群落结构呈显著正相关(P< 0.05),土壤TK 含量与叶绿素和类胡萝卜素含量呈显著正相关(P< 0.05),土壤TN与花青素含量呈显著正相关(P< 0.05)。
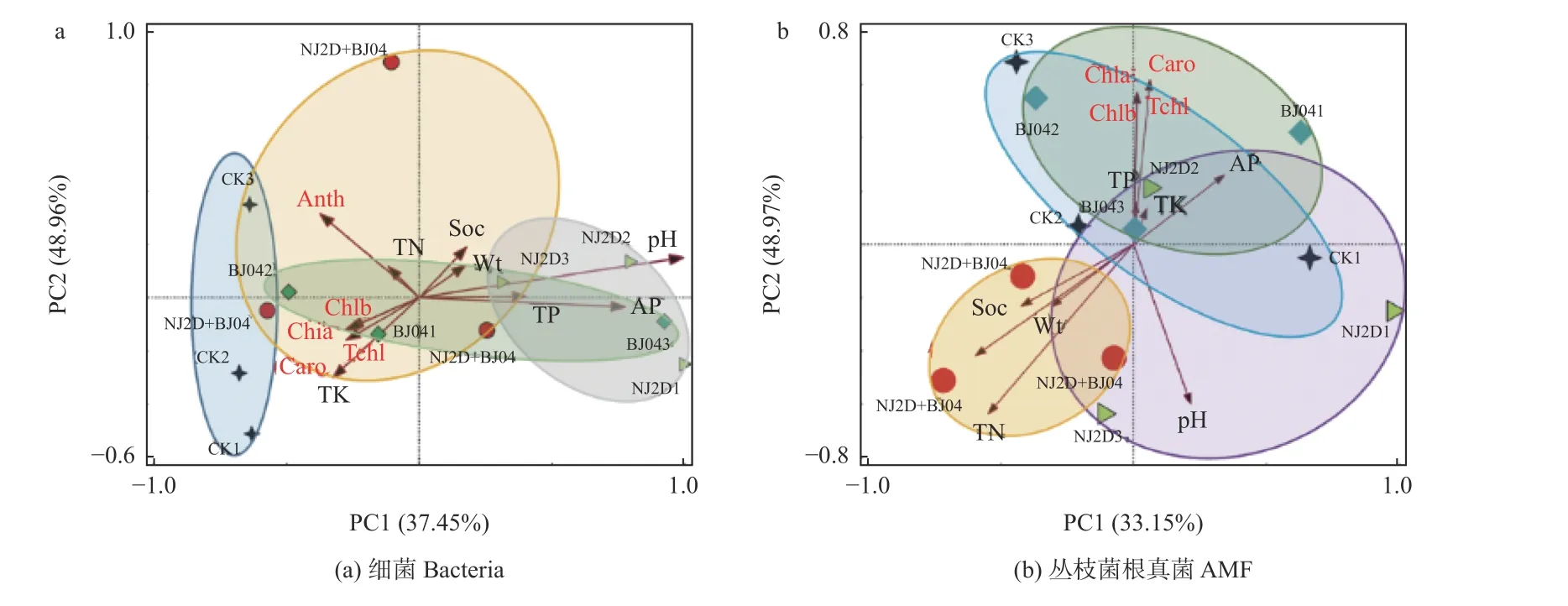
图5 接种促生菌对枫香根际土壤微生物群落组成与环境因子、叶色素间的PCA 分析Fig.5 PCA of soil microbial community composition, environmental factors and leaf pigments in rhizosphere of L.formosana by inoculating microorganism
对枫香根际AMF 群落而言,主成分分析表明,PCA1、PCA2 分别解释了样本间33.15%和48.97%的变异来源,第一、二两轴的累积贡献率达82.12%。CK 组、单接种黏质沙雷氏菌NJ2D、摩西斗管囊霉BJ04 菌剂的处理组之间的点距离较近,说明3 个样地的AMF 群落构成相似;而CK 组和单接种摩西斗管囊霉BJ04 处理组与双接种NJ2D+BJ04 处理组之间距离较远,说明双接种NJ2D+BJ04 处理组与CK 组和单接种摩西斗管囊霉BJ04 处理组之间的AMF 群落结构差异较大(图5b)。利用置换多元方差分析(PERMANOVA),发现研究区样品两两之间均有着显著性差异(P< 0.05),进一步佐证了样本组间群落结构差异的显著性。此外,本研究结果显示,土壤TN、土壤水分含量、土壤有机质以及枫香叶片中花青素的含量与双接种NJ2D+BJ04 菌剂处理组的AMF 群落结构呈显著正相关(P< 0.05),土壤 TK、TP、AP、叶片中叶绿素和类胡萝卜素值与单接种摩西斗管囊霉BJ04 处理组中的AMF 群落结构呈显著正相关(P< 0.05)(图5b)。
为了进一步明确不同接种处理土壤微生物群落与土壤理化性质、叶色素间的的相关性,对土壤微生物群落与土壤理化因子和叶色素间进行Pearson 相关分析,结果表明土壤pH 与类胡萝卜素、叶绿素a、叶绿素b、总叶绿素含量和chao1(AMF)呈显著负相关(P< 0.05)(P< 0.01)(表3)。有效磷与类胡萝卜素、叶绿素a、叶绿素b 和总叶绿素呈显著正相关(P<0.05)(P< 0.01);土壤有机质与土壤全氮呈极显著正相关(P< 0.01)(表3);而土壤含水率、土壤全钾对枫香叶色素、微生物多样性间无显著性影响。说明枫香叶色含量和微生物多样性对土壤pH、土壤有机质、土壤总钾、土壤有效磷和土壤含水量有响应,其中枫香叶色和微生物多样性受土壤pH 和土壤有效磷的影响最大(表3)。
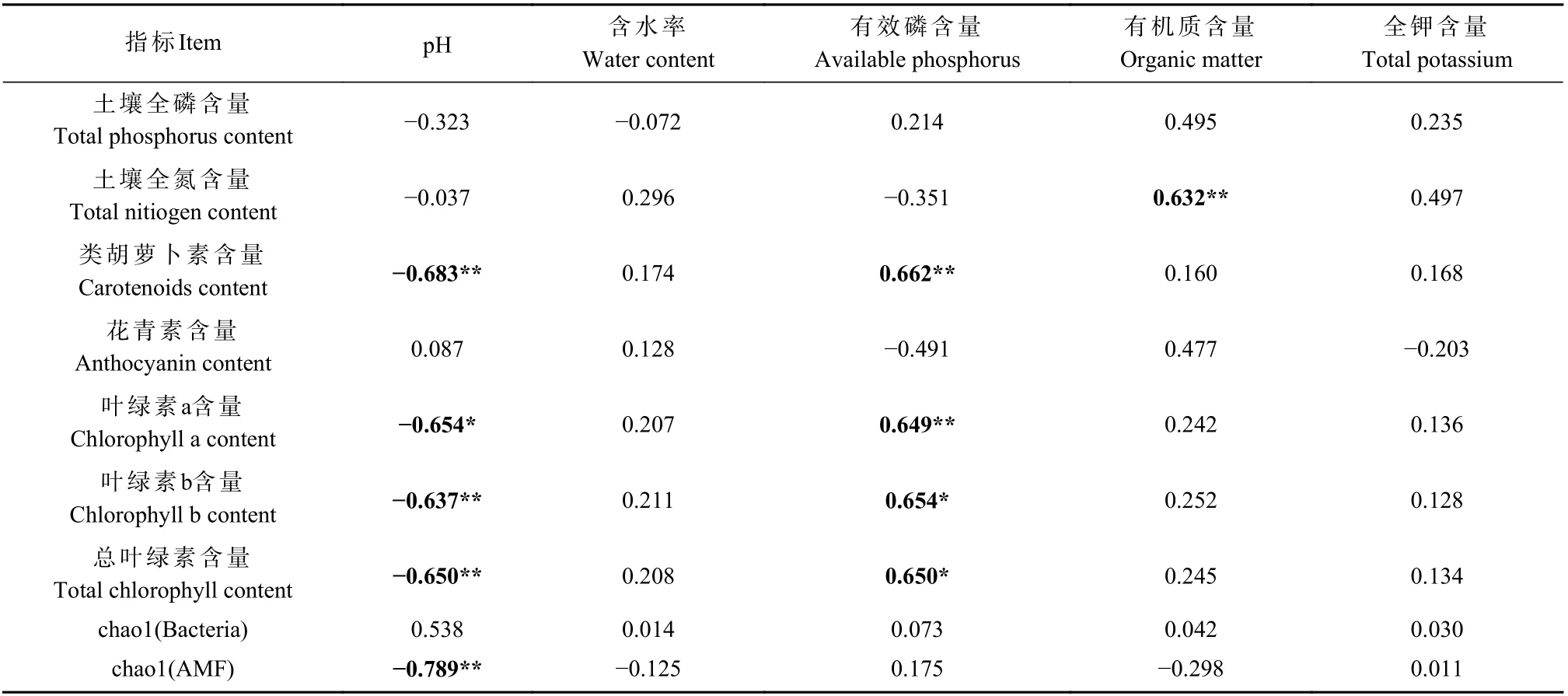
表3 不同接种处理下土壤微生物群落与土壤理化性质、叶色素间的Pearson 相关性分析①Tab.3 Correlation analysis of soil microbial community, soil chemical and physical properties, and leaf pigments, as determined by Pearson correlation analysis
3 讨 论
3.1 对土壤理化性质的影响
氮和磷是最常见的限制植物生长和生产的营养元素(Güsewell, 2004)。钾可以调节植物根系的吸水能力,是促进植物生长重要的营养物质之一(Wanget al., 2013),能够有效提高植物对水分胁迫的耐受性。本研究中,单接种NJ2D、BJ04 和双接种NJ2D+BJ04菌剂后的枫香根际土壤当中的TN、TP、有机质、AP、水分含量和pH 均有所增加。其中,单接种BJ04 后枫香根际土壤的TK 含量增加最多。NJ2D 经鉴定为沙雷氏菌属(Serratiasp)。前人研究表明黏质沙雷氏菌是一种高效的磷酸盐溶解菌(Misraet al., 2012),其促进植物生长的机制之一是增强其固氮、固磷的能力(Selvakumaret al., 2008 , Islamet al., 2010)。 此外,有研究认为,AMF 通过其根外菌丝可以有效提高植物对水分和根际营养物质的吸收,从而帮助其生长(Augéet al., 2014)。由于单接种NJ2D、BJ04 和双接种NJ2D+BJ04 菌剂能够显著提高枫香苗根际土壤养分,可对枫香的生长起到促生长作用。此外,笔者通过微生物多样性分析发现, NJ2D、BJ04 和NJ2D+BJ04会影响到枫香根际的微生物群落结构,土壤微生物群落能够驱动土壤有机质的分解和土壤养分循环(Xuet al., 2019)。NJ2D、BJ04 和双接种NJ2D+BJ04 处理组的枫香根际土壤细菌群落多样性的Chao1 指数较CK 组高。由此推断NJ2D、BJ04 和双接种NJ2D+BJ04 菌剂可在一定程度上提高土壤肥力。
3.2 对叶色表型参数的影响
与其他处理相比,单接BJ04 处理组中的叶绿素和类胡萝卜素含量相对较高,表明接种BJ04 可影响植物的活力,提高植物的抗逆性。Stahl 等(2005)发现叶绿素是影响植物颜色的主要因素,这可能是因为胡萝卜素容易被叶绿素掩盖。因此,单接种BJ04 处理组叶片在深秋时候仍呈现深绿色,可能是因为单接种BJ04 处理组枫香叶片的叶绿素含量最高所致。植物叶片颜色的变化与其叶片花青素的含量密切相关(Liet al., 2018)。花青素是植物重要的次生代谢物,可赋予植物呈现橙色、红色、品红、紫色和蓝色(Huet al.,2015)。在本研究中,双接种NJ2D+BJ04 处理组的花青素含量高于其他各组,而该组的叶绿素含量较低,且双接种NJ2D+BJ04 处理组的枫香叶子颜色要比其他各组更红。上述研究可能在一定程度上解释了枫香深秋叶色变化差异的原因,为通过接种微生物 来培育更丰富的观赏植物叶片颜色 提供了理论依据。另外,由于花青素具有帮助植物抵抗生物和非生物胁迫:如高光强、热环境条件、水分胁迫和营养缺乏、草食动物的攻击和植物渗透平衡的调节的能力(Qiet al.,2011)。因此,笔者进一步推测双接种NJ2D+BJ04 具有减轻植物生物和非生物胁迫的潜力。
3.3 对根际微生物多样性的影响
在根际微生物群落方面,PCA 分析表明,接种外源菌株NJ2D、BJ04 和NJ2D+BJ04 对枫香人工林区枫香根际微生物群落结构产生影响,并且处理组的细菌α 多样性显著高于对照组(P< 0.05),接种后细菌群落快速发生了改变。有研究指出,土壤细菌菌群结构对干扰的反应比其他微生物更为灵敏(Denget al., 2016),并且干扰和扰动可能会增加细菌群落结构之间的相似性(Petsch, 2016),因此,单接种NJ2D、BJ04 和双接种NJ2D+BJ04 菌剂处理组中特有的OTU 较少。值得注意的是,黏质沙雷氏菌NJ2D 处理组和CK 组的细菌群落结构明显不同,这可能是因为NJ2D 的加入使其在枫香根际形成了不受阻碍的竞争类群,从而与CK 组之间形成了差异显著的细菌群落结构。单接种NJ2D、BJ04 和双接种NJ2D+BJ04 菌剂明显影响到枫香根际AMF 群落的Chao1 指数。与对照相比,各处理均未显著增加枫香根际土壤中的AMF Chao1 指数,这可能是因为接种的外源菌株竞争力不如土壤中原有的内源AMF, NJ2D、BJ04 的接种处理仅仅可能只是调节植物选择其特定AMF 的一个诱导剂,证明寄主植物在对其根际AMF 群落的选择时起到了主导性作用(Guyonnetet al., 2017),AMF 菌株在侵染过程中具有专一性和共生特性(Bonfanteet al., 2010)。双接种NJ2D+BJ04 菌剂的处理组与CK 组相比其引起枫香根际AMF 群落结构的差异性更显著,表明其对AMF 群落结构的影响程度更大。这可能是因为双接种NJ2D+BJ04 菌剂对土壤中全氮、有机质含量和土壤含水率的影响较大。
与对照组相比,单接种NJ2D、BJ04 和双接种NJ2D+BJ04 菌剂处理组中的酸杆菌门、绿弯菌门和浮霉菌门的相对丰度值下降,而变形菌门和放线菌门的相对丰度值增加。有研究指出,变形菌门可以促进植物生长(Mendeset al., 2013),放线菌门常常出现在富营养化土壤当中(Yanget al., 2017),变形菌门和放线菌门具有一些共同的特征:包括分解有机物和对植物根际病原菌的抑制功能(Yanget al., 2017)。绿弯菌门常常在极端、压力的生境条件下出现,如干旱、贫瘠和高温的土壤条件下(Yamadaet al., 2009)。在寡营养的土壤条件下,酸杆菌门更容易富集(Leffet al., 2015)。此外,酸杆菌门与土壤pH 呈负相关(Catãoet al., 2014)。经单接种NJ2D、BJ04 和双接种NJ2D+BJ04 菌剂处理后可有效增加枫香根际变形菌门和放线菌门的数量,表明菌剂NJ2D、BJ04 和NJ2D+BJ04 具有改善土壤营养条件和抑制植物根际病原菌的潜力。拟杆菌门(Bacteroidetes)通常与土壤pH 呈正相关(Jeanbilleet al.,2016),且拟杆菌门更适宜在营养物质丰富的生境条件生存。浮霉菌门在与植物竞争营养物质,特别是磷时候被认为是生长缓慢的细菌(Polletet al., 2014)。笔者发现, NJ2D 处理组的pH 以及NJ2D 处理组中的拟杆菌门的丰度均高于CK 组。但是在土壤pH 值相对较低的CK 组中,其浮霉菌门的数量相对较高。上述现象表明,拟杆菌门丰度的增加极有可能与土壤pH 值的增加有关。此外, NJ2D 处理组中拟杆菌门丰度的增加也可能是其促进枫香生长的原因之一。另外,在本研究中发现, NJ2D 处理组中的链霉菌属的相对丰度较高。有研究发现,链霉菌属是一类有效的生物防治剂菌种资源(Shekharet al., 2006)。表明接种NJ2D处理的枫香幼苗对病原菌的抵抗能力在一定程度上得到提高。
球囊霉属和根生囊霉属是土壤当中最为丰富的属。CK 组中根生囊霉属的相对丰度值高于其他各处理组。有研究发现根生囊霉属通过与病原菌竞争营养物质、空间以及通过提高植物对逆境环境(如重金属污染和高盐)的耐受性来促进寄主植物的生长(Siddiqui and Akhtar, 2008)。由此可见,单接种NJ2D、BJ04 或者双接种NJ2D+BJ04 菌剂后均可在一定程度上提高土壤养分,促进枫香生长。此外,双接种NJ2D+BJ04 菌剂处理组中的球囊霉属相对丰度值与CK 组相似,且黏质沙雷氏菌NJ2D 和摩西斗管囊霉BJ04 处理组中球囊霉属的相对丰度值也与CK 组相似。球囊霉属在所有样本中均普遍存在,这与Biermann 和Linderman(Biermann and linderman, 1983)和 Daniell 等(Daniellet al., 2001)的研究结果一致,源于球囊霉属具有很高的产孢率和快速定殖的能力。一些研究发现,引入本地微生物可以避免土著菌株与引入的外来菌株之间的拮抗关系(Pellegrinoet al., 2011)。NJ2D 筛选自枫香根际土样, BJ04 筛自桃树根际中,单独接种NJ2D、BJ04 均能够降低枫香根际球囊霉属的丰度值,而单接种NJ2D 引起的球囊霉属相对丰度值变化比单接种BJ04 菌剂处理组的大,表明NJ2D 对枫香根际球囊霉属丰度值及整个AMF 群落结构具有较强的修饰能力。
4 结 论
在本研究中,笔者发现单接NJ2D、BJ04 和双接种NJ2D+BJ04 均可以有效改善枫香根际土壤养分和叶色素含量。在枫香根际接种NJ2D、NJ2D+BJ04 可形成独特的细菌、AMF 群落结构。这说明NJ2D 和NJ2D+BJ04 外源性菌剂的接种是影响枫香根际细菌、AMF 群落结构的重要因素。另外,土壤TN、TK、有机质、AP、水分和pH 对枫香根际细菌、AMF 群落结构变化的会产生一定的影响。以上结果为开发适合枫香生长的微生物菌肥提供了理论和实践依据。

