丛枝菌根真菌对低磷胁迫下核桃幼苗根系磷吸收的影响及机制*
曹明奡 张 菲 黄光明 刘瑞成 刘利平 吴强盛 徐永杰
(1.长江大学园艺园林学院/西藏高原核桃产业研究所 荆州 434025;2.黄冈师范学院 经济林木种质改良与资源综合利用湖北省重点实验室 黄冈 438000;3.湖北省林业科学研究院 武汉 430075)
磷(P)是植物生长发育不可缺少的营养元素之一,不仅参与光合作用、核苷酸合成、信号转导以及能量传递等多种代谢过程,还是蛋白质和脂质等生物大分子的重要组成部分。土壤中20%~80%的P 以有机形态存在,这些有机P 很难被植物根系直接吸收,必须被磷酸酶转化(Shaoet al.,2021)。此外,土壤速效P也容易被土壤中的铁和铝等固定,导致土壤P 不足,是作物产量的主要限制因素之一(Izabelaet al.,2019)。施P 肥可补充土壤P 不足,然而P 肥会消耗不可再生的磷矿储量,如何提高植物对P 的吸收是农林业生产需要解决的一个重要课题。
核桃(Juglans regia)为胡桃科(Juglandaceae)胡桃属(Juglans)多年生落叶乔木,既是优质的用材树种,也是营养丰富的食用干果树种和珍贵的油料树种。P是核桃生长发育必需的营养素之一,特别是果实的产量和品质直接受土壤和核桃植株P 含量的影响(Yuet al.,2011)。然而,核桃园土壤肥力普遍偏低,特别是有效P 含量,导致核桃果实产量不高,油脂含量低(张翠萍,2014)。核桃根际存在某些有益的丛枝菌根(arbuscular mycorrhizal,AM)真菌,这些AM 真菌能够侵入核桃根系建立丛枝菌根共生体(Liet al.,2021)。研究表明,AM 真菌[如摩西球囊霉(Glomus mosseae)和根内球囊霉(G.intraradices)]接种在核桃组培苗上可显著提高移栽成活率(Dolcet-Sanjuanet al.,1996)。Huang 等(2020)在‘辽河一号’核桃(J.regiacv.Liaohe 1)上接种5 种AM 真菌 [细凹无梗囊霉(Acaulospora scrobiculata)、沾屑多样孢囊霉(Diversisporaspurca)、幼套球囊霉(G.etunicatum)、摩西球囊霉(G.mosseae)和地表球囊霉(G.versiforme)] 后发现植株生长明显改善,其中沾屑多样孢囊霉促进效果明显。Cheng 等(2020)研究发现,接种AM 真菌可提高'辽河一号'核桃叶片的P、K、Mg、B、Fe、Zn 和Cu 含量。在正常水分和干旱胁迫条件下,摩西球囊霉、幼套球囊霉及二者混合物均可增加核桃叶片的N、P 和Zn 含量(Behroozet al.,2019)。已有研究表明,AM 真菌通过根外菌丝网络从根系无法接触的土壤区域将无机磷酸盐转运到宿主植物,并通过AM 真菌高亲和力的磷转运基因(如RiPT7)、向根际分泌磷酸酶以及上调宿主根系磷转运基因表达水平,促进宿主P 的吸收(Zuccaro,2019;Shaoet al.,2021; Xieet al.,2022)。目前,AM 真菌是否并如何通过磷转运基因调控根际磷酸酶活性促进核桃根系P 吸收尚不清楚。鉴于此,本研究采用低P 胁迫处理核桃幼苗并接种AM 真菌,探索低P 胁迫下AM 真菌对核桃幼苗根系 P 吸收的影响及机制,以期为核桃幼苗的栽培生产提供参考。
1 材料与方法
1.1 试验设计
采用2×2 双因素试验设计。因素一为沾屑多样孢囊霉接种和不接种处理;因素二为P 处理,包括适P(100 μmol·L-1)和低P(1 μmol·L-1)。试验共4 个处理,每处理重复8 次,共32 盆,每盆定植1 株核桃幼苗,随机排列。
1.2 试验处理
以‘辽河一号’核桃为材料,其种子由湖北省保康县核桃技术推广中心提供。种子预先用体积分数75%的乙醇表面消毒,灭菌水润洗后,播种于经高温高压(121℃,0.11 MPa,2 h)灭菌的河沙中,在昼夜温度28 ℃ /20 ℃、相对湿度80% 的培养箱内催芽。待长出4 片真叶后移栽至塑料盆(2.4 L)中,盆栽基质为河沙。为防止基质中原有P 元素对试验的干扰,使用前先经酸洗脱并用蒸馏水洗净,后在高温、高压(121 ℃,0.11 MPa)下灭菌2 h。
基于前期筛选的1 个高效AM 真菌菌株——沾屑多孢囊霉(Huanget al.,2020;Chenget al.,2020),移栽时进行沾屑多孢囊霉的接种。该菌种保存于长江大学根系生物学研究所,经白三叶(Trifolium repens)扩繁3 个月后,收获被AM 真菌侵染的根段(菌根侵染率在95%以上)与含AM 真菌的栽培基质(孢子密度为15 个·g-1)作为菌剂。接种AM 真菌处理的植株每盆施入120 g 菌剂,不接种处理施入等量灭菌的菌剂,并添加等量菌剂的过滤灭菌液2 mL 以保持除目的菌种以外的微生物区系一致性。接种1 周后,进行P 胁迫处理。通过控制Hoagland 营养液(pH7.0)中的KH2PO4浓度调节盆栽基质P 浓度,其中100 μmol·L-1KH2PO4为适P 处理(李永夫等,2010),1 μmol·L-1KH2PO4为低P 处理。每盆、每3 天加营养液150 mL。此外,营养液浇灌每3 次后的次日以100 mL 重蒸水施入以洗去基质残留的营养液,防止P 积累。所有处理的核桃苗置于长江大学的塑料温室中进行苗木培养,3 个月后收获植物和土壤材料。
1.3 指标测定
收获时将植株分成地上部分和地下部分,测定各自的鲜质量。
根系菌根侵染判断依据Phillips 等(1970)方法。利用卷尺测量主根长度,使用Epson 扫描仪对根系进行扫描,应用WinRHIZO 2007 软件分析根系形态参数。运用ICP 光谱仪测量根系P 含量。根系酸性磷酸酶活性采用对硝基苯酚磷酸二钠比色法(Mclachlanet al.,1987)测定。土壤磷酸酶活性采用磷酸苯二钠法(赵兰坡等,1986)测定。
通过NCBI 数据库获取拟南芥紫色酸性磷酸酶分泌基因(AtPAP10和AtPAP12,可水解有机磷)和磷转运基因(AtPT3;1和AtPT3;3,可促进植物在缺P 条件下对P 的吸收)序列。经过核桃基因组数据库(http://aegilops.wheat.ucdavis.edu/Walnut/data.php)比对分析,使用Primer Premier 5.0 软件设计JrPAP10、JrPAP12、JrPT3;1、JrPT3;3基因引物序列(表1),由上海生物工程有限公司合成。根样总RNA 采用植物专用RNA提取试剂盒(Aidlab) 进行,然后利用反转录试剂盒(Takara)进行RNA 反转录。以反转录的cDNA 为模板,以核桃的18S rRNA作为内参基因进行qRT-PCR扩增。实时荧光定量表达分析采用荧光染料法进行,每处理3 个生物学重复。采用2-ΔΔCt方法(Livaket al.,2001)计算基因相对表达量。

表1 qRT-PCR 中的基因引物序列Tab.1 The primer sequence of genes in qRT-PCR
1.4 统计分析
采用SAS 软件的GLM 过程进行双因素(沾屑多样孢囊霉接种和P 处理)方差分析,应用邓肯多重比较法分析(P< 0.05),使用SAS 软件分析皮尔逊相关系数。
2 结果与分析
2.1 根系菌根侵染
未接种AM 真菌的核桃根系未观察到任何菌根结构,接种沾屑多样孢囊霉处理的核桃幼苗根系发现菌根侵染(图1)。接种沾屑多孢囊霉的植株在低P(1 μmol·L-1)和适P(100 μmol·L-1)条件下根系菌根侵染率分别为53.2%±3.6% 和45.6%±4.9%(均值±SD),且低P 处理显著提高根系菌根侵染率。
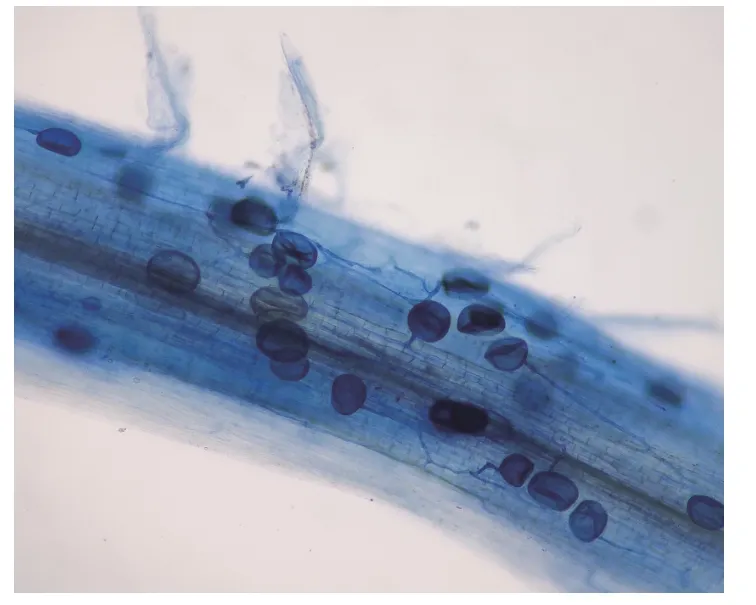
图1 核桃根系被沾屑多孢囊霉侵染Fig.1 Root colonization of walnut by D.spurca
2.2 低P 胁迫下AM 真菌对核桃幼苗生长的影响
与适P 处理相比,低P 胁迫显著降低地上部、地下部及总生物量(表2)。此外,在低P 和适P 条件下,接种AM 真菌均显著提高植物地上部、地下部及总生物量,低P 下分别提高56%、52%、51%,适P 下分别提高56%、27%、27%。交互作用结果显示,AM 真菌处理和P 处理均显著提高生物量,但二者间没有显著的交互作用。
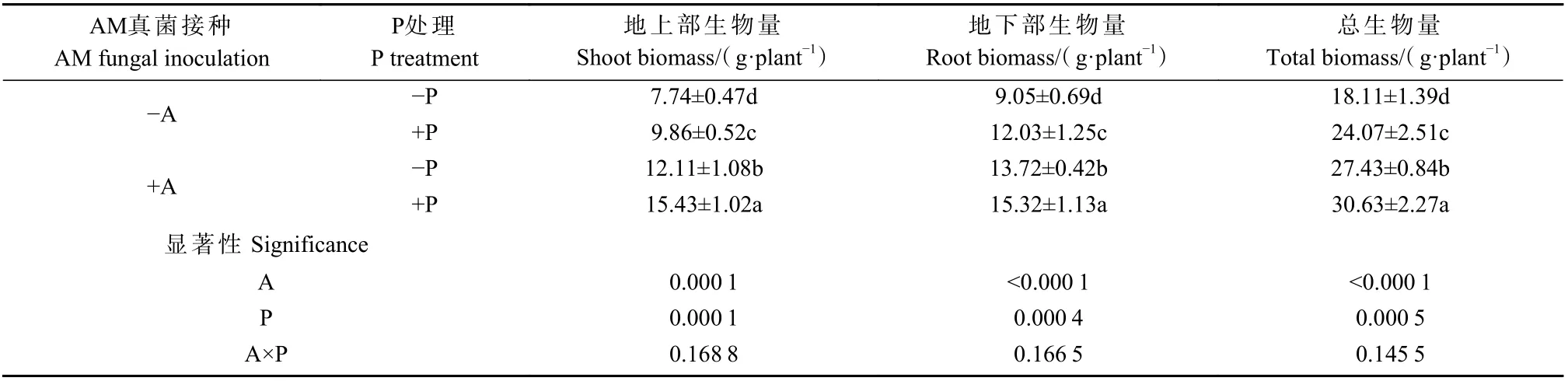
表2 低P 胁迫下沾屑多孢囊霉对核桃幼苗生物量的影响①Tab.2 Effects of D.spurca on biomass of walnuts seedlings under low P stress
2.3 低P 胁迫下AM 真菌对核桃幼苗根系形态的影响
在适P 条件下,接种AM 真菌提高根系体积48%,降低根平均直径12%,对总长、投影面积以及表面积无显著影响(表3)。在低P 条件下,接种AM 真菌显著提高根系总长、投影面积、表面积、平均直径和体积,分别提高21%、27%、28%、29% 和45%。AM 真菌接种显著影响根系总长、表面积和体积,P 处理对根系形态没有影响,AM 真菌和P 对根系投影面积和平均直径存在显著交互作用。
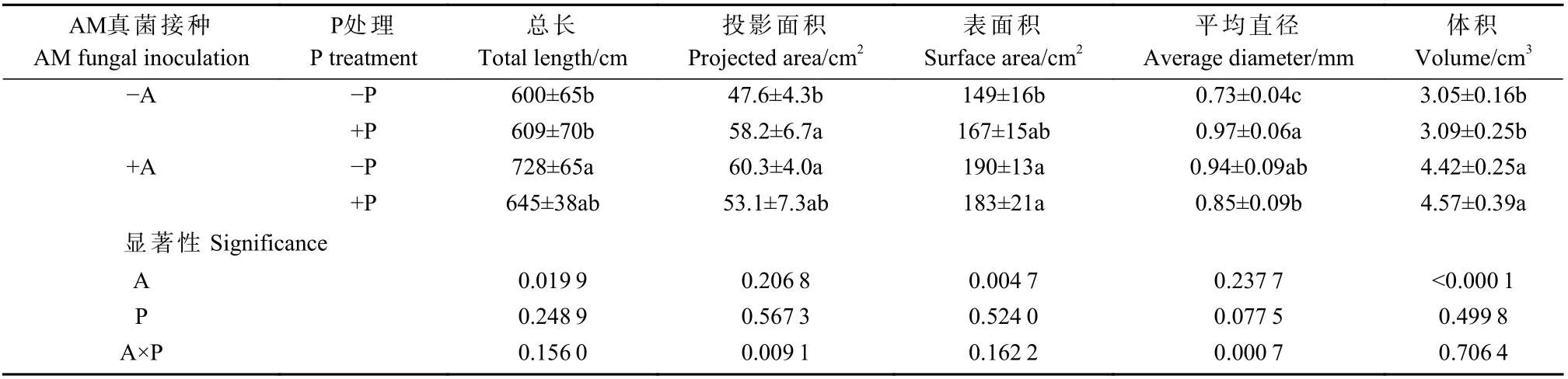
表3 低P 胁迫下沾屑多孢囊霉对核桃幼苗根系形态的影响①Tab.3 Effects of D.spurca on root morphology of walnut seedlings under low P stress
2.4 低P 胁迫下AM 真菌对核桃幼苗根系P 含量和酸性磷酸酶活性的影响
未接种AM 真菌条件下,低P 处理显著降低根系P 含量65%;接种AM 真菌条件下,低P 处理降低根系P 含量11%(图2A)。此外,低P 胁迫下接种AM 真菌显著增加根系P 含量51%,适P 条件下接种AM 真菌对根系P 含量无显著影响。P 胁迫仅对菌根化植株根系酸性磷酸酶活性有促进效应。适P 条件下,AM真菌接种对根系酸性磷酸酶活性没有显著影响;低P条件下,AM 真菌接种显著地提高根系酸性磷酸酶活性11%(图2B)。交互作用分析显示,单一AM 真菌处理和P 处理均显著影响了系P 含量和根系酸性磷酸酶活性,且两因素仅显著交互影响根系P 含量(表4)。
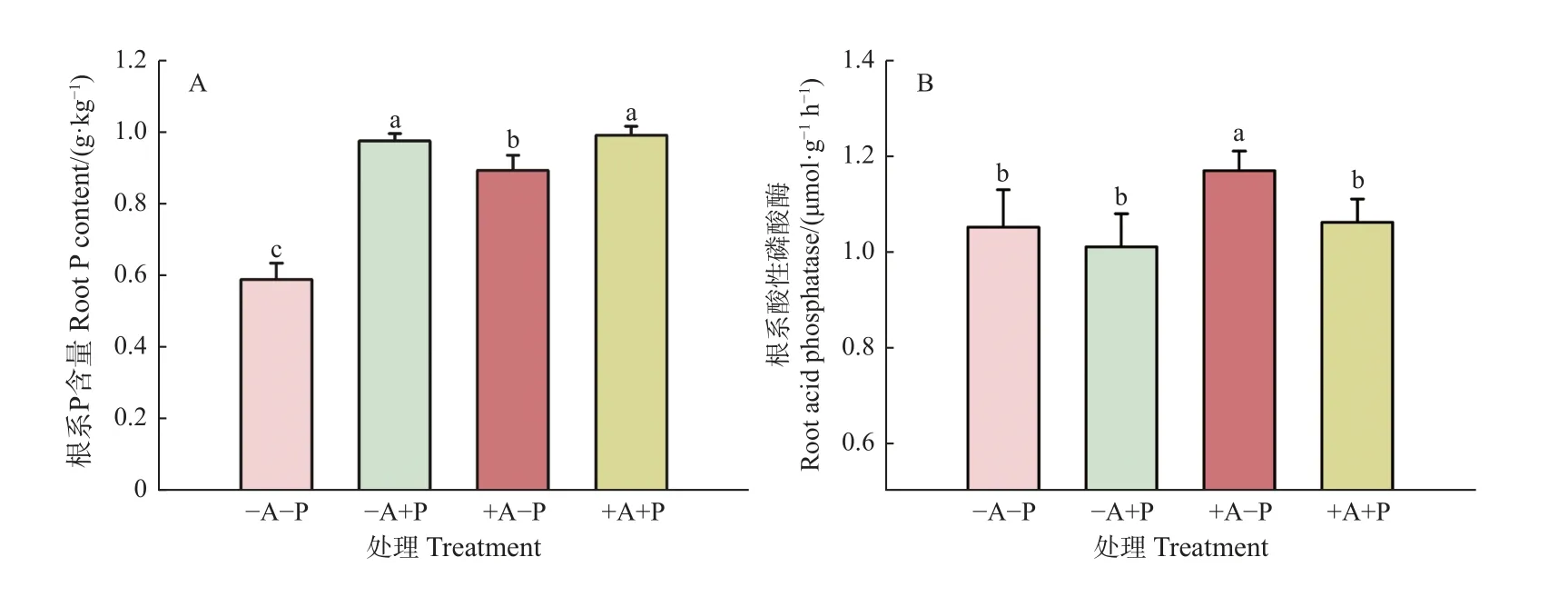
图2 低P 胁迫下沾屑多孢囊霉对核桃幼苗根系磷含量(A)和酸性磷酸酶活性(B)的影响Fig.2 Effects of D.spurca on root P content (a) and acid phosphatase activity (b) of walnut seedlings under low P stress
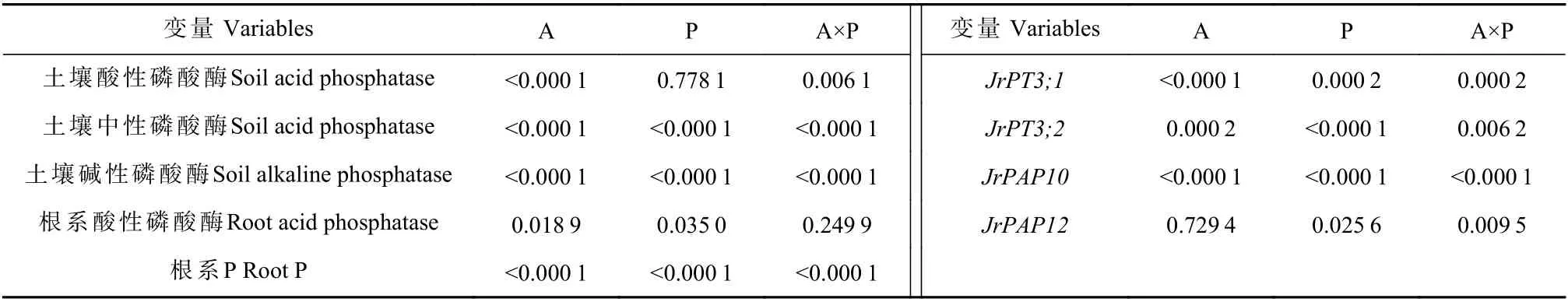
表4 AM 真菌处理(A)和P 处理(P)间变量的交互作用显著性Tab.4 Variable significance of the interaction between AM fungal inoculation (A) and P treatments (P)
2.5 低P 胁迫下AM 真菌对核桃幼苗土壤磷酸酶活性的影响
与适P 处理相比,低P 处理仅抑制非菌根化植株土壤碱性磷酸酶活性,对土壤酸性和中性磷酸酶无显著影响(图3)。相反,在菌根化植株上,低P 处理提高土壤酸性和中性磷酸酶活性,但降低碱性磷酸酶活性。另一方面,在低P 和适P 条件下,接种AM 真菌均对土壤酸性、中性和碱性磷酸酶活性有显著提高作用(图3),分别在低P 下提高47%、220%、164%以及适P 下提高15%、66%、162%。AM 真菌和P 处理显著交互影响土壤各磷酸酶活性(表4)。由此可见,低P状态下,AM 真菌对土壤酸性和中性磷酸酶活性的提升效果明显高于适P 条件,这表明AM 真菌在P 缺乏条件下更能促进土壤酸性和中性磷酸酶活性。
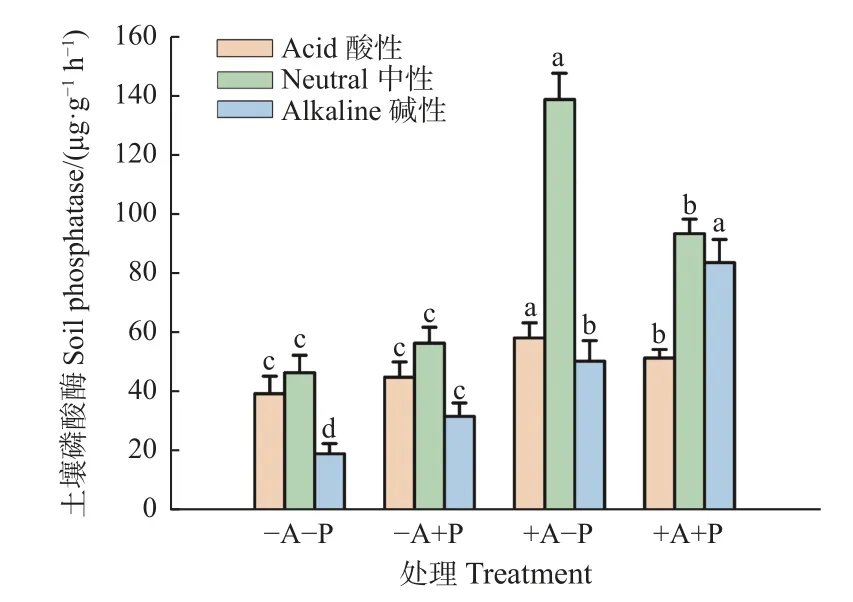
图3 低P 胁迫下沾屑多孢囊霉对核桃土壤磷酸酶活性的影响Fig.3 Effects of D.spurca on soil phosphatase activity of walnuts under low P stress
2.6 低P 胁迫下AM 真菌对核桃幼苗根系酸性磷酸酶分泌基因和磷转运基因表达量的影响
低P 和适P 处理下接种AM 真菌, 均根系JrPAP10的相对表达量分别提高1 570% 和96%(P<0.05)(图4A)。低P 胁迫下接种AM 真菌,根系JrPAP12的相对表达量提高35%(P<0.05),适P 处理时接种AM 真菌对根系JrPAP12的相对表达量无显著影响。此外,低P 和适P 条件下接种AM 真菌,根系JrPT3;1的相对表达量分别提高354% 和83%(P<0.05)(图4B)。低P 胁迫下接种AM 真菌,根系JrPT3;2的表达量降低45%,但对适P 条件下根系JrPT3;2的表达量无显著影响。AM 真菌和P 处理均显著交互影响根系JrPT3;1、JrPT3;1、JrPAP10和JrPAP12的表达水平(表4)。

图4 P 胁迫下沾屑多孢囊霉对核桃根系酸性磷酸酶分泌基因(a)和磷转运蛋白基因(b)表达量的影响Fig.4 Effect of D.spurca on the relative expression of acid phosphatase secretion genes (a) and phosphate transporter protein genes (b) of walnut roots under P stress
2.7 相关性分析
根系P 与土壤碱性磷酸酶活性、根系JrPAP12相对表达量、根系投影面积、根系表面积以及根平均直径呈显著正相关(P< 0.05),与根系JrPT3;2相对表达量呈极显著负相关(P< 0.01)(表5)。菌根侵染率与土壤酸性、中性、碱性磷酸酶、根表面积、体积以及根系JrPT3;1 和JrPAP10的相对表达量呈极显著正相关,与根总长呈显著正相关。

表5 核桃根系磷含量与相关变量的相关性①Tab.5 Relationship between P content and relevant variables of walnut roots
3 讨论
沾屑多孢囊霉可与‘辽河一号’核桃根系建立菌根共生体,且低P 处理促进根系菌根侵染率,与黄京华等(2006)研究玉米(Zea mays)幼苗在低P 胁迫菌根侵染率升高一致。AM 真菌侵染率往往与宿主根际基质P 含量呈负相关,低P 状态刺激菌丝的长度及菌根的形成(Wuet al.,2015)。本研究中,低P 处理显著降低核桃幼苗生物量,但接种AM 真菌在不同程度缓解低P 胁迫对核桃幼苗生物量的抑制影响,且在低P 条件下菌根促进生长作用要高于适P 条件下,说明菌根的作用在低P 条件下更突出(黄京华等,2006)。
根系是植物的重要吸收器官,也是土壤与植物的动态界面,根系的生长和形态构建与环境中养分的供应和利用率密切相关,且具有很大可塑性,能被AM真菌调控(Liuet al.,2021)。本研究发现,适P 条件下接种AM 真菌仅显著提高根系体积,而低P 条件下接种AM 真菌显著提高根系总长、投影面积、表面积、平均直径和体积,从而导致菌根化的植株能接触到更多的土壤区域,进而有利于植物对P 的吸收,与Shao等(2021)在低P 胁迫下茶树(Camellia sinensis)上接种幼套球囊霉提高根系形态的结果一致。接种AM 真菌能显著改善核桃根系构型且在低P 条件下响应更强烈。此外,根系P 含量与根系投影面积、表面积以及平均直径呈显著正相关,AM 真菌改善根系构型是影响植物吸收P 的重要原因(Zhanget al.,2018a)。
土壤有机P 是土壤全P 的重要组成部分,占20%~50%,需在土壤磷酸酶的作用下转化为无机P后才能被根系吸收(Zuccaro,2019)。本研究发现,接种AM 真菌对低P 和适P 条件下土壤酸性、中性和碱性磷酸酶活性均显著提升,与Yang 等(2021)在枳(Poncirus trifoliata)实生苗上接种摩西管柄囊霉提高土壤酸性、中性和碱性磷酸酶活性的结果一致,且低P 状态下接种AM 真菌对土壤磷酸酶活性的提升更明显。植物在低P 条件下生长受抑制,菌根通过增加植物向根系分泌磷酸酶,从而促进植物P 的吸收(Smithet al.,2003)。此外,AM 真菌在根外菌丝招募溶磷细菌并促进其分泌磷酸酶,有利于土壤有机磷的矿化(Jianget al.,2021;Zhanget al.,2018b; 2018c)。本研究显示,菌根侵染率与土壤酸性、中性和碱性磷酸酶均呈极显著正相关,表明菌根促进土壤碱性磷酸酶活性的提升而显著影响根系P 含量。另一方面,低P 处理下接种AM 真菌可提高核桃根系酸性磷酸酶活性。已知菌根菌丝、液泡和丛枝中包含酸性磷酸酶(Aarleet al.,2010),低P 条件比适P 条件显著促进沾屑多孢囊霉对核桃根系的侵染,说明菌根侵染率的增加可能促进根系磷酸酶的活性,并加快向根际释放。酸性磷酸酶能催化多聚磷酸盐分解(Tatsuhiroet al.,2010),从而促进植物对P 的吸收。
本研究表明,低P 处理下接种AM 真菌显著诱导根系JrPAP10和JrPAP12的表达(尤其是JrPAP10),与舒波(2013)的研究结果一致。相关性分析表明,根系JrPAP10与根系菌根侵染率和根系酸性磷酸酶活性(r= 0.72,P< 0.01)均呈极显著正相关,表明低P 条件下AM 真菌促进根系酸性磷酸酶活性与AM 真菌诱导根系JrPAP10表达有关。此外,根系P 含量与JrPAP12表达量呈显著正相关。因此,菌根可以通过间接地对酸性磷酸酶基因的表达产生影响,进而改善植物P 的吸收功能。
AM 真菌能促进植物对P 的吸收,尤其在土壤营养匮乏的环境中,菌根菌丝对P 的传递作用更显著(薛英龙等,2019)。本研究表明,低P 胁迫显著降低根系P 含量,且只有在低P 条件下AM 真菌才显著提高核桃根系P 含量,适P 条件下则无显著影响。适P条件下植物根系能吸收到足够的P,因此菌根的作用不显著;而低P 条件下,植物吸收不到足够的P,需在AM 真菌的帮助下增强土壤磷酸酶活性,促进土壤有机磷水解,且其菌丝能伸展到根系不能到达的区域摄取额外的P 以满足植物对P 的需求(Zuccaro,2019)。
AM 真菌通过诱导植株根系的高亲和力磷转运基因高效表达,增强植物对P 的吸收并转移到相应的部位(薛英龙等,2019)。本研究表明,低P 和适P 条件下AM 真菌均上调根系JrPT3;1的相对表达量,且菌根侵染率与JrPT3;1极显著正相关,与刘春艳等(2017)在低P 胁迫下接种摩西管柄囊霉诱导枳根系PtaPT3、PtaPT5和PtaPT6表达的研究结果一致。然而,低P条件下AM 真菌却抑制根系JrPT3;2的相对表达量,根系P 含量与根系JrPT3;2的相对表达量呈极显著负相关,可能JrPT3;2是一个低亲和力的磷转运基因,而菌根能够特异地诱导某些高亲和力磷转运基因如玉米ZmPT9的表达水平(Rauschet al.,2001; Xuet al.,2018)。本研究中,JrPT3;1在低P 条件下被沾屑多孢囊霉诱导,增加354%,因此,JrPT3;1是否是一个沾屑多孢囊霉特异诱导的磷转运基因,JrPT3;1在含有丛枝的根系皮层细胞中的功能,还待深入研究。
4 结论
低P 胁迫抑制核桃幼苗根系发育,降低生物量、根系P 含量、土壤碱性磷酸酶活性以及JrPAP12的表达。而在低磷胁迫下接种AM 真菌诱导JrPAP10、JrPAP12和JrPT3;1基因的表达,促进土壤以及根系磷酸酶活性,改变根系构型,从而提高植物P 吸收和生物量积累,但AM 真菌接种在适P 条件下并没有在低P 条件下对核桃幼苗根系P 含量改善显著。因此,在生产实践中,可在土壤相对贫瘠的核桃园引入AM真菌或者核桃育苗过程中接种AM 真菌,培育菌根化核桃苗,用于各种土壤的定植。

