基于羟基自由基高级氧化快速杀灭锥状斯氏藻孢囊的研究
郭枫,李超,白敏冬*,林艳强,贺霄,郑琦琳
(1. 厦门大学 福建省海洋生物资源开发利用协同创新中心 滨海湿地生态系统教育部重点实验室 环境与生态学院,福建 厦门 361102; 2. 厦门大学 海洋与地球学院,福建 厦门 361102)
基于羟基自由基高级氧化快速杀灭锥状斯氏藻孢囊的研究
郭枫1,李超2,白敏冬1*,林艳强1,贺霄1,郑琦琳1
(1. 厦门大学 福建省海洋生物资源开发利用协同创新中心 滨海湿地生态系统教育部重点实验室 环境与生态学院,福建 厦门 361102; 2. 厦门大学 海洋与地球学院,福建 厦门 361102)
随着船舶压载水的转运,我国面临严重的外来入侵生物风险,其中部分赤潮藻形成的孢囊可成为赤潮的“种源”,严重危害近岸海洋环境,因而快速有效地杀灭赤潮藻孢囊至关重要。本文利用大气压强电离放电高效生成的羟基自由基(·OH),对典型赤潮藻锥状斯氏藻孢囊进行杀灭研究。采用萌发实验、SYTOX Green荧光染色法确定·OH杀灭锥状斯氏藻孢囊的阈值和时间,扫描电子显微镜观察孢囊的形态变化。结果表明,·OH杀灭孢囊的CT阈值为0.49 mg·min/L,时间为10 s,·OH氧化降解孢囊体内叶绿素,破坏DNA,抑制萌发,具有其他方法无法比拟的优势。因此,·OH快速杀灭赤潮藻孢囊的新方法,对防控外来入侵生物引发的海洋赤潮灾害具有重要的作用。
羟基自由基;强电离放电;赤潮;休眠性孢囊;锥状斯氏藻
1 引言
海洋赤潮的频繁暴发、范围扩大,加剧了海洋灾害,影响了海洋生物的生存,对我国近岸海域环境质量亮出了红牌。部分海洋赤潮暴发的主要成因之一是累积于海底沉积物的处于休眠状态的赤潮藻孢囊,也被称为赤潮的“种源”,在合适条件下萌发并且大量繁殖,形成大规模赤潮[1]。此外,远洋船舶压舱水中的外来赤潮藻在极端特有的无光、缺氧条件下“钝化”或“休眠”产生具有保护机制的孢囊,随压载水排放入侵到中国海域,若要从源头上阻断海洋生物入侵,最关键的是杀灭压载水中的孢囊。锥状斯氏藻(Scrippsiellatrochoidea)是分布于世界各地的典型赤潮藻,其有性生殖形成的休眠性孢囊广泛存在于我国沿海海域沉积物中,由其引发的赤潮破坏了海洋生态环境,造成了重大经济损失[2—3]。
基于高级氧化技术的羟基自由基(·OH)是绿色强氧化剂,能在数秒内完成整个生化反应过程,剩余的·OH分解成H2O和O2,无任何残余药剂。·OH杀灭赤潮藻孢囊的剂量与其比表面积成反比,而藻孢囊与海洋中生物如鱼虾的比表面积相差甚大,杀灭藻孢囊的·OH剂量对鱼虾等海洋生物几乎无影响。2002年,本课题组在山东龙口天然海域,进行了6.0 m3围隔·OH杀灭海洋赤潮生物试验研究,围隔中赤潮生物含量达到1 380×104cells/mL,含有膝沟藻(Gonyaulax)孢囊及多甲藻(Peridinium)孢囊,·OH海面喷洒杀灭99.8%的赤潮生物及100%的孢囊[8]。本研究利用大气压强电离放电高效生成·OH,对典型赤潮藻锥状斯氏藻孢囊进行杀灭研究,采用SYTOX Green荧光染色法确定·OH杀灭的阈值和时间,利用扫描电子显微镜观察孢囊形态变化。
2 材料与方法
2.1 实验材料
本文采用氮限制诱导生成锥状斯氏藻孢囊,获得孢囊母液[9]。锥状斯氏藻(Scrippsiellatrochoidea)藻种由厦门大学海洋微型生物保种中心提供,培养基为缺氮f/2配方,培养温度为(22±1)℃,光照强度为2 000 lx,光暗比为12L∶12D,孢囊浓度为1×103~2×103cells/mL,经15 μm网筛过滤后收集母液待用。
2.2 实验流程
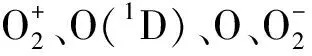
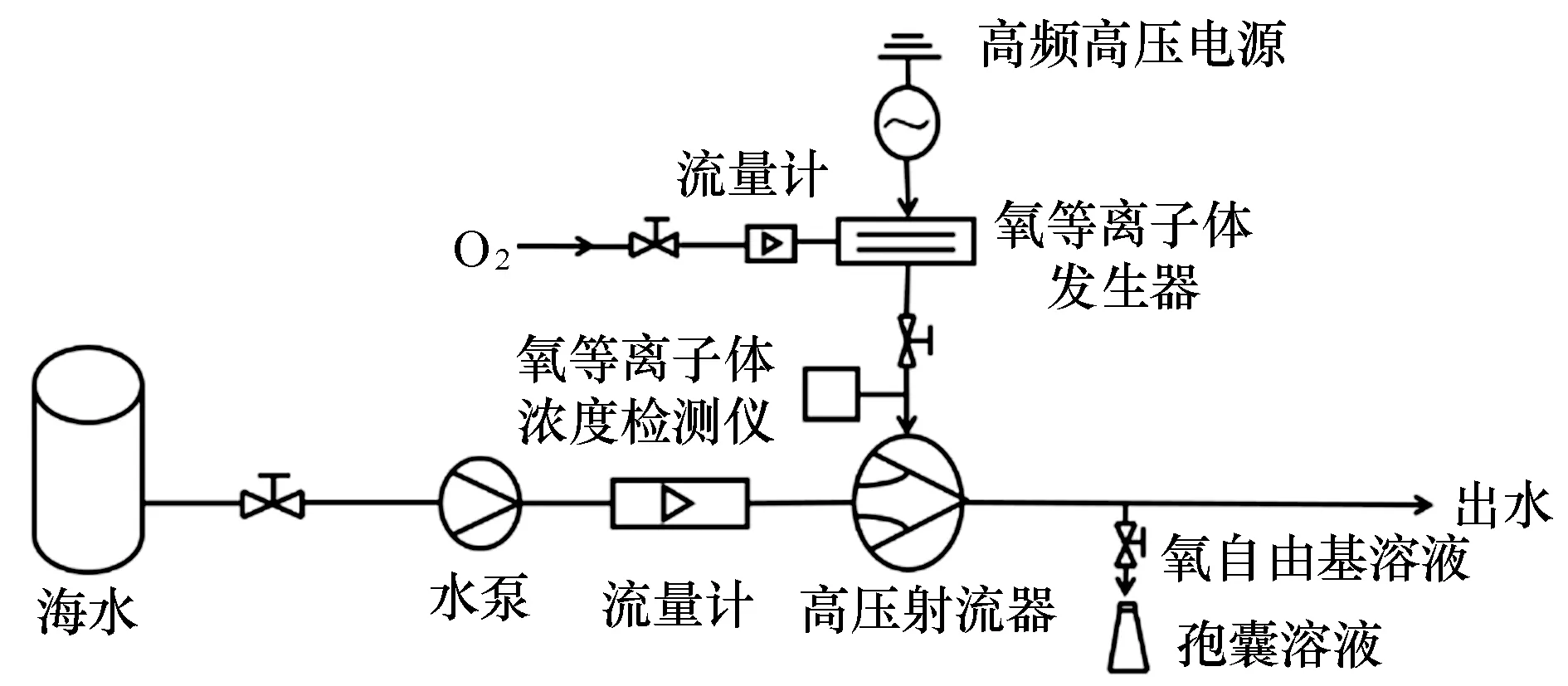
图1 ·OH杀灭锥状斯氏藻孢囊的实验系统Fig.1 Schematic of ·OH treatment system for the inactivation of S.trochoidea cysts
2.3 检测方法
2.3.1 TRO检测
其三,农村中学生语文底子薄,基础不扎实。大多农村孩子,童年时代的启蒙教育几乎是缺失的,他们无法享受到城市儿童那样的社会文化和家庭文化的熏陶,即使是跨进了小学的校门,也只能获得教材上有限的知识内容。
TRO浓度采用DPD(N,N-二乙基对苯二胺)分光光度法进行测定,依据USEPA标准330.5建立,使用BioQuest CE2501型紫外-可见分光光度计测定,本研究TRO在0.88~2.42 mg/L。
2.3.2 锥状斯氏藻孢囊死活判定
采用荧光计数法判断锥状斯氏藻孢囊死活,SYTOX Green核酸染料可进入死亡细胞结合DNA发出绿色荧光[11]。本实验中染料浓度1 μmol/mL,染色时间10 min,使用Leica DM6000B型荧光显微镜观察孢囊,活孢囊在488 nm波长激发后发出红色叶绿素荧光,死孢囊在488 nm波长激发后发出绿色荧光。
2.3.3 萌发实验
经过20 d强制休眠期后,对杀灭前后孢囊的萌发率进行检测,在正置显微镜下,利用特制细胞针挑选30个孢囊放入装有f/2培养基的96孔培养皿中,每孔1个孢囊,培养温度为(22±1)℃,光照强度为2 000 lx,光暗比为12L∶12D,每天观察孢囊萌发情况,计算萌发率。
2.3.4 锥状斯氏藻孢囊形态变化
利用扫描电子显微镜观察锥状斯氏藻孢囊的形态变化,杀灭前后的孢囊经过固定-脱水-冷冻干燥-喷金,使用LEO 1530型扫描电镜系统观察。
3 结果与讨论
3.1 ·OH杀灭锥状斯氏藻孢囊的阈值
采用不同TRO浓度杀灭560 cells/mL的锥状斯氏藻孢囊,杀灭时间为10 s,荧光染色判断孢囊死活,·OH杀灭孢囊的CT值如图2所示,其中C为TRO浓度,T为杀灭时间。结果表明,随着CT值的增加,活孢囊数量显著下降;当CT值达到0.40 mg·min/L时,活孢囊从560 cells/mL下降为20 cells/mL;当·OH杀灭阈值为0.49 mg·min/L时,孢囊被全部杀灭。
据查阅文献所知,过氧化氢法CT值达到144×104mg·min/L时,杀灭了32%的链状裸甲藻孢囊[4],其CT值是·OH法的293×104倍;甲萘醌法CT值达到240.0 mg·min/L时,对链状亚历山大藻孢囊杀灭率达到70%[6],其CT值是·OH法的490倍;蛋白酶抑制剂法杀灭链状亚历山大藻孢囊的CT阈值高达300 mg·min/L[7],其CT值是·OH法的610倍。大气压强电离放电产生·OH,杀灭锥状斯氏藻孢囊的CT阈值仅为0.49 mg·min/L,是基于·OH氧化还原电位高达2.80 V,能破坏具有坚硬外壁的孢囊,·OH化学反应速率常数高达109M-1·s-1[12],可在数秒内快速杀灭,与其他方法相比具有无可比拟的优势。
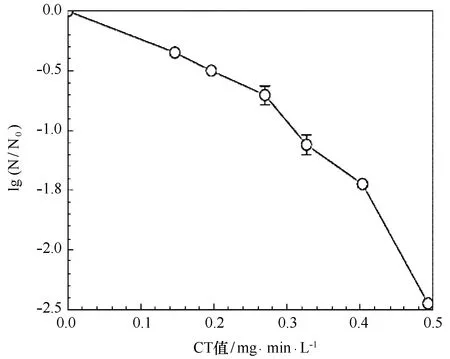
图2 ·OH杀灭锥状斯氏藻孢囊的CT阈值Fig.2 Effect of CT value on the inactivation of S.trochoidea cysts孢囊浓度为560 cells/mL,杀灭时间为10 sThe content of cysts was 560 cells/mL and the contact time was 10 s
3.2 ·OH杀灭锥状斯氏藻孢囊的时间效应
·OH杀灭赤潮藻孢囊的时间效应如图3所示,锥状斯氏藻孢囊浓度分别为340 cells/mL和560 cells/mL,杀灭TRO浓度为2.42 mg/L,在3 s、6 s、10 s、12 s及15 s时分别取样加入过量饱和硫代硫酸钠中止反应,采用荧光染色判定藻孢囊死活。当杀灭时间为3 s时,340 cells/mL的活孢囊降到95 cells/mL,560 cells/mL的活孢囊降到190 cells/mL;当杀灭时间为10 s时,340 cells/mL的活孢囊被全部杀死,560 cells/mL的活孢囊仅剩3 cells/mL。因此,·OH杀灭赤潮藻孢囊的时间为10 s。
据查阅文献所知,在杀灭时间上,蛋白酶抑制剂法杀灭链状亚历山大藻孢囊的时间为1 h[7],是·OH法的360倍;二氯异氰尿酸钠法杀灭链状裸甲藻孢囊的时间为24 h[4],是·OH法的8 640倍;过氧化氢法杀灭斯氏多沟藻孢囊的时间为48 h[5],是·OH法的1.7×104倍。因而,·OH法可在压载水排放过程中实现对孢囊的快速杀灭,阻断海洋外来生物入侵;在爆发海洋赤潮的海面喷洒高浓度·OH,不仅可快速杀灭赤潮藻,还可以快速杀灭孢囊。

图3 ·OH致死锥状斯氏藻孢囊的时间效应Fig.3 Time effect of ·OH inactivation on S.trochoidea cysts TRO浓度为2.42 mg/L,孢囊浓度分别为560和340 cells/mLTRO content was 2.42 mg/L, cyst concents were 340 cells/mL and 560 cells/mL, respectively
3.3 ·OH处理后锥状斯氏藻孢囊的萌发率
外界环境适宜时,孢囊可萌发为营养细胞,进入上层水体大量繁殖,进而爆发赤潮。不同CT值下锥状斯氏藻孢囊的萌发率如表1所示,未经·OH处理孢囊的萌发率达到93.3%,具有极高的爆发赤潮潜力,而随着CT值的增加,萌发率逐渐降低,当施加到·OH阈值浓度时,萌发率降为0,孢囊被杀灭,失去赤潮“种源”的功能。因此,·OH法能够完全抑制孢囊的萌发,能很好地适用于船舶外排压载水中赤潮藻孢囊的杀灭。

表1 ·OH杀灭阈值CT对锥状斯氏藻孢囊萌发率的影响
3.4 ·OH杀灭锥状斯氏藻孢囊的形态观察
采用荧光显微镜观察·OH杀灭锥状斯氏藻孢囊的形态变化如图4所示,A为藻孢囊的明场照片,B、C及D为注入不同CT值时藻孢囊的明场照片。原孢囊大小为20~30 μm,呈椭圆形,具有较厚的钙质孢囊壁,内容物饱满,红色体明显;随着CT值的增加,孢囊整体形状没有变化,内容物越发黯淡,原生质体发生一定程度的收缩;当CT值达到0.66 mg·min/L时,红色体和油滴消失,表明·OH氧化降解了孢囊内容物。
如图4所示,a为藻孢囊的SYTOX Green染色荧光照片,b、c及d为·OH注入不同CT值的荧光照片。原藻孢囊在蓝光激发下发出叶绿素自体红色荧光,表明孢囊具有很好的光合作用能力。随着注入CT值的提高,·OH改变藻孢囊细胞膜的通透性,使大分子SYTOX Green染料能进入孢囊体内与DNA结合,在蓝光激发下发出绿色荧光,表明藻孢囊被杀致死[11]。在荧光显微镜下观察到孢囊的叶绿素自体红色荧光逐渐消失,表明·OH氧化降解了叶绿素,破坏了孢囊的光合作用系统。若CT值提高至0.66 mg·min/L,观察不到绿色荧光,因为·OH进入孢囊体内后与DNA发生加成反应,进攻嘌呤碱基和嘧啶碱基,使DNA断链,导致SYTOX Green染料无法与DNA结合发出绿色荧光[13]。

图4 ·OH处理锥状斯氏藻孢囊的明场及荧光染色照片(标尺为20 μm)Fig.4 Light and fluorescence microscope images of S.trochoidea cysts (scale bar is 20 μm)A、a分别为·OH杀灭前孢囊的明场及SYTOX Green荧光染色照片;B、C、D分别为不同CT值的·OH杀灭后孢囊的明场照片,b、c、d为对应的荧光染色照片A. bright-field image of cyst before ·OH treatment, a.SYTOX Green fluorescence image of cyst before ·OH treatment, B,C,D.bright-field images of cyst after ·OH treatment with different CT values, b,c,d.SYTOX Green fluorescence images of cyst after ·OH treatment with different CT values

图5 ·OH致死锥状斯氏藻孢囊的SEM照片Fig.5 SEM images of S.trochoidea cysts before and after ·OH inactivationA为原藻孢囊的SEM照片;B为·OH致死藻孢囊的SEM照片A. SEM image of cyst before ·OH inactivation; B. SEM image of cyst after ·OH inactivation with CT value of 0.49 mg·min/L
·OH致死锥状斯氏藻孢囊的扫描电子显微镜照片如图5中所示,A为原藻孢囊表面形貌,完整饱满,具有较厚的孢囊壁,表面覆盖有钙质刺。B为·OH阈值浓度致死时,藻孢囊表面(图c中箭头处)出现细小裂纹,导致·OH进入孢囊体内,氧化降解叶绿素,破坏DNA,致死孢囊,但其外形结构完整。
4 结论
本文基于大气压强电离放电·OH高级氧化方法杀灭锥状斯氏藻孢囊,杀灭CT阈值为0.49 mg·min/L,杀灭时间仅为10 s。
采用SYTOX Green荧光染色和扫描电子显微镜观察,·OH对锥状斯氏藻孢囊的作用是由锥状斯氏藻孢囊外壁上细小裂纹处进入孢囊体内,氧化降解叶绿素并破坏DNA,抑制孢囊萌发。
综上,采用·OH快速杀灭赤潮藻孢囊的新方法,可有效地防控船舶压载水导致的海洋外来生物入侵。
[1] Wang Zhaohui, Qi Yuzao, Yang Yufeng. Cyst formation: an important mechanism for the termination ofScrippsiellatrochoidea(Dinophyceae) bloom[J]. Journal of Plankton Research, 2007, 29(2): 209-218.
[3] 王朝晖, 康伟. 柘林湾表层沉积物中甲藻孢囊的分布与浮游植物休眠体萌发研究[J]. 环境科学学报, 2014, 34(8): 2043-2050.
Wang Zhaohui, Kang Wei. Distribution of dinocysts and germination of phytoplankton resting spores in surface sediments from Zhelin Bay, the South China Sea[J]. Acta Scientiae Circumstantiae, 2014, 34(8): 2043-2050.
[4] Bolch C J, Hallegraeff G M. Chemical and physical treatment options to kill toxic dinoflagellate cysts in ships’ ballast water[J]. Journal of Marine Environmental Engineering, 1993, 1(1): 23-29.
[5] Ichikawa S, Wakao Y, Fukuyo Y. Extermination efficacy of hydrogen peroxide against cysts of red tide and toxic dinoflagellates, and its adaptability to ballast water of cargo ships[J]. Nippon Suisan Gakkaishi, 1992, 58(12): 2229-2233.
[6] Wright D A, Dawson R, Cutler S J, et al. Naphthoquinones as broad spectrum biocides for treatment of ship’s ballast water: toxicity to phytoplankton and bacteria[J]. Water Research, 2007, 41(6): 1294-1302.
[7] Córdova J L, Vega M P, Lembeye G S. Intracellular damage and death caused by protease inhibitors onAlexandriumcatenellanatural cysts and vegetative cells[J]. Harmful Algae, 2003, 2(3): 173-181.
[8] Bai Mindong, Yang Bo, Bai Xiyao, et al. Killing of red tide organisms in ocean using hydroxyl radicals[M]//Sun Keping, Yu Gefei. Recent Developments in Applied Electrostatics. Amsterdam: Elsevier, 2004: 216-219.
[9] Wang Zhifu, Yu Zhiming, Song Xiuxian, et al. Effects of ammonium and nitrate on encystment and growth ofScrippsiellatrochoidea[J]. Chinese Science Bulletin, 2014, 59(33): 4491-4497.
[10] Bai Mindong, Zheng Qilin, Tian Yiping, et al. Inactivation of invasive marine species in the process of conveying ballast water using ·OH based on a strong ionization discharge[J]. Water Research, 2016, 96: 217-224.
[11] Fan Jiajia, Ho L, Hobson P, et al. Evaluating the effectiveness of copper sulphate, chlorine, potassium permanganate, hydrogen peroxide and ozone on cyanobacterial cell integrity[J]. Water Research, 2013, 47(14): 5153-5164.
[12] Wang Jianlong, Xu Lejin. Advanced oxidation processes for wastewater treatment: formation of hydroxyl radical and application[J]. Critical Reviews in Environmental Science and Technology, 2012, 42(3): 251-325.
[13] Bohne C, Faulhaber K, Giese B, et al. Studies on the mechanism of the photo-induced DNA damage in the presence of acridizinium salts-involvement of singlet oxygen and an unusual source for hydroxyl radicals[J]. Journal of the American Chemical Society, 2005, 127(1): 76-85.
Inactivation ofScrippsiellatrochoideacysts using hydroxyl radials
Guo Feng1, Li Chao2, Bai Mindong1, Lin Yanqiang1, He Xiao1, Zheng Qilin1
(1.CollegeoftheEnvironmentandEcology;FujianCollaborativeInnovationCenterforExploitationandUtilizationofMarineBiologicalResources;KeyLaboratoryofEducationMinistryforCoastalandWetlandEcosystems,XiamenUniversity,Xiamen361102,China; 2.CollegeofOceanandEarthSciences,XiamenUniversity,Xiamen361102,China)
Resting cysts are largely formed during the red tide which may be the “seed bank” of next harmful algal bloom. And the resting cysts are resistant to normal physical and chemical treatments due to their thick cyst walls. In this paper, the resting cysts ofScrippsiellatrochoideawere produced using N-limited medium. The resting cysts were inactivated using hydroxyl radicals based on a strong ionization discharge. The results showed that hydroxyl radicals could inactivate the resting cysts effectively when the CT value was 0.49 mg·min/L with a contact time of 10 s. Morphological changes were observed using scanning electron microscope which showed that hydroxyl radicals could destroy the thick cyst wall. After entering the cell, hydroxyl radicals may damage the chlorophyll and DNA. Also, the germination rate decreased to zero. In general, the ·OH treatment can be applied to inactivate the resting cysts ofS.trochoideaand provide a new method to kill the harmful algal cysts in ballast water.
hydroxyl radicals; a strong ionization discharge; red tide;Scrippsiellatrochoidea; resting cyst
10.3969/j.issn.0253-4193.2017.04.010
2016-08-24;
2016-12-12。
国家科技支撑计划项目(2013BAC06B01,2013BAC06B02);国家重大科研仪器研制项目(61427804);科技部创新人才推进计划重点领域创新团队(2015RA4008)。
郭枫(1991—),男,四川省成都市人,研究方向为海洋外来入侵生物防控。E-mail:guofeng911017@163.com
*通信作者:白敏冬,教授,长江学者奖励计划特聘教授、国家杰出青年基金获得者。E-mail:mindong-bai@163.com
U698.7
A
0253-4193(2017)04-0101-06
郭枫,李超,白敏冬,等. 基于羟基自由基高级氧化快速杀灭锥状斯氏藻孢囊的研究[J].海洋学报,2017,39(4):101—106,
Guo Feng, Li Chao, Bai Mindong, et al. Inactivation ofScrippsiellatrochoideacysts using hydroxyl radials[J]. Haiyang Xuebao,2017,39(4):101—106, doi:10.3969/j.issn.0253-4193.2017.04.010

