基于浒苔暴发海水池塘的微生物生态特征研究
王春忠,孙富林,侯代云,肖懿哲,林国荣,严涛
(1. 福建省莆田市水产科学研究所,福建 莆田351100;2. 中国科学院 南海海洋研究所,广东 广州 510301;3. 91329部队,山东 威海 264200;4. 莆田学院 环境与生物工程学院,福建 莆田351100)
基于浒苔暴发海水池塘的微生物生态特征研究
王春忠1,孙富林2,侯代云3,肖懿哲1,林国荣4,严涛2
(1. 福建省莆田市水产科学研究所,福建 莆田351100;2. 中国科学院 南海海洋研究所,广东 广州 510301;3. 91329部队,山东 威海 264200;4. 莆田学院 环境与生物工程学院,福建 莆田351100)
为研究浒苔对海水养殖环境微生物生态的影响,采用Illumia高通量测序技术测定冬季垦区进水区、浒苔暴发的池塘和排水区水体以及底泥中菌群结构,分析进水区、池塘养殖区和排水区的环境微生物结构演变过程。结果表明:(1)γ-变形细菌、α-变形细菌、放线菌、拟杆菌和δ-变形细菌为海水养殖区的优势细菌门类;(2)进水区水体和底泥微生物种类和多样性指数均高于浒苔池塘和排水区;浒苔暴发的池塘和排水区微生物群落结构较为相似; (3)浒苔池塘的水体微生物以异养细菌为主,底泥以脱硫杆菌等厌氧细菌为主,增加了底泥潜在产生硫化氢的危害;(4)进水区水体含有丰度较高的弧菌和鱼立克次氏体等条件致病性病原菌,而浒苔池塘中含量较低,说明浒苔对弧菌等有一定的抑制作用;但浒苔暴发的池塘和排水区中另一种潜在致病菌黄杆菌类的丰度较高,养殖品种务必防患此类病菌感染疾病的发生。本文从微生态学角度全面揭示浒苔对近岸海区、海水池塘和排水区微生态演变过程的影响,发现了浒苔具有抑制和增加不同致病菌的双重作用,这对水产养殖有一定指导,也为浒苔发生原因、预报、预防等研究提供一定理论参考。
浒苔;高通量测序;细菌群落;弧菌;鱼立克次氏体;黄杆菌
1 引言
浒苔是绿藻纲石莼科的一属。近年来,在中国沿岸海域暴发浒苔绿潮造成危害的现象变得越来越频繁,呈现规模大、危害重、持续时间长等特点,对沿海景观、生态环境、渔业生产和滨海旅游造成影响,已经成为一种海洋灾害。仅2008年黄海海域的暴发,覆盖面积大约650 km2[1],造成了13.22亿人民币直接经济损失[2]。浒苔在养殖池塘中大量发生严重消耗水体营养物质,抑制单胞藻繁殖,影响池塘贝类生长;盖住滩面造成底部贝类窒息,死亡的浒苔会消耗海水中的氧气。绿色的藻类大量繁殖,通常与遮阳、生物分解、缺氧相关[3],影响或改变生态系统功能和结构[4]。微生物群落在水体生态系统中发挥着重要作用,同水体的生产力、养分循环、养殖动物的营养,以及宿主动物抗病密切相联系[5—7]。
目前国内外对浒苔的生理、生态研究表明,浒苔生长繁殖在秋转冬时,此时水温逐步下降,经过孢子发育形成具有假根附着固着物叶状体分化形成个体,在冬转春夏时随着水温升高,脱离固着物漂浮水面后进行营养繁殖和生殖生长聚集,并漂浮海面形成绿潮[8—10]。研究浒苔附着阶段的环境微生物群落特征及其影响显得尤其重要。本实验在福建莆田地区固着池塘底质的浒苔达到全年高峰时,通过Illumia高通量测序技术测定海水进水区、浒苔覆盖的池塘以及排水区的水体和底泥中菌群结构,了解分析浒苔生长池塘、进水区和排水区的环境微生物结构演变特征,揭示浒苔对海水池塘养殖生产、海区微生物的影响,为浒苔发生原因、预报、预防和近海养殖生态的研究提供一定理论参考。
2 材料和方法
2.1 采样地点与时间
样品于2015年12月采集自福建省莆田市北江垦区对虾养殖区,每个养殖池面积3.33 hm2,平均水深1 m,泥沙底质,泥∶沙比例为81∶19,混养硬壳蛤(Mercenariamercenaria)和日本囊对虾(Penaeusjaponicus)。浒苔主要种类为浒苔属(Enteromorpha),覆盖整个池塘近1/3。养殖进水区水体无浒苔,排水区也长有大量浒苔。采用抓斗式采泥器采集底泥样品,无菌采集0~4 cm 泥样。水体用有机玻璃采水器采集,先预过滤除去大颗粒物质,再用孔径为0.2 μm的聚碳酸酯膜过滤500 mL,将滤膜用锡箔纸包好保存。所有样品保存于-80℃超低温冰箱以备DNA 提取。
2.2 DNA 提取及IlluminaMiSeq平台测序
无菌条件下取出滤膜,剪碎后放置于1.5 mL离心管中, 水样滤膜的提取参照之前的方法[11]。称取1 g (湿质量) 底泥样品,参照土壤核酸提取试剂盒(OMEGA公司)说明步骤提取总DNA。本实验16S rRNA测序以V3和V4为目标区域进行引物设计,引物序列为319F (5′- ACTCCTACGGGAGGCAGCAG -3′) 和 806R (5′-GGACTACHVGGGTWTCTA AT-3′),扩增片段大小大约469 bp;使用水样和底泥的DNA模板50 ng,25 μL的PCR体系,使用Phusion酶扩增30个循环。PCR 反应条件为95℃预变性3 min; 95℃变性30 s,55℃退火30 s,72℃延伸45 s; 72℃延伸10 min。在正反引物两段加上不同的barcode以区分不同的样品,扩增完成后的PCR产物使用beads纯化之后进行上机测序。
2.3 数据分析
对于Miseq测序获得的双端数据,首先根据barcode信息进行样品区分,然后根据overlap关系进行拼接,随后进行Q20、Q30等质控分析,对最终获得clean数据归一化之后进行OTU聚类分析和物种分类学分析。采用CD-HIT工具将序列相似性大于97%的Tags定义为一个OTUs操作分类单元(Operational Taxonomic Units,OTUs)聚类。采用Qiime软件对样品序列进行Alpha多样性分析,包括物种数目(observed species)、Shannon指数(Shannon Index)、Chao1指数(Chaos1 Index)。选择OTUs操作单元里的一条代表序列(默认丰度最高)采用RDP classifier软件进行物种分类,分类阈值默认为0.8。利用PAST软件对微生物群落结构进行除趋势对应分析(DCA),揭示微生物种类与环境样品间的关系。
3 结果分析
3.1 高通量测序数据
通过IlluminaMiSeq测序,总共测定出355 996条序列,在97%相似性水平为标准观测到14 418个物种,各样本结果见表1。结果显示底泥微生物数量高于水体;进水区水体(LZ3)、底泥(YN3)微生物种类和多样性要分别高于浒苔池养殖池(LZ6、YN6)和排水区(LZ5、YN5)。养殖池水体的丰富度指数chao1显著低于进水区水体,而底泥丰富度指数和进水区相差不大。

表1 基于高通量测序分析的细菌生态多样性指数
3.2 养殖系统微生物群落结构分析
通过对样品微生物种类信息进行注释,比较不同样品所对应的微生物种类在样品中的丰度信息。由图1所示,从细菌门分类水平分析,γ-变形细菌(Gammaproteobacteria)、α-变形细菌(Alphaproteobacteria)、放线菌(Actinobacteria)、拟杆菌(Bacteroidete)和δ-变形细菌(Deltaproteobacteria)是优势细菌门类。进水区水体微生物以γ-变形细菌(Gammaproteobacteria,45.71%)和α-变形细菌(Alphaproteobacteria,16.55%)为主,底泥以γ-变形细菌(Gammaproteobacteria,45.82%)和δ-变形细菌(Deltaproteobacteria,17.33%)为主。浒苔池塘水体以放线菌(Actinobacteria,50.58%)、α-变形细菌(Alphaproteobacteria,10.16%)、拟杆菌(Bacteroidetes,26.10%)为主,底泥以γ-变形细菌(Gammaproteobacteria,20.28%)和δ-变形细菌(Deltaproteobacteria,27.99%)为主;排水区水体以放线菌(Actinobacteria,32.35%)、α-变形细菌(Alphaproteobacteria,27.41%),拟杆菌(Bacteroidetes,25.21%)为主,底泥以γ-变形细菌(Gammaproteobacteria,25.67%)和δ-变形细菌(Deltaproteobacteria,25.29%)为主。
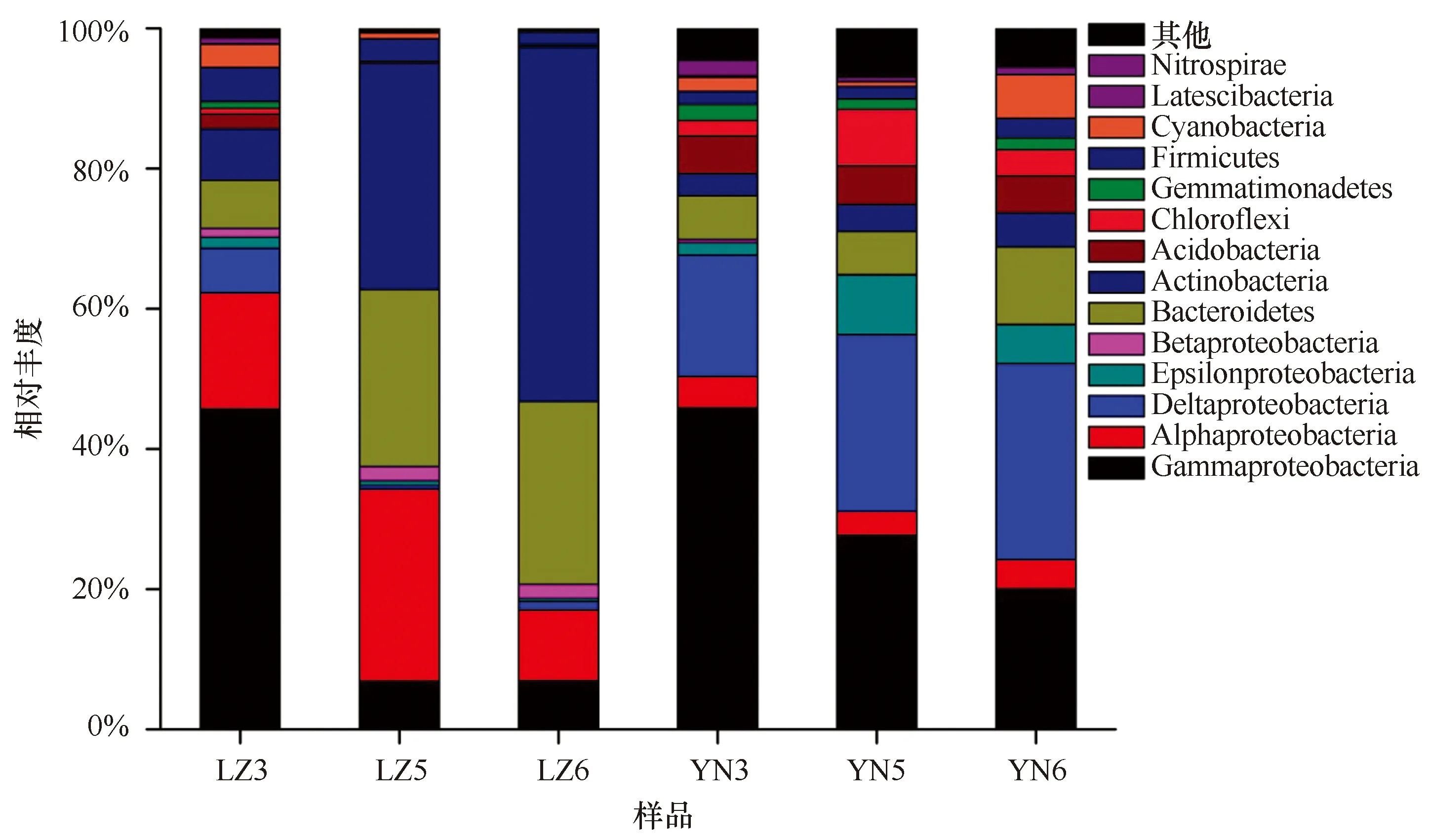
图1 在门分类水平样品中细菌种群结构及其相对丰度Fig.1 Bacterial communities found between the source in bacterial phylum level

图2 在目分类水平样品中细菌种群结构及其相对丰度Fig.2 Bacterial communities found between the samples in bacterial order level
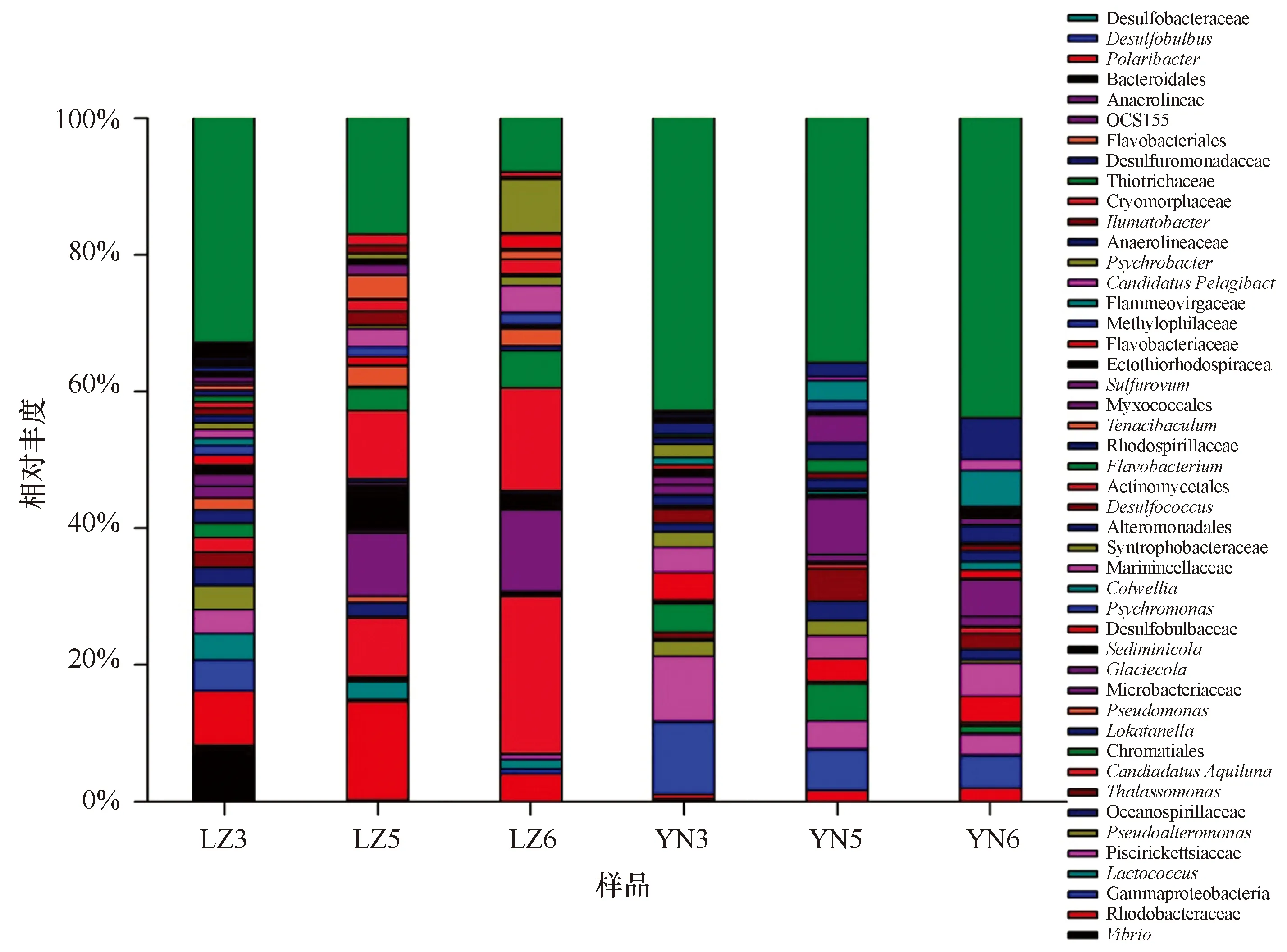
图3 在属分类水平样品中细菌种群结构及其相对丰度Fig.3 Bacterial communities found between the source in bacterial genus level
从图2目分类水平分析,样品之间微生物种类差异更为明显(ANOVA,P<0.01)。以相对丰度大于5%计算,进水水体微生物优势种类为Alteromonadales(13.10%)、Rhodobacterales(12.97%)、Oceanospirillales(5.80%)、Actinomycetales(5.55%)、Flavobacteriales(5.51%);底泥微生物优势种类为Thiotrichales(10.02%)、Desulfobacterales(7.16%)、Alteromonadales(6.27%)、Chromatiales(5.42%)。浒苔池塘水体微生物优势种类为分别为Actinomycetales(50.29%)、Flavobacteriales(25.11%)、Rhodobacterales(4.79%);底泥微生物以Desulfobacterales(21.07%)、Campylobacterales(5.56%)、Thiotrichales(3.34%)、Chromatiales(1.59%)为主。排水区水体微生物优势种类分别为Actinomycetales(28.17%)、Flavobacteriales(23.56%)、Rhodobacterales(23.02%);底泥微生物以Desulfobacterales(16.61%)、Campylobacterales(8.49%)、Thiotrichales(5.98%)、Chromatiales(5.68%)为主。
从图3属分类水平分析,进水区水体微生物以Vibrio(8.24%)、Rhodobacteraceae(7.97%)、Gammaproteobacteria(4.46%)为主;底泥以Gammaproteobacteria(10.43%)、Piscirickettsiaceae(9.48%)、Chromatiales(4.16%)为主。浒苔池塘水体微生物以Rhodobacteraceae(4.01%)、Actinomycetales(15.15%)、Microbacteriaceae(11.87%)、CandidatusAquiluna(23.02%)、Sediminicola(1.78%)为主;底泥LZ6以Desulfopila(6.19%)、Desulfobacteraceae(5.29%)、Sulfurovum(5.28%)、Marinicellaceae(4.83%)、Desulfobulbaceae(3.87%)为主。排水区微生物以Rhodobacteraceae(14.41%)、Actinomycetales(9.96%)、Microbacteriaceae(9.17%)、CandidatusAquiluna(8.64%)、Sediminicola(6.57%)为主;底泥LZ5以Sulfurovum(8.15%)、Gammaproteobacteria(5.99%)、Chromatiales(5.37%)、Desulfococcus(4.79%)为主。
3.3 微生物群落结构的对应分析
为了更好的理解样品与微生物类群之间的关系,除趋势对应分析(DCA)用来表观微生物群落间的差异与相似性(图4)。排序图表明了细菌在属分类水平同样品间的联系。模型的第一和第二特征值为0.734 8和0.101 8。从图上可以看出,浒苔覆盖水体样品(LZ5、LZ6;YN5、YN6)分别相似,距离较近;进水区样品同它们差异大,相距较远,样品间共有的细菌种类较少。浒苔覆盖水体以CandidatusAquiluna、Actinomycetales、Microbacteriaceae、Lishizhenia、Flavobacterium等异养细菌为特征微生物种类,沉积物以Desulfopila、Desulfobacteraceae、Desulfobulbaceae、Desulfuromonadaceae和Desulfococcus等厌氧性硫还原细菌为特征微生物种类。

图4 样品间微生物群落的对应分析Fig.4 Correspondence analysis of bacterial communities generated
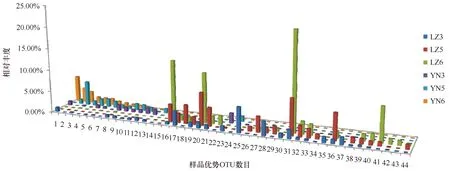
图5 样品间优势OTU分布特征Fig.5 Rank abundance histograms for the top OTUs

表2 各样品中细菌丰富度最高的10个OTUs(括号内为各OTU相对丰度,%)
3.4 优势OTU分析
为了更详细分析浒苔对微生物的影响,分析了44个优势OTU(丰度大于1%)的分布特征。图5表明水体和底泥样品具有显著的微生物差异;进水区与浒苔爆发的池塘、排水区水体的优势OTU差异显著(ANOVA,P<0.01);同样是浒苔覆盖的区域,优势的OTU种类在养殖池中的丰度要高于排水区。对不同样品中所含菌群丰度最高的10个OTUs的研究有助于了解样品中所含的主要细菌类型和其生态功能,表2体现了主要样品间主要物种丰度和种类变化。经序列比对发现主要的种类组成为变形菌门、拟杆菌门、放线菌门和酸杆菌门的细菌。同进水区水体相比,浒苔覆盖的池塘和排水区水体具有较高的异养细菌如Microbacteriaceae、CandidatusAquilunarubra、Flavobacteriales等;底泥具有较高丰度的厌氧细菌如Desulfopila、Desulfobacteraceae、Desulfobulbaceae、Desulfuromonadaceae、Desulfococcus等。这些微生物群落结构充分体现了浒苔对微生物生态结构和功能的影响。
4 讨论
本文分析了海水垦区养殖区浒苔暴发时水体及底泥的微生物群落状况,并与进水区微生物群落进行比较。通过illumia平台的高通量测序,详尽的分析了它们的微生物组成、多样性以及遗传进化信息。结果表明样品中优势细菌为变形菌门、拟杆菌门、绿弯菌门、蓝细菌门、酸杆菌门、厚壁菌门、放线菌门和芽单胞菌门等24个类群,总共355 996条序列被测定,在97%相似性水平为标准观测到14 418个物种,而之前采用16S rRNA基因克隆文库的方法在养殖区检测获得到的物种数为133和212[11—12],类群为7和11个门类;基于Illumina Miseq平台的高通量测序在本实验中测定了几十万条序列,序列覆盖范围和数量相比于传统方法更广更多,更能全面反应微生物的多样性特性,为深入研究海洋微生物群落特征提供了极大可能,因此高通量测序分析是了解海水养殖环境中菌群多样性的一种有效研究手段。
底泥中微生物多样性较水体类型中微生物多样性较高,可能与底泥高度的分层特性以及化学梯度相关[13]。同进水区比较,浒苔池塘和浒苔覆盖的排水区的微生物组成物种的种类和多样性都要低,这与Chrzanowski等[14]研究发现相一致,在相对较低的营养条件下,细菌的多样性会增加,而当营养水平较高趋近富营养化时,会抑制对环境敏感的细菌的生长,水体中细菌群落多样性表现为减少的趋势。
浒苔水体含有较高的异养细菌Actinomycetales和Flavobacteriales。Actinomycetales主要包括Actinomycetales、Microbacteriaceae、CandidatusAquiluna。尤其是CandidatusAquiluna的相对丰度高达23.02%,并与CandidatusAquilunarubra具有99%的相似度。CandidatusAquilunarubra代表一类革兰氏阳性、好氧、携带actinorhodopsin光合异养菌[15—16]。浒苔暴发后一定时间之内可能会导致养殖池中有机物含量增加,异养细菌很容易从浒苔栖息地获取可利用的溶解性有机碳[17],诱发异养细菌丰度的增加。这与之前报道微型底栖生物在大型藻类环境中主要为异养细菌[18—19]的结果相一致。
本研究发现浒苔不仅增加异养菌的丰度,也增加了黄杆菌等潜在致病菌在水体中的丰度,同他人研究中浒苔腐烂过程中黄杆菌是占优势的微生物群落结果相似[19]。但黄杆菌在浒苔池塘中虾和蛤的肠道含量较低,几乎没有测定出(另文报道)。本实验中黄杆菌优势的微生物种类是Sediminicola、Flavobacteriales、Tenacibaculum、Owenweeksia和Winogradskyella。Sediminicola的细菌Sediminicolaluteus能还原硝酸盐和降解明胶、酪蛋白和淀粉等[20]。而黄杆菌的很多种类也是潜在的致病菌,如黄杆菌属(Flavobacterium)的几个种类导致引起人类肺炎、脑膜炎、败血症等感染[21—22];一些种类对淡水鱼类有致病作用[23—24],患病鱼体会出现烂鳃、体表溃疡、组织坏死及鳍条腐烂等症状,死亡率可高达100%,全球每年因黄杆菌引发的柱形病感染引起淡水鱼类发病死亡所造成的经济损失极其严重[25]。Tenacibaculum常常分离在大型绿藻,是一种溃疡性疾病称为滑动细菌病或tenacibaculosis的病原体[26],这种病原菌导致高死亡率,增加其他病原体的易感性[27]。至于海水中黄杆菌对人类和海水中鱼、虾、贝是否潜在的致病作用有亟待进一步研究。浒苔池塘底泥Desulfopila和Desulfobacteraceae等硫还原细菌等含量较高 (Desulfobacterales和Desulfuromonadales, 大于20%)。Desulfobacterales和Desulfuromonadales是严格厌氧硫还原细菌,能还原硫酸盐获得能量,产生硫化氢,Desulfobacterales也被确定为在水产养殖沉积物中主要的硫酸盐还原菌。Asami 和 Kondo等使用特定引物扩增16SrRNA基因以及亚硫酸还原酶功能基因和测序,证明硫循环在硫还原细菌在贝类养殖沉积物中比较丰富[28—29]。这些研究结果表明,在浒苔影响下养殖池产生低氧或缺氧,并增加厌氧细菌丰度;这些硫酸盐还原菌可在缺氧条件下转化生成硫化氢,对水产动物和环境造成严重的危害。
弧菌是海洋环境中最常见的细菌类群之一,广泛分布于近岸、河口海区的海水和生物体中,是一类条件致病菌, 可引起养殖对象出现皮肤溃疡、烂尾、烂鳍、出血等症状, 导致养殖动物对外界反应迟钝, 摄食率下降或停止摄食等。鱼立克次氏体Piscirickettsiaceae中的一些种类如Piscirickettsia,是鱼类(鲑鱼、海鲈鱼等)的致病菌[30—31];受感染的鱼类会聚集在养殖笼的表面,变得行动迟缓和没有食欲。本研究发现,进水区含有较高丰度的弧菌和鱼立克次氏体等潜在致病菌,但是在浒苔覆盖的池塘和排水区,其在水体中含量变得很低。有研究表明浒苔多糖提高对弧菌V.splendidus的抗性,降低海参的死亡率[32];浒苔抗性物质合成的纳米颗粒也具有显著的体外抗菌活性,对革兰氏阳性菌类具有很高的抑制作用[33];提取的浒苔精油能沉积在胞浆内或通过酶法降解细胞胞内酶,诱导细胞膜结构的损坏,从而导致细胞裂解,具有很强的自然抗菌活性,能对革兰氏阴性菌如E.coli和S.typhimurium起到明显的抑制作用[34]。浒苔爆发会增加黄杆菌类致病菌和产硫化氢等厌氧硫还原细菌的丰度,同时也会抑制弧菌等潜在致病菌的增殖,具有两重性。因此,在存有大量浒苔池塘或海区,为了保证养殖水生生物的健康生长,不仅应密切关注水体硫化氢等水质指标,加强养殖管理,采取相关措施提高水体溶解氧,而且要防患黄杆菌这类致病菌感染引发疾病的发生。
5 结论
综上所述, 本研究采用高通量测序研究在浒苔爆发期间养殖池细菌群落结构的变化,结果显示微生物生态结构的变化与浒苔密切相关。浒苔影响下水体和沉积物形成自己特征性细菌类群;浒苔水体微生物以异养细菌为主,主要是放线菌和黄杆菌类群;沉积物以厌氧细菌为主,主要是硫还原细菌。另一方面浒苔对弧菌以及鱼立克次氏体有抑制作用,使得这些致病菌在养殖池中的丰度减少;但是浒苔暴发增加了黄杆菌类潜在致病菌的丰度,要做好这类致病菌的预防及防治工作。本研究揭示浒苔对海水池塘养殖生产、海区微生物的影响,为浒苔发生原因、预报、预防的研究提供一定理论参考。
[1] Liu Dongyan, Keesing J K, Dong Zhijun, et al. Recurrence of the world’s largest green-tide in 2009 in Yellow Sea, China:Porphyrayezoensis aquaculture rafts confirmed as nursery for macroalgal blooms[J]. Mar Pollut Bull, 2010, 60(9): 1423-1432.
[2] 国家海洋局. 2008年中国海洋灾害公报[R]. (2011-04-26). http://www.coi.gov.cn/gongbao/zaihai/201107/t20110729_17725.html.
[3] Nelson T A, Haberlin K, Nelson A V, et al. Ecological and physiological controls of species composition in green macroalgal blooms[J]. Ecology, 2008, 89(5): 1287-1298.
[4] Valiela I, McClelland J, Hauxwell J, et al. Macroalgal blooms in shallow estuaries: controls and ecophysiological and ecosystem consequences[J]. Limnol Oceanogr, 1997, 42(5): 1105-1118.
[5] Crab R, Avnimelech Y, Defoirdt T, et al. Nitrogen removal techniques in aquaculture for a sustainable production[J]. Aquaculture, 2007, 270(1/4): 1-14.
[6] Gatesoupe F J. The use of probiotics in aquaculture[J]. Aquaculture, 1999, 180(1/2): 147-165.
[7] Moriarty D J W. The role of microorganisms in aquaculture ponds[J]. Aquaculture, 1997, 151(1/4): 333-349.
[8] Luo Minbo, Liu Feng, Xu Zhaoli. Growth and nutrient uptake capacity of two co-occurring species,UlvaproliferaandUlvalinza[J]. Aquatic Bot, 2012, 100: 18-24.
[9] Gao Shan, Chen Xiaoyuan, Yi Qianqian, et al. A strategy for the proliferation ofUlvaprolifera, main causative species of green tides, with formation of sporangia by fragmentation[J]. PLoS One, 2010, 5(1): e8571.
[10] Huo Yuanzi, Zhang Jianheng, Chen Liping, et al. Green algae blooms caused byUlvaproliferain the southern Yellow Sea: identification of the original bloom location and evaluation of biological processes occurring during the early northward floating period[J]. Limnol Oceanogr, 2013, 58(6): 2206-2218.
[11] 王春忠, 林国荣, 严涛, 等. 长毛对虾海水养殖环境以及虾肠道微生物群落结构研究[J]. 水产学报, 2014, 38(5): 706-712.
Wang Chunzhong, Lin Guorong, Yan Tao, et al. Microbial community in the shrimp intestine (Penaeuspenicillatus) and its culture environment[J]. Journal of Fisheries of China, 2014, 38(5): 706-712.
[12] Wang Chunzhong, Lin Guorong, Yan Tao, et al. The cellular community in the intestine of the shrimpPenaeuspenicillatusand its culture environments[J]. Fish Sci, 2014, 80(5): 1001-1007.
[13] Lozupone C A, Knight R. Global patterns in bacterial diversity[J]. Proc Natl Acad Sci U S A, 2007, 104(27): 11436-11440.
[14] Chrzanowski T H, Sterner R W, Elser J J. Nutrient enrichment and nutrient regeneration stimulate bacterioplankton growth[J]. Microb Ecol, 1995, 29(3): 221-230.
[15] Hahn M W. Description of seven candidate species affiliated with the phylumActinobacteria, representing planktonic freshwater bacteria[J]. Int J Syst Evol Microbiol, 2009, 59(1): 112-117.
[16] Kang I, Lee K, Yang S J, et al. Genome sequence of “CandidatusAquiluna” sp. strain IMCC13023, a marine member of theActinobacteriaisolated from an arctic fjord[J]. J Bacteriol, 2012, 194(13): 3550-3551.
[17] Pregnall A M. Release of dissolved organic carbon from the estuarine intertidal macroalgaEnteromorphaprolifera[J]. Mar Biol, 1983, 73(1): 37-42.
[18] Corzo A, van Bergeijk S A, García-Robledo E. Effects of green macroalgal blooms on intertidal sediments: net metabolism and carbon and nitrogen contents[J]. Mar Ecol Prog Ser, 2009, 380: 81-93.
[19] 张艳, 李秋芬, 孙雪梅, 等. 浒苔腐烂过程中水体细菌群落结构变化的PCR-DGGE分析[J]. 中国水产科学, 2012, 19(5): 872-880.
Zhang Yan, Li Qiufen, Sun Xuemei, et al. Changes in population structure of bacteria during decomposition ofEnteromorphaprolifera[J]. Journal of Fishery Sciences of China, 2012, 19(5): 872-880.
[20] Khan S T, Nakagawa Y, Harayama S.Sediminicolaluteusgen. nov., sp. nov., a novel member of the familyFlavobacteriaceae[J]. Int J Syst Evol Microbiol, 2006, 56(4): 841-845.
[21] Xu Jian, Bjursell M K, Himrod J, et al. A genomic view of the human-Bacteroidesthetaiotaomicronsymbiosis[J]. Science, 2003, 299(5615): 2074-2076.
[22] Hsueh P R, Wu J J, Hsiue T R, et al. Bacteremic necrotizing fasciitis due toFlavobacteriumodoratum[J]. Clin Infect Dis, 1995, 21(5): 1337-1338.
[23] Bernardet J F. Order I.Flavobacterialesord. nov.[M]//Krieg N R, Staley J T, Brown D R, et al. Bergey’s Manual of Systematic Bacteriology. New York: John Wiley & Sons, Inc., 2011: 105.
[24] Duchaud E, Boussaha M, Loux V, et al. Complete genome sequence of the fish pathogenFlavobacteriumpsychrophilum[J]. Nat Biotechnol, 2007, 25(7): 763-769.
[25] Kumar Verma D, Rathore G. Molecular characterization ofFlavobacteriumcolumnareisolated from a natural outbreak of columnaris disease in farmed fish,Catlacatlafrom India[J]. J Gen Appl Microbiol, 2013, 59(6): 417-424.
[26] Romero M, Avendao-Herrera R, Magarios B, et al. Acylhomoserine lactone production and degradation by the fish pathogenTenacibaculummaritimum, a member of theCytophaga-Flavobacterium-Bacteroides(CFB) group[J]. FEMS Microbiol Lett, 2010, 304(2): 131-139.
[28] Asami H, Aida M, Watanabe K. Accelerated sulfur cycle in coastal marine sediment beneath areas of intensive shellfish aquaculture[J]. Appl Environ Microbiol, 2005, 71(6): 2925-2933.
[29] Kondo R, Mori Y, Sakami T. Comparison of sulphate-reducing bacterial communities in Japanese fish farm sediments with different levels of organic enrichment[J]. Microbes Environ, 2012, 27(2): 193-199.
[30] Arkush K D, McBride A M, Mendonca H L, et al. Genetic characterization and experimental pathogenesis ofPiscirickettsiasalmonisisolated from white seabassAtractoscionnobilis[J]. Dis Aquat Organ, 2005, 63(2/3): 139-149.
[32] Wei Jianteng, Wang Shuxian, Pei Dong, et al. Polysaccharide fromEnteromorphaproliferaenhances non-specific immune responses and protection againstVibriosplendidusinfection of sea cucumber[J]. Aquacult Int, 2015, 23(2): 661-670.
[33] Yousefzadi M, Rahimi Z, Ghafori V. The green synthesis, characterization and antimicrobial activities of silver nanoparticles synthesized from green algaEnteromorphaflexuosa(Wulfen) J. Agardh[J]. Mater Lett, 2014, 137: 1-4.
[34] Patra J K, Das G, Baek K H. Antibacterial mechanism of the action ofEnteromorphalinzaL. essential oil againstEscherichiacoliandSalmonellatyphimurium[J]. Botan Stud, 2015, 56(1): 13.
Study on the microbial characteristics of seawater pond based onEnteromorphabloom
Wang Chunzhong1, Sun Fulin2, Hou Daiyun3, Xiao Yizhe1, Lin Guoron4, Yan Tao2
(1.PutianInstituteofAquacultureScienceofFujianProvince,Putian351100,China; 2.SouthChinaSeaInstituteofOceanology,ChineseAcademyofSciences,Guangzhou510301,China; 3.PLA91329Unit,Weihai264200,China; 4.CollegeofEnvironmentandBiologicalEngineering,PutianUniversity,Putian351100,China)
In order to explore the effect ofEnteromorphabloom on the bacterial community, Illumina MiSeq Sequencing was used to investigate the bacterial structure in source water, culture pond and drainage area in this study. The results showed that Gammaproteobacteria, Alphaproteobacteria, Actinobacteria, Bacteroidete and Deltaproteobacteria were the dominant bacteria groups in aquaculture water. Bacterial community in source water had higher in species numbers and Shannon diversity than pond and drainage area withEnteromorpha. Furthermore, pond and drainage area withEnteromorphawas dominated by heterotrophic bacteria in water (mainly Actinomycetales and Flavobacteriales), as well as by anaerobic bacteria in underlying sediment (mainly Desulfobacterales), which increased potential ability to produce hydrogen sulfide. Source water contained high abundance of conditional pathogenic microbe, such as vibrio and Piscirickettsiaceae; whereas little was detected inEnteromorpha-containing pond,which indicated thatEnteromorphahad strong inhibitory effect on these pathogens. In addition,Enteromorphaalso increased the abundance of Flavobacterium in pond and drainage areas; some genera of Flavobacterium are conditional pathogenic bacteria for aquaculture animal, and need pay attention to prevent such infections disease.Enteromorphahas the dual role to inhibit or increase abundance of different pathogens, and have importance effect to aquaculture. Overall, massive growth ofEnteromorphawould produce the significant effect on the bacterial community, and have serious impact on the coastal environment. This study explored the novel findings of the microbial community relevant toEnteromorpha, and will provide guidance for the prevention and control of the green tide.
Enteromorpha; Illumina MiSeq Sequencing; bacterial community; vibrio; piscirickettsiaceae; flavobacterium
10.3969/j.issn.0253-4193.2017.04.011
2016-07-19;
2016-08-31。
国家青年科学基金项目(41406130);国家星火计划项目(2015GA720002);福建省科技计划项目(2015N0013,2016I1002);广东科技项目(2016A020221024)。
王春忠(1969—),男,福建省莆田市人,研究员,主要从事水产养殖及其环境生态学研究。E-mail: ptwcz@163.com
Q938.1
A
0253-4193(2017)04-0107-10
王春忠,孙富林,侯代云,等. 基于浒苔暴发海水池塘的微生物生态特征研究[J].海洋学报,2017,39(4):107—116,
Wang Chunzhong, Sun Fulin, Hou Daiyun, et al. Study on the microbial characteristics of seawater pond based onEnteromorphabloom[J]. Haiyang Xuebao,2017,39(4):107—116, doi:10.3969/j.issn.0253-4193.2017.04.011

