吲哚乙酸、萘乙酸和吲哚丁酸对蔓越莓组培苗扦插生根的影响
董环宇,高芳,王兴溶,陈士刚,秦彩云,才巨锋,郭忠玲,陶晶



摘要:蔓越莓(Oxycoccos)耐寒性较强,其果实具有很高的保健价值和經济价值。以蔓越莓组培苗作为插穗,探究吲哚乙酸(Indole-3-acetic acid,IAA)、萘乙酸(1-naphthlcetic acid,NAA)和吲哚丁酸(3-Indolebutyric acid,IBA)不同质量浓度处理下蔓越莓插穗的浸泡和速沾试验,同时探究不同激素种类和质量浓度对生根率、苗高增长量、生物量和根系生长特点(包括最长根长、根表面积、根平均直径和平均根数)的影响。结果表明,当NAA浸泡处理为100、200 mg/L时根系生长状态较好,但是最长根长仅为(30.77±0.18) cm(NAA 100 mg/L)、根平均直径为(0.3±0.02) mm。而IBA质量浓度为 1 000 mg/L时速沾处理的插穗最长根长为(30.13±3.22) cm、根平均直径为(0.39±0.04) mm、根表面积为(1.27±0.01) cm2、平均根数为(128.22±2.38)条。由此来看,浸泡处理和速沾处理最优处理根系生长状况相差不大,但是综合来看当IBA质量浓度为1 000 mg/L,速沾时生根率最高,为85%。因此速沾的方法更适合蔓越莓组培苗的扦插生根。该研究初次建立蔓越莓组培苗扦插繁殖技术,为蔓越莓规模化繁育奠定基础。
关键词:蔓越莓;组织培养;扦插生根;组培苗;根系生长特点
中图分类号:S663.9文献标识码:A文章编号:1006-8023(2024)01-0037-07
Effects of IAA, NAA and IBA on Rooting of Tissue Culture Seedlings of Cranberry
DONG Huanyu1,2, GAO Fang2, WANG Xingrong2,3, CHEN Shigang2, QIN Caiyun2, CAI Jufneg2, GUO Zhongling1*, TAO Jing2*
(1.Forestry College, Beihua University, Jinlin Jinlin 132013, China; 2.Institute of Biotechnology, Jilin Provincial Academy of Forestry Sciences, Changchun 130000, China; 3.College of Forestry and Grassland, Jilin Agricultural University, Changchun 130118, China))
Abstract: Cranberry (Oxycoccos) has strong cold resistance, and its fruit has high health value and economic value. In this study, the tissue cultured seedlings of cranberry were used as cuttings to explore the soaking and quick dipping tests of cranberry cuttings under different indole-3-acetic acid (IAA), 1-naphthlcetic acid (NAA) and 3-indolebutyric acid (IBA) concentrations, and the effects of different hormone types and concentrations on rooting rate, seedling height growth, biomass and root growth characteristics (including the longest root length, root surface area, average root diameter and average root number). The results showed that, when NAA soaking treatment was 100 and 200 mg/L, the root system grew well, but the longest root length was only (30.77±0.18) cm (NAA 100 mg/L), and the average root diameter was (0.3±0.02) mm. However, the longest root length of cuttings treated with IBA 1000 mg/L per hour was (30.13±3.22) cm, the average root diameter was (0.39±0.04) mm, the root surface area was (1.27±0.01) cm2, and the average number of roots was (128.22±2.38). From this point of view, there was little difference in root growth between the soaking treatment and the rapid soaking treatment, but in general, when the IBA concentration was 1000 mg/L, the rooting rate, was 85% at the highest. Therefore, the quick dipping method was more suitable for the rooting of cranberry tissue culture seedlings. In this study, the cutting propagation technology of tissue culture seedlings of cranberry was established for the first time, which laid the foundation for large-scale propagation of cranberry.
Keywords: Cranberry; tissue culture; rooting by cutting; tissue culture seedling; root growth characteristics
0引言
蔓越莓(Oxycoccos)又称蔓越桔、小红莓、酸果蔓,是杜鹃花科,越橘属[1]。蔓越莓抗寒能力较强,原产于北半球气温凉爽高寒的湿地区域,另外中国的大、小兴安岭和长白山地区也有野生种群分布[2]。蔓越莓果实具有很高的经济价值,果实中含有丰富的鞣酸[3]、单宁酸[4]和多酚类物质[5]。不仅能够抗氧化、抗肿瘤,还能够抗感染,是一种很有价值的保健果实[6-7]。另外有研究表明蔓越莓具有极佳的美容养颜的功效[8]。
蔓越莓作为美国原产的水果在中国市场上仅有10 a左右的时间,目前我国蔓越莓种植面积小、田间管理不规范等因素导致产量十分有限,加工原料需要大量进口,使鲜果及深加工产品的价格居高不下[9]。研究蔓越莓组培苗扦插繁殖技术,不但可以实现优良种质资源的迅速繁殖,还可以降低成本,提高繁殖效率,具有非常重要的研究意义。然而截至目前,蔓越莓组培苗扦插繁殖尚未见报道。
本研究以蔓越莓组培苗为试材,探究吲哚乙酸(Indole-3-acetic acid,IAA)、萘乙酸(1-naphthlcetic acid,NAA)和吲哚丁酸(3-Indolebutyric acid,IBA)不同质量浓度处理下蔓越莓插穗的浸泡和速沾试验,同时探究不同激素种类和质量浓度对生根率、苗高增长量、生物量和根系生长特点(包括最长根长、根表面积、根平均直径和平均根数)的影响,为通过蔓越莓组培苗扦插方式的繁殖提供基础,为其他越橘属植物提供借鉴。
1材料与方法
1.1蔓越莓组培苗获得
蔓越莓材料来自吉林农业大学引种选育的蔓越莓优良品种组培苗,截取2~3 cm茎段接种至增殖培养基,培养基配方为木本植物培养基(woody plant medium, WPM)+ 1.0 mg/L 激动素(Kinetin,ZT)。通过增殖培养获得大量的可用于生根的组培苗。待扦插时,将蔓越莓组培苗取出,剪成4~5 cm的插穗,以备蔓越莓扦插生根研究。
1.2试验地概况
吉林省长春市属于温带大陆性湿润气候,夏季气候温暖,阳光充沛,但时间较短,秋季晴朗温差大。年降水量达600~700 mm,全年无霜期为 140~150 d。本次试验基地位于吉林省林业科学研究院净月苗圃基地,试验在净月苗圃基地温室大棚内进行。试验期间保持温室大棚内温度在25~30 ℃,空气相对湿度为75%~80%。
1.3试验方法
1.3.13种外源激素浸泡试验
以全苔藓为基质。激素采用IBA、NAA、IAA,质量浓度分别为50、100、200 mg/L,以清水处理为对照(CK),处理时间为1 h。每个处理200根蔓越莓插穗,扦插后35 d统计生根率、苗高增长量和生物量。
1.3.23种外源激素速沾试验
以全苔藓为基质,激素选用IAA、NAA、IBA,质量浓度分别为500,1 000、2 000 mg/L,以清水处理为对照(CK),速沾时间为1~3 s,共10个处理。每个处理200根插穗,扦插后35 d统计生根率、苗高增长量和生物量。
1.3.3不同处理蔓越莓扦插苗的根系生长特点研究
随机选取1.3.1和1.3.2中每個处理的扦插苗,用WinRHIZO软件分析(Epson Perfection V850 Pro,日本),统计最长根长、根表面积、根平均直径和平均根数。
1.4扦插及养护管理
蔓越莓扦插基质为全苔藓。扦插前1~2 d用1 000倍多菌灵溶液对基质进行灭菌,对扦插环境进行全面消毒,并浇透水。在扦插时,提前拿镊子在基质上插深度为3~5 cm的小洞,避免损伤插穗基部。采用直插法,插入后将基质压实,浇透水。扦插后,在大棚上加盖塑料保水保温,对插穗每天进行浇水,控制棚内相对湿度在75%~80%。
1.5数据统计与分析
在试验扦插第35天时,对插穗进行全面统计,计算生根率、苗高增长量和生物量。用根系扫描仪(Epson Perfection V850 Pro,日本)扫描完整根系,用WinRHIZO软件分析,统计最长根长、根表面积、根平均直径和平均根数。随后将插穗根系放入65 ℃烘箱烘干48 h后称取鲜重质量干质量[10]。运用Excel2007进行数据的统计分析。各指标均采用平均值±标准误差。数据使用SPSS 26进行方差分析、Duncan多重比较(显著性水平设0.05)。
2结果与分析
2.13种外源激素浸泡对蔓越莓扦插的影响
2.1.13种外源激素浸泡对生根率的影响
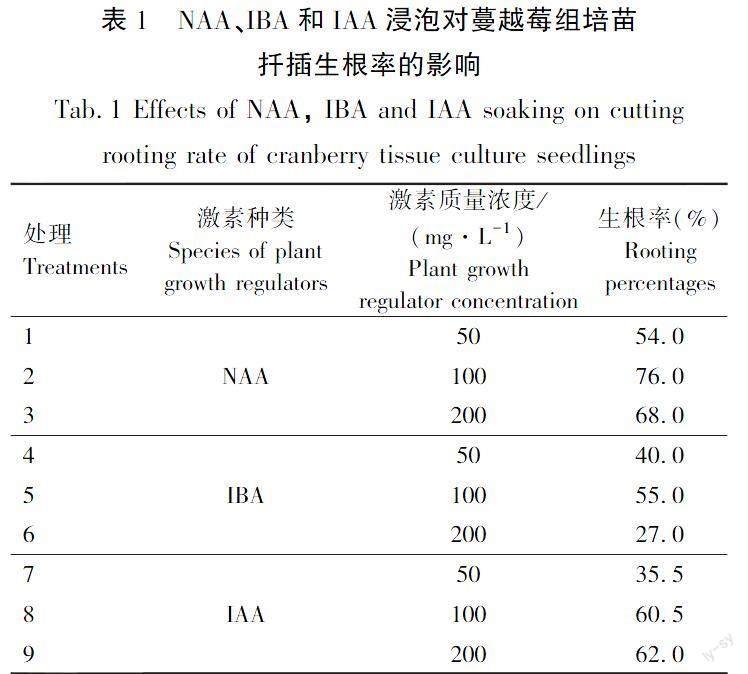
3种外源激素浸泡对蔓越莓组培苗生根率影响较大,试验结果见表1。由表1可以看出,当IBA为200 mg/L时生根率最低,仅为27%。而IBA的3个质量浓度处理中100 mg/L时生根率最高,为55%。而IAA的3个质量浓度处理生根率分别为35.5%(IAA 50 mg/L)、60.5%(IAA 100 mg/L)、62.0%(IAA 200 mg/L),NAA质量浓度的3个处理中,当NAA质量浓度为100 mg/L时,生根率最高,为76.0%。
2.1.23种外源激素浸泡对苗高增长量的影响
3种外源激素浸泡对蔓越莓组培苗苗高增长量的影响差异显著,试验结果见表2。由表2可以看出,3种激素的9个处理苗高均有一定程度的提高,其中IAA 100 mg/L时苗高增长量最小,仅为(1.00±0.12) cm,IAA的另外2个处理苗高增长量分别为(1.02±0.16) cm(IAA 50 mg/L)和(1.60±0.20) cm(IAA 200 mg/L)。总体来看IBA处理的3个质量浓度苗高增长量较高,分别为(2.33±0.35) cm(IBA 50 mg/L)、(2.22±0.17) cm(IBA 100 mg/L)、(2.26±0.21)(IBA 200 mg/L)。
2.1.33种外源激素浸泡对扦插苗生物量的影响
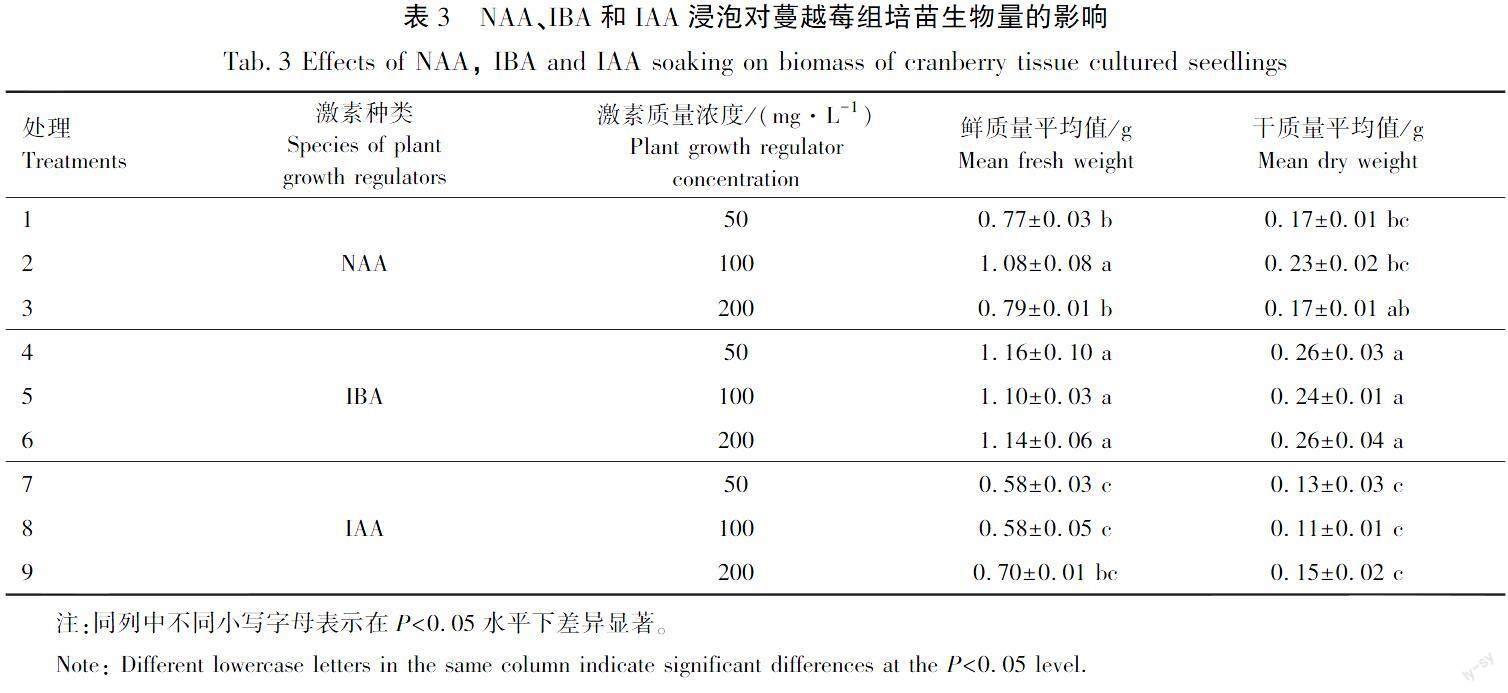
3种外源激素浸泡对蔓越莓组培苗生物量的影响差异显著,试验结果见表3。
由表3 可以看出,IAA浸泡的3个质量浓度处理干质量和鲜质量均较低,鲜质量分别为(0.58±0.03) g(IAA 50 mg/L)、(0.58±0.05) g(IAA 100 mg/L)和(0.70±0.01) g(IAA 200 mg/L)。NAA质量浓度的3个处理鲜质量和干质量平均值介于IAA和IBA之间。总体来看IBA质量浓度的3个处理鲜质量平均值和干质量平均值较高,当IBA质量浓度为50 mg/L时鲜质量平均值最高,为(1.16±0.10) g。
2.1.4 3种外源激素浸泡对生根状况的影響
3种外源激素浸泡对蔓越莓组培苗生根状况的影响差异显著,试验结果见表4。由表4可以看出,随着NAA、IBA和IAA质量浓度的升高,最长根长呈现升高后降低趋势。当IAA质量浓度为50 mg/L时最长根长最小,为(7.58±0.28) cm,当NAA浓度为100 mg/L时最长根长最大,为(30.77±0.18) cm;当IAA质量浓度为50 mg/L时根表面积最小,为(0.46±0.00) cm2,当NAA质量浓度为200 mg/L时根表面积最大,为(1.92±0.12) cm2;当IBA质量浓度为200 mg/L时根平均直径最小,为(0.13±0.00) mm,当NAA质量浓度为100 mg/L时根平均直径最大,为(0.3±0.02) mm;当IBA质量浓度为200 mg/L时平均根数最少,为(25.67±2.86)条,当NAA质量浓度为200 mg/L时平均根数最多,为(193.11±15.27)条;总体来看,当NAA质量浓度为100 mg/L和200 mg/L时根系生长状态较好。
2.23种外源激素速沾对蔓越莓扦插的影响
2.2.13种外源激素速沾对生根率的影响
3种外源激素速沾对蔓越莓组培苗生根率影响较大,试验结果见表5。由表5可以看出, IAA的3个质量浓度处理生根率分别为71.5%(IAA 500 mg/L)、71.5%(IAA 1 000 mg/L)、51.0%(IAA 2 000 mg/L),NAA质量浓度的3个处理中,当NAA质量浓度为500 mg/L时,生根率最高为76.0%。当IBA为500 mg/L时生根率最低,仅为61.0%。而IBA的3个质量浓度处理中1 000 mg/L时生根率最高,为85.0%。
2.2.23种外源激素速沾对苗高增长量的影响
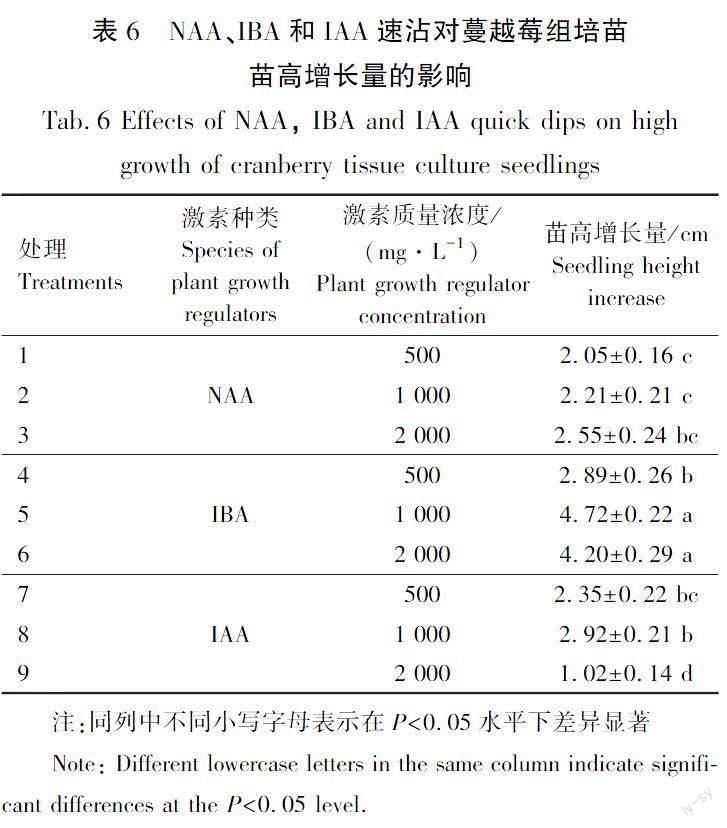
3种外源激素速沾对蔓越莓组培苗苗高增长量的影响差异显著,试验结果见表6。由表6可以看出,3种激素的9个处理苗高均有一定程度的提高,其中IAA 2 000 mg/L时苗高增长量最小,仅为(1.02±0.14) cm,IAA的另外2个处理苗高增长量分别为(2.35±0.22) cm(IAA 500 mg/L)和(1.60±0.20) cm(IAA 1 000 mg/L)。总体来看IBA处理的3个质量浓度苗高增长量较高,分别为(2.89±0.26) cm(IBA 500 mg/L)、(4.72±0.22) cm(IBA 1 000 mg/L)、(4.20±0.29) cm(IBA 2 000 mg/L)。
2.2.33种外源激素速沾对扦插苗生物量的影响
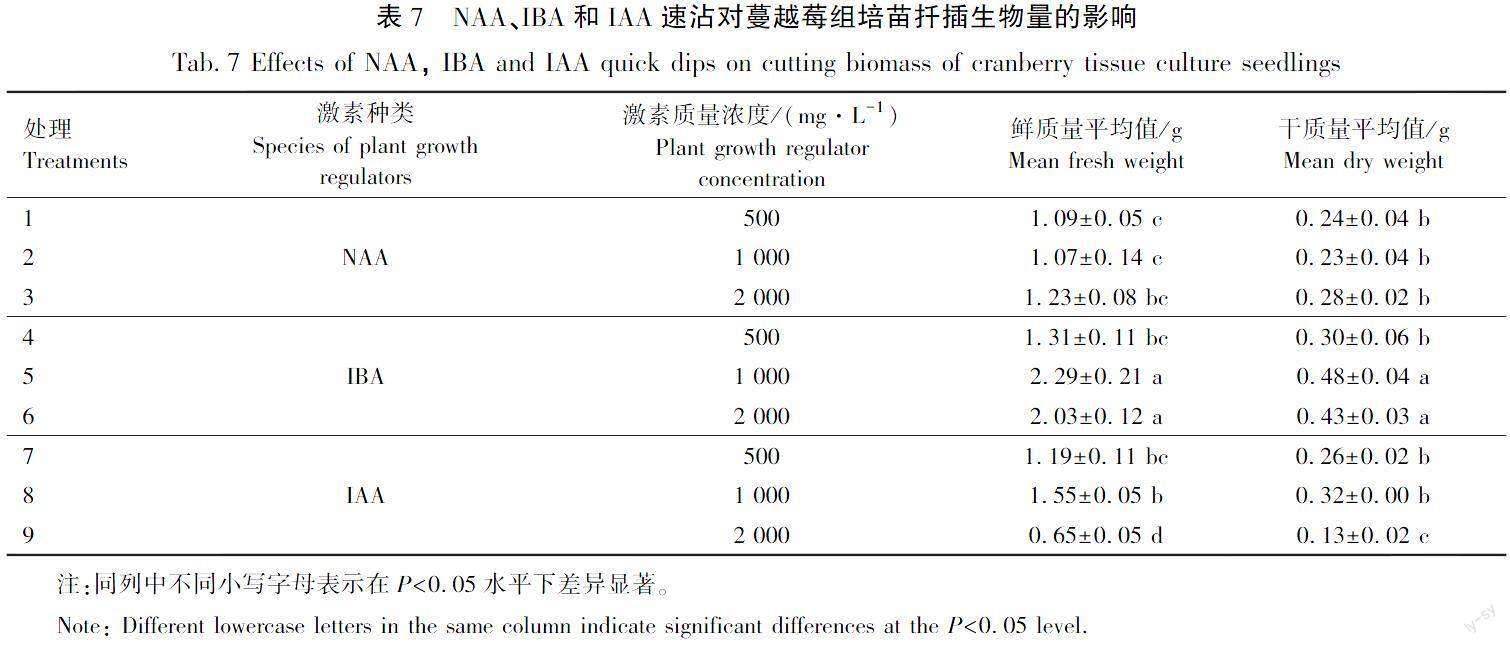
3种外源激素速沾对蔓越莓组培苗生物量的影响差异显著,试验结果见表7。由表7可以看出,IAA速沾的3个质量浓度处理干质量和鲜质量均较低,鲜质量分别为(1.19±0.11) g(IAA 500 mg/L)、(1.55±0.05) g(IAA 1 000 mg/L)和(0.65±0.05) g(IAA 2 000 mg/L)。总体来看IBA质量浓度的3个处理鲜质量平均值和干重平均值较高,当IBA质量浓度为1 000 mg/L时鲜质量和干质量平均值最高,分别为(2.29±0.21) g和(0.48±0.04) g。
2.2.43种外源激素速沾对生根状况的影响
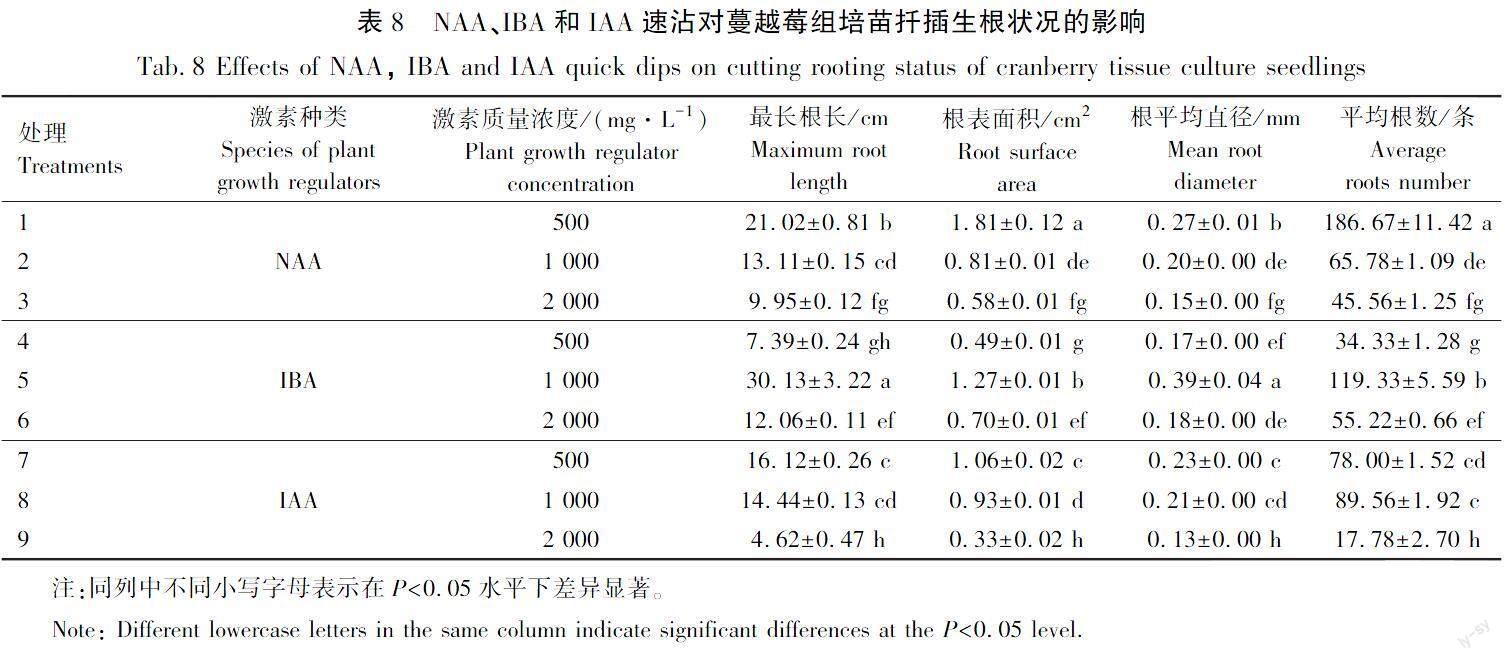
3种外源激素速沾对蔓越莓组培苗生根状况的影响差异显著,试验结果见表8。
由表8可以看出,当IAA质量浓度为2 000 mg/L时最长根长最小,为(4.62±0.47) cm,当IBA质量浓度为1 000 mg/L时最长根长最大,为(30.13±3.22) cm;当IAA质量浓度为2 000 mg/L时根表面积最小,为(0.33±0.02) cm2,当NAA质量浓度为500 mg/L时根表面积最大,为(1.81±0.12) cm2;当IAA质量浓度为2 000 mg/L时根平均直径最小,为(0.13±0.00) mm,当IBA质量浓度为1 000 mg/L时根平均直径最大,为(0.39±0.04) mm;当IBA质量浓度为500 mg/L时平均根数最少,为(34.33±1.28)条,当NAA质量浓度为500 mg/L时平均根数最多,为(186.67±11.42)条;总体来看当IBA质量浓度为1 000 mg/L时根系生长状态较好。
3讨论
目前对蔓越莓进行组织培养繁殖研究较少,学者对蔓越莓进行组织培养中外植体的筛选、消毒方式、基本培养基和激素配比的选用进行了一系列研究[11]。本研究在蔓越莓离体快繁体系建立的基础上,利用蔓越莓组培苗作为扦插插穗,进行蔓越莓组培苗扦插生根的研究,不但能保证插穗生理形状和基因型的一致,还能够降低插穗获得的成本,对蔓越莓离体快繁研究具有重要的意义。植物扦插繁殖是利用细胞的全能性和植物的再生性的无性繁殖方法。选取植物根、茎和叶等部位作为插穗,扦插入泥炭土、蛭石、河沙和蛭石等基质中,利用外源激素、营养物质促进其生根,使其生长为可以进行生理活动完整植株[12]。扦插繁殖可以最大程度地保持母株的优良性状,并且具有操作方便、生长周期较短和繁殖系数大等特点[13]。目前,对于植物扦插繁殖有2方面的研究,一是通过对插穗的处理和外部环境的改善来增加其成活率,如扦插基质、插穗类型、外源激素等,以及对扦插温度和湿度调节等技术;二是通过解剖学分析不定根的发生和生长,从生理生化的角度对不定根形成的机理进行理论方面的说明,为技术措施提供理论依据。蔓越莓的扦插繁殖利于缩短生长周期、具有操作方便等优点,方便对蔓越莓的大规模生产。对于蔓越莓扦插技术的研究非常重要,而目前蔓越莓组培苗的扦插研究尚未见报道。
在目前植物扦插生根的研究中,施加外源激素可以有效促进植物的代谢和生长发育。NAA、IAA和 IBA是植物扦插过程中较为常用的激素。常用的3种激素中,IBA是一种长期有效的化合物,稳定性强且对插穗毒性较小[14]。本研究3种激素质量浓度的浸泡和速沾试验结果显示,激素种类对蔓越莓生根影响较大,这与多种植物如大马士革玫瑰(Rose damascene) [15]、破布木(Cordia dichotoma)[16]和乌饭树(Vaccinium bracteatum) [17]等研究结果类似,激素种类为主导因素,其他因素随之变化。总体来看在浸泡试验中NAA最优,当NAA质量浓度为500 mg/L时,生根率最高,为76.0%。在速沾试验中IBA处理较好,当IBA质量浓度为1 000 mg/L时生根率最高,为85%。因此总体来看速沾比浸泡试验生根效果好。有研究表明,经 IBA处理过的插穗生根能力明显优于 NAA和 IAA[18];而且南京椴(Tilia miqueliana)[19]、中华金叶榆(Ulmus pumila 'jinye')[20]和毛梾(Swida walteri)[21]等植物的研究中也发现,IBA处理过的插穗明显优于其他激素。同时还发现,不同质量浓度促进效果各有不同。本研究也与上述研究类似,发现IBA时蔓越莓速沾处理的最佳激素种类。
在扦插过程中利用植物生长调节剂浸泡插穗,可以提高生根率。相较于“浸泡”处理,“速沾”处理能缩短扦插过程的时间,有利于减低外界环境对插穗的不利影响,提高扦插效率[22]。本研究利用浸泡和速沾2种方法对蔓越莓生根影响进行研究,结果表明。IBA浸泡处理苗高增长量最高,为(2.33±0.35) cm(IBA 50 mg/L),IBA速沾处理的苗高增长量最高,为(4.72±0.22) cm(IBA 1 000 mg/L)。总体来看当NAA浸泡处理为100 mg/L和200 mg/L時,根系生长状态较好,最长根长为(30.77±0.18) cm(IBA 100 mg/L)、根平均直径为(0.3±0.02) mm。而IBA 质量浓度1 000 mg/L时速沾处理的插穗最长根长,为(30.13±3.22) cm、根平均直径为(0.39±0.04) mm、根表面积为(1.27±0.01) cm2、平均根数为(119.33±5.59)条。由此来看浸泡处理和速沾处理最优处理根系生长状况相差不大,但是综合来看当IBA质量浓度为1 000 mg/L速沾时生根率最高,为85%。因此速沾的方法更适合蔓越莓组培苗的扦插生根。
【参考文献】
[1]万学道.北美超微果树——蔓越橘[J].中国林业,2002(16):40-41.
WAN X D. Ultramicro trees-cranberry in North America[J]. Forestry of China, 2002(16):40-41.
[2]张利,李亚东,陆晓雅.世界蔓越橘产业[J].世界农业,2014(10):140-142.
ZHANG L, LI Y D, LU X Y. World cranberry industry[J]. World Agriculture, 2014(10):140-142.
[3]钟文君,游伟程.蔓越莓的保健功能[J].国外医学(卫生学分册),2004(6):370-373.
ZHONG W J, YOU W C. Health care function of cranberry[J]. Foreign Medical Sciences (Section Hygiene), 2004(6):370-373.
[4]MASTUSHIMA M, SUZUKI T, MASUI A, et al. Growth inhibitory action of cranberry on Helicobacter pylori[J]. Gastroenterol Hepatol, 2008, 23(2):175-180.
[5]周劭桓,叶兴乾,江萍,等.浆果多酚的功能活性[J].粮油加工,2008(2):126-129.
ZHOU S H, YE X Q, JIANG P, et al. Functional activity of polyphenols in berry[J]. Cereals and Oils Processing, 2008(2):126-129.
[6]尹喜玲,段雪英,肖颖.浅谈蔓越莓的保健作用[J].中国食物与营养,2003(10):48-49.
YIN X L, YIN X Y, XIAO Y. Effects of cranberry on health care[J]. Food and Nutrition in China, 2003(10): 48-49.
[7]WEISS E L, LEV-DOR R, SHARON N, et al. Inhibitory effect of a high-molecular-weight constituent of cranberry on adhesion of oral bacteria[J]. Critical Reviews in Food Science and Nutrition, 2002, 42(S1):285-292.
[8]郭佳,丁庆波.蔓越莓的营养与功能特性概述[J].农产品加工(学刊),2011(5):100-104.
GUO J, DING Q B. Nutritional elements and functional characters of cranberry[J]. Academic Periodical of Farm Products Processing, 2011(5):100-104.
[9]裴彤,李金英,王颖,等.蔓越莓产业发展及栽培技术研究进展[J].吉林林业科技,2022(2):32-37.
FEI T, LI J Y, WANG Y, et al. Industry development and cultivation technology research progress of Vacciniium macrocarpon[J]. Journal of Jilin Forestry Science and Technology, 2022(2):32-37.
[10]杨庆春,李国雷.不同植物生长调节剂对栓皮栎嫩枝扦插的影响[J].东北林业大学学报,2017,45(6):12-16.
YANG Q C, LI G L. Effects of plant growth regulators on the rooting of softwood cutting of Quercus variabilis[J] Journal of Northeast Forestry University, 2017,45(6):12-16.
[11] 杨瑞芹. 蔓越橘茎段离体快速繁殖与叶片再生体系建立[D].长春:吉林农业大学,2012.
YANG R Q. Establishment of rapid propagation and regeneration system from shoots and leaves in vitro of cranberry[D]. Changchun: Jilin Agricultural University, 2012.
[12]H.T.哈特曼D.E.凯斯特.植物繁殖原理和技术[M].北京:中国林业出版社,1985.
HARTMANN H T, KOESTER D E. Principles and techniques of plant reproduction[M]. Beijing: China Forestry Publishing House, 1985.
[13]李继华.扦插的原理与应用[M].上海:上海科学技术出版社,1987.
LI J H. Principle and application of cutting[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1987.
[14]BARTEL B, LECLERE S, MAGIDIN M, et al. Inputs to the active indole-3-acetic acid pool: De novo synthesis, conjugate hydrolysis, and indole-3-butyric acid b-oxidation[J]. Journal of Plant Growth Regulation, 2001, 20(3):198-216.
[15]刘雷,蒋攀,黄怡,等.大马士革Ⅲ玫瑰嫩枝扦插及其生根机制初步研究[J].种子,2020,39(3):92-100.
LIU L, JIANG P, HUANG Y et al. Preliminary study on twig cuttage and its rooting mechanism of Rosa damascene Miller[J]. Seed, 2020, 39(3): 92-100.
[16]杨浩.破布木扦插繁殖技术及生根机理研究[D].湛江:广东海洋大学,2020.
YANG H. The study on cutting propagation technology and rooting mechanism of Cordia dichotoma Forst. F.[D]. Zhanjiang: Guangdong Ocean University, 2020.
[17]陈庆生,周鹏,张敏,等.激素和插穗处理对乌饭树扦插生根的影响[J].东北林业大学学报,2016,44(4):41-43+47.
CHEN Q S, ZHOU P, ZHANG M, et al. Influence of different treatment of cuttings and hormone on rooting of cutting of Vaccinium bracteatum[J]. Journal of Northeast Forestry University, 2016, 44(4): 41-43+47.
[18]KOCHHAR S, SINGH S P, KOCHHAR V K. Effect of auxins and associated biochemical changes during clonal propagation of the biofuel plant-Jatropha curcas[J]. Biomass & Bioenergy, 2008, 32(12):1136-1143.
[19]杨虹,李乃伟,郭忠仁,等.南京椴扦插繁殖技术研究[J].安徽农业科学,2010,38(26):14390-14391+14397.
YANG H, LI N W, GUO Z R, et al. Research on the propagation technique of Tilia miqueliana Maxim.[J]. Journal of Anhui Agricultural Sciences, 2010, 38(26): 14390-14391,14397.
[20]徐笑玥,佟兆庆,闫文涛,等.中华金叶榆嫩枝扦插繁殖技术[J].东北林业大学学报,2016,44(5):1-4.
XU X Y, TONG Z Q, DOU W T, et al. Soft cutting propagation technology of Ulmus pumila Zhonghuajinye[J]. Journal of Northeast Forestry University, 2016, 44(5):1-4.
[21]张亚男,刘勇,贺国鑫,等.植物生长调节剂对毛梾嫩枝扦插生根及内源激素含量的影响[J].西北林学院学报,2021,36(6):92-99.
ZHANG Y N, LIU Y, HE G X, Effects of plant growth regulators on rooting and endogenous hormones content of Cornus walteri softwood cuttings[J]. Journal of Northwest Forestry University, 2021, 36(6):92-99.
[22]許琪.光皮树扦托苗繁育及优良无性系组培快繁技术研究[D].长沙:中南林业科技大学,2012.
XU Q. Breeding and tissue culture technique research of Swida wilsoniana by cutting and superior clones[D]. Changsha: Central South University of Forestry and Technology, 2012.

