磷胁迫对不同基因型魔芋组培苗生长及生理生化特性的影响
王自布+陈相为+李浩


摘要:旨在探讨不同磷水平对魔芋生长及相关生理特性的影响,为发掘磷高效魔芋提供科学依据。以贵州喀斯特山区农户种植的花魔芋和白魔芋组培苗为材料,采用沙培方法研究不同磷水平(正常供磷、低磷)下2种魔芋的生长及生物量大小、根长、叶片的氧化酶活性、可溶性蛋白含量和淀粉含量。结果表明:在相同磷浓度下,花魔芋与白魔芋的部分生物性状、生理性状显著不同;在生长特征方面,在高磷条件下,与花魔芋相比,白魔芋的根长极显著降低,株高显著降低;在低磷条件下,与花魔芋相比,白魔芋株高、根长均极显著降低,根冠比显著下降;在生理特征方面,在相同供磷条件下,与花魔芋相比,白魔芋叶片可溶性蛋白含量、淀粉含量、抗氧化酶活性均有一定的变化。可以看出,基因型不同的魔芋在不同磷环境下表现出不同的磷利用能力,且花魔芋表现出更强的磷高效利用能力。
关键词:魔芋;基因型;组培苗;磷胁迫;生长特性;生理特性
中图分类号: S632.301文献标志码:
文章编号:1002-1302(2016)08-0251-03
研究磷胁迫下不同基因型魔芋的生长情况及其与磷相关的生理生化特征,可以为磷高效魔芋种质资源的开发提供科学的理论依据。魔芋是贵州省名、优、特农作物之一,总产量居全国前列,是贵州山区魔芋种植户脱贫致富的一个特色产业[1]。但是对于生长在喀斯特区域的植物来说,由于喀斯特地区的偏碱性环境及较多的钙离子,能直接被植物吸收利用的有效磷被土壤矿物质紧密结合而导致其活性降低,从而极易成为影响植被生长的限制因子而导致植被的退化,这正是喀斯特石漠化的重要前提[2],植物受到这种地貌特征的影响,要吸收到足够的磷十分不易,尤其是魔芋的种植户习惯把魔芋种植在林下或套种以节省有限的土地资源。在这种条件下,土壤缺磷是作物生产的限制因素之一[3]。磷又是不可再生的资源,全球磷矿资源有限。据美国地质调查局统计,预测全球磷矿资源将在50~100年内面临耗竭的危险。已有很多研究表明,不同物种、品种、种源及无性系之间对磷的利用效率存在显著的差异,高磷效品种具有自身特有的低磷适应机制,在整个农林业面临着土地资源有限、大量施肥带来资源浪费和环境污染的情况下,开展魔芋低磷胁迫研究、充分发挥魔芋自身潜力、改良魔芋磷素营养性状,是提高魔芋对土壤磷吸收利用的一个重要途径。尤其是在喀斯特区域开展魔芋低磷胁迫研究,将为地区魔芋高磷效率品种筛选压力、指标和磷胁迫程度评价指标等积累资料,为发掘魔芋自身的高效磷利用能力、提高魔芋磷利用效率、促进魔芋低磷育种和栽培管理技术升级提供科学依据和技术支撑,对节约资源、保护环境和降低魔芋生产成本具有重要的现实意义。
植物在低磷胁迫时,其在性状以及生理生化等方面均会发生变化,最终将会影响植物的生长发育进而影响植株的生物产量[4-7]。研究发现,低磷对植物的生长发育具有影响,能够增加叶片与根系中淀粉含量,植物地上部和根系的生长均明显减缓[8]。在逆境胁迫时(如干旱、盐分、污染物等),可溶性蛋白的合成也会受到抑制或促进[9-10]。另外,逆境胁迫也会导致植物体内的保护酶系统发生改变,如过氧化氢酶(CAT)、过氧化物酶(POD)及超氧化物歧化酶(SOD)等活性提高[11-13]。我国学者研究了不同植物包括玉米[14]、松树[15]、番茄[12]、油茶[16]、马铃薯[17]等的磷利用情况,将一些生理生化特点作为评价和筛选耐低磷品种的指标。但是魔芋的耐低磷筛选指标的研究目前还没有统一的标准,而魔芋又是贵州喀斯特山区分布较广的经济作物,种质资源丰富,目前还缺乏对这些资源在不同磷胁迫下生长状况和生理特征方面的研究。为此,本试验选择贵州喀斯特山区农户种植的不同基因型的魔芋为试验材料,以前期获得的盆栽组培苗为研究对象,探讨不同磷水平对不同基因型魔芋在生长状况、根、茎、叶、叶片可溶性蛋白含量、淀粉含量、酶活性方面的影响,以期为魔芋磷高效资源的筛选和评价指标提供参考依据。
1材料与方法
1.1试验材料
本试验材料来源于贵州师范学院组培实验室培养的花魔芋、白魔芋组培苗。
1.2试验方法
选择大小一致的组培苗,洗去根部粘连的培养基,用1%次氯酸钠溶液消毒10 min左右,再用去离子水冲洗2~3次,栽培在基质中统一炼苗。然后选择整齐度均匀的幼苗室外盆栽,塑料盆大小为30 cm×25 cm,每盆装沙、蛭石、珍珠岩,按照1 ∶[KG-*3]1 ∶[KG-*3]1进行混合;设置2个磷素水平[低磷(1.0 μmol/L磷酸二氢铵)、高磷(1.0 mmol/L磷酸二氢铵)];定期定量地进行营养液浇灌管理。营养液组分浓度:4.0 mmol/L硝酸钙、5.0 mmol/L硝酸钾、2.0 mmol/L硫酸镁、1.0 mmol/L磷酸二氢铵、0.1 mmol/L EDTA-Fe、0.01 mmol/L氯化锰、0001 mmol/L硫酸铜、0.001 mmol/L硫酸锌、0.033 mmol/L硼酸、0.000 2 mmol/L钼铵酸;低磷的营养液中磷酸二氢铵浓度为1.0 μmol/L,缺少的氮以硝酸铵补齐。每个处理3个重复(单位:盆),每个重复20盆。待魔芋叶片全展开后取样测定。
1.3指标测定
每个重复取1株,用去离子水洗净,吸水纸吸净表面水分,测定株高、根长、茎粗,计算叶面积,再将植株分为地上部、地下部2个部分,分別称质量。然后将样品用液氮处理5 min左右,保存于-80 ℃冰箱中备用。魔芋CAT、SOD活性测定参考苏贺等方法[18];用考马斯亮蓝法测定可溶性蛋白含量;POD活性测定参照李合生的方法[19]。
1.4数据处理
数据整理采用Excel 2003 软件,采用SPSS18.0进行方差分析和相关性分析。
2结果与分析
2.1不同磷处理对魔芋生长的影响
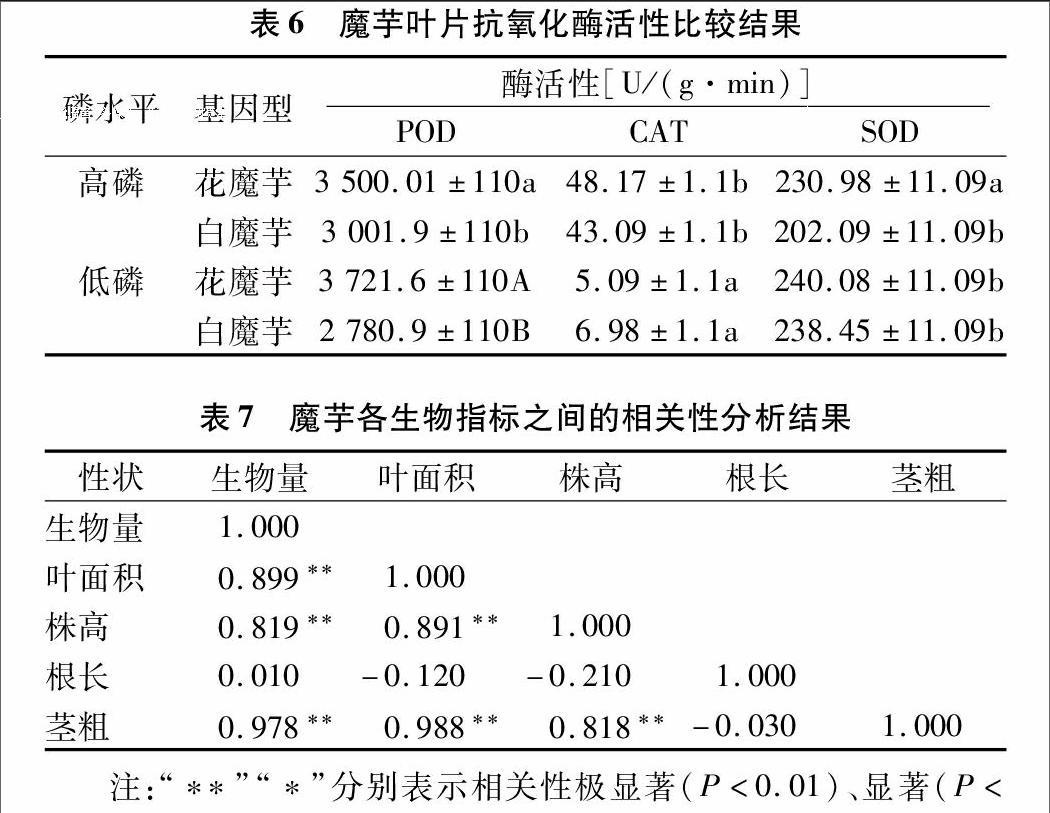
由表1可以看出,本试验中魔芋的7个性状中只有株高和根长受魔芋基因型影响,达显著或极显著差异,其他几个性状与基因型无关。磷水平对魔芋地下鲜质量没有影响,其他几种性状均受磷水平的影响,分别达到了显著或极显著水平。试验中7个性状均受基因型和磷水平交互作用的影响,分别达到了显著或极显著水平。
由表2可知,株高在高磷水平下均高于低磷水平,同一磷水平下不同基因型间差异达到显著或极显著水平;根长在低磷条件下,明显高于正常供磷的水平;根冠比在低磷水平差异显著;其余性状差异均没有达到显著水平。
3结论与讨论
磷是植物生长的必需营养元素之一,可参与植物的光合作用、呼吸代谢、能量转化、信号转导、生物大分子合成以及酶活性的调节等,在植物整个新陈代谢过程中扮演着十分重要的角色[20]。研究发现,当外界磷有效性较低时,植物能够将更多的碳源分配到根系,促进根系生长,提高根冠比[21]。在本试验中,低磷条件下魔芋根系长度明显高于正常供磷水平;而低磷处理的根冠比要比正常供磷的处理大,但是差异没有达到显著水平。除此之外,全展叶叶面积对魔芋生物量的影响具有决定意义。在低磷条件下,花魔芋叶面积、茎粗、地上鲜质量、地下鲜质量、可溶性蛋白含量以及淀粉含量均高于白魔芋,花魔芋表现出磷高效利用能力。
轻微逆境能刺激保护酶系统活性的提高,且在不同植株体内反应能力不同[22]。本试验中,魔芋基因型极显著地影响SOD活性,显著影响POD活性,但是对CAT活性没有显著影响。磷水平对SOD、POD活性均达到了极显著的影响水平,对CAT酶活性没有显著影响。基因型与磷水平二者交互作用对3种酶活性影响不显著。但是低磷水平时,花魔芋中只有POD活性高于白魔芋,而SOD活性变化不大,差异不显著,这说明基因型对氧化酶活性的影响要高于磷水平的影响。低磷胁迫程度不同的魔芋叶片中酶活性的变化幅度不一致,表明保护酶的绝对活力与低磷胁迫无关,而变化幅度与低磷胁迫有关。这与王晶等在番茄中低磷胁迫结论一致[12]。
本试验根据不同磷水平,观察不同基因型的2种魔芋的生长状况、根系长度和氧化酶活性变化,证实花魔芋具有很强的耐低磷胁迫能力及特性,对今后进一步深入研究花魔芋耐低磷胁迫的分子机理和将其作为磷高效种质资源加以利用提供了重要的线索和依据。
参考文献:
[1]丁海兵,姜霞,邓宽平,等. 贵州魔芋产业发展现状、存在的问题及对策[J]. 贵州农业科学,2012,40(8):226-230.
[2]刘方,王世杰,刘元生,等. 喀斯特石漠化过程土壤质量变化及生态环境影响评价[J]. 生态学报,2005,25(3):639-644.
[3]陈磊,王盛锋,刘自飞,等. 低磷条件下植物根系形态反应及其调控机制[J]. 中国土壤与肥料,2011(6):1-12.
[4]周志春,谢钰容,金国庆,等. 马尾松种源对磷肥的遗传反应及根际土壤营养差异[J]. 林业科学,2003,39(6):62-67.
[5]Gilbert G A,Knight J D,Vance C P,et al. Proteoid root development of phosphorus deficient lupin is mimicked by auxin and phosphonate[J]. Annals of Botany,2000,85(6):921-928.
[6]Neumann G,Massonneau A,Langlade N,et al. Physiological aspects of cluster root function and development in phosphorus deficient white lupin(Lupinus albus L.)[J]. Annals of Botany,2000,85(6):909-919.[HJ1.7mm]
[7]Baldwin J C,Karthikeyan A S,Raghothama K G. LEPS2,a phosphorus starvation-induced novel acid phosphatase from tomato[J]. Plant Physiology,2001,125(2):728-737.
[8]Fredeen A L,Rao I M,Terry N. Influence of phosphorus nutrition on growth and carbon partitioning in Glycine max[J]. Plant Physiology,1989,89(1):225-230.
[9]蒋继志,王金胜. 分子生物学[M]. 北京:科学出版社,2011:200.[ZK)]
[10]李妮亚,高俊凤,汪沛洪. 小麦幼芽水分胁迫诱导蛋白的特征[J]. 植物生理学报,1998,24(1):65-71.
[11]李键,黄锦湖,洪滔,等. 低磷胁迫对雷公藤幼苗形态指标及生物量的影响[J]. 热带亚热带植物学报,2012,20(5):482-488.
[12]王晶,韩晓日,战秀梅,等. 低磷胁迫对番茄叶片膜脂过氧化及保护酶活性的影响[J]. 植物营养与肥料学报,2005,11(6):851-854.
[13]郑金凤,董少鸣,严小龙,等. 低磷胁迫对小麦代换系保护酶活性和丙二醛含量的影响及染色体效应[J]. 植物营养与肥料学报,2010,16(6):1366-1372.
[14]张丽梅,郭再华,张琳,等. 缺磷对不同耐低磷玉米基因型酸性磷酸酶活性的影响[J]. 植物营养与肥料学报,2015,21(4):899-911.
[15]庞丽,张一,周志春,等. 模拟氮沉降对低磷胁迫下马尾松生长和磷效率的影响[J]. 应用生态学报,2014,25(5):1275-1282.
[16]张雪洁,谭晓风,袁军,等. 磷胁迫对油茶幼苗光合生理指标的影响[J]. 西北农林科技大学学报:自然科学版,2013,41(7):125-133.
[17]李锡宁,农兰霞,牟科,等. 低磷胁迫下对转[WTBX][STBX]AtGAPC2[WTBZ][STBZ]基因马铃薯株系的评价与筛选[J]. 四川农业大学学报,2015(2):126-132.
[18]苏贺,牛晓雪,陈小文,等. 低磷胁迫对转基因抗虫玉米苗期生长的影响[J]. 中国农业大学学报,2014,19(3):63-72.
[19]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:184-185.
[20]梁翠月,廖红. 植物根系响应低磷胁迫的機理研究[J]. 生命科学,2015,27(3):389-397.
[21]Wang X R,Yan X L,Liao H. Genetic improvement for phosphorus efficiency in soybean:a radical approach[J]. Annals of Botany,2010,106(1):215-222.
[22]孙彩霞,刘志刚,荆艳东. 水分胁迫对玉米叶片关键防御酶系活性及其同工酶的影响[J]. 玉米科学,2003,11(1):63-66.

