不同改性玉米芯作为反硝化固体碳源的比选
耿雅雯,王玲玲,王浩然,王雪艳
(徐州生物工程职业技术学院,江苏 徐州 221006)
氮污染是水污染中较为严重且突出的问题,水体中总氮含量高于0.2 mg/L 就会引起富营养化,造成水质缺氧恶化[1]。我国城镇污水处理厂二级出水总氮含量远高于水体富营养化的临界值,且主要以硝态氮的形式存在,具有低碳氮比(C/N),仍需要进行深度脱氮处理。而传统的异养反硝化生物脱氮技术需要外加液体碳源作为电子供体,存在药剂成本高、投加量难以控制、易造成二次污染、污泥产生量大等弊端[2]。相较于液体碳源,固体碳源不仅具有缓释功能,还能作为微生物附着的载体,尤其是被视作农业废弃物的天然纤维素碳源,价格低廉,来源广泛,具有生物降解性。研究发现[3],天然纤维素材料作为反硝化碳源均具有一定的脱氮效果,其中玉米芯作为固体碳源时二次污染系数最低,持续释碳能力最强,其浸出液的生化性最好。
我国玉米芯年产量超过4 000 万t,但大部分被焚烧处理,既造成资源浪费,又污染环境。玉米芯主要由纤维素(32%~36%)、半纤维素(35%~40%)、木质素(17%~20%)及少量灰分和含氮化合物组成。其中,纤维素与半纤维素可在微生物的作用下降解为单糖进而释放碳,但纤维素的晶体结构以及较难分解的木质素保护层的交联缠绕降低玉米芯的释碳量。为此,国内外研究者采用物理(机械破碎)、化学(酸、碱、氧化等)及微生物方法对玉米芯进行改性处理,以破坏纤维素的晶体结构和木质素保护层,提高释碳量。本研究响应碳达峰碳中和政策,采用1.5% NaOH、O3、1.5% NaOH+O3、O3+1.5% NaOH 对玉米芯进行改性处理,以提高有机碳的释放比例,减轻后续焚烧处理对环境的污染,同时重点分析不同改性玉米芯的释放特性和反硝化脱氮性能,比选出玉米芯作为固体反硝化碳源的最佳改性方式,以期为玉米芯作为反硝化碳源时的脱氮效果提高提供参考。
1 材料与方法
1.1 试验材料
一是玉米芯颗粒。将取自江苏省徐州市某农村地区的玉米芯作为原材料,剪切成体积约1 cm3的玉米芯颗粒,用蒸馏水清洗干净,置于70 ℃的干燥箱中烘干,待其自然冷却后密封保存。二是低C/N 污水。试验用水为实验室模拟污水,由实验室蒸馏水配制,以KNO3作为氮源、KH2PO4作为磷源,并添加一定的微量元素,配制成硝酸盐浓度为50 mg/L 的低C/N污水。三是接种污泥。取自实验室正在运行的反硝化反应器,将其静置并倒去上清液,沉淀的污泥浓度约为20 g/L。
1.2 试验方法
1.2.1 改性玉米芯的制备
分别称取20 g 玉米芯颗粒放入4 个500 mL 烧杯中,将其分为4 组,按照表1 的方法对其进行改性处理,分别将其简称为碱组、碱+O3组、O3组、O3+碱组。将改性后的玉米芯用蒸馏水清洗干净,烘干后密封保存,备用。

表1 改性玉米芯的制备方法
1.2.2 静态释放试验
分别称取2.5 g 未处理和改性处理后的玉米芯颗粒,放入5 个250 mL 的锥形瓶中,在室温下(约25 ℃)加250 mL 蒸馏水浸泡,分别在第2 天、第4 天、第6 天、第9 天、第15 天时取样,测定浸出液中总有机碳(TOC)、总氮(TN)、总磷(TP)、化学需氧量(COD)的浓度,考察其碳释放特性及二次污染物的释放水平,每次取样后彻底换水。
1.2.3 表面特征分析
通过扫描电镜观察玉米芯改性前后表观结构的变化,综合分析采用不同改性处理方法时其作为反硝化固态碳源的可行性。
1.2.4 反硝化脱氮试验
取5 个250 mL 锥形瓶,加入50 mL 接种污泥和200 mL 低C/N 污水,并分别加入2.5 g 未处理和改性处理后的玉米芯颗粒,用封口膜密封,放入恒温振荡培养箱中振荡培养,控制培养箱转速为50 r/min,温度为25 ℃。每24 h 换水200 mL,并测定出水pH、COD、硝酸盐氮(NO3--N)、亚硝酸盐氮(NO2--N)和TN 浓度。
1.3 分析方法
常规水质指标采用国标法来测定。COD 的测定采用快速消解分光光度法;NO3--N 的测定采用紫外分光光度法;NO2--N 的测定采用N-(1-萘基)-乙二胺光度法;TP 的测定采用钼酸铵分光光度法;TN 的测定采用过硫酸钾氧化-紫外分光光度法;TOC 的测定采用总有机碳分析仪;pH 的测定采用便携式pH 计。
2 结果与讨论
2.1 静态释放特性分析
静态释放特性主要涉及两个方面,一是碳释放,二是二次污染物释放。
2.1.1 碳释放特性
未处理和改性处理后的玉米芯连续15 d 的累计释碳量变化曲线如图1所示,五组玉米芯均具有相似的释碳规律,初期释碳量大且释碳速率较快,随着浸泡时间的延长,单位时间释碳量逐渐减少,释碳速率逐渐降低。经推测,原因是试验初期玉米芯表面的可溶性小分子有机物迅速溶解至水中,导致浸出液的TOC 浓度急剧增加。玉米芯属于天然纤维素材料,纤维素和半纤维素是主要的碳源,但其仅在微生物的作用下才能分解释放有机碳。同时,纤维素与木质素的交联作用阻拦玉米芯内部的可溶性小分子有机物向外释放,所以试验后期释碳速率逐渐降低,最终趋于平稳。
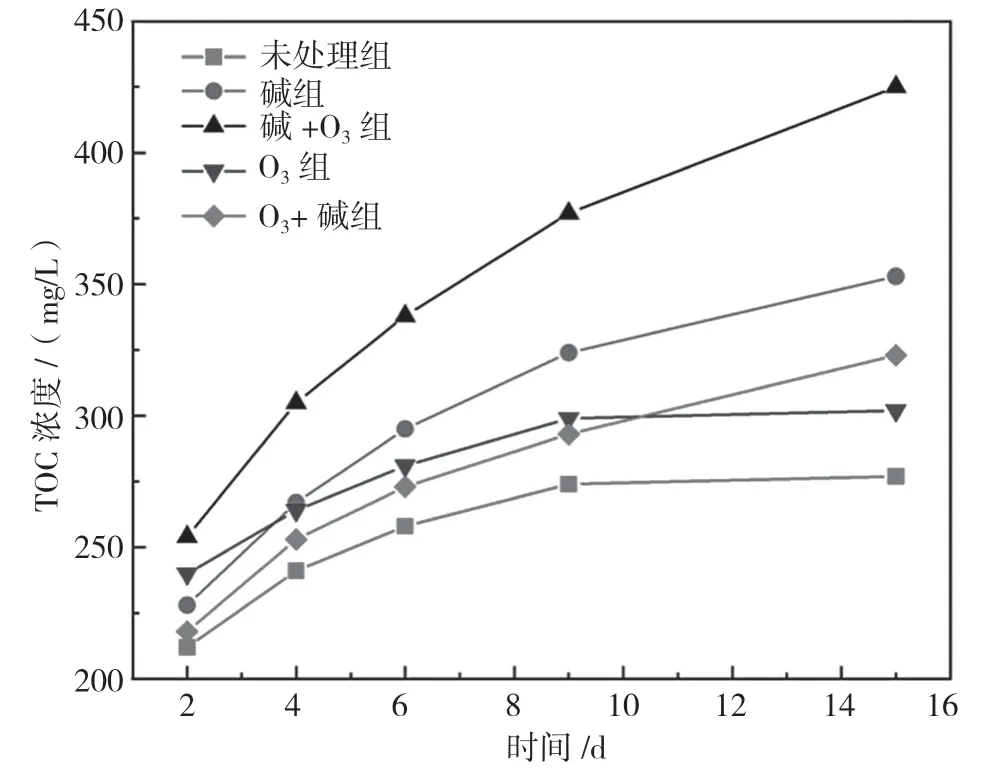
图1 玉米芯浸出液TOC 浓度
对比5 组玉米芯的释碳量,由大到小的排序分别为:碱+O3组>碱组>O3+碱组>O3组>未处理组。改性后的玉米芯释碳量均得到一定的提升。碱+O3组释碳量最大,后期释碳速率也最快。这是因为OH-不仅可以使木质素的醚键断裂从而导致大部分木质素溶解,还可以同半纤维素与木质素之间的醚键发生皂化反应,使部分半纤维素溶解;而O3作为强氧化剂,可以破坏木质素的复杂结构,进一步降解剩余的木质素,增强对木质素的脱除作用,因此碱+O3改性处理后的玉米芯具有较强的持续供碳能力。
2.1.2 二次污染物释放特性
对5 组玉米芯浸出液的TN、TP 浓度进行检测分析,以判断玉米芯浸出液的二次污染系数。各组玉米芯15 d浸出液的TN和TP日平均释放浓度如图2所示,氮的释放量均小于0.8 mg/L,所有涉及碱处理的组别较未处理组释氮量均有一定的降低;磷的释放量均小于0.15 mg/L,其中碱组和碱+O3组最低,分别为0.07 mg/L和0.06 mg/L,浸出液中的氮、磷含量远低于《城镇污水处理厂污染物排放标准》(GB 18918—2002)的一级A 排放要求。冯伟林等[4]对玉米芯进行营养成分分析,发现玉米芯中氮、磷的含量仅占碳含量的1.3%和0.4%,而改性处理又进一步降低玉米芯浸出液的二次污染系数。
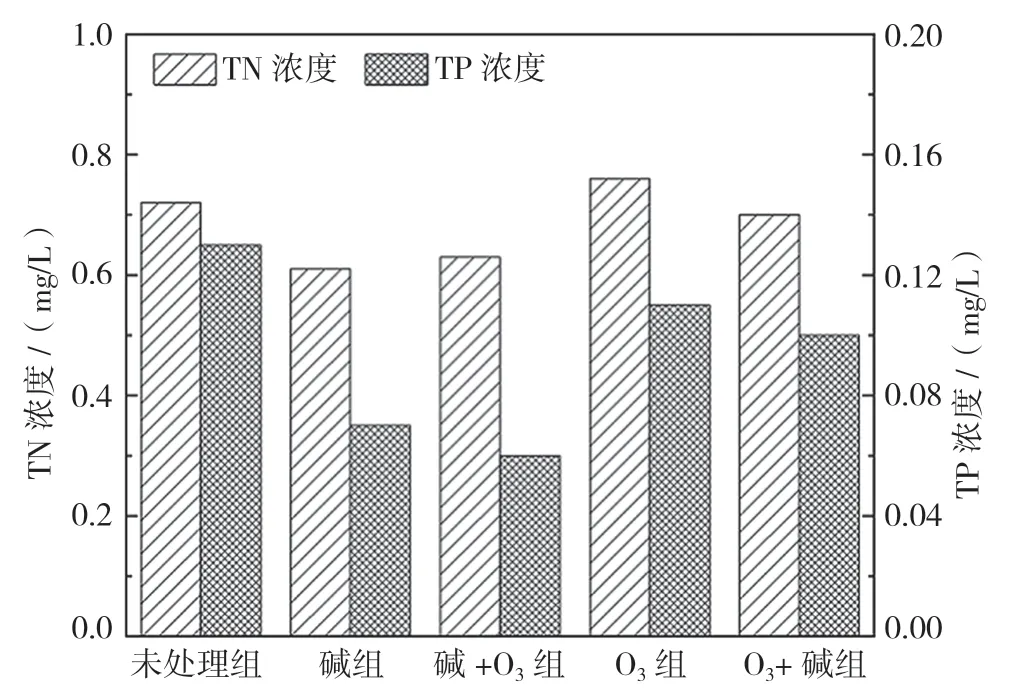
图2 玉米芯浸出液TN、TP 浓度
2.2 表面特征分析
由图3 扫描电子显微镜(SEM)图片可以看出,未改性处理的玉米芯表面比较平坦且没有发生破损,而改性处理后的玉米芯表面结构均发生一定变化。O3组变化不明显,仅发生一定的凸起,而所有被碱处理的玉米芯均出现不同程度的空洞损伤,说明碱处理分解了半纤维素与木质素[5]。对比碱组、碱+O3组和O3+碱组,碱组出现密集的细小孔洞;碱+O3组的孔隙率更高,孔洞尺寸也更大;O3+碱组也有孔洞存在,但O3处理形成的凸起破裂后对空洞形成一定的覆盖。在生物反硝化系统中,玉米芯作为固体碳源的同时还作为微生物附着生长的载体。玉米芯粗糙的表面和完整的孔洞能够增加微生物的附着量,形成致密的生物膜,从而增强纤维素酶对纤维素与半纤维素的分解作用,保证反硝化系统有持续的碳源。因此,碱+O3组玉米芯更适合作为反硝化固体碳源。

图3 玉米芯SEM 图片
2.3 静态反硝化脱氮特性分析
2.3.1 硝酸盐去除率变化
将未处理和不同改性处理的玉米芯作为反硝化固体碳源进行连续50 d 的静态反硝化脱氮研究,各组NO3--N 去除率如图4所示。前4 d 脱氮效果不稳定,这是由于接种的反硝化污泥需要适应新环境,以玉米芯作为载体生长生物膜。第5 天时,碱组、碱+O3组和O3+碱组的NO3--N 去除率均达到100%,远高于未处理组和O3组。50 d 内,碱+O3组运行状况最为平稳,硝酸盐去除率始终保持在98%以上。碱组、O3+碱组的NO3--N 去除率分别从第25 天、第17 天开始呈现下降趋势,50 d 时分别降低至90%和68%。赵文莉等[6]对玉米进行不同方式的预处理,发现碱处理玉米芯的反硝化效果最好,25 d 内NO3--N去除率稳定在95%以上,单位质量玉米芯NO3--N 去除负荷达到129.15 mg/g,但在25~41 d 时出现波动与下降。研究发现[7],木质素对纤维素酶分解半纤维素和纤维素起到吸附和抑制作用,阻碍微生物对纤维素的降解。研究结果显示,碱+O3组单位质量玉米芯NO3--N 去除负荷更大,因为在碱处理后,O3的进一步处理破坏木质素的构造,解除木质素对纤维素的包裹,增加纤维素酶与纤维素的接触面积,从而使其具有较高的反硝化脱氮效率和反硝化脱氮时长。
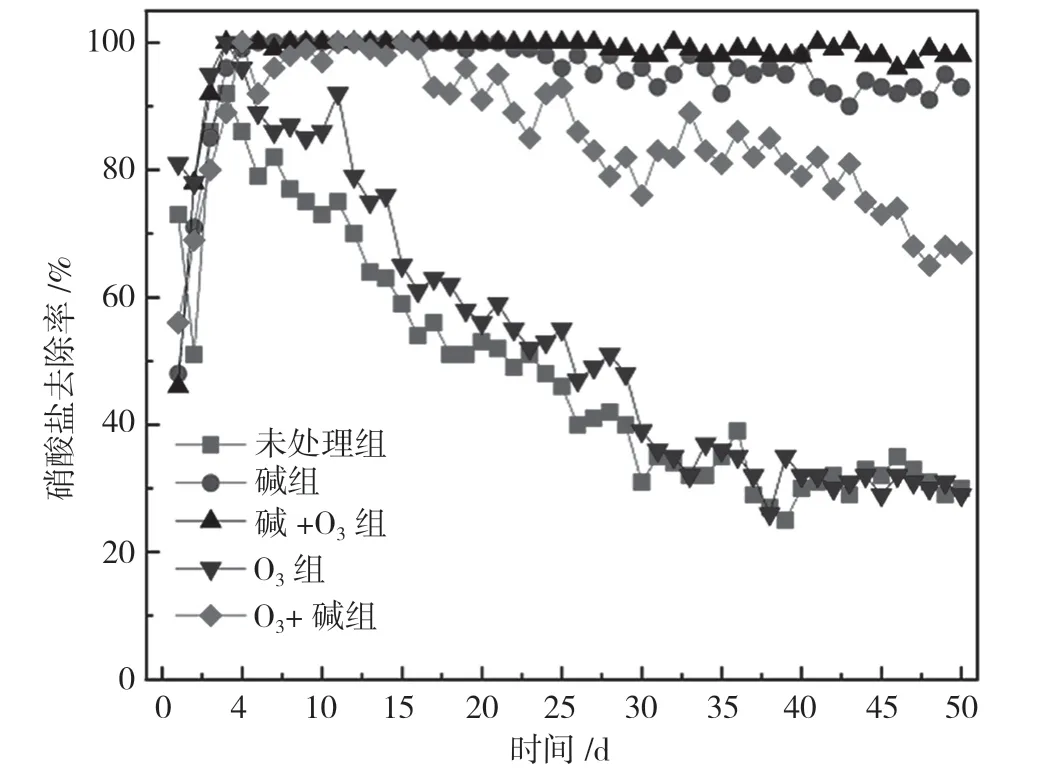
图4 硝酸盐去除率变化
2.3.2 出水COD 变化
由图5 可知,未处理组和O3组反硝化出水的COD 浓度最低,由于其改性处理强度较低,玉米芯内部结构未发生破损,各个组分之间紧密缠绕,导致微生物较难接触纤维素与半纤维素,TOC 释放量较小。同时,纤维素与半纤维素依靠水解发酵菌分解释放有机碳,研究表明,水解发酵菌的最适环境为厌氧环境[8],而未处理组和O3组的NO3--N 去除率较低,导致水体中有大量NO3--N 残留,使水环境变成缺氧环境,阻碍有机碳的释放。碱+O3组玉米芯COD 浓度从第15 天开始稳定在20 mg/L,碳的释放与碳的消耗达到平衡,既未造成碳源浪费,又没有产生出水有机物的二次污染。
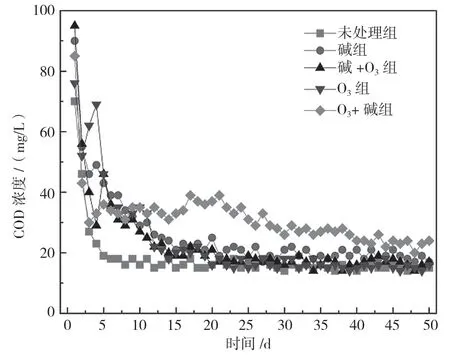
图5 出水COD 浓度变化
2.3.3 出水亚硝酸盐、TN 变化
反硝化脱氮分为两个过程:NO3--N转化为NO2--N;NO2--N 还原为N2。NO2--N 作为反硝化的中间产物,对反硝化反应程度具有指示作用,但其具有毒性,因此也是反硝化出水必须控制的指标。研究表明[9],碳源是影响亚硝酸盐转化的最重要因素,硝酸盐还原酶对碳源的竞争强于亚硝酸盐还原酶对碳源的竞争,导致NO3--N 向NO2--N 的转化速度过快,易产生NO2--N 的积累。而投加碳源可以明显加快NO2--N 转化为N2的反应过程。因此,要有足够的碳源存在,才能保证反硝化反应进行完全。
由图6 可以看出,碱+O3组在5~44 d 无NO2--N的积累,直到后期才有小幅度波动;碱组和O3+碱组分别从26 d、14 d 开始有NO2--N 的积累,50 d 时亚硝酸盐浓度分别达到0.5 mg/L;未处理组和O3组出现明显的NO2--N 积累,50 d 时达到3.6 mg/L。这表明所有碱组的玉米芯结构发生改变,木质素得到大量脱除,微生物分解释放有机碳。其中,碱+O3组反硝化碳源更充足,反硝化反应更彻底。
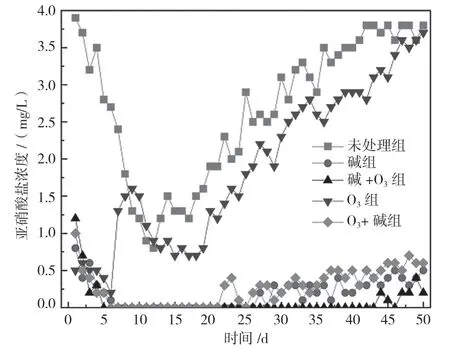
图6 出水亚硝酸盐浓度
反硝化出水TN 变化如图7所示,由计算得出,TN 浓度未明显高于出水硝酸盐和NO2--N 浓度之和,证明反硝化过程没有大量氨氮生成,即没有发生硝酸盐异化还原为铵(DNRA)的反应。研究发现[10],DNRA 通常发生在电子供体过量的反硝化系统中,这也说明改性处理后玉米芯释碳稳定,在满足反硝化脱氮的同时未产生大量有机碳的剩余。
2.3.4 出水pH 变化
异养反硝化生物脱氮技术以有机碳作为电子供体,在厌氧或缺氧的条件下利用反硝化细菌将硝酸盐和亚硝酸盐还原为氮气,该反应过程会释放碱,使出水pH升高。而pH是影响微生物活性的重要环境条件,研究发现[11],反硝化菌的最适生长pH 为6.8~8.2。
各组玉米芯反硝化进水pH 恒定在7.4 左右。反硝化初期,出水pH 较高,最高达到7.9,这是由于反硝化菌利用浸出液中可溶性小分子碳源进行反硝化产生碱;随着反硝化系统运行时间的延长,出水pH下降,从第7 天开始稳定在7.6 左右,这是因为纤维素和半纤维素在微生物的作用下水解成乙酸、乳酸等小分子有机酸,中和反硝化产生的一部分碱,从而使出水pH 始终稳定在反硝化菌的最适生长范围内。邵留等[12]以稻草为固体碳源进行反硝化研究,发现出水pH 基本维持在中性,与本试验结果一致。因此,以天然纤维素材料玉米芯作为反硝化固体碳源,具有稳定反硝化系统pH 的能力。
3 结论
不同改性方法均强化玉米芯的释放特性,增加碳释放量,减少N、P 及其他耗氧无机物的释放量。其中,碱+O3组释碳量最多且释碳速率最快,15 d 累计TOC 释放达到425 mg/L,且二次污染系数最低。碱+O3组玉米芯的SEM 图显示,玉米芯结构发生破损,出现较为明显的孔洞,有利于微生物的附着生长,可作为反硝化固体碳源。静态反硝化系统中,碱组、碱+O3组和O3+碱组反硝化效能较高,其中,碱+O3组50 d 硝酸盐去除率可稳定在98%以上,且出水无亚硝酸盐的积累,也未发生DNRA 反应,pH 稳定在7.6左右,有机碳的释放与利用达到平衡。

