青藤碱对骨肉瘤细胞增殖的影响及其抑瘤作用观察
林琰杰,于嘉智,魏传银
(1淄博市第一医院,山东淄博 255200;2济南市儿童医院)
骨肉瘤常发生于儿童和青少年,患者预后较差,病死率高[1]。目前骨肉瘤的治疗多采用外科手术联合化疗,患者的5年生存率可达70%,但化疗的不良反应较多,常影响治疗计划的完成及治疗效果[2]。青藤碱是一种生物碱,为中药青风藤提取物,已被证实具有抗肿瘤、抗炎、镇痛、降压、抗心律失常等药理作用[3,4]。目前青藤碱对骨肉瘤细胞增殖的影响及其抑瘤作用的相关研究鲜见。为此,我们于2017年1月~2018年1月进行了如下研究,以期为骨肉瘤的治疗提供依据。
1 材料与方法
1.1 材料 细胞:人骨肉瘤细胞株MG-63(以下称骨肉瘤细胞)购于上海拜力生物科技有限公司。实验动物:SPF级Balb/c裸鼠20只,6周龄,均为雄性,体质量(20±3)g,购自上海斯莱克实验动物有限责任公司,动物许可证号:SCXK(沪)2012-0005。药物:青藤碱购自美国Selleck公司。主要试剂:DMEM培养液、FBS、胰蛋白酶均购自美国Gibco公司,MTT细胞增殖检测试剂盒购自日本同仁公司,实时荧光定量试剂盒、TRIzol试剂、TaqMan均购自上海吉凯生物科技有限公司,MTT试剂盒以及脂质体2000均购自杭州吉诺生物医药技术有限公司,Krappel 样因子4(KLF4) 及GAPDH抗体均购自北京博奥森生物技术有限公司,双氧水以及柠檬酸钠抗原修复液均购自杭州昊鑫生物科技股份有限公司,DAB显色盒购自北京中杉金桥有限公司。
2 方法与结果
2.1 青藤碱对骨肉瘤细胞增殖能力及KLF4表达影响的观察
2.1.1 细胞分组及青藤碱干预 将骨肉瘤细胞培养于含10% FBS、100 U/mL青霉素、100 U/mL链霉素的DMEM培养基中,37 ℃、5% CO2饱和湿度的细胞培养箱中培养,当细胞融合至80%~90%时进行消化传代。取传至3~7代的细胞,随机分为空白组、50 mmol/L青藤碱组、100 mmol/L青藤碱组、200 mmol/L青藤碱组。空白组不予处理,50 mmol/L青藤碱组、100 mmol/L青藤碱组、200 mmol/L青藤碱组分别予50、100、200 mmol/L青藤碱干预24 h。
2.1.2 细胞增殖能力检测 采用MTT法。取干预24 h的各组细胞,制备细胞悬液,将细胞密度调整为1×104个/mL。取100 μL接种于96孔板,37 ℃、5% CO2细胞培养箱中进行培养,每组设置3个复孔。各组分别于培养12、24、36、48 h,每孔加入MTT溶液20 μL,检测各组450 nm处的光密度(OD)值,以此表示细胞增殖能力。结果显示,随着培养时间延长,各组细胞增殖能力均呈逐渐升高趋势。培养12、24 h时四组细胞增殖能力比较差异无统计学意义(P均>0.05);培养36、48 h时对照组、50 mmol/L青藤碱组、100 mmol/L青藤碱组、200 mmol/L青藤碱组细胞增殖能力依次降低,组间比较P均<0.05。见表1。
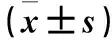
表1 四组细胞增殖能力比较
2.1.3 细胞KLF4蛋白相对表达量检测 采用Western blotting法。取作用24 h的各组细胞,加入500 μL蛋白裂解液,离心去后上清液,采用BCA法检测蛋白浓度。取40 μg总蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳结束后转至PVDF膜,室温下5% BSA脱脂奶粉封闭30 min。加入KLF4、GAPDH一抗(稀释倍数均为1∶1 000),4 ℃孵育过夜,TBST洗膜;加入兔二抗(稀释倍数均为1∶5 000),室温下孵育2 h,TBST洗膜。加入ECL液进行化学发光反应并曝光。采用Quantity One软件分析条带灰度值,以KLF4与GAPDH条带灰度值的比值计算KLF4蛋白相对表达量。结果显示,空白组、50 mmol/L青藤碱组、100 mmol/L青藤碱组、200 mmol/L青藤碱组KLF4蛋白相对表达量依次降低,分别为0.96±0.15、0.91±0.08、0.55±0.08、0.24±0.09,两组间比较P均<0.05。
2.2 青藤碱对裸鼠骨肉瘤模型的抑瘤作用及其对肿瘤组织KLF4 表达影响的观察
2.2.1 裸鼠骨肉瘤模型建立 取对数生长期细胞,制备细胞悬液,将细胞密度调整为1×107个/mL。取SPF级Balb/c裸鼠20只,于其背部皮下注射骨肉瘤细胞悬液100 μL。注射后无菌条件下饲养。注射后16周,20只裸鼠全部成瘤,成瘤率100%。
2.2.2 青藤碱的抑瘤作用观察 将20只骨肉瘤模型裸鼠随机分为青藤碱组和对照组各10只,分别腹腔注射青藤碱20 mg/kg和等体积生理盐水。3周后处死两组裸鼠,剥离皮下肿瘤称重并测量其长径、短径,测量瘤体质量(测量后肿瘤组织于液氮中冻存),计算两组瘤体体积及青藤碱抑瘤率。瘤体体积=(肿瘤长径×肿瘤短径)/2。青藤碱抑瘤率=(1-青藤碱组平均瘤体质量/对照组平均瘤体质量)×100%。 结果青藤碱组和对照组瘤体质量分别为(0.24±0.03)、(0.64±0.05)g,瘤体体积分别为(0.31±0.05)、(0.98±0.11)cm3;青藤碱组瘤体质量、瘤体体积均低于对照组(P均<0.05);青藤碱抑瘤率为62.51%。
2.2.3 青藤碱对肿瘤组织KLF4表达的影响 ①KLF4 mRNA检测:采用real-time PCR法。取青藤碱组和对照组液氮冻存的肿瘤组织,研磨后采用TRIzol法提取总RNA,按照逆转录试剂盒说明书将总RNA逆转录成cDNA,再以cDNA为模板进行PCR扩增。KLF4上游引物:5′-ACAGGCCGGGACAAGTGCAATA-3′,下游引物:5′-GCTGTCAACGATACGCTACGTAACG-3′;以U6作为内参,上游引物:5′-GTGCTCGCTTCGGCAGCACAT-3′,下游引物:5′-AAAAATATGGAACGCTCAC-3′。PCR反应条件:95 ℃预变性10 min, 95 ℃变性15 s, 60 ℃退火60 s,共40个循环。采用2-ΔΔCt法计算KLF4 mRNA相对表达量。结果显示,青藤碱组和对照组肿瘤组织KLF4 mRNA相对表达量分别为0.69±0.09、1.65±0.14,青藤碱组明显低于对照组,P<0.05。② KLF4蛋白表达检测:采用Western blotting法。取出青藤碱组和对照组液氮冻存的肿瘤组织,研磨后加入蛋白裂解液,参照2.1.3的方法及步骤检测KLF4蛋白相对表达量。结果显示,青藤碱组和对照组肿瘤组织KLF4蛋白相对表达量分别为1.28±0.14、2.42±0.54;青藤碱组明显低于对照组,P<0.05。
3 讨论
目前对青藤碱药理作用的研究多集中在其镇痛、镇静、镇咳、局麻、降血压、抗炎等方面[5]。近年研究表明,青藤碱在多种恶性肿瘤中具有抗肿瘤活性[6]。Zhang等[7]研究表明,青藤碱能抑制乳腺癌细胞生长,减少乳腺癌转移,改善化疗和肿瘤免疫。Lu等[8]研究表明,青藤碱能通过促进细胞周期阻滞和诱导凋亡抑制肝细胞癌增殖。Li等[9]研究表明,青藤碱可诱导血管正常化,对乳腺癌具有抗肿瘤和抗转移作用。Ghaleb等[10]报道,青藤碱可通过调控CXCR4-STAT3通路抑制骨肉瘤新生血管形成和骨质溶解,从而抑制骨肉瘤细胞侵袭。本研究体外实验结果显示,青藤碱干预培养36、48 h时对照组、50 mmol/L青藤碱组、100 mmol/L青藤碱组、200 mmol/L青藤碱组细胞增殖能力依次降低;体内实验结果显示,青藤碱组瘤体质量、瘤体体积均低于对照组,青藤碱抑瘤率为62.51%。证实青藤碱能抑制骨肉瘤细胞增殖及骨肉瘤组织生长。
KLF4是真核锌指蛋白转录因子,在细胞增殖分化、血管生成和肿瘤转移进展等多种生理、病理过程中具有重要作用[10]。研究表明,KLF4在食管癌、肺癌、胰腺癌、结直肠癌、前列腺癌、B淋巴细胞和膀胱癌等肿瘤组织中的表达降低,起抑癌基因作用[11,12];但其在乳腺癌和口腔鳞状细胞癌组织中表达升高,具有促癌基因作用[13]。KLF4在骨肉瘤组织中表达的报道较多。Martins-Neves等[14]报道,骨肉瘤细胞中KLF4蛋白过度表达可能导致骨肉瘤的进展。Qi等[15]报道,KLF4在骨肉瘤中表现为促癌基因作用。Zhang等[16]研究表明,KLF4通过上调CRYAB表达而促进骨肉瘤细胞增殖和侵袭,KLF4蛋白是治疗骨肉瘤的潜在靶点。林琰杰等[17,18]报道,抑制miR-133可通过抑制骨肉瘤细胞中KLF4表达而降低其增殖能力。本研究体外实验结果显示,对照组、50 mmol/L青藤碱组、100 mmol/L青藤碱组、200 mmol/L青藤碱组KLF4蛋白相对表达量依次降低;体内实验结果显示,青藤碱组裸鼠肿瘤组织KLF4 mRNA和蛋白表达均低于对照组;说明青藤碱能抑制骨肉瘤组织KLF4表达,此可能是青藤碱抑制骨肉瘤细胞增殖和骨肉瘤组织生长的分子机制之一。
综上所述,青藤碱可抑制骨肉瘤细胞增殖,其作用呈浓度依赖性;还可抑制骨肉瘤组织生长。下调肿瘤细胞或组织KLF4表达是其可能的机制。本研究为骨肉瘤发病机制的研究以及中药治疗骨肉瘤提供了新的思路。

