紫草素调控Hippo信号通路抑制鼻咽癌细胞株生物学功能及其机制研究
曹华琳,尹昕,梁天嵩
作者单位:1南阳市中心医院耳鼻喉科,河南 南阳473000;2郑州大学第一附属医院放疗科,河南 郑州450000
鼻咽癌(NPC)是一种罕见的头颈癌,位于鼻咽部上皮层,居我国头颈部恶性肿瘤发病率之首[1],具有典型的地域性和种族分布性,多见于中国南部和东南亚地区[2]。目前,NPC 治疗的主要策略为放射疗法[3],但易导致NPC 局部复发及远处转移,病人5年生存率也因此不足60%[4],积极探索NPC 侵袭和转移的分子机制并开发新型治疗药物,可能是提高病人生存率的有效手段。紫草素广泛用于治疗烧伤、麻疹、痈和黄斑疹[5],据报道,其可通过多种途径抑制NPC发展[6]。研究发现,Hippo通路有助于顺铂耐药诱导的NPC 细胞上皮间质转化(EMT)进而利于癌症侵袭和远处转移[7],但关于紫草素是否可通过Hippo 信号通路作用NPC 细胞的相关报道较少,故本研究于2021年1—12月以人鼻咽癌细胞(CNE2细胞)为研究载体并利用不同浓度紫草素加以作用,探讨其抗CNE2效果及可能机制,以期为NPC 干预机制及治疗药物选择提供一定的参考资料。
1 材料与方法
1.1 材料
1.1.1 细胞系 人鼻咽癌细胞株CNE2 购自上海中国科学院细胞库。
1.1.2 试剂和仪器 紫草素(纯度98%)(南京道斯夫生物科技有限公司,批号517-89-5);Matrigel 基质胶(美国BD公司,批号356234);AnnexinV-FITC∕PI流式细胞凋亡检测试剂盒(南京凯基生物科技公司,批号KGA106);胎牛血清(美国Gibco 公司,批号10270);肿瘤抑制激酶1∕2抗体(LATS1∕2)(武汉艾美捷生物科技有限公司,批号ABP51705);p-LATSA1∕2 抗体(bs-7913R)及波形蛋白(Vim)抗体(bs-8533R)购自北京博奥森生物科技有限公司;yes相关蛋白1(YAP1)抗体(批号ab52771)、p-YAP1抗体(批号ab76252)、具有PDZ 结合基序的转录共激活子(TAZ)抗体(批号ab176396)、N-钙黏蛋白(N-cad)抗体(批号ab76011)、E-钙黏蛋白(E-cad)抗体(批号ab227639)购自美国Abcam公司;p-TAZ抗体(批号sc-17610)购自细胞生物科技上海股份有限公司;550型全自动酶标仪购自美国Bio-Rad 公司;FluorChem HD2 化学发光凝胶成像系统购自美国ProteinSimple公司。
1.2 方法
1.2.1 细胞培养 RPMI 1640 完全培养液(含10%胎牛血清)复苏CNE2 细胞,以1×105个∕毫升密度接种至25 cm2培养瓶中,于37 ℃、体积分数为5%二氧化碳及饱和湿度环境条件下的培养箱中培养,待细胞生长至80%左右时即进行传代,传代2~3次。
1.2.2 CCK8 法检测紫草素对CNE2 细胞存活率的影响 收集对数期细胞,配制RPMI 1640 条件培养液(含0、2.0、4.0、8.0、16.0 mg∕L 紫草素),分别重悬细胞,并以5×103个∕毫升密度接种200 μL 细胞悬液于96 孔板中,相应浓度各设5 个复孔。培养箱内培养48 h,直接加入20 μL CCK8试剂于培养箱内培养2 h。全自动酶标仪测定450 nm 处的吸光度(OD)值,细胞存活率(%)=实验组OD 值∕对照组OD 值×100%(实验组指含有紫草素的实验孔,对照组不含紫草素的对照孔),重复3次。
1.2.3 流式细胞仪检测细胞凋亡率 收集对数期细胞,RPMI 1640 条件培养液培养48 h,磷酸盐缓冲液(PBS)洗涤3 次,1 000 r∕min 离心5 min,收集细胞沉淀,70%乙醇-PBS溶液4 ℃固定过夜,PBS洗涤2~3 次,结合缓冲液重悬,5 μL Annexin V-FITC 溶液、5 μL PI溶液避光染色15 min,流式细胞仪检测细胞凋亡率,重复3次。
1.2.4 平板克隆形成实验检测集落形成能力 收集对数期细胞,RPMI 条件培养液重悬,并以每孔100 个细胞的密度接种在6 孔板中,对应培养14 d,至肉眼可见的细胞克隆后终止培养,冷4%多聚甲醛固定,1%结晶紫染色,显微镜下观察并利用ImageJ计算菌落(超过50个细胞)。
1.2.5 伤口愈合实验检测细胞迁移能力 收集对数期细胞,RPMI完全培养液重悬,以2×105个细胞接种于6孔板中。待培养至汇合,10 μL塑料移液枪头作垂直细胞面划痕,PBS 洗涤细胞3 次,拍照记录划痕;后利用RPMI 1640 条件培养液(不含胎牛血清)培养48 h,拍照记录划痕,ImageJ软件测量划痕宽度变化,计算划痕愈合率即(0 h划痕宽度-48 h划痕宽度)∕0 h划痕宽度×100%,重复3次。
1.2.6 Transwell检测细胞侵袭能力 Matrigel基质胶涂布上腔室,4 ℃下干燥,RPMI 1640条件培养液(不含胎牛血清)重悬的细胞以每孔1×105个接种200 μL至Transwell 24孔板上室,下室加入500 μL含10%胎牛血清的对应条件培养液,48 h后弃去培养液,甲醇固定15 min,0.1%结晶紫染色15 min,擦除过滤器上层细胞,镜下观察底部细胞并计数,重复3次。
1.2.7 RT-qPCR 技术检测YAP1、TAZ mRNA 相对表达水平 收集对数期细胞,RPMI 1640 条件培养液培养48 h,Trizol试剂提取紫草素各浓度下细胞总RNA,检测其浓度及纯度可用后逆转录为cDNA。制备RT-PCR反应体系,反应条件为95 ℃ 30 s,95 ℃5 s,60 ℃ 34 s 40 个循环。以β-actin 为内参,2-ΔΔCt法计算目的基因的相对表达量。Primer Premier 5.0 软件设计引物,送至华大基因合成。引物序列:YAP1正向5"-ACCCACAGCTCAGCATCTT C-3",反向引物5"-GCTGTGACGTTCATCTGGGA-3";TAZ 正 向 5"-ACCCGC GAGTACAACCTTCTT-3",反向5"-TATCGTCATCCATGGCGAACT-3";β-actin 正向5"-CCCACACTGTGCCCATCTAC-3",反 向5"-GGAACCGCTCATT GCCAATG-3"。
1.2.8 蛋白质印迹法技术检测相关蛋白相对表达情况 收集对数期细胞,RPMI 1640 条件培养液培养48 h,收集细胞沉淀,RIPA 裂解液提取细胞总蛋白并测定蛋白浓度,取约50 μg 总蛋白上样,10%SDS-PAGE 凝胶电泳分离蛋白,蛋白转移至PVDF膜,5%脱脂牛奶室温封闭1 h,一抗(均1∶1 000 稀释)4 ℃孵育过夜,TBST 洗膜3 次,每次10 min,二抗(1∶8 000 稀释)室温孵育1 h,洗膜,HRP-ECL 法显影,化学发光凝胶成像系统曝光,Image J 分析条带灰度值,以目的蛋白与内参β-actin 灰度值比值表示蛋白相对表达量。
1.3 统计学方法SPSS 26.0 软件进行数据统计学处理,多组计量资料比较采用单因素方差分析,两组间比较采用LSD-t检验,计量结果均以±s表示。P<0.05为差异有统计学意义。
2 结果
2.1 紫草素对CNE2 细胞增殖、集落形成能力及CNE2 细胞凋亡的影响CNE2 细胞存活率随紫草素浓度增大而降低(P<0.05),集落形成数随紫草素作用浓度增大而减少(P<0.05)。CNE2 细胞凋亡率随紫草素浓度增大而升高(P<0.05)。见表1,图1。
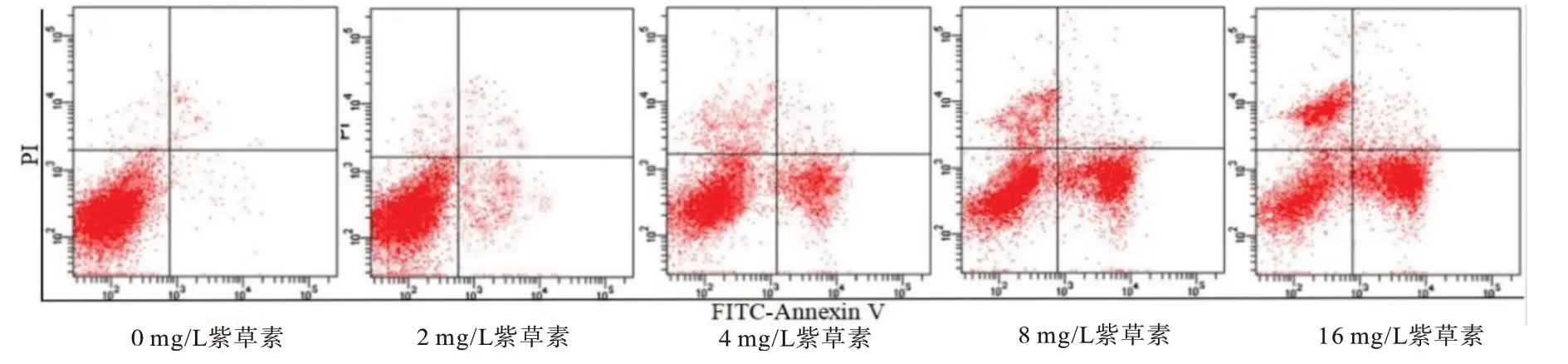
图1 流式细胞仪检测紫草素各浓度下CNE2细胞凋亡情况
表1 不同浓度紫草素培养下CNE2细胞存活率比较∕ ± s
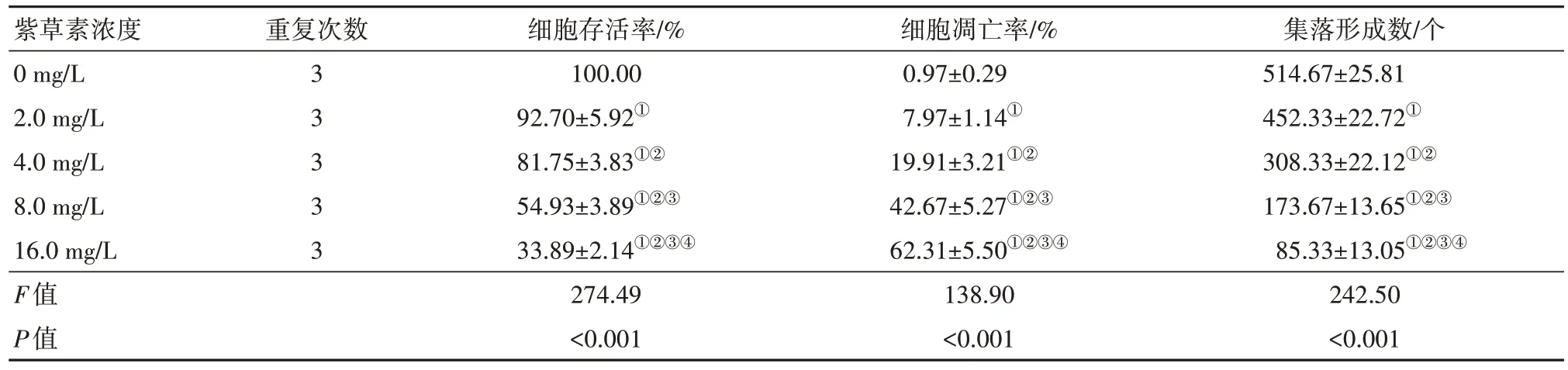
表1 不同浓度紫草素培养下CNE2细胞存活率比较∕ ± s
注:①与0 mg∕L紫草素比较,P<0.05。②与2.0 mg∕L紫草素比较,P<0.05。③与4.0 mg∕L紫草素比较,P<0.05。④与8.0 mg∕L紫草素比较,P<0.05。
紫草素浓度0 mg∕L 2.0 mg∕L 4.0 mg∕L 8.0 mg∕L 16.0 mg∕L F值P值集落形成数∕个514.67±25.81 452.33±22.72①308.33±22.12①②173.67±13.65①②③85.33±13.05①②③④242.50<0.001重复次数3 3 3 3 3细胞存活率∕%100.00 92.70±5.92①81.75±3.83①②54.93±3.89①②③33.89±2.14①②③④274.49<0.001细胞凋亡率∕%0.97±0.29 7.97±1.14①19.91±3.21①②42.67±5.27①②③62.31±5.50①②③④138.90<0.001
2.2 紫草素对CNE2 细胞迁移能力的影响CNE2细胞划痕愈合率随紫草素作用浓度增大而降低(P<0.05)。见图2,表2。

图2 各浓度紫草素培养下CNE2细胞迁移情况
表2 不同浓度紫草素培养下CNE2侵袭细胞数比较∕ ± s
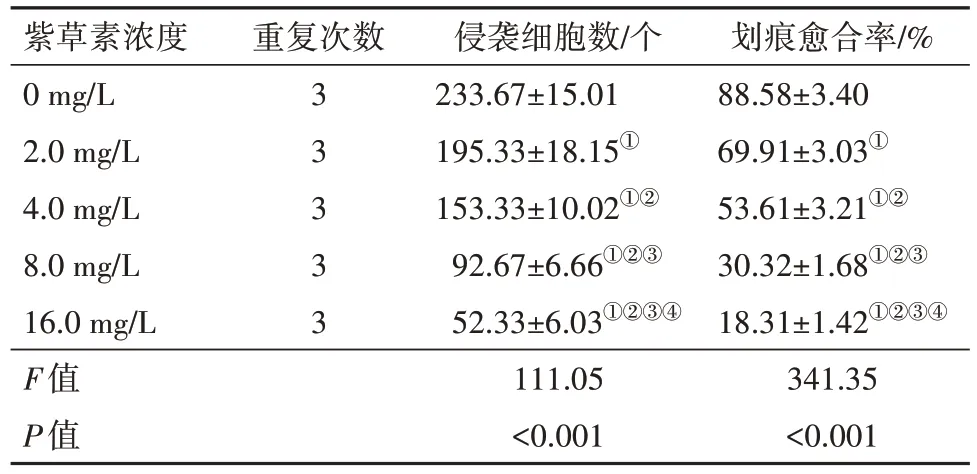
表2 不同浓度紫草素培养下CNE2侵袭细胞数比较∕ ± s
注:①与0 mg∕L 紫草素比较,P<0.05。②与2.0 mg∕L 紫草素比较,P<0.05。③与4.0 mg∕L 紫草素比较,P<0.05。④与8.0 mg∕L 紫草素比较,P<0.05。
划痕愈合率∕%88.58±3.40 69.91±3.03①53.61±3.21①②30.32±1.68①②③18.31±1.42①②③④341.35<0.001紫草素浓度0 mg∕L 2.0 mg∕L 4.0 mg∕L 8.0 mg∕L 16.0 mg∕L F值P值重复次数3 3 3 3 3侵袭细胞数∕个233.67±15.01 195.33±18.15①153.33±10.02①②92.67±6.66①②③52.33±6.03①②③④111.05<0.001
2.3 紫草素对CNE2 细胞侵袭能力的影响CNE2侵袭细胞数随紫草素作用浓度增大而减少(P<0.05)。见表2。
2.4 紫草素对CNE2 细胞YAP1、TAZ mRNA 表达的影响CNE2细胞YAP1、TAZ mRNA相对表达水平均随紫草素作用浓度增大而降低(P<0.05)。见表3。
表3 不同浓度紫草素培养下CNE2细胞YAP1、TAZ mRNA相对表达水平比较∕ ± s
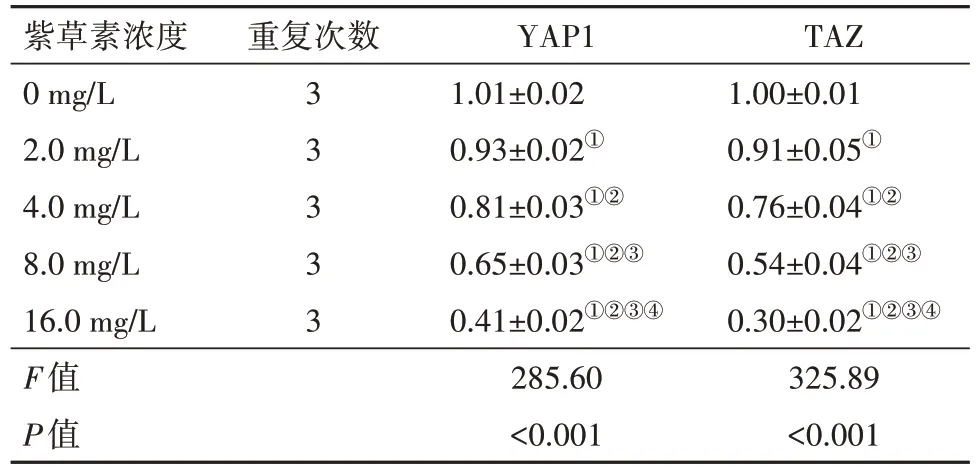
表3 不同浓度紫草素培养下CNE2细胞YAP1、TAZ mRNA相对表达水平比较∕ ± s
注:YAP1为yes相关蛋白1,TAZ 为具有PDZ 结合基序的转录共激活子。①与0 mg∕L紫草素比较,P<0.05。②与2.0 mg∕L紫草素比较,P<0.05。③与4.0 mg∕L 紫草素比较,P<0.05。④与8.0 mg∕L 紫草素比较,P<0.05。
TAZ 1.00±0.01 0.91±0.05①0.76±0.04①②0.54±0.04①②③0.30±0.02①②③④325.89<0.001紫草素浓度0 mg∕L 2.0 mg∕L 4.0 mg∕L 8.0 mg∕L 16.0 mg∕L F值P值重复次数3 3 3 3 3 YAP1 1.01±0.02 0.93±0.02①0.81±0.03①②0.65±0.03①②③0.41±0.02①②③④285.60<0.001
2.5 紫草素对Hippo 信号通路相关蛋白表达的影响YAP1、TAZ、N-cad 及Vim 蛋白相对表达水平随紫草素作用浓度增大而降低;p-YAP1、p-TAZ 及Ecad 蛋白相对表达水平随紫草素作用浓度增大而升高。见图3,表4。
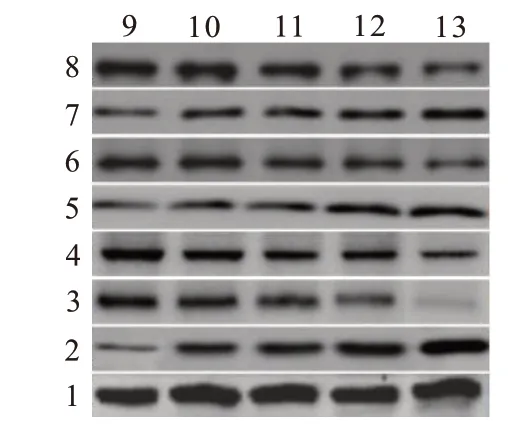
图3 蛋白质印迹法检测紫草素培养下CNE2细胞相关蛋白条带图
表4 不同浓度紫草素培养下CNE2细胞YAP1等蛋白相对表达水平比较∕ ± s
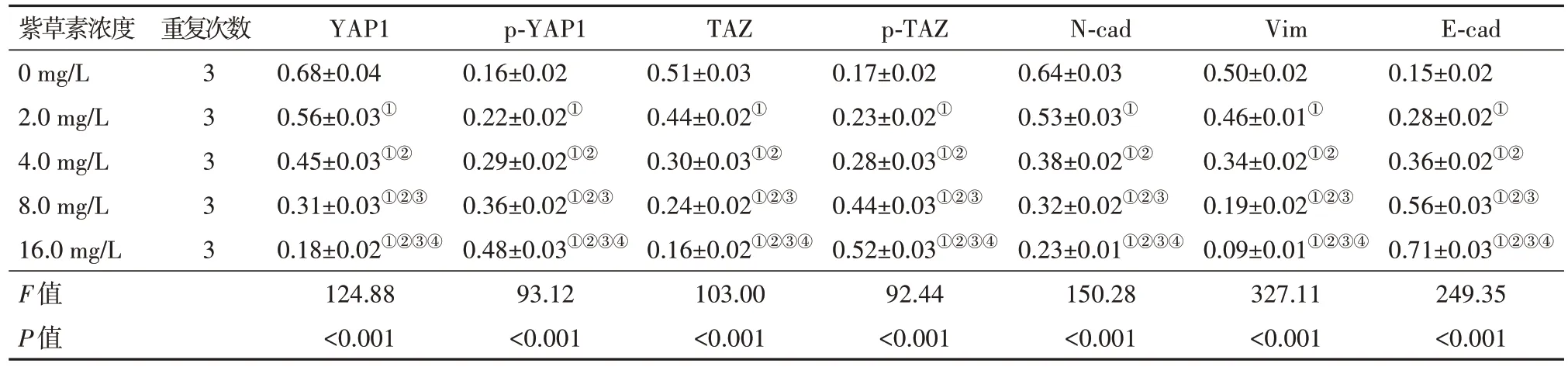
表4 不同浓度紫草素培养下CNE2细胞YAP1等蛋白相对表达水平比较∕ ± s
注:YAP1为yes相关蛋白1,p-YAP1为磷酸化yes相关蛋白1,TAZ为具有PDZ结合基序的转录共激活子,p-TAZ为磷酸化具有PDZ结合基序的转录共激活子,N-cad为N-钙黏蛋白,Vim为波形蛋白,E-cad为E-钙黏蛋白。①与0 mg∕L紫草素比较,P<0.05。②与2.0 mg∕L紫草素比较,P<0.05。③与4.0 mg∕L紫草素比较,P<0.05。④与8.0 mg∕L紫草素比较,P<0.05。
E-cad 0.15±0.02 0.28±0.02①0.36±0.02①②0.56±0.03①②③0.71±0.03①②③④249.35<0.001紫草素浓度0 mg∕L 2.0 mg∕L 4.0 mg∕L 8.0 mg∕L 16.0 mg∕L F值P值重复次数3 3 3 3 3 YAP1 0.68±0.04 0.56±0.03①0.45±0.03①②0.31±0.03①②③0.18±0.02①②③④124.88<0.001 p-YAP1 0.16±0.02 0.22±0.02①0.29±0.02①②0.36±0.02①②③0.48±0.03①②③④93.12<0.001 TAZ 0.51±0.03 0.44±0.02①0.30±0.03①②0.24±0.02①②③0.16±0.02①②③④103.00<0.001 p-TAZ 0.17±0.02 0.23±0.02①0.28±0.03①②0.44±0.03①②③0.52±0.03①②③④92.44<0.001 N-cad 0.64±0.03 0.53±0.03①0.38±0.02①②0.32±0.02①②③0.23±0.01①②③④150.28<0.001 Vim 0.50±0.02 0.46±0.01①0.34±0.02①②0.19±0.02①②③0.09±0.01①②③④327.11<0.001
3 讨论
紫草素是一种萘醌色素,为紫草主要生物活性成分之一,对多种类型肿瘤具有抗癌作用[8]。研究发现,其可以时间和剂量依赖性方式显著抑制结直肠癌细胞的活性并促进其凋亡[9],并可通过调节细胞增殖、凋亡、迁移及有氧糖酵解途径发挥抗NPC 作用[6,10]。鼻咽部位隐匿,多数病人在确诊时已出现颈淋巴结转移,预后较差,抗凋亡特性及肿瘤细胞向周围组织和远处器官的侵袭与转移是恶性肿瘤的重要特征[11-12],本研究发现,紫草素可显著抑制CNE2细胞的增殖活性、集落形成、迁移及侵袭能力,并可诱导其凋亡,且呈剂量依赖性,提示紫草素可以剂量依赖性方式抑制CNE2 癌细胞的恶性发展,可能是改善NPC复发及转移等不良预后的潜在药物。
EMT 已被证明是介导NPC 转移的关键因素,此过程中上皮性肿瘤细胞转化为间充质表型,细胞形态改变、上皮细胞极性丧失、细胞间黏附中断、迁移和侵袭能力增强[13]。E-cad 是上皮细胞中的特征性分子标志,位于黏附连接处和基底外侧质膜上,Vim 和N-cad 则主要在间充质来源的细胞中表达,与肿瘤细胞侵袭密切相关[14],抑制NPC 细胞中EMT 可降 低Vim 和N-cad 表达,上调E-cad 水 平并来抑制NPC 细胞侵袭、转移[15-16]。Mo 等[17]研究发现,紫草素可逆转EMT,抑制膀胱癌细胞的迁移和侵袭;Li、Zeng[18]研究结果显示,紫草素可下调EMT标志蛋白N-cad、Vim 水平,上调E-cadherin 蛋白表达,抑制肝细胞癌的恶性生物学行为,包括增殖、抗凋亡、迁移及侵袭。本研究经不同浓度紫草素作用后发现,CNE2 细胞中N-cad 及Vim 蛋白相对表达水平降低,E-cad 蛋白相对表达水平升高,且呈剂量依赖性,提示紫草素可能通过减少上皮细胞向间质细胞形态转化,促进细胞极性及细胞间黏附能力恢复,抑制EMT 进展,进而抑制CNE2 细胞迁移及侵袭。
Hippo 通路控制组织稳态,包括器官大小、细胞增殖和凋亡,YAP 和TAZ 是该通路中的关键蛋白,在许多肿瘤中过度表达[19]。研究发现,癌细胞中增加的YAP 及TAZ 可破坏细胞间连接,促进间充质基因表达,并增强EMT 相关的形态变化[20],Hippo∕YAP∕TAZ 信号通路可通过调节EMT 促进肿瘤的转移及侵袭[21]。在没有活性激酶级联反应的情况下,YAP1 和TAZ 蛋白以其未磷酸化的形式转移到细胞核中并充当转录辅助因子,并结合TEA 结构域转录因子家族的成员并促进促增殖和抗凋亡基因的转录[22];Hippo 激酶存在时,YAP1 和TAZ 被上游信号磷酸化,p-YAP 和p-TAZ 在细胞质中积累并被定向降解[23]。据报道,紫草素可依赖于Hippo 通路的活性,调节癌细胞葡萄糖代谢,发挥肿瘤抑制作用[24],但关于紫草素介导Hippo信号通路调节EMT过程而发挥抗NPC 作用的相关研究较少。本研究经分子实验分析紫草素可能通过减少YAP1 及TAZ 的核转移,降低与TEA 结构域转录因子家族的成员结合,促进两者在细胞质内的积累并通过定向降解,抑制癌细胞恶性生物学相关基因转录,进而发挥抗EMT及抗增殖作用。
综上所述,紫草素可抑制鼻咽癌细胞株CNE2恶性生物学功能,其作用机制可能与抑制Hippo 信号通路中核心下游信号因子YAP1、TAZ蛋白表达并抑制EMT进展有关。

