2017—2021年某院腹腔感染患者细菌分布及耐药性分析
高延可 常璠 蒋国梅 李美玲 纪荣祖

【摘要】 目的:分析腹腔感染患者腹腔標本中分离菌株的分布及对抗菌药物的耐药情况,为临床抗感染经验性治疗及合理使用抗菌药物提供依据。方法:回顾性分析2017年1月—2021年12月在西宁市第三人民医院住院的腹腔感染患者送检的胆道分泌物、胰腺分泌物、阑尾分泌物、腹水标本中分离菌株及耐药情况。结果:在所有送检的腹腔感染标本中共分离出细菌970株,其中革兰阴性杆菌731株,占75.36%,革兰阳性球菌239株,占24.64%;腹腔感染单一菌引起的感染638例,占79.35%,两种菌感染166例,占20.65%。革兰阴性杆菌是腹腔感染的主要分离菌株,以大肠埃希菌、肺炎克雷伯菌为主,腹腔感染革兰阳性球菌以肠球菌属细菌、金黄色葡萄球菌为主。产超广谱β-内酰胺酶(ESBLs)在大肠埃希菌中检出率为34.61%,在肺炎克雷伯菌中检出率为21.15%,耐甲氧西林金黄色葡萄球菌(MRSA)检出率为32.26%,耐甲氧西林凝固酶阴性葡萄球菌(MRCNS)检出率为23.81%。大肠埃希菌、肺炎克雷伯菌对氨苄西林、哌拉西林、头孢唑林、环丙沙星耐药率均>40%,未发现对碳青霉烯类药物的耐药菌株。粪肠球菌和屎肠球菌对高浓度庆大霉素、高浓度链霉素、环丙沙星、左氧氟沙星的耐药率均>40%,金黄色葡萄球菌对阿奇霉素、克林霉素的耐药率均≥30%,未发现对万古霉素、利奈唑胺和替考拉宁的耐药菌株。结论:腹腔感染细菌以大肠埃希菌、肺炎克雷伯菌、粪肠球菌和金黄色葡萄球菌为主,ESBLs、MRSA和MRCNS检出率较高,应加强对腹腔感染患者细菌耐药性监测和流行病学调查,根据药敏试验结果合理使用抗菌药物,以延缓细菌的耐药率。
【关键词】 腹腔感染 分离菌株 耐药性 抗生素
Bacterial Distribution and Drug Resistance in Patients with Intra-abdominal Infection in a Hospital from 2017 to 2021/GAO Yanke, CHANG Fan, JIANG Guomei, LI Meiling, JI Rongzu. //Medical Innovation of China, 2023, 20(34): 0-100
[Abstract] Objective: To analyze the distribution and antimicrobial resistance of bacterial strains isolated from patients with intra-abdominal infection, and to provide evidence for clinical empirical treatment of anti-infection and rational use of antibiotics. Method: The isolated strains and drug resistance in biliary tract secretion, pancreatic secretion, appendiceal secretion and ascites samples of patients with intra-abdominal infection hospitalized in the Third People's Hospital of Xining from January 2017 to December 2021 were retrospectively analyzed. Result: A total of 970 strains of bacteria were isolated from all samples of abdominal infection, including 731 strains of Gram-negative bacilli accounted for 75.36%, 239 strains of Gram-positive cocci, accounting for 24.64%; 638 cases of abdominal infection caused by single bacteria, accounting for 79.35%, 166 cases were infected with two kinds of bacteria, accounting for 20.65%. Gram-negative bacilli were the main isolates of abdominal infection, mainly Escherichia coli and Klebsiella pneumoniae. Gram-positive bacteria of abdominal infection were mainly Enterococcus and Staphylococcus aureus. The detection rate of extended-spectrum β-lactamase (ESBLs) was 34.61% in Escherichia coli, 21.15% in Klebsiella pneumoniae, 32.26% in methicillin-resistant Staphylococcus aureus (MRSA) and 23.81% in methicillin-resistant coagulase-negative staphylococcus (MRCNS). The resistance rates of Escherichia coli and Klebsiella pneumoniae to Ampicillin, Piperacillin, Cefazolin and Ciprofloxacin were all higher than 40%, and no carbapenem resistant strains were found. The resistance rates of Enterococcus faecalis and Enterococcus faecium to high concentrations of Gentamicin, high concentrations of Streptomycin, Ciprofloxacin and Levofloxacin were all >40%. The resistance rates of Staphylococcus aureus to Azithromycin and Clindamycin were all ≥30%. No drug-resistant strains to Vancomycin, Linezolid and Teicoplanin were found. Conclusion: Bacterial infections in intra-abdominal are mainly Escherichia coli, Klebsiella pneumoniae, Enterococcus faecalis and Staphylococcus aureus. The detection rates of ESBLs, MRSA and MRCNS are high, surveillance and epidemiological investigation of bacterial resistance in patients with intra-abdominal infection are necessary, and rationally use antibiotics according to the results of drug sensitivity test to delay the drug resistance rate of bacteria.
[Key words] Intra-abdominal infection Isolated strain Drug resistance Antibiotic
First-author's address: The Third People's Hospital of Xining, Xining 810005, China
doi:10.3969/j.issn.1674-4985.2023.34.021
腹腔感染(intra-abdominal infection,IAI)是由病原体通过各种途径侵入腹腔而引起的腹膜腔或腹腔脏器的感染,是临床常见的感染性疾病,相关文献[1-2]报道,腹腔感染发生率为4.29%~12.3%,其死亡率10.50%,如果不及时、不合理使用抗菌药物都可能严重影响患者的治疗效果及预后,另外,由于在各地区使用抗菌药物的不同,其腹腔感染病原菌分布、类型也存在一定差异[3-4],因此,在细菌培养结果及药敏试验结果回报之前,根据本地区腹腔感染病原菌及耐药特点,及时有效使用抗菌药物治疗对于患者的预后非常关键,本研究回顾性分析腹腔感染患者腹腔标本分离菌株的分布及对抗菌药物的耐药情况,为临床抗感染经验性治疗及合理使用抗菌药物提供依据。
1 资料与方法
1.1 菌株来源
选取2017年1月—2021年12月在西宁市第三人民医院住院的腹腔内感染患者送检的胆道分泌物、胰腺分泌物、阑尾分泌物、腹水等腹腔感染标本中分离的菌株。
1.2 仪器与试剂
美华医疗MA120全自动微生物鉴定药敏分析系统及其配套试剂,药敏纸片、培养基均为英国Oxoid公司产品。
1.3 菌株鉴定及药敏试验
按照《全国临床检验操作规程》第4版要求接种标本和分离菌株,细菌鉴定和药敏分析采用美华医疗MA120全自动微生物鉴定药敏分析系统,对自动仪器法折点不覆盖的抗菌药物采用英国Oxoid公司药敏纸片做补充药敏试验,参照美国和临床实验室标准化协会(CLSI)标准判读药敏试验结果,质控菌株为大肠埃希菌ATCC25922、肺炎克雷伯菌ATCC70603、铜绿假单胞菌ATCC27853、金黄色葡萄球菌ATCC25923、粪肠球菌ATCC29212。
1.4 统计学处理
采用WHONET 5.6软件统计分析,计数资料以率(%)表示。
2 结果
2.1 腹腔感染患者分离菌株的来源及构成
2017年1月—2021年12月腹腔感染患者804份分离细菌的标本分布及构成情况显示,分离菌株主要来源于胆道分泌物标本,占43.78%,其次为阑尾分泌物标本,占30.60%,胰腺分泌物标本占20.65%,腹水标本占4.98%,见表1。
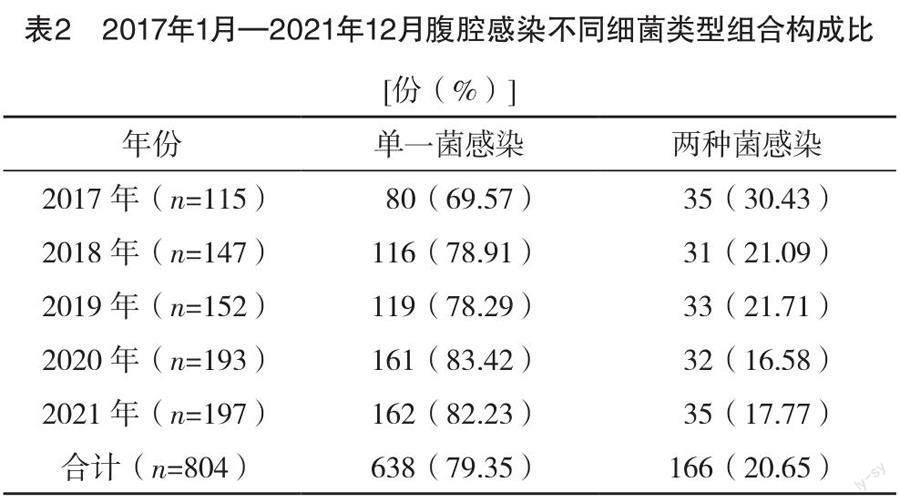
2.2 腹腔感染类型
2017年1月—2021年12月腹腔感染患者送检的804份腹腔感染标本中,其中单一细菌感染638份,占79.35%,两种细菌混合感染166份,占20.65%,见表2。
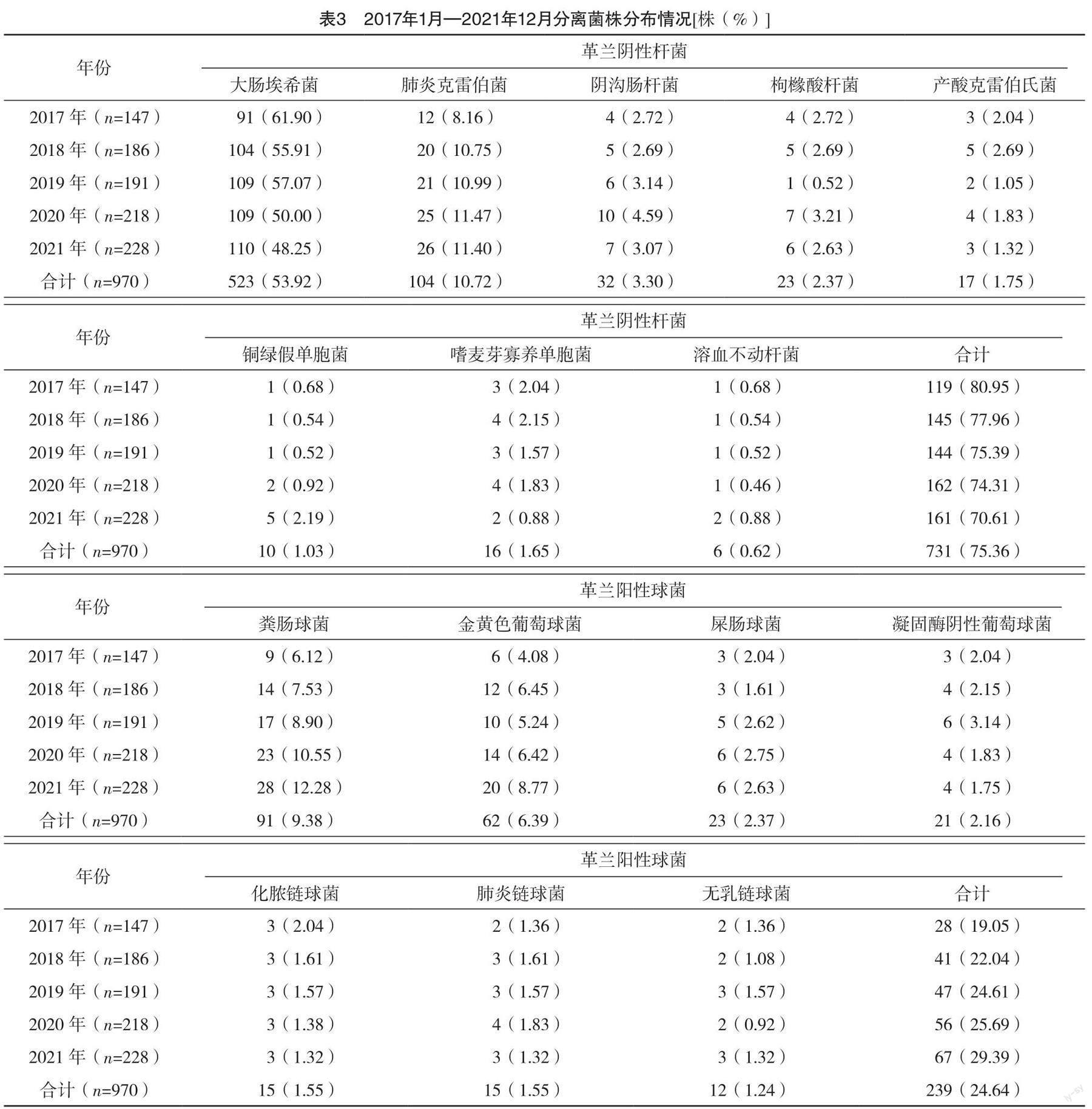
2.3 腹腔感染分离菌株的分布
2017年1月—2021年12月从腹腔感染标本中共分离细菌970株,其中革兰阴性杆菌731株,占75.36%,革兰阳性球菌239株,占24.64%。腹腔感染主要以大肠埃希菌、肺炎克雷伯菌、粪肠球菌、金黄色葡萄球菌为主,未分离出真菌,结果见表3。
2.4 腹腔感染细菌产酶菌株分离情况
2017年1月—2021年12月腹腔感染标本中分离出金黄色葡萄球菌62株,凝固酶阴性葡萄球菌21株,其中耐甲氧西林金黄色葡萄球菌(MRSA)20株,分离率为32.26%,耐甲氧西林凝固酶阴性葡萄球菌(MRCNS)5株,分离率为23.81%;大肠埃希菌523株,其中产超广谱β-内酰胺酶(ESBLs)菌株181株,检出率为34.61%,肺炎克雷伯菌104株,其中ESBLs(+)菌株12株,检出率为11.54%,见表4。
2.5 临床腹腔感染分离菌株对常用抗菌药物的耐药性分析
2.5.1 腹腔感染主要革兰阴性杆菌对常用抗菌药物的耐药性分析 2017年1月—2021年12月腹腔感染革兰阴性杆菌主要以大肠埃希菌、肺炎克雷伯菌为主,大肠埃希菌、肺炎克雷伯菌对头孢哌酮/舒巴坦、氨苄西林/他唑巴坦、哌拉西林/他唑巴坦耐药率均<20%,对氨苄西林、哌拉西林、头孢唑林、环丙沙星耐药率均>40%,未发现对碳青霉烯类药物的耐药菌株,见表5。
2.5.2 腹腔感染主要革兰阳性球菌对常用抗菌药物的耐药性分析 2017年1月—2021年12月腹腔感染革兰阳性球菌主要以粪肠球菌、金黄色葡萄球菌为主,粪肠球菌和屎肠球菌对高浓度庆大霉素、高浓度链霉素、环丙沙星、左氧氟沙星的耐药率均>40%,对米诺环素的耐药率均<35%,金黄色葡萄球菌对阿奇霉素、克林霉素的耐药率均≥30%,未发现对万古霉素、利奈唑胺和替考拉宁的耐药菌株,结果见表6、7。
3 讨论
本研究结果显示,2017年1月—2021年12月腹腔感染标本中分离菌株主要以革兰阴性杆菌为主,占75.36%,主要包括大肠埃希菌、肺炎克雷伯菌,腹腔感染革兰阳性球菌占24.64%,主要包括粪肠球菌、金黄色葡萄球菌,这与文献[5-6]研究结果基本一致,未分离出真菌,此外,腹腔感染标本中79.35%是由单一细菌引起的感染,20.65%是由两种细菌引起的混合型感染,这可能与感染部位的不同有关,也为临床治疗带来了困难[7]。
腹腔感染革兰阴性杆菌中,分离菌株主要以大肠埃希菌、肺炎克雷伯菌为主,这与以往文献[5-6,8]研究报道一致。大肠埃希菌、肺炎克雷伯菌对常用抗菌药物耐药率较高,一方面,这与腹腔感染肠杆菌科细菌ESBLs(+)菌株检出率逐年增加有关,大肠埃希菌、肺炎克雷伯菌ESBLs(+)检出率分别由2017年的19.78%、8.33%上升到2021年的49.09%、26.92%,肠杆菌科细菌ESBLs(+)菌株通常对青霉素类、第一代、第二代、第三代及部分第四代头孢菌素体外耐药,同时对氨基糖苷类药物和喹诺酮类药物均具有耐药机制,从而导致ESBLs(+)菌株产生多重耐药、泛耐药、甚至全耐药现象[9-10]。另一方面,这与该地区的常用药物在短时间内临床上使用频率增加有关,故临床医生应严格按照药敏试验结果合理选择抗菌药物,抗菌药物的不合理使用也可以导致ESBLs的产生。大肠埃希菌、肺炎克雷伯菌对头孢哌酮/舒巴坦、氨苄西林/他唑巴坦、哌拉西林/他唑巴坦耐药率均<20%,临床上可将此类药物作为治疗腹腔感染中革兰阴性杆菌感染的常规用药,有研究报道,产ESBLs的大肠埃希菌,碳青霉烯类及阿米卡星是最有效的抗菌药物[11]。本研究显示,大肠埃希菌对阿米卡星的耐药率由2017年的16.48%上升到2021年的37.27%,近年来由于阿米卡星的耐药率上升较为明显,故此阿米卡星不建议作为治疗腹腔感染中革兰阴性杆菌感染的单独用药,但是可作为β-内酰胺酶加酶抑制剂联合用药的选择。对于在腹腔感染中肺炎克雷伯菌感染,需要注意的是,临床医生应辨别其是否为高毒力肺炎克雷伯菌感染,同时须要结合细菌报告单上有无备注高黏性菌落来辨别确定[12],近年来,不断检出多重耐药及泛耐药高毒力肺炎克雷伯菌[13],对于高毒力肺炎克雷伯菌感染治疗,联合用药是最为有效的治疗方案[14]。本研究未发现碳青霉烯类耐药菌株,然而,耐碳青霉烯酶肠杆菌科细菌(carbapenem-resistant enterobacteriaceae,CRE)主要由細菌产生碳青霉烯酶引起[15],CHINET调查研究显示,目前国内大肠埃希菌对碳青霉烯类药物的耐药率<17%[16]。国内有研究显示,耐碳青霉烯类高毒力肺炎克雷伯菌的耐药率>90%[17]。所以,在今后的工作中还需要进一步加强对腹腔感染分离菌株的监测和流行病学调查,临床医生应严格按照药敏试验结果合理选择抗菌药物,以延缓细菌的耐药率。
腹腔感染革兰阳性球菌中,分离菌株主要以肠球菌属细菌、金黄色葡萄球菌为主,屎肠球菌的耐药率大于粪肠球菌,这与文献[18]研究报道基本一致,粪肠球菌和屎肠球菌对高浓度庆大霉素、高浓度链霉素、环丙沙星、左氧氟沙星的耐药率均>40%,故此类药物不建议作为粪肠球菌和屎肠球菌感染的常规用药或单独用药。屎肠球菌和粪肠球菌对米诺环素的耐药率均<35%,未发现对万古霉素、利奈唑胺和替考拉宁的耐药菌株,万古霉素、利奈唑胺和替考拉宁仍然是治疗肠球菌感染的首选抗菌药物。本研究显示,MRSA和MRCNS检出率较高,分别为32.26%,23.81%,在今后的工作中需严格有效控制MRSA感染发生率。金黄色葡萄球菌对克林霉素和阿奇霉素的耐药率≥30%,因此,克林霉素和阿奇霉素不建议治疗腹腔感染中葡萄球菌感染的单独用药,但是可作联合用药的选择,未发现对万古霉素、利奈唑胺和替考拉宁的耐药菌株,糖肽类药物仍然是治疗MRSA感染的常规药物[19],本研究显示腹腔感染中未发现由真菌引起的感染,但是,真菌容易引起继发感染[20],临床医生应高度重视。
综上所述,腹腔感染细菌以大肠埃希菌、肺炎克雷伯菌、粪肠球菌和金黄色葡萄球菌为主,腹腔感染细菌的产酶情况和耐药情况较为严重,应加强对腹腔感染患者细菌耐药性监测和流行病学调查,根据药敏试验合理选择抗菌药物,以延缓细菌的耐药率。
参考文献
[1]刘豪,鄢超,施慧群,等.腹腔感染患者分离细菌的分布及耐药性分析[J].中国实验诊学,2020,24(3):384-385.
[2] SARTELLI M,CATENA F,ANSALONI L,et al.Complicated intra-abdominal infections worldwide: the definitive data of the CIAOW study[J].World J Emerg Surg,2014,9:37.
[3]滕达,谢天宇,杜晓辉,等.普通外科患者术后感染病原菌分布及耐药性分析[J].解放军医学院学报,2018,39(1):9-12.
[4]潘剑飞,张泓,戴成才.腹腔感染患者病原菌分布及耐药性和药敏分析[J].安徽医科大学学报,2018,53(3):453-457.
[5]张莎娜,吴晓红,胥俊越,等.腹腔手术感染的病原菌分布及耐药性分析[J].中国药物滥用防治杂志,2022,28(5):583-587.
[6]秦圆圆,黄文祥,赵罗乐,等.腹腔内感染478例临床分析及病原菌分布[J].中国感染与化疗杂志,2018,18(6):561-567.
[7] FLUM D R,DAVIDSON G H,MONSELL S E,et al.Arandomzed trial comparing antibiotics with appendectomy forappendicitis[J].New Engl J Med,2020,383(20):1907-1919.
[8]胡付品,郭燕,朱德妹,等.2016年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2017,17(5):481-491.
[9] RUPP? ?,WOERTHER P L,BARBIER F.Mechanisms of antimicrobial resistance in Gram-negative bacilli[J].Ann Intensive Care,2015,5(1):61.
[10]崔建,王毅,刘威,等.耐药革兰阴性杆菌在腹腔感染中作用研究进展[J/OL].中华卫生应急电子杂志,2021,7(6):365-370.http://www.cqvip.com/QK/72029X/202106/7106883119.html
[11] ZHANG H,YANG Q,LIAO K,et al.Update of incidence and antimicrobial susceptibility trends of escherichia coli and klebsiella pneumoniae isolates from Chinese intra-abdominal infection patients[J].BMC Infect Dis,2017,17(1):776.
[12] YANG Y,LIU J H,HU X X,et al.Clinical and microbiolongical characteristics of hypervirulent Klebsiella pneumonia (hvKp) in a hospital from North China[J].J Infect Develop County,2020,14(6):606-613.
[13]王粟,丁立,姜文容,等.高毒力肺炎克雷伯菌耐药性和治疗策略研究进展[J].检验医学,2023,38(1):81-86.
[14] CHE H,WANG J,WANG R,et al.Novel beta-lactam/beta-lactamase inhitors puls metronidazole versus carbapenem for complicated intra-abdominal infections:a meta-analysis of randomized controlled trials[J].Open Forum Infect Dis,2020,8(1):591.
[15] ALEKSHUN M N,LEVY S B.Molecular mechanisms of antibacterial multidrug resistance[J].Cell,2007,128(6):1037-1050.
[16]胡付品,郭燕,朱德妹,等.2018年CHINET中國细菌耐药性监测[J].中国感染与化疗杂志,2020,20(1):1-10.
[17]乔艳,孙红,李江艳,等.某教学医院耐碳青霉烯类高毒力肺炎克雷伯菌临床及分子特征[J].中国感染控制杂志,2022,21(12):1185-1192.
[18]邵懿.某院102例患者术后并发腹腔感染的病原菌分布与耐药性分析[J].抗感染药学,2022,19(7):960-963.
[19]李德保,任冬梅,田春梅,等.2014-2016年某院腹腔感染病原菌分布及耐药性分析[J].河南预防医学杂志,2017,28(9):674-676,729.
[20]汪小杰,藿翔,茆京来,等.中国援外医疗队队员传染病感染情况调查[J].中华疾病控制杂志,2020,24(8):892-895.
(收稿日期:2023-04-03) (本文编辑:何玉勤)
*基金项目:青海省医药卫生科技项目(2021-wjzdx-117)
①西宁市第三人民医院 青海 西宁 810005
通信作者:常璠

