光照条件变化对蓝隐藻色素蛋白复合物表达含量的影响
王 静,张 昆,王宇涵,李 琴,陈 敏
(烟台大学生命科学学院,山东 烟台 264005)
作为光的受体,光合生物色素蛋白复合物的积累与光照条件是密不可分的,同时对光合生物的生长、环境适应以及进化都具有至关重要的影响[1]。由于隐藻同时含有位于光合膜上的脂溶性叶绿素(chlorophyll,Chl)-蛋白复合物以及位于类囊体腔中的水溶性隐藻藻胆蛋白复合物两套捕光体系,其独特的光合系统结构和机理还不完全确定,有关光适应机制的报道和研究也比较有限。一般认为,低光照环境更适用于多数隐藻的生存,其细胞内可能贮存大量的藻胆蛋白[2],并且借助独特的量子相干机制,使激发能在藻胆蛋白之间的传递效率大幅度提高[3-4],说明隐藻的捕光色素蛋白天然具有高效光能利用能力。了解捕光色素蛋白组成、结构与捕光功能的关系,对于阐明隐藻光合系统结构、功能、进化,提高光能利用效率都具有重要的意义。
自从发现隐藻藻胆蛋白存在两种不同的α亚基后[5],目前发现的9种隐藻藻胆蛋白都认为是以(α1β) (α2β)异二聚体形式存在[3,6-7]。其中β亚基18~20 kU,α1和α2亚基分别为10 kU和8~9 kU。异二聚体形式被认为是隐藻藻胆蛋白最稳定和最普遍的存在形式[8]。基因比较分析显示,隐藻中α亚基是核基因家族编码,β亚基由叶绿体基因编码[9-10]。由于次级内共生的原因,隐藻细胞核、线粒体、红藻残核(类核体)以及红藻质体之间存在一系列复杂的基因转移[11-12],因而分析困难。有报道称,Rhodomonassalina[13]和G.theta[14-15]两种隐藻的光保护机制中不涉及藻胆蛋白天线;但在G.theta中核基因家族编码的PE545的6个编码α1亚基基因及14个编码α2亚基基因在白光条件下均可在蛋白质水平表达[16-17],且表达情况与藻体细胞生长的光照强度有关。显然,光照条件与隐藻藻胆蛋白亚基基因表达之间的关系尚不确定。此外,实验室前期研究发现,蓝隐藻(C.placoidea)藻蓝蛋白PC645中,存在一种未被报道的β亚基,命名为β2亚基[18]。与β1亚基相比,β2亚基分子质量小了约2 kU,等电点小于5.7。目前该β2亚基仅在本实验室所用的蓝隐藻PC645中被发现,其受光照条件的影响及表达情况都未曾报道,该亚基在隐藻光合系统结构组成以及功能发挥过程中的作用亦不清楚。因此,实验以蓝隐藻(C.placoidea)为材料,通过设计不同光照条件进行培养,比较其不同光合色素组成变化;同时分离纯化其藻蓝蛋白PC645,对两种β亚基的比例以及与光照强度的关联性进行比较分析,为分析两种β亚基与光能传递的功能关系提供理论依据。
1 材料与方法
1.1 不同光照条件下蓝隐藻的培养
1.1.1 不同光照条件设置 利用TES-1334A照度计测得光照培养箱中培养瓶两侧光照强度,取平均值,设置0级(500 lx)、1级(1000 lx)及2级(2000 lx)三个不同程序,对应室内、阴天室外、晴天室外背阴三个常见光照条件,每个光照强度下又设置照光12 h与照光24 h。按照0级12 h、0级24 h、1级12 h、1级24 h、2级12 h和2级24 h六组不同的光照条件,设计六个实验组对蓝隐藻(C.placoidea)进行培养。除光照条件不同及按照藻液浓度等量接种外,培养基的配置及接种培养过程均参照文献[19]。将培养至第4天的蓝隐藻按照3500×g,5 min进行离心,弃去上清,沉淀用甘油悬浮液悬浮收集,保存在-70 °C冰箱。
1.1.2 蓝隐藻光谱测定 蓝隐藻培养到第四天时每组取两份5 mL新鲜藻液,一份利用TU-1900紫外-可见分光光度计直接测定藻液的吸收光谱;另一份经过2%的丙酮抽提叶绿素后测定630 nm(Chl a)和663 nm(Chl c)处的吸收值,根据JEFFREY公式[20]计算Chl a/c比值。
离心收集培养至第四天的六组藻细胞,用高压灭菌后的海水悬浮。将等质量(每组0.021 g)的蓝隐藻藻液稀释4倍,测定400~750 nm范围内等质量吸收光谱;稀释11倍,利用LS55荧光分光光度计测700 nm发射光下的400~700 nm范围激发光谱和436、460 及580 nm激发光下的600~750 nm发射光谱。
1.2 蓝隐藻藻蓝蛋白超速离心分离
六组蓝隐藻样品,利用单细胞压力破碎仪进行破碎,破碎条件和操作参照文献[19],细胞破碎液经Beckman Coulter超速冷冻离心机于4 ℃,90 000×g离心20 min,重复3次除去膜碎片和未破碎藻体沉淀,收集富含PC645的蓝色上清液,调至A645=1.0,测定吸收、荧光光谱,用于后期纯化。
1.3 蓝隐藻藻蓝蛋白纯化
六组样品经过超速离心后,得到的上清PC645样品浓缩使其A645=15,进行Sephadex G-100凝胶过滤层析。进样速度为15 mL/h,洗脱速度为30 mL/h,洗脱液为50 mmol/L、pH 7的PBS缓冲液,过程中利用HD-988核酸蛋白检测仪记录A280处的洗脱曲线。收集第一次凝胶过滤层析(MI)洗脱下来的PC645样品,收集A645/A280>4的样品,超滤浓缩至A645=15后进行第二次凝胶过滤层析(MII),收集A645/A280>7的PC645样品,4 ℃冰箱保存。
1.4 蓝隐藻藻蓝蛋白光谱测定
经凝胶过滤层析纯化后的各组PC645样品浓缩至A645=1.5,测定250~750 nm范围内吸收光谱、700 nm发射光下的400~700 nm范围内激发光谱和580 nm激发光下的600~750 nm范围内的发射光谱。
1.5 非变性聚丙烯酰胺凝胶电泳
六组光照条件下培养得到的PC645纯化后,可采用非变性聚丙烯酰胺凝胶电泳的方法检测纯度。选取pH 8.3的Tris-Gly体系,分离胶pH 8.8、浓度10%,浓缩胶pH 6.8、浓度4%,具体操作参见文献[21],但需在上槽的电极液中加入0.01%的SDS。电泳结束后,在BioSpectrum Imaging System UVP凝胶成像系统进行紫外拍照,后进行考马斯亮蓝染色,脱色后于白光下拍照保存。
1.6 SDS聚丙烯酰胺凝胶电泳
六组不同光照条件培养后获取的纯化后的PC645,调节A645为1.5且取等量样品,利用三氯乙酸(TCA)使样品沉降,分离胶pH 8.8、浓度13%,浓缩胶pH 6.8,浓度4%,SDS-PAGE电泳参照LAEMMLI[22]方法进行。电泳结束后在紫外灯下拍照,后进行考马斯亮蓝染色,脱色后于白光下拍照保存。
2 结果与分析
2.1 不同光照条件下蓝隐藻的培养
本实验条件下培养的蓝隐藻,在第3~4天左右进入对数生长期。六组不同光照条件下培养的蓝隐藻的生长情况如图1所示,藻液从刚接种时的浅绿色逐渐加深至呈深绿色。在相同接种量的情况下,根据培养至第4天的藻体颜色进行判断,六组不同光照条件的藻体细胞生长密度由低到高顺序为0级12 h、1级12 h、0级24 h、2级12 h、1级24 h和2级24 h。这一现象在藻体原液吸收光谱(图2(a))中得到证实。可以说明在本实验所涉及的光照强度范围内,蓝隐藻细胞的生长速度与光照周期内光照强度呈正相关。但六组不同光照条件下培养的蓝隐藻中,藻蓝蛋白与叶绿素相对含量仅凭对藻体颜色的判断并不明确。

图1 藻体细胞的培养

图2 不同光照条件下培养的藻体细胞的吸收光谱
2.1.1 藻细胞吸收光谱 原液吸收光谱(图2(a)),通过色素含量变化可反映不同光照条件下藻细胞的生长速度。结果显示,随着光照强度的增强,藻细胞中各种色素,包括Chl a(437~438 nm和679~682 nm)、Chl c(465 nm)、类胡萝卜素(497 nm)和PC645(580~650 nm)的吸收峰明显升高,与通过培养液颜色观察得到的趋势一致。另外1级12 h的样品吸收值低于0级24 h的样品,2级12 h的样品吸收值低于1级24 h的样品,说明光通量总值相近情况下,光照时间长有利于藻细胞生长。
等质量藻体吸收光谱(图2(b))可反映各种色素(或色素蛋白复合物)的相对积累情况。以2级24 h样品的吸收光谱为基准,对六组样品679~750 nm之间的吸收峰垂直差进行归一化处理。结果显示,在465 nm处Chl c的吸收峰以及在584、627和652 nm处藻蓝蛋白的吸收值在六组样品之间是存在差异的,1级12 h样品在584 nm处的吸收峰与其他五组样品相比较低,但由于藻体细胞悬浮液并非真溶液,测量过程中会产生较大程度的散射,导致测得吸收光谱会有明显的噪声波动而影响对图谱的规律性分析。测定各组藻体细胞样品中Chl a和Chl c含量并计算Chl a/c比值,结果如表1。

表1 不同光照条件下培养的藻体细胞的叶绿素含量
Chl c是只存在于捕光复合物中的辅助色素,Chl a与 Chl c相对含量变化可以反映出类囊体膜上处于光合系统外围的捕光复合物的结构和含量的变化。由表1可知,Chl a和Chl c含量分别随光照强度的增加而呈增加趋势,均在1级24 h时达到最高,与藻体细胞密度增长呈正相关,与吸收光谱变化规律一致。但实验所涉及的光照条件变化范围内,六组不同光照条件下样品Chl a/c比值的变化不明显,基本维持在4.5~4.9 μg/mL,说明两种叶绿素含量几乎呈等比例趋势增加,Chl a/c-蛋白复合物的大小和含量没有显著变化。
2.1.2 蓝隐藻藻细胞荧光光谱 六组不同光照条件下培养藻细胞的荧光发射光谱(图3(a)~(c))峰形大致相似。当给予436 nm和460 nm的激发光时,各组藻细胞样品均只产生682~683 nm(PSⅡ的Chl a)处的荧光发射峰,表明在活体状态下的藻细胞中,Chl c吸收的能量全部传递给了Chl a,且是波长稍长的Chl a(683 nm),其光能传递效率可达100%。当给予580 nm (PC645的主要吸收光)的激发光时,产生位于663 nm属于PC645的特征末端荧光发射峰,以及680 nm属于PSⅡ的Chl a荧光发射峰。通过对663 nm的荧光发射峰进行归一化处理发现,低光照强度的样品中663 nm处峰为发射主峰,说明在这几组藻体细胞中,有相当一部分 PC645 是以游离形式存在的,其吸收的光能并没有传递给

图3 不同光照条件下培养的藻体细胞的荧光光谱
反应中心用于光合作用,而是以荧光的形式耗散掉,这一部分PC645的功能是富余的;同时,在580 nm激发光下,产生属于PSⅡ的Chl a的位于680~681 nm处的荧光发射峰,说明PC645更倾向于将吸收的光能传递给短波长Chl a。此外,680 nm处峰与663 nm处峰相比较,低光照强度时680 nm处的峰值较低,但在2级光照的样品中680 nm峰高于663 nm,说明低光照强度对藻蓝蛋白的积累比例更高,当光照强度变强时,游离的藻蓝蛋白积累量逐渐减少,传递给短波长Chl a的光能增多。
藻体细胞荧光激发光谱(图3(d))显示,在700 nm发射波长下,藻体细胞主要在580、625和642 nm产生属于PC645的激发峰,这表明对700 nm处的荧光贡献主要来自于PC645,而Chl a(436 nm)和Chl c(458 nm)以及类胡萝卜素(499 nm)的激发贡献并不明显,且六组样品激发光谱激发峰的高低变化趋势与荧光发射光谱类似。调整各组样品在436 nm处的荧光激发峰等高,结果显示低光照强度样品在属于PC645的642 nm处激发峰比Chl a在436 nm 和 Chl a在458 nm处的激发峰高,再次证明PC645在低光照强度培养的藻细胞中积累相对更多。对适应低光照强度生长的隐藻来说,藻胆蛋白作为其另一套捕光复合物在低光照时积累更多,有利于提高捕光能力,这一结论与其生境情况相适应。
2.2 粗PC645的分离与光谱表征
不同光照条件下培养的蓝隐藻破碎后经过超速离心得到的上清吸收光谱如图4(a)所示。各样品在可见光区吸收光谱比较相似,均有来自于PC645中β亚基的二氢胆绿素(15,16-dihydrobiliverdin,DBV)的580 nm和藻蓝胆素(phycocyanobilin,PCB)的645nm处的特征吸收峰,α亚基上的2个中胆绿素(mesobiliverdin,MBV)色基产生位于625 nm处的肩峰。280 nm处为蛋白质吸收峰,此外350~400 nm与四吡咯色基有关的吸收峰起伏程度略有所差异。六组样品尤其是0级12 h的样品,经过超速离心分离后仍含有相当量的无色杂蛋白,上清液A645/A280约在1.1~1.4,因此需进一步纯化。
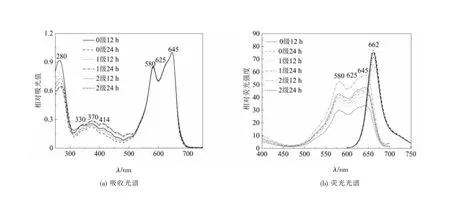
图4 超速离心后的PC645样品光谱
荧光光谱(图4(b))显示,六组样品在580 nm激发光下都只产生位于660 nm处的PC645特征荧光发射峰;而在700 nm的发射光下,只产生属于PC645的位于580、625、645 nm的特征荧光激发峰,说明六组样品亚基内部色基结合状态完好。
2.3 PC645凝胶过滤层析纯化与表征
2.3.1 PC645的凝胶过滤层析纯化 样品在MI洗脱曲线(图5(a))中出现3个洗脱峰,位于76~80 mL附近的洗脱峰峰值较高,此处样品呈现淡黄绿色,是富含叶绿素或类胡萝卜素的大分子蛋白复合物成分;位于150~154 mL处洗脱峰,样品呈现蓝色,为富含藻蓝蛋白PC645的组分;位于266~277 mL的洗脱峰处的样品无明显颜色,其成分尚不明确,该类蛋白出峰在PC645之后,其分子质量比PC645小,推测为小分子无色杂蛋白或叶绿素蛋白复合物的脱辅基蛋白。蓝色样品的MII洗脱曲线(图5(b))均只产生一个位于150~154 mL处的蓝色的窄峰,为富含藻蓝蛋白PC645的组分,它们具有相同的分子质量,应为稳定存在的异二聚体形式。

图5 PC645样品的MI(a)和MII(b)洗脱曲线
2.3.2 PC645的光谱测定 经过两次凝胶过滤层析纯化后的六组样品的吸收光谱(图6(a))和荧光光谱(图6(b))峰完全一致。与超速离心后上清液的吸收光谱比较,层析纯化后得到的PC645样品吸收光谱中280 nm处的峰值明显降低,A645/A280>7,说明各组样品已充分去除了无色杂蛋白。
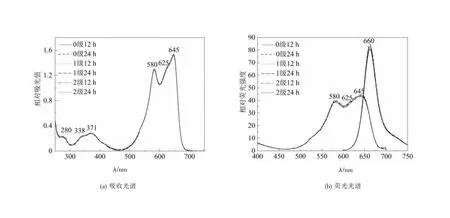
图6 凝胶过滤层析纯化PC645样品的光谱
2.3.3 PC645的纯度鉴定 非变性聚丙烯酰胺凝胶电泳结果(图7)表明,纯化后各组PC645样品经考马斯亮蓝染色后只有一条带,紫外光下也只呈现单一荧光带,说明各组样品中成分均一,无其他杂蛋白。

图7 凝胶过滤层析纯化PC645样品的非变性电泳图
2.3.4 SDS-PAGE亚基组成分析 各组PC645样品经SDS-PAGE电泳后(图8)均呈现3条荧光带,从下至上依次为10 kU的α亚基、15.9 kU的β2和17.9 kU的β1亚基。由于β亚基中含有2个PCB色基和1个DBV色基共3个色基,因此其荧光较强,而α亚基中只含有一个MBV色基,荧光相对较弱。对比各组条带的荧光强度显示,六组样品中α亚基的相对含量相差不大,说明在本实验设计的光照条件范围内,对α亚基(包括α1和α2)的相对含量影响不明显。六组样品中均存在β1和β2亚基,但两者的相对含量有所不同,0级时,照光24 h的样品中β2亚基含量比12 h更高;1级时,照光12 h和24 h的样品中β2亚基含量相近;而2级时,照光24 h的样品中β2亚基含量低于12 h。PC645样品中β2亚基含量在0级和1级光照条件下随光照时间的加长而增加,但光照强度过高或光照时间过长的光照周期(如2级24 h)对PC645样品中β2亚基的积累不利。
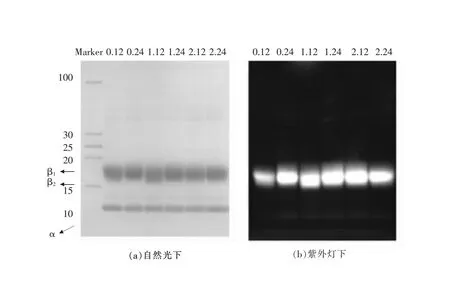
图8 凝胶过滤层析纯化的PC645样品的SDS-PAGE电泳图
3 讨 论
隐藻的捕光系统包括位于类囊体膜上的脂溶性Chl a/c-蛋白复合物和位于类囊体腔中的藻蓝蛋白两类。研究表明,低光强或常规光强下生长的隐藻G.theta细胞中,相对于叶绿素而言藻红蛋白PE545积累更多,且储备是冗余的,表现为处于对数生长期的细胞在77 K低温荧光发射光谱中可产生属于游离PE545的578 nm荧光发射;而该荧光在高光条件下培养的藻体细胞中消失,因此认为高光条件下藻胆蛋白可能发生了降解,且表达量降低,但储备量降低的藻胆蛋白却可以100%的高效率将吸收的激发光全部传递给光合反应中心,因而不再显示游离PE545的578 nm荧光发射[19]。模拟室内、阴天室外、晴天室外背阴三个常见光照条件下,每个光照强度下又设置照光12 h与24 h,设置六组不同光照条件对蓝隐藻进行培养。结果显示,在实验条件范围内,高光照强度有利于蓝隐藻细胞的生长,且连续光照更有利;光照强度低有利于PC645的积累,在0级12 h时,蓝隐藻藻细胞中Chl a/c-捕光天线相对含量最小,光能捕获更大比例依赖于藻蓝蛋白;光照增加后,蓝隐藻对数生长期细胞Chl a/c比值稳定在4.5~4.9之间,与叶绿素相比,藻蓝蛋白的相对含量逐渐降低,说明1级12 h或0级24 h以上,光照对Chl a/c-外周捕光复合物影响不明显,主要影响的是水溶性的藻胆蛋白,推测后者在隐藻的光适应机制中可能担负更大的调节作用。
SDS-PAGE电泳图显示,从不同光照条件培养下的藻体中纯化的PC645,各亚基含量有所差异,1级12 h和24 h的PC645样品中β2亚基含量较其它样品略多,似乎PC645样品中β2亚基含量比例在1级光照条件下更高,更高的光照强度和更长的光照周期,都不利于PC645样品中β2亚基的积累,但对α亚基(包括α1和α2)的相对含量影响不明显。实验室前期研究结果表明,β2亚基的pI小于5.7,因而在异二聚体结构中,与pI=6.2的β1亚基相比,和碱性的α1亚基的相互作用更强,可有效地中和其所带电荷。含β2亚基的PC645亲水性相对于不含β2亚基只含两个β1亚基的PC645来说更弱[20],因而可能与镶嵌在类囊体膜上的脂溶性的叶绿素蛋白复合物的作用更加便利。本实验中0级和1级光照条件下β2亚基含量比例随光照程度增高而升高,由此可以推测,光照强度增高,PC645与类囊体膜上的捕光Chl a/c2-蛋白复合物以及反应中心作用更强;但光照继续增强时,又表现为相互作用削弱。β2亚基的存在不仅意味着隐藻藻胆蛋白亚基组装方式存在异质性,不再只有(α1β) (α2β)一种,且PC645不同的异二聚体形式还可能与其光能传递功能的差异性和可调性有关。

