耐盐芦苇高频遗传转化体系的建立
王美玲,韩建玮,陈方军,尹海波,张 侠
(烟台大学生命科学学院,山东 烟台 264005)
芦苇(Phragmiesaustralis),禾本科,芦苇属,具有较强的繁殖能力和环境适应能力[1],在滨海湿地生态系统中属于优势物种[2]。芦苇可以通过调整形态和生理特征来应对水淹、盐渍和极端气候等不同类型的非生物胁迫[2],具有较高的生态价值。芦苇在盐胁迫下可以将体内过多的Na+排出体外以减少离子的毒害[3],并通过调节体内Na+和K+平衡,将Na+从地下组织转运到地上组织,因此对湿地有一定除Na+的作用[4]。芦苇作为研究耐盐胁迫的模式植物,已建立多个EST文库并鉴定了大量功能基因。国内外针对芦苇的遗传转化报道甚少且大多使用下胚轴诱导愈伤组织[5-6],研究并优化芦苇遗传转化体系,将有助于芦苇重要基因功能的鉴定,更好地挖掘抗逆相关基因。
本研究利用山东东营滨海湿地的耐盐芦苇种子诱导愈伤组织,就愈伤组织分化、抗性筛选的条件进行优化探讨,建立高频转化体系,同时利用沉默载体验证该体系的转化效率,为进一步鉴定抗逆相关基因提供参考。
1 材料和方法
1.1 材料
芦苇种子采自山东东营滨海湿地,侵染用根瘤农杆菌EHA105、沉默载体pFGC1008-GRPi(潮霉素hyp作为抗性标记)由烟台大学生命科学学院植物发育分子生物学实验室构建并保存。
1.2 方法
1.2.1 光照对诱导愈伤组织的影响 挑选颗粒饱满、大小相近的成熟芦苇种子,75%乙醇振荡消毒1 min;再用0.1%安替福民浸泡20 min,不间断地轻轻振荡;最后用无菌水振荡清洗3 min,重复5~7次,放在无菌滤纸上吸干水份。
将消毒后的种子均匀放至诱导培养基(MS+1.0 mg/L 2,4-D+1.0 mg/L 6-BA+0.5 mg/L NAA,pH 5.8)上,每个培养皿接种30粒,4 ℃低温处理36~48 h打破种子热休眠,转入恒温培养室(25±2) ℃,光照强度2000 lx,分为以下3组进行处理:(1)暗培养8 d;(2)光照培养8 d;(3)先进行暗培养96 h,观察到种子出现萌动迹象再放于光下培养96 h。每个处理含10个培养皿。
待愈伤组织长到直径0.3 cm左右,在超净工作台内将褐化的芽切除,将愈伤组织转接至诱导培养基上继续培养,待愈伤组织生长到黄豆大小,挑选黄色致密的块状愈伤组织在继代培养基(MS+1.0 mg/L 2,4-D,pH 5.8)上培养,每3周继代一次,继代3次,观察其增殖情况,统计诱导出愈伤组织数和出愈率。
出愈率=(诱导出愈伤组织数/接种的芦苇种子数)×100%。
1.2.2 根瘤农杆菌EHA105介导的转化和共培养 将pFGC1008-GRPi载体利用冻融法转入农杆菌EHA105中,然后将构建好的重组根瘤农杆菌接种于含12.5 mg/L氯霉素(Chl)的甘露醇培养基(YEP)中,于28 ℃暗培养2 d,调整侵染液的吸光度值为0.07左右,培养得到的单菌落刮下后转至30 mL AAM侵染液中,并轻轻摇晃。从诱导后的愈伤组织中挑选表面干燥、生长旺盛的在预/共培养基(MS+1.0 mg/L 2,4-D+100 μmol/L AS,pH5.2)中预活化3 d,将活化后的愈伤组织切成直径1 cm左右的组织块置于侵染液中浸泡2~3 min,期间不断晃动以保证愈伤组织可以充分接触侵染液。侵染完成后倒出悬浮液,取愈伤组织吸干水份,转移至盖有滤纸的预/共培养基中于23 ℃暗培养2~3 d。无菌水振荡冲洗6~7次直至溶液完全澄清,然后用含250 μg/L头孢的水振荡3~5 min脱菌。
1.2.3 不同浓度潮霉素(Hyp)对转化的影响 将上述脱菌后的愈伤组织用无菌滤纸吸干水份,置于不同浓度Hyp抗性的筛选培养基(MS+1.0 mg/L 2,4-D+300 mg/L头孢+12.5 mg/L Chl+30 mg/L蔗糖,pH 5.8)中。Hyp浓度梯度设置为40、45、50、55、60 mg/L,每个培养皿接入30块愈伤组织,每个浓度处理含3个培养皿,培养两周后,更换培养基继续培养,重复筛选两次后,统计抗性愈伤率。
抗性愈伤率=(抗性愈伤组织数/侵染的愈伤组织总数)×100%。
1.2.4 不同浓度6-BA对分化的影响 挑选侵染后的黄色颗粒状、疏松的抗性愈伤组织,分割成0.5 cm大小,接种在不同浓度6-BA的分化培养基(MS+0.08 mg/L IAA+50 mg/L Hyp+12.5 mg/L Chl,pH 5.8)上,6-BA浓度梯度设置为0.6、0.8、1.0 mg/L,每个培养皿接入22~25块愈伤组织,每个处理含3个培养皿,等到长出绿色组织后统计不定芽分化率。
不定芽分化率=(分化出不定芽的外植体数量/外植体总数)×100%。
1.2.5 驯化与移栽 将出芽的愈伤组织于分化培养基上培养两代(2周/代)后,将整株苗移入生根壮苗培养基(1/2MS+20 g/L蔗糖+0.1 mg/L NAA,pH 5.8),23 ℃光照诱导生根两周,等到再生苗的根长到8~10 cm时,将瓶苗移出,轻轻洗去根基部培养基,移栽到蛭石∶黑土=1∶1的移栽基质中于温室培养。
1.2.6 转基因植株的检测与鉴定 采用CTAB法提取候选转基因植株叶片的基因组DNA,PCR扩增hyp基因片段,以野生型芦苇叶片DNA扩增产物为阴性对照,重组载体扩增产物为阳性对照。确定阳性转基因株系,并计算转化率。
转化率=(PCR检测均为阳性植株数/以最佳组合转化的总愈伤组织数)×100%。
提取阳性转基因株系的RNA,根据芦苇GPR基因设计引物进行实时荧光定量PCR检测。
2 结果与分析
2.1 光照对诱导愈伤组织的影响
本研究分析了光照对外植体的生长状态、颜色以及愈伤组织出现的时间等方面的影响,并统计不同光照培养条件下诱导愈伤组织的数量和出愈率(表1)。与单一的光照或黑暗培养相比,暗培养96 h+光培养96 h条件下愈伤组织成长状态最好,呈浅黄色,表面紧致,出愈率更高,且达91.0%。

表1 不同光照条件对芦苇诱导愈伤组织的影响
2.2 Hyp筛选浓度的确定
芦苇愈伤组织与根瘤农杆菌共培养后,被转入含有抗生素的筛选培养基上,以筛选出抗性转基因组织。抗生素浓度太高会使芽白化甚至死亡,太低易出现假阳性植株。为了确定最佳的抗生素筛选浓度,设置培养基中Hyp分别为40、45、50、55、60 mg/L,分化率结果如表2所示。50 mg/L Hyp得到最优分化效果,不定芽的个数最多,可作为芦苇愈伤组织遗传转化的筛选压力。

表2 Hyp对不定芽生长及分化的影响
2.3 分化培养基中6-BA浓度对不定芽发生的影响
6-BA作为一种强分裂素,其浓度也会影响愈伤组织的分化[7],若浓度太低会使不定芽分化太慢,浓度太高则易出现褐化。在愈伤组织两次继代分化出芽的过程中,设置不同6-BA浓度,分析其对分化的影响,结果如表3所示,当6-BA为0.8 mg/L时,分化出不定芽个数最多,平均出芽率达97.1%,由此确定最适分化培养基为:MS+0.8 mg/L IAA+50 mg/L Hyp+12.5 mg/L Chl+0.8 mg/L 6-BA。

表3 6-BA浓度对不定芽发生的影响
2.4 芦苇遗传转化体系的建立
芦苇遗传转化体系如图1所示。消毒后的耐盐芦苇种子放入诱导培养基中,4~5 d后开始出现白色幼芽,10 d左右芽的基部开始诱导出黄色愈伤组织(图1(a)),三周左右形成淡黄色的胚性愈伤组织(图1 (b))。将褐化的愈伤组织切除后进行继代培养,继代后胚性愈伤组织呈不均一的淡黄色、紧密颗粒状,生长速度快。将愈伤组织切成1 cm左右块状进行根瘤农杆菌侵染,在预/共培养基中暗培养2~3 d(图1(c))后转入筛选培养基筛选3代,形成抗性愈伤组织(图1(d)),抗性愈伤组织分化5~8 d后开始变绿,15 d后不定芽长到0.3~0.5 cm(图1(e)),待芽长到3~5 cm时转接到生根壮苗培养基中,5 d左右长出须根(图1(f)),在温室炼苗2~3周后移栽到蛭石∶黑土=1∶1的基质中继续培养(图1(g))。

图1 根瘤农杆菌介导的芦苇遗传转化体系
2.5 转基因植株的检测
利用表达载体上筛选标记基因hyp对转基因植株进行PCR鉴定。琼脂糖凝胶电泳结果如图2所示,目的基因hyp大小约500 bp,阴性对照组无扩增产物,转基因株系T0-1、T0-2、T0-3、T0-4、T0-5、T0-6、T0-7、T0-8均得到预期大小的扩增产物。
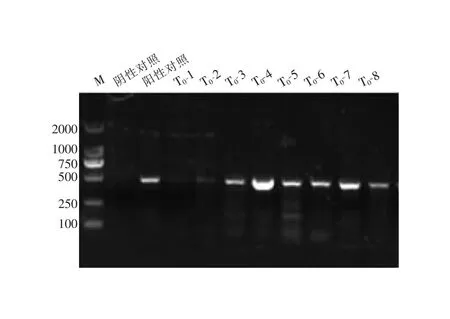
图2 芦苇转化植株PCR鉴定
分别提取以上T0代转基因株系的RNA,利用实时荧光定量PCR检测植株GPR基因的表达水平。结果如图3所示,目的基因GPR在各个转基因株系中的表达都呈现出降低趋势,其中转基因株系T0-1的表达量降至对照植株的73.5%,达到显著差异;转基因株系T0-4、T0-5、T0-6、T0-7和T0-8的表达量与对照相比降幅均超过40%,达到极显著差异。但T0-2、T0-3中目的基因表达量下降水平与对照相比差异不明显。总体来看,转基因抗性株系中,获得较强沉默干扰效果的株系达75%。

图3 转基因株系GPR基因相对表达量
3 讨论与结论
本研究采用山东东营滨海湿地的耐盐芦苇进行遗传转化体系的优化。通过改变愈伤组织的诱导培养条件发现,与单一的光照或暗培养相比,在光培养与暗培养的组合条件下愈伤组织生长更快、状态更佳。在最适分化培养基中共得到203块抗性愈伤组织,愈伤诱导率达91.0%,与其他研究报道[8-11]相比,诱导效率较高,有利于后期芽的分化。
选择标记基因早在1989年由MCHUGHEN于亚麻植物中成功应用[11],为基因转化开辟了一条捷径。根瘤农杆菌介导的遗传转化中潮霉素hyp是较为常用的抗性基因[12-13],故本研究沿用hyp作为转基因植株的筛选标记。潮霉素的筛选浓度对转化有重要影响[14],本研究条件下芦苇愈伤组织对潮霉素的耐受浓度为50 mg/L,筛选两代后抗性愈伤率为44%。
分裂素是大多数禾本科植物分化出芽的必要条件,在本研究中,6-BA为0.8 mg/L时愈伤组织分化率可达97.1%,这与周晓燕等[6]的研究结果相似,与同属的禾本科植物水稻和大麦相比[8-9],6-BA浓度相近。
本研究建立了根瘤农杆菌介导的耐盐芦苇遗传转化体系,经过根瘤农杆菌侵染、筛选、PCR鉴定后,T0代阳性转基因株系的转化率为13.8%。高鸿等[5]同样利用根瘤农杆菌侵染的方式对芦苇愈伤组织进行了遗传转化,平均转化率仅为7%左右。此外,本研究利用荧光实时定量PCR检测T0代阳性转基因植株,其中具有较强沉默干扰能力的株系比例高达75%,也高于同类研究结果[15-16]。可见,本研究中建立的芦苇遗传转化体系较为成熟,遗传转化率较高,可为后续耐盐芦苇的基因功能研究及抗逆机制分析提供基础。

