吲哚在生物材料表面大肠杆菌生物膜中的研究进展
苏丹燕,唐文甜,杨谨旭,刘 华,李邦胜,赵应鼎,黄云超
(昆明医科大学第三附属医院/云南省肿瘤医院胸外一科,云南 昆明 650118)
随着生物材料被广泛应用于临床,各种形式的植入手术已经成为临床治疗中不可或缺的重要组成部分,虽使成千上万的患者从中获益,但其带来的高植入失败率和再次手术风险的危害同样不可忽视[1]。一旦治疗失败,患者不得不进行完全清创或者植入物置换手术,这不仅给患者带来严重的健康损害和经济负担,还制约着全球卫生经济水平的发展[2-3]。生物材料作为外源性材料,细菌在其表面定植而导致的生物膜相关感染(biofilm-associated infections,BAI)是植入物手术失败的主要原因,但目前尚无特异性的靶向药物,寻找靶向生物膜的抗感染药物已成为一种研究热点[4]。
抗生物膜治疗仍是一个非常具有挑战性的难题,为此,大量研究者致力于抗生物膜的研究,构建了聚氯乙烯(polyvinyl chloride,PVC)、硅胶等生物材料表面细菌生物膜感染模型[1,5-9],发现群体感应信号可能是生物材料植入相关感染的潜在治疗靶点。细菌常常黏附于生物材料表面,形成细菌生物膜(bacterial biofilms,BF),因其结构的特殊性及致密性,常常能够有效抵御机体的防御反应及抗生素的渗透,是导致慢性持续性感染的根源之一[10-11]。有研究发现,生物膜感染占人类微生物感染的80%[12],细菌定植在尿管导管的概率是每天5%~10%[13]。大肠杆菌是引起以生物材料为中心植入感染的优势菌种之一,在术后生物材料植入感染中的检出率为1.6%~2.4%[14]。研究表明大肠杆菌生物膜形成过程中还受到新型群体感应信号分子吲哚的调控[15]。本文重点就大肠杆菌生物膜、吲哚的微生物代谢及其对大肠杆菌生物膜的调控进行综述,为临床靶向药物的研发提供理论依据。
1 大肠杆菌生物膜概述
1.1 细菌生物膜定义
细菌生物膜是细菌为了适应环境黏附在生物或非生物表面通过分泌多种胞外聚合物(主要是胞外多糖)包裹菌体从而保护膜内细菌免受机体攻击及抗生素清除作用的三维立体膜状结构,是细菌在自然界中一种常见的生存状态[16]。
1.2 大肠杆菌生物膜形成
大肠杆菌的致病力很大程度上来自于其形成细菌生物膜的能力。不同细菌形成的生物膜虽在结构上呈现多样性,但形成过程大致相似。大肠杆菌生物膜的形成是一个动态、循环往复的连续性过程,在不同阶段,其组成比例、菌体形态、菌体数量、细菌耐药程度及清除难度都不相同[17],一般经历4 个生理阶段,见图1:(1)细菌黏附:包括可逆附着和不可逆黏附两相过程。浮游细菌黏附在生物材料表面,随着血流的冲击、集体的吞噬作用以及抗生素的清除作用,细菌被迫迁徙或被杀灭。Brun 等[18]研究表明,通过倒置显微镜观察附着阶段的大肠杆菌在中等流动状态和高剪切速率下,大肠杆菌极易被水流冲走,不利于细菌在生物材料表面进一步黏附。细菌通过菌毛、鞭毛、肽聚糖、荚膜、胞外黏质物、脂壁酸等具有黏附作用的聚合物[19]与机体组织、生物材料等特异性结合,使细菌不可逆黏附在生物材料表面,进行增殖和形成多细胞群落[18-20];(2)生物膜形成:细菌不断生长繁殖,基因表达发生变化,分泌大量胞外聚合物,如多糖、蛋白质、脂质和细胞外DNA(eDNA)等大分子物质[21-22],将细菌包埋和固定,形成高度水合的极性化合物,有助于整体支架的构建和稳定的三维微型菌落形成;(3)生物膜成熟:生物膜逐渐发育成熟,此时生物膜体积达到最大,外观似蘑菇状或塔状结构,生物膜功能更加完善,膜内营养物质实现有效分配,细菌之间通过信号分子通道进行信息交流[23];(4)脱落再黏附:内外因素的相互作用下,生物膜基质降解和表面活性剂的破坏,细胞团主动扩散,生物膜转换为浮游状态,游离细菌继续附着并定植,发育成熟形成新的生物膜。附着是生物膜形成的开始,主动扩散并不是生物膜的结束,生物膜的不断循环往复的动态过程使微生物得以不断适应各种恶劣环境,也能够不断分散和定植新的生态位[24]。

图1 生物膜形成模式图Fig.1 Diagram of bioflm formation
大肠杆菌作为临床上常见的条件致病菌,在人体正常生理状态下通常不致病,当在心脏大血管手术体外循环、骨科、泌尿外科及神经外科等术中控制性降压,缺血再灌注损伤及临床上失血性休克等病理情况下,人体免疫力下降,肠道内的大肠杆菌发生表型变化穿透肠壁黏膜屏障进入淋巴系统或血液系统,发生细菌移位[25],成为生物材料植入相关感染的菌源,形成细菌生物膜,导致菌血症或败血症的发生,可引起远处器官或组织的局部感染,严重者甚至全身感染导致MODS、SIRS 等,死亡率大大提高,甚至达37%[26]。大肠杆菌生物膜形成的调控机制目前尚未完全阐明,但近年来发现群体感应(quorum sensing,QS)对大肠杆菌生物膜形成的调控起至关重要的作用。群体感应是细菌通过产生、分泌、检测并利用具有扩散特性的化学信号分子来感知自身及周围环境中的细菌数量,细菌数量达到最低阈值时,细菌将会调控一系列靶基因的表达从而协调群体行为并发挥相应的生物学功能[27]。
1.3 大肠杆菌群体感应系统
群体感应系统是大肠杆菌1 种重要的信号传递机制。大肠杆菌通过群体感应系统接收复杂的外界环境信号并感知环境中自身的密度,从而调控胞外基质多糖的特定化学信号使细菌之间相互聚集和粘连,这对生物膜的形成和维持具有重要的意义。根据信号分子的不同,将大肠杆菌群体感应系统分为5 种:(1)由N-酰基高丝氨酸内脂(acyl-homoserine lactones,AHLs)信号分子,AHLQS 系统普遍存在于革兰氏阴性菌中,与胞内DNA受体蛋白LuxR 结合,调控目的基因的表达[28];(2)由自身诱导肽(autoinducing peptides,AIP)介导,调控目的基因表达,参与种内细菌信号交流[29];(3)由自体诱导剂(autoinducer-2,AI-2)介导[30],调控细菌多种生物学功能,其中包括生物膜的形成[31];(4)由AI-3/肾上腺素/去甲肾上腺素介导,负责宿主-细菌间的相互交流[32-33];(5)细菌自身产生的吲哚效应分子介导的QS 系统,见图2。吲哚通常作为大肠杆菌的生理生化鉴定标记之一,直到近年来,吲哚作为新型QS 信号分子参与细菌多种生理活动,如孢子形成[34]、质粒稳定性[35]、耐药性[36]、吲哚产生菌的毒力[37]以及生物膜形成[38-40]等的调控作用才逐渐被揭示并重视。
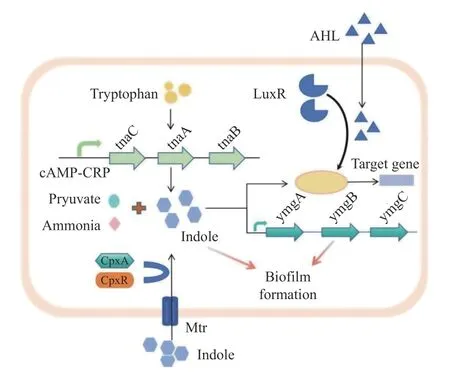
图2 参与大肠杆菌界间通讯过程的吲哚系统示意图Fig.2 Schematic representation of the indole system that participates in inter-kingdom communication processes in E. coli
2 吲哚的微生物代谢
吲哚是1 种典型的相对稳定的氮杂环芳烃有机化合物,在自然界中广泛存在。微生物和动植物在进行生理生化活动过程中通常会伴随着吲哚的产生,动物肠道中吲哚的浓度可高达1.0 mmol/L[41]。色氨酸(tryptophan,Trp)在色氨酸酶(tryptophanase,TnaA)以5′-磷酸吡哆醛为辅酶的作用下催化L-色氨酸(pyridoxal 5′-phosphate,PLP)生成吲哚,同时产物还有丙酮酸和氨[37]。大肠杆菌色氨酸酶的表达受操纵子(trpEDCBA)调控[42]。色氨酸有3 条代谢途径,分别是犬尿氨酸途径、5-TH 途径、微生物代谢途径[43]。研究发现大肠杆菌的细胞膜上存在3 种分别由Arop、TnaB 和Mtr 编码的转运蛋白可将胞内色氨酸转运至胞外进行色氨酸代谢[38]。犬尿氨酸途径承担约95%的色氨酸代谢,是色氨酸代谢的主要途径[44],肠道内微生物可直接或间接调节色氨酸代谢,经tnaA 编码的酶将色氨酸转化为吲哚,最终经尿液排出[45]。大部分生物体内均存在色氨酸合成及代谢通路,但吲哚只有在编码tnaA 的细菌中产生[46],在低水平色氨酸的培养基条件下,Trp 操纵子的表达升高,而tna 操纵子的表达下降,吲哚生成受到抑制,与此相反,当在富含色氨酸的培养基条件下时,消除转录终止 Rho 依赖性,激活tnaA 基因表达,产生大量的吲哚[47]。吲哚的生成量还受到环境和生物等多种因素的影响,如温度、pH、细胞密度、碳源及抗生素等,其中外源性色氨酸量的多少很大程度上直接影响吲哚的生成量。据报道,当提供一定浓度范围内的色氨酸量时,进入稳定期的大肠杆菌可以把这些色氨酸转化为等量的吲哚,最高达5.0 mmo/L[48],然而继续加入色氨酸,生成吲哚的量却不再增加,可能是过量的吲哚抑制TnaA 的活性以及色氨酸的转运。
3 吲哚—信号分子新成员
细菌通过产生信号分子用于接收细胞内和细胞间的通讯信息,进行种内和种间的信息交流。目前已发现有超过85 种细菌能够产生吲哚[12],吲哚调控细菌群感效应功能逐渐被研究者重视。尽管有研究者对吲哚是否为细胞间信号分子存在一定争议,但相关证据表明吲哚具备成为细胞间信号分子的条件。吲哚主要产生于大肠杆菌生长的指数期晚期和稳定期的过渡期,在细菌生长迟缓期和指数期早期以非常低的水平产生[49]。研究发现[50],在小鼠肠道中吲哚水平的高低可以通过细菌膜结合组氨酸传感器激酶(histidine sensor kinases,HK)CpxA-CpxR 双组分系统调节肠出血性大肠杆菌(enterohemorrhagic Escherichia coli)毒力基因的表达,随着吲哚浓度的升高,毒力基因表达下降。外源吲哚还可以诱导不产生吲哚的恶臭假单胞菌和铜绿假单胞菌中编码两个RND 型多药外排操纵子基因的ttgAB 和一个编码β-内酰胺酶ampC 的表达增加,上调CpxA-CpxR 双组分系统,导致与抗微生物耐药相关的基因转录激活,增强细菌耐药性[51]。大肠杆菌SdiA 蛋白属于LuxR 家族,是一种参与细胞分裂的转录调节因子,可以与AHL、AI-2 等信号分子相互作用[52]。有研究表明,吲哚介导的信号转导与AHL 介导的信号转导之间可能存在一定的联系,高浓度吲哚抑制大肠杆菌的AHL 活性,AHL 与SdiA 结合可以免受吲哚的影响[40,53]。目前尚不清楚吲哚是如何对SdiA 同源物做出反应并发挥相应的生物学功能。此外,吲哚还通过下调噬菌体受体IV 型菌毛(T4P)活性和组装相关基因的表达,减少T4P 介导的噬菌体吸附保护铜绿假单胞菌免受噬菌体的感染,在细菌行为调节中发挥重要的作用[54]。吲哚还可以调控非吲哚产生菌的生理活动,非吲哚产生菌通过编码萘双加氧酶、P540 单加氧酶和苯酚羟化酶等加氧酶对吲哚进行转化或降解为吲哚衍生物[55]。目前,吲哚信号传导已被证实在细菌生理生化等各个方面发挥作用,其生物学功能也不断被揭示。
4 吲哚介导的生物膜调节作用
吲哚通过干扰大肠杆菌营养获取和黏附定植,减弱细菌毒力,调控BF 形成相关基因的表达及群体感应系统等途径,调控大肠杆菌的生长和BF 的形成。Wang 等[56]指出,在大肠杆菌S17-1菌株中,TnaA 缺失是抑制生物膜形成能力的主要原因,添加吲哚后,其生物膜形成能力得到恢复,证实吲哚参与调控并促进大肠杆菌生物膜的形成。Liu 等[57]实验通过利用蛋白质的细菌通讯谱表达式(CAPPEX)来分析细菌间信息交流响应方式时发现,大肠杆菌与鼠伤寒沙门氏菌竞争Trp 以增加吲哚的产生,吲哚抑制鼠伤寒沙门氏菌HilA、SipB 和SopB 等毒力因子的表达。Sun 等[58-59]研究团队报道指出,亚最低抑制浓度头孢他啶(亚MIC CAZ)抑制大肠杆菌的生物膜形成能力,可能是通过增加TnaA 基因的表达和胞外吲哚浓度来实现的。Lee 等[60]研究发现,吲哚通过与基因调控蛋白YmgB 相互作用降低大肠杆菌运动性从而抑制生物膜形成。Domka 等[61]研究报道,大肠杆菌生物膜形成调控基因YliH(BssR)和YceP(BssS)通过cAMP-CRP 介导的分解代谢抑制途径参与吲哚的调节,YliH、YceP 突变体抑制吲哚的生成,从而提高大肠杆菌运动和生物膜的形成,外源吲哚的加入使YliH、YceP 突变体大肠杆菌生物膜的形成受到抑制。
虽然目前研究者对吲哚介导BF 形成的观点表示赞同,但因研究者所研究的实验菌株、实验条件的不同和难以排除内生吲哚对实验结果的干扰,以及通过何种机制来发挥作用还是未知的,吲哚对BF 的形成起促进或是抑制作用暂无定论,还需要进一步的实验来验证。
5 小结
目前,随着全球预期寿命的增长,生物材料植入人体内以替换受损的细胞、组织及器官的需求不断增加,医药卫生领域以生物材料为中心植入感染问题愈加严峻。越来越多研究表明吲哚对于细菌生物膜的形成起着重要的调控作用,但相关机制研究仍较少,未来可能需要从以下方面进一步探索:(1)吲哚调控网络仍需进一步完善,未来将需要更多的体内体外研究来揭示和阐明吲哚调控大肠杆菌生物膜形成的具体机制;(2)吲哚及其衍生物在抗感染治疗中的应用前景及可能的不良反应;(3)吲哚信号通路可能是药物研发的重要潜在靶点。

