4D—CTA 成像对前交通动脉瘤破裂分险的相关性
徐艺铭,朱红丽,周欣颜,梁 婧
(昆明市延安医院放射科,云南 昆明 650500)
颅内动脉瘤(intracranial aneurysm,IA)在临床中是高致死、致残率的脑血管疾病,发病率约3%~7%。IA 破裂后有13%的患者在就诊前死亡,剩余超过30%的患者将出现迟发性神经功能损伤,极大程度影响患者生活质量[1];前交通动脉瘤时最常见动脉瘤约占24%,近年来影像学探索其形态学相关数据信息,但没有对前交通动脉瘤破裂的形态学参数阈值分析[2-4],同时各医疗机构对于未破裂的动脉瘤治疗各异,难以为患者提供最优治疗方案;同时随着颅内未破裂的动脉瘤(unruptured intracranial aneurysm,UIA)的检出率明显增高,这些动脉瘤将会如何发展?破裂的风险有多少?对患者及家属至关重要。本文旨在通过对前交通动脉瘤相关数值结合人工智能软件为临床在未破裂颅内动脉瘤的处理决策提供依据。
1 资料与方法
1.1 一般资料
选取2020 年6 月至2023 年3 月收治的未破裂颅内前交通动脉瘤患者50 例和破裂颅内前交通动脉瘤患者50 例,分为未破裂组和破裂组。未破裂组男性29 例,女性21 例,年龄49~71 岁,平均(61.05±3.57)岁。破裂组男24 例,女26 例,年龄50~74 岁,平均(62.30±3.47)岁。2 组间一般资料平衡良好,具有可比性(P> 0.05)。
纳入标准[5]与排除标准:(1)单发、多发颅内动脉瘤;(2)完整影像学资料且其中的信息清晰可见。排除标准:(1)有过手术史或外伤史的动脉瘤;(2)存在多发性;(3)血管痉挛严重或其它原因导致的检查困难的动脉瘤;(4)缺乏完整的临床和医疗记录。本研究经研究对象知情同意,经昆明市医学委员会批准(2023-223-01)。
1.2 研究方法
1.2.1 CTA 扫描方法采用佳能320 层CT 机。选用320 mgI/mL 碘佛醇(每瓶50 mL)或300 mgI/mL的碘海醇(100 mL/瓶)作为造影剂。主要扫描参数:电压=100 kV,管电流=100~400 mA,层厚=0.5 mm,层间距=0.3 mm,螺距=0.813∶1,先320 层螺旋CT 平扫,后经肘前静脉先以高压注射器团注60~80 mL 的碘海醇/碘佛醇,后注入20 mL 生理盐水(速率3.5~5.5 mL/s)进行增强扫描。扫描范围:C2 椎体上缘扫描至颅顶骨外板,应用连续容积扫描法,重建后图像传送至佳能工作站处理。
1.2.2 图像后处理将所获得的原始图像及减影图像传送至Start Vitrea 工作站,重建层厚0.5 mm、层间距0.4 mm,从多角度、多方位观察。(1)动脉瘤的瘤颈是指动脉瘤与载瘤动脉相交的两点间连线,瘤高是指动脉瘤底部最高处与动脉瘤颈部中点的连线,瘤颈比(AR)=瘤高/瘤颈;(2)颅内动脉瘤的大小:寻找动脉瘤的最大宽度与瘤高2个数值中的最大者;动脉瘤的最大宽度定义为垂直于瘤高的、连接动脉瘤2 侧壁的最大段长度;动脉瘤的瘤高与载瘤动脉直径比(SR)=瘤高/载瘤动脉平均直径;(3)VOR=Volume(动脉瘤体积)/Ostium Area(动脉瘤底面积)。
(1)AR、SR 和VOR 标准测量示意图,见图1。
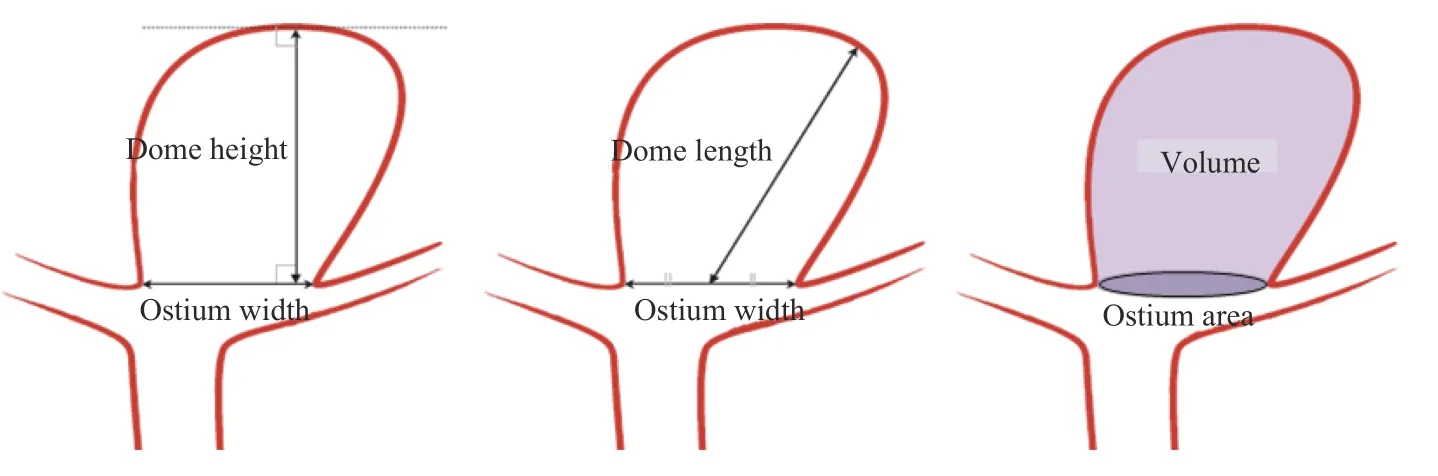
图1 AR、SR 及VOR 测量简图Fig.1 AR,SR,and VOR measurement diagrams
(2)记录CTA 形态学特征参数,包括动脉瘤大小、垂直高度、瘤颈宽度、瘤颈比(AR)、动脉瘤的瘤高与载瘤动脉直径之比(SR)等信息,见图2。
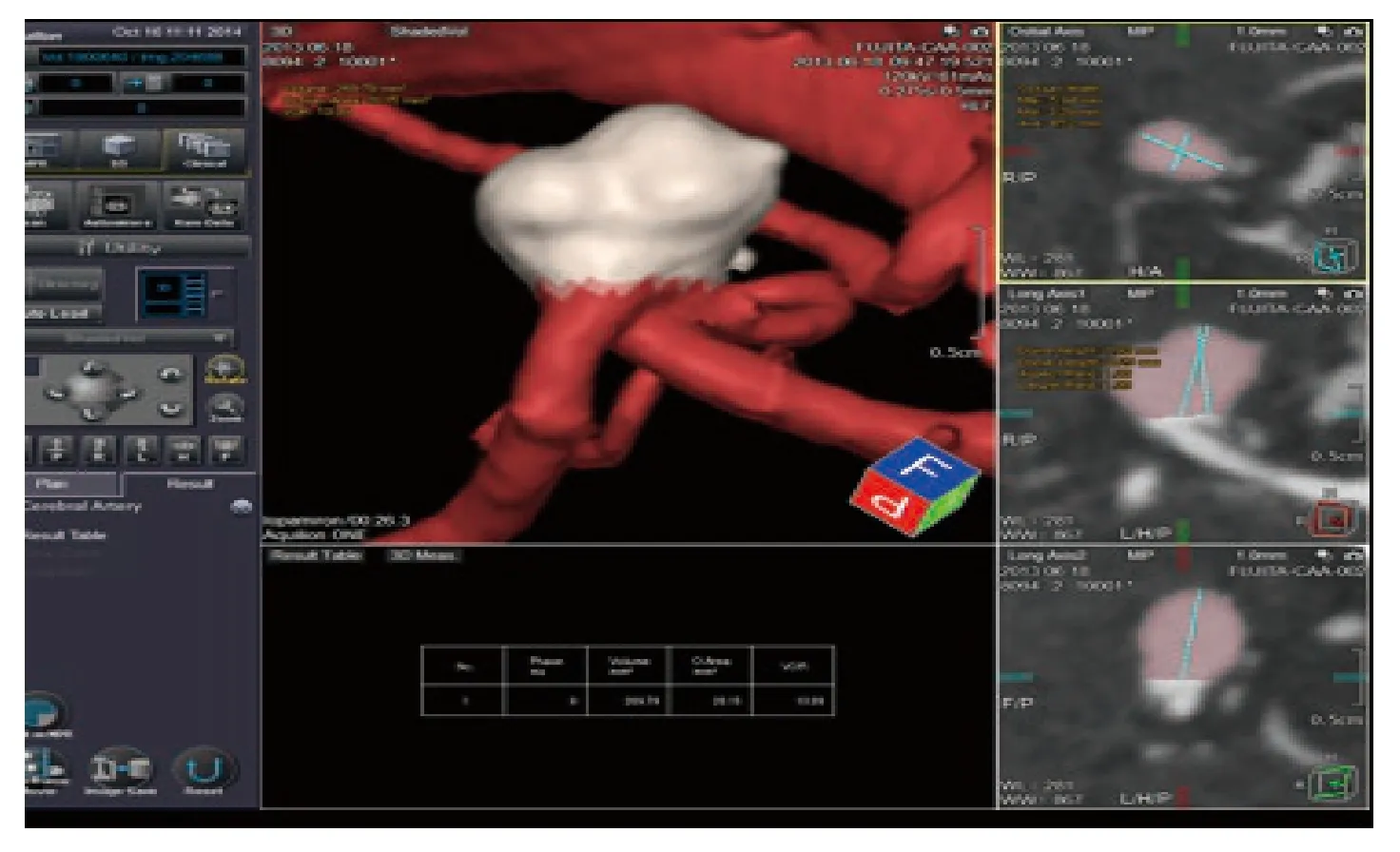
图2 AR、SR 及VOR 数值 4D 测量图示Fig.2 Diagram of 4D measurement of AR,SR,and VOR values
(3)大脑中动脉 M1 段分叉处动脉瘤四维 CT血管成像(4D-CTA),见图3。

图3 4D-CTA 成像示意图Fig.3 4D-CTA imaging schematic diagram
(4)20 幅动态图像中的5%期相图,0%~95% 代表4D-CTA 中的 20 个期相连续3 个期限可见动脉瘤瘤底出现搏动点,见图4。

图4 4D-CTA 搏动点示意图Fig.4 Schematic diagram of 4D-CTA pulsatile points
(5)基底动脉和右侧椎动脉异常搏动点,见图5。
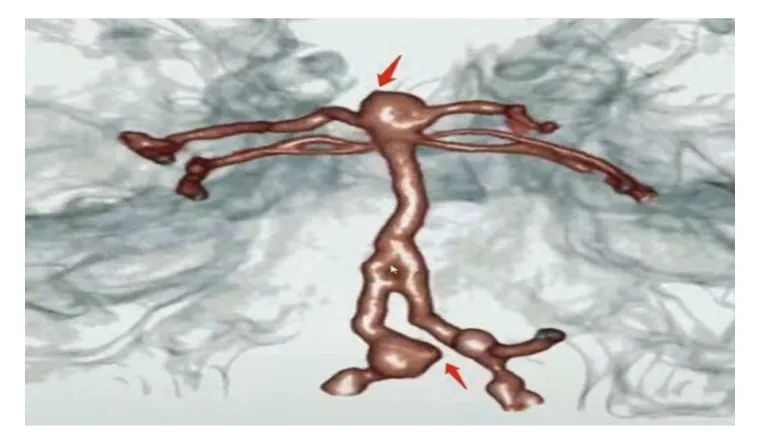
图5 颅内动脉瘤异常搏动点显示Fig.5 Display of abnormal pulsation points in intracranial aneurysms
1.2.3 预后判断及分组50 例未破裂颅内动脉瘤和50 例破裂颅内动脉瘤分别纳入未破裂组1 和破裂组1;未破裂组保守治疗1~12 月观察分为未破裂组2 和破裂组2;本次评估预后包括再破裂(经血管介入或DSA 再次证实为前交通动脉破裂)。
1.3 观察指标
(1)对比前交通支动脉瘤破裂后再破裂与未再破裂患者CTA 形态学特征参数;(2)依据患者预后情况分为(有再破裂)、预后良好组(无再破裂),未破裂组保守治疗1~12 月观察分为未破裂组2和破裂组2,测量Wn、H、AR、L、DA、SR 及VOR 数值和动脉瘤搏动点的寻找。
1.4 统计学处理
SPSS24.0 软件用于统计分析,测量动脉瘤大小、垂直高度、瘤颈宽度、AR、动脉瘤SR 及VOR 用()描述测量数据,并通过独立样本t测试进行分析,P< 0.05 认为差异具有统计学意义。
2 结果
2.1 前交通动脉瘤破裂组和非破裂组对比
破裂组瘤颈宽(Wn)、瘤颈比(AR)、瘤长(L)、动脉瘤的瘤高与载瘤动脉直径之比(SR)、动脉瘤体积/动脉瘤底面积(VOR)大于非破裂组,差异有统计学意义(P< 0.05);载瘤动脉平均直径(DA)及瘤高(H),差异无统计学意义(P> 0.05),见表1。
表1 前交通破裂组1 和非破裂组1 的4D-CTA 成像特征()Tab.1 4D-CTA imaging characteristics of ruptured group 1 and non-ruptured group 1()
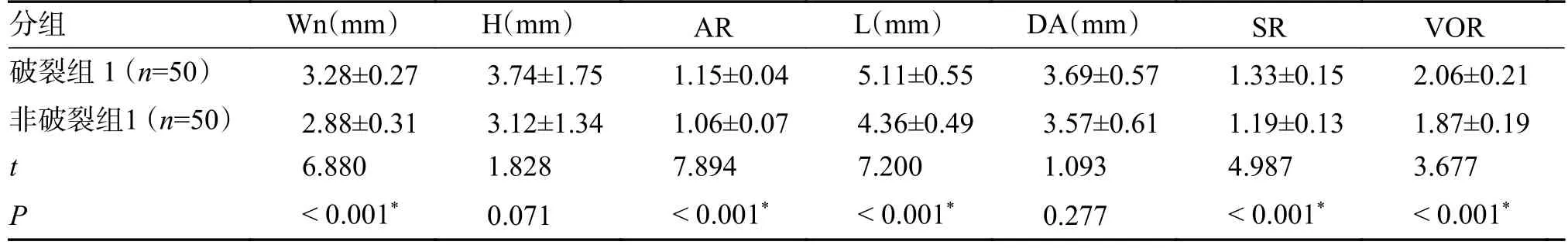
表1 前交通破裂组1 和非破裂组1 的4D-CTA 成像特征()Tab.1 4D-CTA imaging characteristics of ruptured group 1 and non-ruptured group 1()
*P < 0.05。
2.2 未破裂组动脉瘤1~12 月随访成动脉瘤像特征
随访未破裂组动脉瘤1~12 月;破裂组瘤颈宽(Wn)、瘤颈比(AR)、瘤长(L)、动脉瘤体积/动脉瘤底面积(VOR)大于非破裂组,差异有统计学意义(P< 0.05);载瘤动脉平均直径(DA)及瘤高(H)比较,差异无统计学意义(P> 0.05),见表2。
表2 未破裂组前交通动脉瘤1~12 月随访破裂组2 和非破裂组2 的4D-CTA 成像特征()Tab.2 4D-CTA imaging characteristics of ruptured group 2 and non-ruptured group 2 during 1~12 months follow-up of anterior communicating aneurysms in the unruptured group()
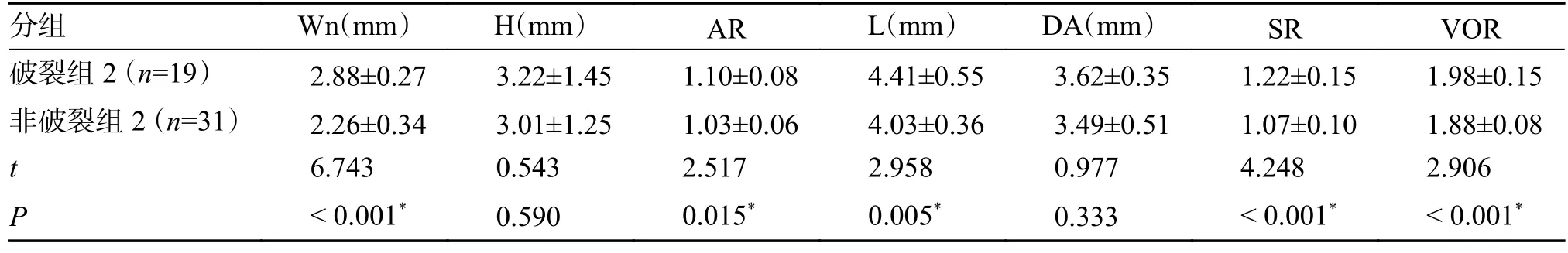
表2 未破裂组前交通动脉瘤1~12 月随访破裂组2 和非破裂组2 的4D-CTA 成像特征()Tab.2 4D-CTA imaging characteristics of ruptured group 2 and non-ruptured group 2 during 1~12 months follow-up of anterior communicating aneurysms in the unruptured group()
*P < 0.05。
2.3 4D-CTA 和 3D-CTA 辐射剂量对比
4D-CTA 中的CTDIvoI、DLP 和 ED 均低于3D-CTA 中的CTDIvoI、DLP 和 ED,差异有统计学意义(P< 0.05),见表3。
表3 非破裂组 1 的 4D-CTA 和 3D-CTA 辐射剂量()Tab.3 Radiation doses of 4D-CTA and 3D-CTA in nonruptured group 1()
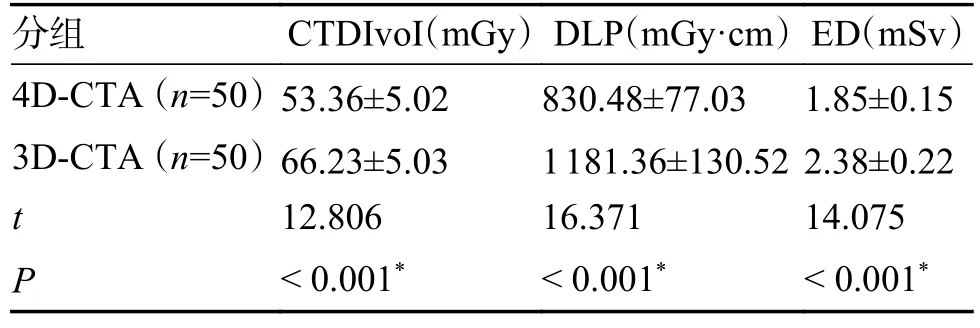
表3 非破裂组 1 的 4D-CTA 和 3D-CTA 辐射剂量()Tab.3 Radiation doses of 4D-CTA and 3D-CTA in nonruptured group 1()
*P < 0.05。
3 讨论
颅内动脉瘤破裂具有发病急和预后差的特点[6-7],未破裂的颅内动脉瘤可通过保守治疗等方式,为避免动脉瘤破裂带来的危险后果[8],分析未破裂动脉瘤的破例倾向性有着重要的临床意义,尤其是发生在前交通处动脉瘤。之前对于前交通动脉瘤的研究[9-11]不够细致,主要是对动脉瘤的瘤高、瘤长等部分因素分析,但是随着颅内动脉研究的深入,动脉瘤的外形是动态变化的,只是对一个期像的动脉瘤的部分形态分析,并不能客观和全面的反应动脉瘤的真实信息;另外由于前交通动脉瘤解剖上的复杂性使位于前交通动脉血流异常后更易发生血管壁发生变性坏死从而引起形态学的改变;4D-CTA 是一种无创血管造影技术,可快速获取脑血管解剖图像并生成三维图像,多角度观察靶血管。此外,4D-CTA 在3DCTA 的基础上增加了时间维度,可实现对心动周期不同阶段血管壁形态变化的实时观察[12]。Cui等[13]的研究表明,4D-CTA 在颅内动脉瘤的诊断有着较高的诊断效率。Cancelliere 等[14]报道,4DCTA 通过定量分析可推测颅内动脉瘤壁异常波动的最大振幅点,有助于发现潜在的破裂点;可能的原因如下:(1)通过时间参数,4D-CTA 可以生成动态图像,通过动态图像可以观察动脉瘤的动脉和早期静脉的引流方式和速度,有效评估动脉瘤的血流情况,有助于判断动脉瘤是否破裂[15]。(2)通过图像融合技术,4D-CTA 可以对动脉瘤进行伪色标记,然后将动脉瘤与血管或 CT 灌注扫描图像进行融合,通过这种方法可以直接观察到动脉瘤的大小、形态、血供等动态信息,为诊断提供数据支持[16]。(3)此外,4D-CTA 还可以通过评估颅内动脉瘤的形态变化,计算出动脉瘤壁的力学特征和分布情况,在稳定的心动周期中,全身血流动力学的变化,是由心脏收缩和舒张交替引起的,那么颅内血流的变化就会导致颅内动脉瘤壁的变化。本研究中,破裂组 1 的Wn、AR、L和 SR 均大于非破裂组 1,AR、VOR 可在一定程度上反映瘤腔内的血液流速和滞留情况,窄颈使得动脉瘤瘤内血流慢,影响内皮的代谢,从而引起内皮的衰老,这些因素都会导致动脉瘤破裂;在 Dhar 等[17]的研究中,破裂的前交通动脉瘤AR 平均值为(1.09±0.61)mm;一般认为过高AR与动脉瘤破裂显著相关对动脉瘤的发展产生不利影响,本研究测量的破裂组1 和破裂组2 数值分别为(1.15±0.04)mm、(1.10±0.08)mm,均是高于文献测量的数值,这与之前的结论一致;本次也发现破裂组的VOR 大于未破裂组,本研究测量的破裂组1 和破裂组2 数值分别为(2.06±0.21)mm、(1.98±0.15)mm,后期对未破裂动脉瘤组在12 月保守治疗的情况下进行随访发现50 例中出现19 裂破裂的动脉瘤,破裂组的VOR 依然大于未破裂组,这表明VOR 在诊断动脉瘤破裂方面具有十分重要的意义。SR 反映了动脉瘤与载瘤血管的差异;Meng 等[18]认为,当SR≥2.1 时,动脉瘤会更容易发生集中性的流入射流,从而增加动脉瘤壁上的剪切应力,进而引起动脉瘤破裂的风险。在本研究中,测量的破裂组1 和破裂组2 的数值分别在(1.33±0.15)mm、(1.22±0.15)mm 之间,但是这2 个组的SR 都没有超过2.1mm,经过分析动脉瘤的外形相对规则,导致数值接近;此外,当20 组期像中超过3 组的小凸起,被认为是异常搏动点,而这些异常搏动点的壁切应力和振荡切变指数较瘤体要低,从而增加动脉瘤的破裂几率[19-20];本组收集100 例动脉瘤中共计69 例破裂的动脉瘤,后经过手术及DSA 证实,其中共计有60 例有异常搏动点87%(60/69),18 例1 个异常搏动点30%(18/60),2 个及2 个以上搏动点51例70%(42/60),异常搏动点的出现和动脉瘤的破裂有着密切的关系后期经过DSA 验证与4D-CTA相同;分析前交通动脉瘤壁搏动点和VOR、AR和SR 等数值,将使得数据更加精准和客观并减低辐射剂量,4D-CTA 成像的CTDIvoI/mGy、DLP/mGy·cm、ED/mSv 分别为(53.36±5.02)voI/mGy、(830.48±77.03)mGy·cm、(1.85±0.15)mSv 低 于3D-CTA 成 像(66.23±5.0)voI/mGy3、(1 181.36±130.52)mGy·cm、(2.38±0.22)mSv,同时能够提供更多的信息。
本研究由于样本量不足,该研究未对患者的临床资料(吸烟、高血压、糖尿病、高血脂等)进行分析,日后将会加大样本量进一步研究影响前交通动脉瘤破裂的风险因素,为患者提供合适的治疗方案。

