奥密克戎变异株老年重症感染者细胞免疫指标对预后的价值研究
唐杰夫 ,杨德兴 ,刘圣哲 ,王 强 ,付 凯 ,王振方 ,栾 英 ,李 敏 ,刘 荣
(1)昆明医科大学第一附属医院老年ICU,云南 昆明 650032;2)云南省第一人民医院急诊内科,云南 昆明 650034)
新型冠状病毒感染(COVID-19,以下简称新冠感染)是由新型冠状病毒(SARS CoV-2,以下简称新冠病毒)感染导致的疾病,自2019 年爆发以来已在全球造成约7 亿人感染[1],对人类健康和生命安全造成巨大威胁。根据中国疾控中心报道[2],全国住院新冠重症感染者数量于2023 年1月5 日达到12.8 万,2022 年12 月至2023 年2 月国内流行的变异株均为奥密克戎变异株及其亚种,主要流行株BA.5.2.4、BF.7.14 和DY.1 占比分别为45.6%、23.8%和8.4%。研究显示[3-5],高龄、有基础疾病是新冠感染者不良预后的危险因素,60 岁以上重症感染者死亡率高达55.7%。高龄重症患者因其基础疾病的复杂、免疫系统功能不佳更容易出现宿主免疫失调,将导致继发感染、发展为危重症等不良预后。由于奥密克戎变异株传播能力和免疫逃逸能力较先前变异株有显著增强[6-8],存在二次感染和再次大规模流行导致高龄重症感染者增加的风险。但目前国内尚无关于奥密克戎变异株老年重症感染者细胞免疫学临床检查特点的报道,因此,有必要探讨奥密克戎变异株老年重症感染者免疫反应特点及其与预后的关系。
1 资料与方法
1.1 研究对象及分组
纳入标准:2022 年12 月至2023 年2 月于昆明医科大学第一附属医院老年ICU 且年龄≥60 周岁住院治疗的根据《新型冠状病毒感染诊疗方案(试行第10 版)》[9](以下简称《诊疗方案》)确诊新型冠状病毒感染者,患者呼吸道标本经过新型冠状病毒核酸检测为阳性(CT 值 < 35),入住ICU 完善12 项细胞因子、T 淋巴细胞亚群和感染相关免疫细胞检测。排除标准:(1)入院前已使用过免疫调节药物;(2)入院前已使用抗新型冠状病毒药物(如奈玛特韦片/利托那韦、莫诺拉韦或阿兹夫定等新型冠状病毒特效药)。
本研究共纳入53 例新型冠状病毒感染者。随访患者入ICU28d 预后,根据《诊疗方案》[9]将患者病情分为重型和危重型,根据ICU 28 d 预后分为存活组及死亡组。本研究为回顾性分析,按照伦理委员会政策标准,可在不泄露患者信息的前提下进行临床资料的分析和使用。
1.2 收集临床数据
收集基础信息包括:性别、年龄、合并的基础疾病、SOFA 评分、GCS 评分、APACHE-II 评分;收集一般临床检查数据包括:血常规、血气分析、肝肾功能、凝血功能;收集免疫学检查指标包括:12 项细胞因子、T 淋巴细胞亚群和感染相关免疫细胞检测;收集临床治疗措施包括:血管活性药物、糖皮质激素、免疫调节剂、机械通气和俯卧位通气的使用。SOFA 评分、GCS 评分和APACHE-II 评分采用患者入ICU 24 h 内最差值,所有实验室检查指标均采用患者入ICU 首次检查结果,记录治疗措施根据患者ICU 住院期间是否使用相应治疗记录,PEEP 值根据患者入ICU 28 d 内呼吸机参数平均值记录。
1.3 病情分级依据
根据《诊疗方案》[9]标准进行分级。
1.3.1 重型符合下列任何1 条且不能以新冠病毒感染以外其他原因解释:(1)出现气促,RR≥30 次/min;(2)静息状态下,吸空气时指氧饱和度≤93%;(3)氧合指数≤300 mmHg;(4)临床症状进行性加重,肺部影像学显示 24~48 h 内病灶进展 > 50%。
1.3.2 危重型符合以下情况之一者:(1)出现呼吸衰竭,且需要机械通气;(2)出现休克;(3)合并其他器官功能衰竭需ICU 监护治疗。
1.4 统计学处理
使用SPSS26.0 软件进行统计学分析。计量资料符合正态分布的使用均数±标准差()表示,两独立样本之间采用t检验,不符合正态分布的计量资料采用中位数(四分位数)[M(P25,P75)]进行表示,两独立样本之间采用Mann-Whitney U 检验。二分类变量,计数资料采用卡方检验或Fisher 精确概率检验。使用多因素Logistic 回归筛选影响因素并绘制ROC 曲线。以P< 0.05 为差异有统计学意义。
2 结果
2.1 患者一般资料特征
本研究共纳入53 例诊断为新型冠病毒感染的患者,其中存活组22 例、死亡组31 例;平均年龄存活组78.5 岁、死亡组77 岁;存活组男性15 例、女性7 例,死亡组男性26 例、女性5 例;重型感染者存活组8 例、死亡组2 例;危重型感染者存活组14 例、死亡组29 例;高血压患者存活组10 例、死亡组19 例;糖尿病患者存活组9 例、死亡组13 例;慢性肾病存活组0 例、死亡组2 例;冠心病患者存活组3 例、死亡组3 例;脑血管意外患者存活组1 例、死亡组6 例;慢性阻塞性肺病患者存活组0 例、死亡组3 例。所有患者均在入ICU 时记录APACHE-II 评分、SOFA评分和GCS 评分。其中存活组与死亡组病情严重程度分级、SOFA 评分和GCS 评分差异有统计学意义(P< 0.05)。死亡组危重型患者更多、SOFA评分更高、GCS 评分更低。存活组与死亡组之间在年龄、性别、基础疾病之间,差异无统计学意义(P> 0.05),见表1。
表1 2 组患者基线资料比较[M(P25,P75)/n(%)/ ]Tab.1 Comparison of baseline data between the two groups [M(P25,P75)/n(%)/ ]
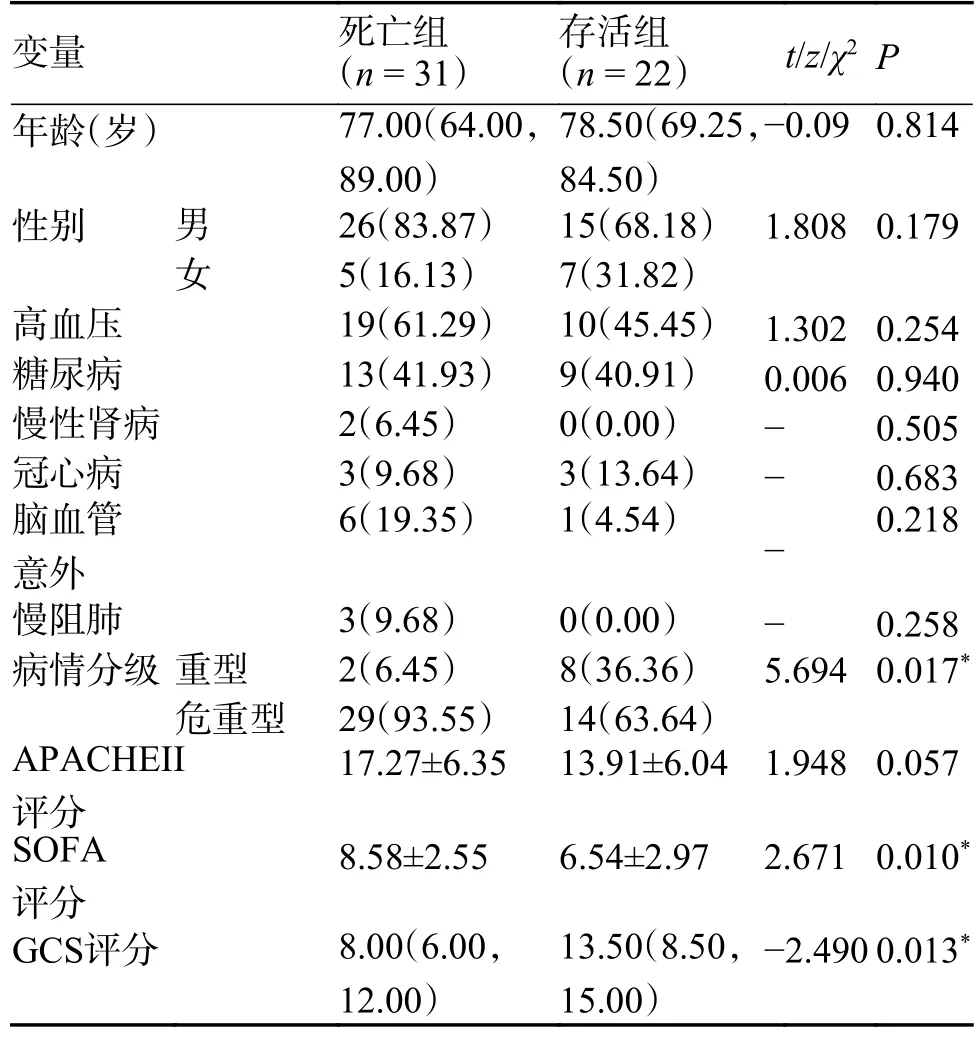
表1 2 组患者基线资料比较[M(P25,P75)/n(%)/ ]Tab.1 Comparison of baseline data between the two groups [M(P25,P75)/n(%)/ ]
APACHE-II评分:急性生理与慢性健康评分;SOFA评分:序贯器官衰竭评估评分;GCS评分:格拉斯哥昏迷评分;存活组与死亡组组间比较,*P < 0.05。
2.2 患者一般实验室检查特征
收集患者入ICU 后第1 次一般实验室检查结果,其中死亡组与存活组之间在血乳酸、pH 值、OI 值、淋巴细胞绝对值、中性粒细胞淋巴细胞比值、PCT、ALB 和BNP 之间差异有统计学意义(P<0.05)。死亡组OI 值、血常规淋巴细胞绝对值、pH 值、ALB 更低,血乳酸、中性粒细胞百分比、中性粒细胞淋巴细胞比值、PCT、BNP 更高,见表2。
表2 2 组患者一般实验室检查比较[M(P25,P75)/]Tab.2 Comparison of laboratory test results between the two groups [M(P25,P75)/ ]

表2 2 组患者一般实验室检查比较[M(P25,P75)/]Tab.2 Comparison of laboratory test results between the two groups [M(P25,P75)/ ]
OI:氧合指数;PCT:降钙素原;HS-CRP:超敏C反应蛋白;PT:凝血酶原时间;APTT:活化部分凝血活酶时间;ALT:谷丙转氨酶;AST:谷草转氨酶;ALB:白蛋白;cTnI:肌钙蛋白I;BNP:脑钠肽;存活组与死亡组组间比较,*P < 0.05。
2.3 患者12 项细胞因子检测特征
收集的53 名患者入ICU 第1 次12 项细胞因子检测分析,在死亡组及存活组之间IL-2、IL-10、IL-6 和IL-12P70 差异有统计学意义(P< 0.05)。其中死亡组IL-2、IL-10、IL-6 和IL-12P70 均高于存活组。死亡组IL-4、IL-5、IL-8 和IFN-γ低于存活组,但组间比较,差异无统计学意义(P> 0.05),见表3。
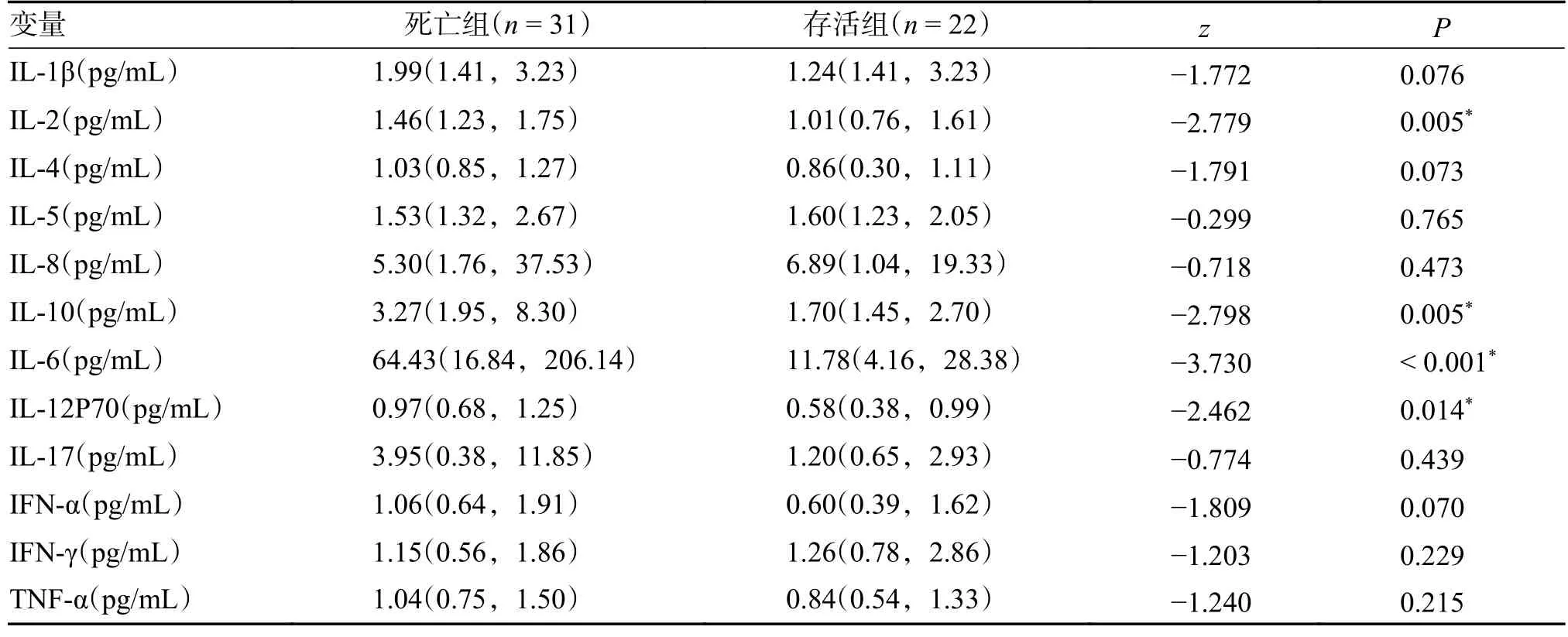
表3 2 组患者12 项细胞因子检测比较[M(P25,P75)]Tab.3 Comparison of 12 cytokines between the two groups[M(P25,P75)]
2.4 患者T 淋巴细胞亚群检测特征
收集患者T 淋巴细胞亚群数据提示,死亡组与存活组之间淋巴细胞绝对值、T 淋巴细胞绝对值、细胞毒/抑制性T 细胞绝对值和Th 辅助性T细胞绝对值,差异有统计学意义(P< 0.05)且均明显下降,见表4。
表4 2 组患者T 淋巴细胞亚群检测比较[M(P25,P75)/ ]Tab.4 Comparison of T lymphocyte subsets examination data between the two groups[M(P25,P75)/ ]
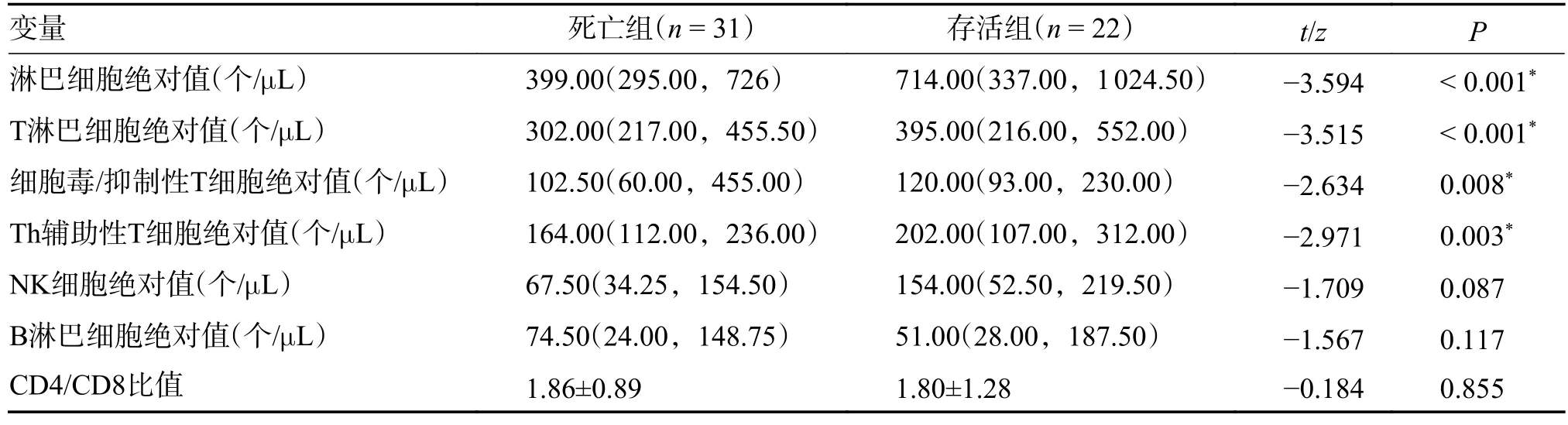
表4 2 组患者T 淋巴细胞亚群检测比较[M(P25,P75)/ ]Tab.4 Comparison of T lymphocyte subsets examination data between the two groups[M(P25,P75)/ ]
存活组与死亡组组间比较,*P < 0.05。
2.5 患者感染相关免疫细胞特征
在纳入的病例中,存活组与死亡组在CD64感染指数和HLA-DR%之间差异有统计学意义(P< 0.05)。其中死亡组的CD64 感染指数高于存活组、HLA-DR%低于存活组,见表5。
表5 2 组患者感染相关免疫细胞比较[]Tab.5 Comparison of infection-related immune cells data between the two groups[]

表5 2 组患者感染相关免疫细胞比较[]Tab.5 Comparison of infection-related immune cells data between the two groups[]
HLA-DR:人类白细胞抗原DR;Treg:调节性T淋巴细胞;存活组与死亡组组间比较,*P < 0.05。
2.6 患者治疗措施特征
所有新冠感染者均按照《诊疗方案》[9]进行治疗,在收集的患者数据中,使用血管活性药物的存活组为9 例、死亡组有30 例,使用俯卧位通气的患者,存活组10 例、死亡组6 例。上述2 种治疗方式在死亡组和存活组之间差异有统计学意义(P< 0.05)。但2 组间糖皮质激素激素、免疫调节剂、抗凝药物、机械通气的使用和PEEP 值比较,差异无统计学意义(P> 0.05),见表6。
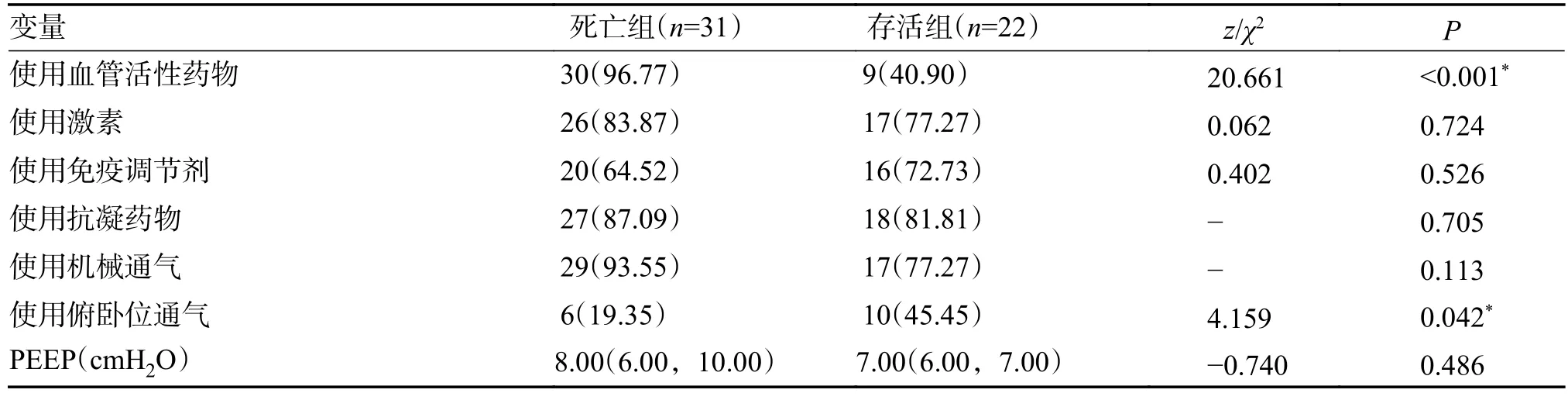
表6 2 组患者治疗措施比较[n(%),M(P25,P75)]Tab.6 Comparison of treatment measures data between the two groups[n(%),M(P25,P75)]
2.7 患者细胞免疫学指标Logistic 回归分析和ROC 曲线构建
2.7.1 多因素Logistic 回归分析通过上述临床数据分析,得出死亡组与存活组差异有统计学意义的变量,为进一步分析影响患者预后的免疫学指标高危因素,将单因素分析结果使用多因素Logistic 回归筛选影响因素,结果显示IL-6 升高和T 淋巴细胞降低是预后不良的独立危险因素,见表7。

表7 免疫指标多因素Logistic 回归分析Tab.7 The multivariate Logistic regression analysis of immune indicators
2.7.2 ROC 曲线构建使用IL-6、T 淋巴细胞绝对值和二者联合进行Logistic 回归分析所得到的值分别构建ROC 曲线,得到的曲线下面积分别为0.818、0.796 和0.887,见图1、表8。
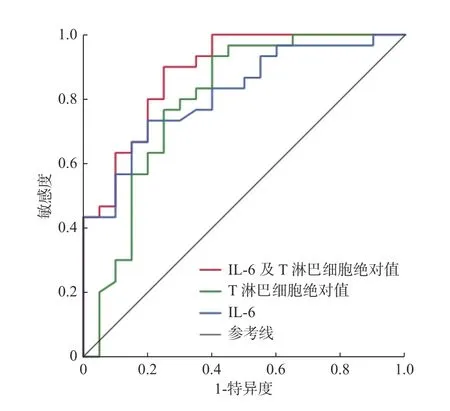
图1 IL-6、T 淋巴细胞绝对值预测奥密克戎变异株老年重症感染者28 d 预后ROC 曲线Fig.1 The ROC curves of IL-6 and absolute T lymphocyte count in prediction of 28 d prognosis of Omicron variant infected elderly severe patients

表8 IL-6、T 淋巴细胞绝对值预测奥密克戎变异株老年重症感染者28 d 预后ROC 曲线Tab.8 The ROC curves of IL-6 and absolute T lymphocyte count in prediction of 28 d prognosis of Omicron variant infected elderly severe patients
3 讨论
人体T 淋巴细胞的免疫反应在对抗病毒感染时至关重要[10],新冠感染者淋巴细胞数量下降会导致严重并发症。有研究指出[11-12],新冠感染者早期便出现T 淋巴细胞绝对值下降,并且重症患者的下降更为明显。本研究也发现,大部分奥密克戎变异株重症感染者淋巴细胞绝对值、T 淋巴细胞(CD3+T cell)绝对值、细胞毒/抑制性T 细胞(CD8+T cell)绝对值、Th 辅助T 细胞(CD4+T cell)绝对值下降,且死亡组较存活组下降更为明显。Chen 等[13]的研究也发现新冠感染者的淋巴细胞绝对值、CD4+T 淋巴细胞绝对值和CD8+T 淋巴细胞绝对值下降,并且重型/危重型病例下降较轻/中型患者更为明显,重症患者的淋巴细胞绝对值、CD4+T 淋巴细胞绝对值和CD8+T 淋巴细胞绝对值与本研究结果基本吻合。除上述淋巴细胞数值下降外,Zheng 等[14]报道发现患者的自然杀伤细胞(Natural killer cell)也呈现下降趋势,其指出由于自然杀伤细胞及CD8+T 细胞对于控制病毒感染是必要的,这两者下降与感染者疾病进展密切相关。但本研究并未发现奥密克戎感染者存活组与死亡组之间自然杀伤细胞存在明显差异。He 等[15]研究发现轻症奥密克戎变异株感染者淋巴细胞减少,而且康复时间长的感染者较康复时间短的感染者CD3+T 细胞绝对值、CD8+T 细胞绝对值、CD4+T细胞绝对值下降更明显,这也证实了淋巴细胞减少与预后相关。
新冠病毒导致人体淋巴细胞减少的原因仍有待进一步研究。已经确认新冠病毒是通过与人呼吸道黏膜细胞表面表达的血管紧张素转化酶2 受体(angiotensin-converting enzyme 2,ACE2)及跨膜丝氨酸蛋白酶2(TMPRSS2)结合进而感染人体。因此,有学说[12,16]认为新冠病毒可通过ACE2 受体直接感染人体免疫细胞并导致淋巴细胞减少。新冠感染者的淋巴细胞内可找到新冠病毒RNA,这一证据看似支持上述观点,但实际上含有新冠病毒RNA 的免疫细胞并不共表达ACE2 和TMPRSS2[17-18]。Shen 等[19]研究发现,新冠病毒感染免疫细胞并不依赖ACE2 受体,其主要感染CD4+T 细胞且能诱发明显的T 细胞死亡,因此新冠病毒可能是通过其他途径感染淋巴细胞并导致淋巴细胞下降。虽然奥密克戎毒株在免疫监视、免疫逃避及感染方式上较早前变异株有众多不同[7,20-21],但本研究证实奥密克戎毒株感染者的淋巴细胞绝对值也出现下降,且依旧以T 淋巴细胞下降为主。因此,有必要进一步研究新冠病毒、特别是奥密克戎变异株导致淋巴细胞减少的原因。
许多研究表明CD64 感染指数是1 种有效判断感染状况的生物标志物[22-23],它可以帮助早期诊断脓毒血症,并有助于区分细菌/病毒感染,本研究发现新冠感染者存活组与死亡组之间CD64差异有统计学意义且死亡组升高更明显。有研究[24]指出在新冠重症感染者中CD64 意味更严重的病情和不良预后,这一结论与本研究得出的结果相似。人类白细胞抗原-DR(HLA-DR)可反应人体免疫系统情况,在脓毒症患者中,HLADR%下降可反应机体免疫系统抑制,目前研究认为HLA-DR%可以帮助判断患者继发感染和临床预后[25-28]。本研究发现,奥密克戎变异株重症感染者的预后情况与HLA-DR%下降有关,死亡组HLA-DR%明显低于存活组,这项结果与国外1项研究一致[25],HLA-DR 可以作为新冠重症感染者预后的早期标志物之一。
炎症因子释放综合症(cytokine release syndrome,CRS)是新冠感染者病情危重的一大表现[29],新冠病毒感染导致的炎症因子释放引发了免疫系统过度激活,容易引发急性呼吸窘迫综合征和多器官功能衰竭,最终导致患者死亡。本研究发现,奥密克戎毒株重症感染者IL-2、IL-6、IL-10 和IL-12P70 在死亡组和存活组之间存在差异,其中死亡组指标IL-6 升高明显,这一结果与其他研究相似[15,30]。其中IL-6 在CRS 病理生理学中起关键作用,IL-6 可导致许多CRS 的关键症状,例如诱发弥漫性血管内凝血(disseminated intravascular coagulation,DIC)[31]。有研究提示IL-6 升高与新冠感染者预后不良相关[32-34],与存活组比较,死亡组的IL-6 水平明显升高,且IL-6 升高是死亡的预测因素[33]。由于IL-6 升高与不良预后相关,对于重症患者可尝试使用IL-6 抑制剂,如托珠单抗以改善患者病情[9,35]。
最后本研究使用多因素Logistic 分析筛选变量,得出IL-6 升高和T 淋巴细胞亚群降低为奥密克戎变异株老年重症感染者预后的独立危险因素。由上述2 项指标分别建立ROC 曲线,IL-6 曲线下面积为0.818,T 淋巴细胞绝对值曲线下面积为0.796,二者联合后曲线下面积为0.887。IL-6和T 淋巴细胞绝对值对判断患者病情、了解预后情况和指导治疗有重要意义。
综上所述,本研究发现奥密克戎变异株可导致重症感染者出现淋巴细胞减少症,并可诱发机体炎症因子释放综合症,早期使用免疫调节剂调节免疫系统功能、减少炎性因子对机体破坏可以帮助降低患者死亡率。本研究还支持使用俯卧位通气帮助重症患者康复,俯卧位通气是新冠病毒重症感染者预后的保护因素,建议遵循《诊疗方案》[9]为合适的患者实施俯卧位通气。同时,本研究纳入了12 项细胞因子、T 淋巴细胞亚群和感染相关免疫细胞检测,其中除已被广泛研究的T淋巴细胞绝对值、IL2、IL-6 外,还包含CD64 感染指数、HLA-DR%等检查,对帮助临床早期判断患者预后提供了新思路。本研究纳入的患者均为奥密克戎变异株重症感染者,目前国内尚无关于奥密克戎变异株感染者免疫学特点的类似研究。

