清肾颗粒含药血清通过miR-23b-5p 靶向Nrf2 通路减轻NRK-52E细胞转分化
刘 敏,金 华,呼 琴,陈 诺,张叶青,王亿平
1安徽中医药大学第一临床医学院,安徽 合肥 230000;2安徽中医药大学第一附属医院肾病科,安徽 合肥 230000;3合肥综合性国家科学中心大健康研究院,新安医学与中医药现代化研究所,安徽 合肥230000
慢性肾脏病(CKD)是全球日益严重的公共卫生问题,发病率在逐年增加。肾纤维化被认为是所有慢性肾脏病病例最终常见的病理途径[1]。肾小管上皮细胞向肌成纤维细胞的上皮-间充质转化(EMT)则是造成肾纤维化的关键因素。有实验表明,miR-23b不仅在肝纤维化、肺纤维化中发挥重要作用[2,3],其在肾纤维化中也发挥着重要作用,有研究表明miR-23b-3p可通过靶向降低浆细胞瘤可变易位基因1(PVT1)的表达,抑制糖尿病肾病和高糖诱导的肾小球系膜细胞模型中系膜细胞的增殖和纤维化[4];也有研究表明,miR-23b-3p的缺失可诱导IgA肾病[5];但这些研究并没有进一步验证miR-23b是如何参与肾纤维化的发生发展,其调节肾纤维化的具体通路是什么。Nrf2在炎症、氧化和代谢应激因子的条件下可以迅速被激活,因此Nrf2信号通路是体内一条极为重要的抗氧化应激通路[6],它直接参与肾纤维化发生、发展和预防的进程。已有研究证实,Nrf2是miR-23b潜在的下游靶基因[7]。因此,Nrf2抗氧化通路可能是miR-23b调节肾纤维化的通路之一。
前期研究表明,中药复方清肾颗粒可通过干预单侧输尿管梗阻大鼠肾脏组织及高糖诱导的HK-2 细胞内的氧化应激和炎症反应来减轻肾小管损伤及EMT的进程[8],以及清肾颗粒还可通过抑制氧化应激NF/kB信号通路来改善肾小管EMT[9]。因此清肾颗粒能够通过抗氧化机制延缓肾小管EMT 进程。本研究实验选择TGF-β1作为刺激因子,观察NRK-52E细胞在转分化过程中miR-23b是否对Nrf2通路靶向调节,并阐明清肾颗粒含药血清减轻NRK-52E细胞转分化的机制。本研究证明清肾颗粒含药血清能通过miR-23b-5p靶向Nrf2通路机制减轻NRK-52E细胞转分化,为中医药防治慢性肾脏病提供新的思路,具有鲜明的中医特色和创新性。
1 材料和方法
1.1 实验动物和细胞
实验动物:SPF级雄性SD大鼠20只,2月龄,体质量200±20 g,购自江苏华创信诺医药科技有限公司,许可证号SCXK(苏)2020-0009。动物研究已获安徽中医药大学伦理委员会审批(伦理批号AHUCM-rats-2022071)。
实验细胞:正常大鼠近端肾小管上皮细胞株(NRK-52E),人胚胎肾细胞(HEK-293T)(赛百慷(上海)生物技术股份有限公司)。
1.2 药物
清肾颗粒由茵陈、丹参、大黄、白花蛇舌草、白术、猪苓、茯苓、白蔻仁、扁豆、薏苡仁、泽泻、黄连、益母草、车前草组成。生药材由安徽省中医院的中药房统一采购,并且有中药质控及固定产地。清肾颗粒生产于安徽省中医院制剂中心,皖药制字BZ20080011,批号20210215,规格为10 g/袋,约含生药34 g。
1.3 试剂
重组人TGF-β1细胞因子(PeproTech);CCK8检测试剂盒(BIOSS);DMEM(cytiva);PBS(Hyclone);Trizol(Life technogies);Novostart SYBR qPCR SuperMix Plus(荧光染料)(novoprotein);PrimeScript™RT reagent Kit with gDNA Eraser(反转录试剂盒)(TaKaRa);引物合成(SangonBiotech);RIPA细胞裂解液(强)(Beyotime);PVDF膜(Millipore);Western一抗二抗去除液(Beyotime);ECL 超敏发光试剂盒(Thermo);山羊抗小鼠IgG(Zsbio);山羊抗兔IgG(Zsbio);GAPDH(Zsbio);Nrf2(SantaCruz);Keap1(bioss);α-SMA(bioss)。
1.4 仪器
倒置显微镜(OLYMPUS);培养箱(Thermo);超净工作台(苏州佳宝净化工程设备有限公司);普通PCR仪(杭州晶格科学仪器有限公司);低速迷你离心机(海门市其林贝尔仪器制造有限公司);高速台冷冻离心机(安徽嘉文仪器装备有限公司);荧光定量PCR 仪(Thermo Scientific);PIKO Plate Illuminator(Thermo Scientific);超微量分光光度计(南京五义科技有限公司);自动曝光仪(上海培清科技有限公司)。
1.5 含药血清的制备
将大鼠随机分为药物组和空白组,10只/组。药物组大鼠给予清肾颗粒20 g/(kg·d)灌胃,连续给药10 d后处死动物,腹主动脉无菌采血,常温静置2 h后,离心后并得到含药血清,混匀后过滤除菌,56 ℃,30 min水浴灭活,置-20 ℃保存备用。空白组动物给予等量生理盐水灌胃,并如上法制备大鼠空白血清。
1.6 含药血清和TGF-β1作用于NRK-52E细胞的刺激浓度和时间筛选
将NRK-52E 细胞株置于DMEM/F12 培养液中(DMEM与F12的比例为1∶1,培养液中含有青、链霉素各100 U/mL,10%FBS),在无菌培养箱中进行培养;将细胞形态良好的NRK-52E传代在6孔板中,待细胞生长到融合度约50%时,将培养液更换为无血清的培养基继续培养24 h。胰酶消化NRK-52E细胞,终止消化后离心弃去培养液,用胎牛血清(FBS)洗1~2遍,用培养基重悬,调整细胞浓度,按照每孔5×104个细胞数铺板到96孔板中。细胞贴壁后加入适量的TGF-β1,根据TGF-β1刺激浓度分为6 组(TGF-β1 浓度分别为0、5、7.5、10、12.5、15 ng/mL),放入培养箱中继续培养。分别在培养到0、24、48和72 h时取出。细胞增殖毒性检测法(CCK8法)检测细胞活性:在96孔板中每孔加入10 μL CCK8进行检测,37 ℃孵育4 h,用酶联免疫检测仪测定在450 nm处的吸光度(A)值并计算细胞活性。
另取NRK-52E细胞,方法同上,待细胞贴壁后用TGF-β1(10 ng/mL)刺激,放入培养箱中培养24 h后,根据加入清肾颗粒含药血清的浓度不同分为5组(分别更换为正常含药血清、5%含药血清、10%含药血清、20%含药血清、30%含药血清的培养基)。边缘孔加PBS缓冲液,分别在培养0、24、48和72 h时取出,在96孔板中每孔加入10 μL CCK8进行检测细胞活性。根据上述实验筛选出清肾颗粒含药血清、TGF-β1刺激的最佳浓度和时间,再进行后续试验。
1.7 细胞转染实验
NRK-52E细胞用DMEM/F12培养基在37 ℃、5%CO2的加湿培养箱中常规培养,用0.25%的胰蛋白酶消化,传代接种到6孔培养板,细胞贴壁后用TGF-β1刺激,待细胞生长融合至70%~90%时,按照Lipofectamine2000 转染试剂盒说明书进行转染处理,将miR-23b-5p mimic、inhibitor以及阴性对照(NC)siRNA分别转染到NRK-52E细胞,分为:模拟物空载对照组(TGF-β1+miR-23b-5p mimic-NC);miR-23b-5p模拟物组(TGF-β1+miR-23b-5p mimic);抑制剂空载对照组(TGF-β1+miR-23b-5p inhibitor-NC);miR-23b-5p抑制剂组(TGF-β1+miR-23b-5p inhibitor)。
1.8 清肾颗粒含药血清干预实验及回复实验
将清肾颗粒含药血清作用于NRK-52E细胞(TGFβ1刺激),并转染miR-23b-5p mimic,分组为:①正常组:NRK-52E+无血清DMEM培养基;②TGF-β1组(模型组):DMEM 培养基+10 ng/mL TGF-β1;③清肾颗粒组:DMEM 培养基+10 ng/mL TGF-β1+20%清肾颗粒含药血清;④miR-23b-mimic-NC组:DMEM 培养基+10 ng/mL TGF-β1+miR-23b-mimic-NC;⑤miR-23bmimic组:DMEM培养基+10 ng/mL TGF-β1+miR-23bmimic;⑥miR-23b-mimic+清肾颗粒组:DMEM 培养基+10 ng/mL TGF-β1+miR-23b-mimic+20%清肾颗粒含药血清。
1.9 检测方法
1.9.1 Western blot法检测NRK-52E细胞中Nrf2通路分子(Keap1、Nrf2)、α-SMA蛋白表达 收集各组细胞,用RIPA裂解液提取总蛋白并测量蛋白浓度。分离总蛋白,电泳并转膜。封闭2 h,TBST洗膜,加入一抗孵育,4 ℃过夜,然后加入二抗孵育1 h后洗膜。使用ECL发光试剂盒来检测蛋白。使用ImageJ 软件以目标蛋白与内参照GAPDH 的灰度值比值做统计分析。
1.9.2 RT-qPCR 法检测NRK-52E 细胞 中miR-23b、Keap1、Nrf2、α-SMA mRNA的表达 使用Trizol试剂从NRK-52E细胞中提取各组细胞总RNA,按microRNA逆转录试剂盒逆转录成cDNA。以cDNA 为扩增模板进行RT-qPCR 扩增,qPCR反应总体系为10 μL,应条件为:95 ℃1 min;95 ℃20 s,60 ℃1 min,40个循环。以U6为内参,2-ΔΔCt方法分析miR-23b、Keap1、Nrf2、α-SMA的相对表达水平。引物序列见表1。
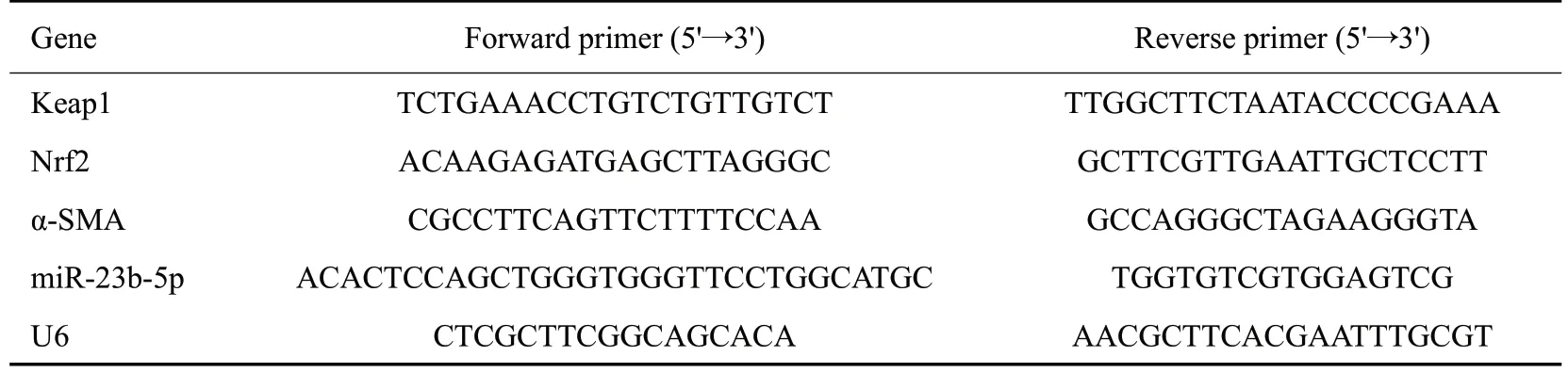
表1 检测指标的引物序列Tab.1 Primer sequence used for RT-qPCR
1.9.3 双荧光素酶报告基因实验检测miR-23b-5p 与Nrf2 的靶向关系 将Nrf2 的3'UTR 全长克隆到pmirGLO载体中,命名为野生型Nrf2(Nrf2-WT),同时将Nrf2突变体克隆到pmirGLO载体中获得Nrf2-MUT报告载体。随后将293T细胞以1×105/孔的密度接种在24 孔板中,并通过lipofectamine 2000 将报告载体和miR-23b-5p mimics或miRNA阴性对照miR-NC共转染入293T细胞。转染48 h后,收集各组细胞通过荧光素酶报告试验系统测定荧光素酶活性。
1.10 统计学分析
所有数据均采用SPSS 26.0软件进行统计分析,计量资料均符合正态分布,以均数±标准差表示。若方差齐,组间比较采用t检验;若方差不齐,则采用非参数检验。P<0.05 认为差异有统计学意义。
2 结果
2.1 CCK8法测定NRK-52E细胞活性
2.1.1 TGF-β1诱导NRK-52E细胞转分化的时间及浓度筛选 不同浓度TGF-β1 刺激NRK-52 细胞24 h,与NRK-52E组比较,A值差异具有统计学意义(P<0.05),TGF-β1浓度为10 ng/mL时,与TGF-β1浓度为7.5 ng/mL及5 ng/mL相比差异有统计学意义(P<0.05),与TGF-β1浓度为12.5 ng/mL及15 ng/mL相比,差异无统计学意义(P>0.05),故选择TGF-β1刺激NRK-52细胞的最佳浓度为10 ng/mL,时间为24 h(表2)。

表2 各组细胞不同时间段A值比较Tab.2 Comparison of absorbance values of TGF-β1-treated cells at different time points(Mean±SD,n=3)
2.1.2 清肾颗粒含药血清作用浓度和时间的筛选 不同浓度清肾颗粒含药血清作用时间为24 h 时,与正常含药血清组相比,清肾颗粒含药血清各组均明显减少(P<0.05)。随着浓度升高,20%含药血清组A值下降最显著,其与5%、10%含药血清组相比,差异均有统计学意义(P<0.05),与30%含药血清组差异无统计学意义(P>0.05,表3)。故选择清肾颗粒含药血清作用NRK-52细胞的最佳浓度为20%,时间为24 h。
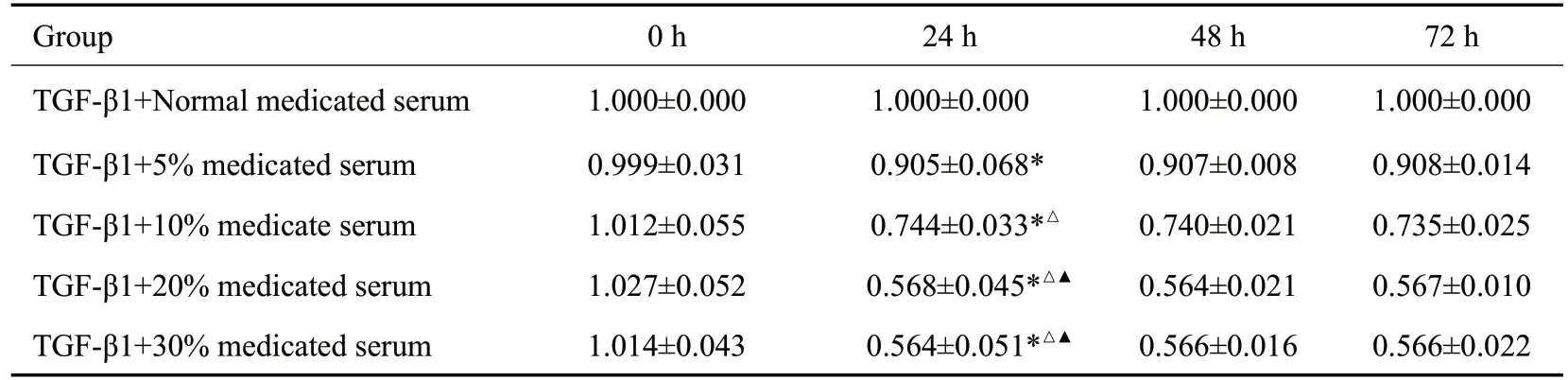
表3 各组细胞不同时间段A值比较Tab.3 Comparison of absorbance values of the cells treated with TGF-β1 and the medicated serum at different dilutions(Mean±SD,n=3)
2.2 NRK-52E细胞中miR-23b-5p对Nrf2 mRNA相对表达量的影响
分别将miR-23b-5p mimic、inhibitor转染到NRK-52E细胞后发现,miR-23b-5p模拟物组的miR-23b-5p、Nrf2 mRNA 的相对表达量高于模拟物空载对照组(P<0.05);miR-23b-5p 抑制剂组的miR-23b-5p、Nrf2 mRNA的相对表达量低于抑制剂空载对照组(P<0.05,表4、图1)。

图1 NRK-52E细胞中miR-23b-5p对NRF2 mRNA的影响Fig.1 Effect of miR-23b-5p on NRF2 mRNA in NRK-52E cells.A:Relative expression of miR-23b-5p mRNAin NRK-52E cells.B:Relative expression of Nrf2 mRNAin NRK-52E cells.**P<0.05;##P<0.05.
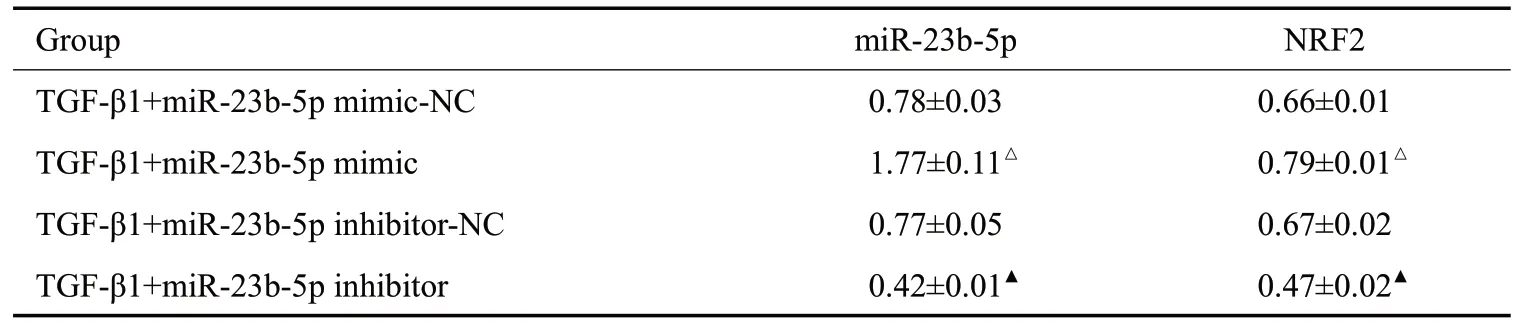
表4 NRK-52E细胞中miR-23b-5p对Nrf2 mRNA的影响Tab.4 Effect of miR-23b-5p on Nrf2 mRNAin NRK-52E cells(Mean±SD,n=5)
2.3 双荧光素酶报告基因实验检测miR-23b-5p与Nrf2的靶向关系
Rno-miR-23b-5p与Rno-Nrf2之间存在互补结合位点(图2A);双荧光素酶报告系统检测结果显示(图2B),NC mimics+Rno-Nrf2-wt 组、Rno-miR-23b-5p+Rno-Nrf2-wt 组、NC mimics+Rno-Nrf2-mu 组、RnomiR-23b-5p+Rno-Nrf2-mu组的荧光素酶相对活性分别为1.000±0.024、0.581±0.048、1.000±0.030、0.968±0.024。与NC mimics+Rno-Nrf2-wt组相比,Rno-miR-23b-5p+Rno-Nrf2-wt组的相对荧光素酶活性降低(P<0.05);而当Nrf2 基因3'UTR 的潜在结合位点发生点突变后,与NC mimics+Rno-Nrf2-mu组相比,Rno-miR-23b-5p+Rno-Nrf2-mu组的相对荧光素酶活性差异没有显著变化(P>0.05,图2)。

图2 Rno-miR-23b-5p和Rno-Nrf2靶位点结合示意图(A)及双荧光素酶报告基因检测二者之间的相互作用(B)Fig.2 Rno-miR-23b-5p and Rno-Nrf2 target site binding (A)and interaction between Rno-miR-23b-5p and Rno-Nrf2 analyzed by dual luciferase reporter gene assay(B).***P<0.05.
2.4 清肾颗粒含药血清对NRK-52E细胞转分化的干预作用
2.4.1 Western blot法检测NRK-52E细胞中Nrf2通路分子(Keap1、Nrf2)、α-SMA 蛋白表达 与正常组比较,TGF-β1组细胞Nrf2表达降低,Keap1和α-SMA表达升高(P<0.05)。与TGF-β1组比较,清肾颗粒组、miR-23bmimic组Nrf2表达均升高,Keap1和α-SMA表达均降低(P<0.05)。与miR-23b-mimic-NC 组比较,miR-23bmimic组Nrf2表达升高,Keap1和α-SMA表达降低(P<0.05)。与miR-23b-mimic组比较,miR-23b-mimic+清肾颗粒组Nrf2表达升高,Keap1和α-SMA表达均降低(P<0.05,表5、图3)。
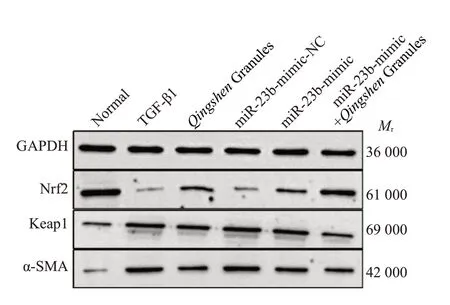
图3 各组细胞Nrf2、Keap1、α-SMA蛋白表达情况比较Fig.3 Comparison of Nrf2,Keap1 and α-SMA protein expression among the group detected by Western blotting.
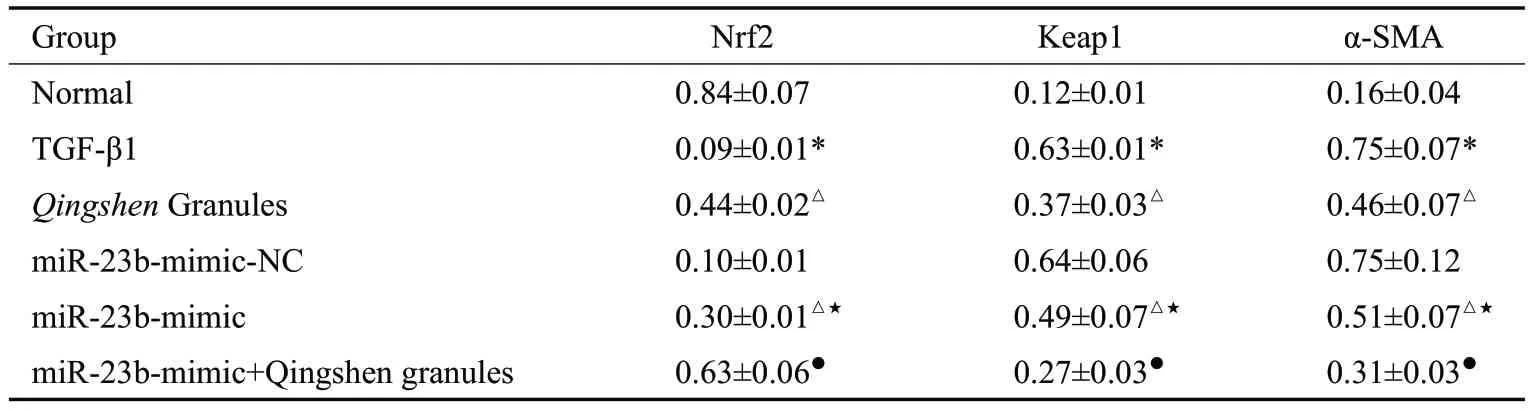
表5 NRK-52E细胞中Nrf2、Keap1、α-SMA蛋白表达比较Tab.5 Comparison of Nrf2,Keap1 and α-SMAprotein expression in NRK-52E cells(Mean±SD,n=3)
2.4.2 RT-qPCR 法 检测NRK-52E 细胞中miR-23b、Keap1、Nrf2、α-SMA mRNA 的表达 与正常组比较,TGF-β1 组miR-23b-5p、Nrf2 mRNA 表达量降低,Keap1、α-SMA mRNA表达量升高(P<0.05)。与TGF-β 1组比较,清肾颗粒组、miR-23b-mimic组miR-23b-5p、Nrf2 表达量均升高,Keap1、α-SMA 表达均水平降低(P<0.05)。与miR-23b-mimic-NC 组比较,miR-23bmimic组miR-23b-5p、Nrf2表达量升高,Keap1、α-SMA表达量降低(P<0.05)。与miR-23b-mimic比较,miR-23b-mimic+清肾颗粒组miR-23b-5p、Nrf2表达量明显升高,Keap1、α-SMA表达量降低(P<0.05,表6)。
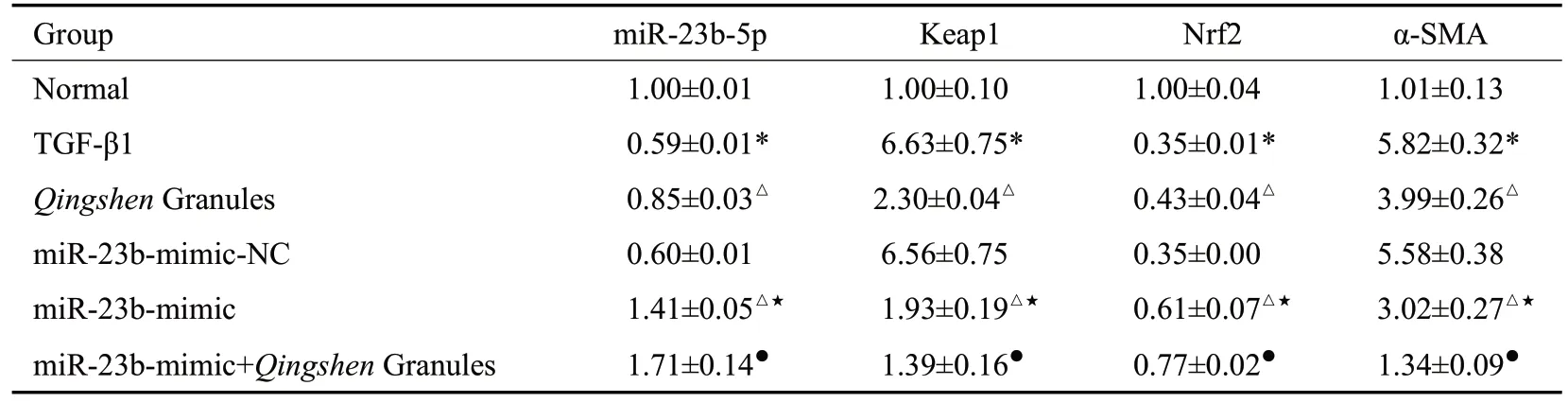
表6 NRK-52E细胞miR-23b-5p、Keap1、Nrf2、α-SMAmRNA表达比较Tab.6 Comparison of miR-23b-5p,Keap1,Nrf2 and α-SMAmRNAexpressions in NRK-52E cells(Mean±SD,n=6)
2.4.3 流式细胞术检测ROS 与正常组比较,TGF-β1组中ROS荧光强度升高(P<0.05)。与TGF-β1组比较,清肾颗粒组、miR-23b-mimic 组ROS 荧光强度均降低(P<0.05)。与miR-23b-mimic-NC 组比较,miR-23bmimic 组ROS 荧光强度降低(P<0.05)。与miR-23bmimic比较,miR-23b-mimic+清肾颗粒组ROS荧光强度降低(P<0.05,表7)。

表7 NRK-52E细胞中ROS平均荧光强度比较Tab.7 Comparison of mean fluorescence intensity of ROS in NRK-52E cells (Mean±SD,n=3)
3 讨论
转化生长因子β1(TGF-β1)通常被认为是肾纤维化的主要调节因子,因为在肾脏损伤后,受损的肾小管上皮细胞(TEC)在G2/M期停滞并分泌大量TGF-β1,触发邻近肾成纤维细胞的活化和转化为肌成纤维细胞[9]。因此其已被广泛应用于肾纤维化研究中的NRK-52E细胞的转分化[10]。本研究以此为基础建立NRK-52E细胞的转分化模型。
miRNA作为一种短链非编码小分子RNA,能够通过在转录后水平上完全或部分结合靶蛋白编码的mRNAs进行降解或翻译抑制,调节蛋白质表达[11]。近年来研究发现,miRNAs参与肾纤维化的调节过程,成为干预肾脏纤维化治疗的新靶点。研究发现miR-23b在高糖处理的HK-2(人肾皮质近曲小管上皮细胞)和DN(糖尿病肾病)小鼠肾组织中水平显著降低,miR-23b被确定为糖尿病肾病中上皮-间质转化的抑制因子[12]。有研究确认糖尿病患者的外周血和1型或2型糖尿病动物的肾脏中miR-23b 的水平低于非糖尿病患者,且miR-23b的过度表达可减轻DN小鼠的高白蛋白尿和肾纤维化[13]。本课题组在前期研究中已通过网络药理学及尿外泌体Small RNA测序技术,筛选出慢性肾衰竭患者体内97个差异miRNA(包含84个上调miRNA和13个下调miRNA),其中miR-23b-5p在慢性肾衰竭患者体内的表达是显著下调的[14]。因此miR-23b-5p参与肾纤维化的发生发展已被证实,且其在肾纤维化中的表达显著下调。已有实验证明,氧化应激是肾纤维化发生发展的关键环节,抑制氧化应激可延缓肾纤维化的进程[15-17]。氧化应激可直接或间接地引起肾皮质固有免疫细胞活化及周围组织、血管中大量炎症细胞的浸润[18],大量的炎症细胞浸润可引起肾皮质缺氧加重,进而促使肾间质纤维化的形成。而Nrf2是氧化应激反应中的关键蛋白,其可以通过抑制肾脏中氧化应激从而起到对抗肾纤维化的作用[19,20]。在氧化应激环境中,Nrf2与其主要抑制剂Keap1从细胞质中分离并向核内迁移,激活许多保护基因(如血红素加氧酶-1、对氧磷酶(PON)-1等)的转录,进而起到抵御氧化应激的作用[21]。而本实验研究发现,miR-23b-5p过表达时,Nrf2 mRNA表达显著升高,而miR-23b-5p表达沉默时,Nrf2 mRNA表达显著降低。此表明Nrf2抗氧化通路极可能是miR-23b-5p参与肾纤维化进展的靶向调节通路。进一步研究发现,在双荧光素酶报告基因实验中,miR-23b-5p能与Nrf2基因3'UTR结合,此说明Nrf2基因为miR-23b-5p的下游基因。因此miR-23b-5p在肾纤维化中的调节通路为Nrf2抗氧化通路。
本课题组团队立足于“热能化湿、燥湿为本、化湿攻下、化瘀通络”等新安医学理论基础,研究出慢性肾脏病的基本病机为“湿热伤肾、湿热与瘀交结”,清肾颗粒由茵陈、丹参、大黄、白花蛇舌草、白术、猪苓、茯苓、白蔻仁、扁豆、薏苡仁、泽泻、黄连、益母草、车前草组成,全方共奏清热化湿,祛瘀泄浊之功。本课题组进一步采用超高效液相色谱-混合四极杆轨道质谱(UPLC-Q-orbitrap HRMS)法鉴定出清肾颗粒的42种化合物,在心脏、肝脏、脾脏、肺脏和肾脏组织中检测到清肾颗粒的9、10、11、10和18个原型组分,这些化合物主要包括黄芩苷、大豆苷元、染料木素、芹菜素、黄连素、邻苯二酚、龙胆酸、D-(+)-色氨酸、核黄素等[22]。其中黄连素、芹菜素、黄芩苷、染料木素等均有有抗肾脏纤维化、抑制EMT作用[23-26]。
通过多中心、随机对照临床试验证实清肾颗粒能够有效改善CKD湿热证患者的临床症状、提高生活质量、延缓肾衰竭进展[27];有效改善肾性贫血、营养不良、钙磷代谢紊乱、胃肠功能紊乱等CKD并发症[28];且安全性良好[29]。前期研究也发现,清肾颗粒在抗肾纤维化中具有多环节、多靶点、多途径作用特点[30-32]。本实验研究发现,清肾颗粒含药血清可以升高miR-23b mRNA的表达,以及升高Nrf2 mRNA及蛋白的表达,降低Keap1及α-SMA mRNA及蛋白的表达,以及降低细胞内ROS的含量。其中Keap1是可以控制Nrf2的激活和稳定性[33],二者为相互抑制状态,在氧化应激状态下,Keap1失活,Nrf2表达增多,进而起到抗氧化作用。EMT被定义为上皮细胞标志物(如E-cadherin)的大量丢失、间充质标志物(α-SMA)的获取、肾小管基底膜的破坏,以及成纤维细胞侵入伴随着前纤维化分子的产生[34]。因此本研究通过α-SMA mRNA和蛋白以及ROS的显著降低证实清肾颗粒抑制了NRK-52E 细胞的转分化,通过Keap1的显著降低和Nrf2的显著升高证实清肾颗粒可激活Nrf2抗氧化通路,通过miR-23b mRNA的显著升高证实清肾颗粒可上调miR-23b的表达。综合以上,本实验证明了清肾颗粒含药血清可以通过上调miR-23b-5p,激活Nrf2抗氧化通路,进而抑制肾小管上皮细胞EMT进程,减慢肾间质纤维化进程。
综上所述,本实验通过细胞转染及双荧光素酶报告基因实验证实了miR-23-5p可通过靶向调节Nrf2通路活性进而抑制NRK-52E细胞转分化;以及清肾颗粒含药血清可以通过上调miR-23b-5p的表达,激活Nrf2抗氧化通路,进而减轻肾小管EMT进程。本实验说明了miR-23b-5p在肾纤维化中的具体调节通路,为清肾颗粒临床治疗慢性肾脏病患者提供新的理论依据,再次表明了清肾颗粒在抗肾纤维化方面多环节、多靶点、多途径的作用特点,并为中医药防治肾脏病提供新的思路和方向。

