六味地黄丸减轻绝经后骨质疏松症及疲劳的作用机制:基于抑制表观调控分子BRD4通路
阮红良,佘冬梅,孙绍裘
1湖南中医药大学第二附属医院骨伤科,湖南 长沙 410007;2湖南省中医骨伤科临床研究中心,湖南 长沙410007
绝经后骨质疏松症(PMOP)是一种与衰老有关的常见病[1],约20%的女性患有PMOP。既往的发病机制研究发现,由于绝经后雌激素及褪黑激素等缺乏,致使骨代谢失衡骨量减少,骨小梁微结构破坏[2],大约10%的女性有不同部位的骨折[3]。疲劳是PMOP的主要症状,也是加重临床症状或骨质疏松性骨折的重要原因,严重影响患者生活质量原因之一[4,5]。因此,开展骨质疏松临床与基础研究,对于早期诊断和防治PMOP至关重要。
中医论治PMOP多属于肾阴虚证,临床表现为膝软无力,患部痿软微热,或五心烦热,失眠多梦等症候。疲劳是PMOP的主要症状之一,属于多脏器虚损与脾肾肝虚损最为密切。《素问·调经论篇》曰:“有所劳倦,形气衰少”。中医理论和现代分子医学研究表明,诸多疲劳症状也是加重临床症状或骨质疏松性骨折的重要原因[6]。有文献报道,六味地黄丸能提高临床患者骨密度,改善临床疲劳症状,其临床疗效与绝经后肾气渐虚,肾阴阳失调,人体免疫机能失调有关[7,8]。目前尚无研究明确阐明六味地黄丸预防和治疗PMOP肾虚疲劳的分子作用机制。
新近研究表明,多种表观遗传和转录因子参与了PMOP 的发生发展过程并起着重要调控作用[9]。溴结构域蛋白4(BRD4)是表观调控蛋白BET家族成员之一[10],已有研究发现BRD4是一种转录调节因子,其可以与乙酰化染色质结合,参与细胞分裂循环过程中的基因稳定表达,在成骨细胞分化过程中BRD4也发挥重要作用[11,12]。尽管目前BRD4分子研究的线索支持其可能在PMOP的发生发展过程中具有重要调控作用,但BRD4是否和PMOP中医病机及症候分类存在内在联系尚不清楚。此外,BRD4是否有望成为中医药的干预靶标也鲜见报道。鉴于六味地黄丸在治疗PMOP及抗疲劳方面具有较好的临床应用前景,本研究通过去卵巢骨质疏松大鼠模型探讨BRD4表达与六味地黄丸干预PMOP及疲劳的关系,以期从BRD4/MAPK/NF-κB转录因子角度探讨六味地黄丸防治骨质疏松症的科学依据及其作用机制,为补肾中药在广大的骨质疏松症患者中的推广应用提供一定实验依据。
1 材料和方法
1.1 实验动物
SPF级雌性SD大鼠60只,6~8月龄,购自武汉华联科生物科技有限公司模式动物中心,动物合格使用许可证号SYXK(河北省)2021-006。寄养于湖南中医药大学动物实验中心,喂养环境温度设置21~25 ℃,湿度10%~30%;大鼠自由进食和饮水,适应性喂养后开展后续实验。本研究经湖南中医药大学动物实验伦理委员会审批同意实施(202104100009)。
1.2 药物与试剂
六味地黄丸[ 北京同仁堂(国药准字ZI9993068)],参照文献报道的方法计算配制六味地黄丸(385.7 mg/(kg·d)[13],用纯净水调整至4 mL,每日上午灌胃。BRD4抗体工作浓度1∶1000、β-actin抗体工作浓度1∶3000、MAPK抗体工作浓度1∶1000、NF-κB抗体工作浓度1∶1000(Abcam)。蛋白提取试剂盒、BCA蛋白浓度检测试剂盒和超敏ECL化学发光试剂盒(杭州碧云天生物技术公司),cGMP环磷酸鸟苷活性检测试剂盒(BioVision),1%茜素红染色试剂盒(索宝来)。
1.3 主要仪器
Discovery A 型小动物骨密度测试仪(Holigic),YLS-16A型小动物骨骼强度测定仪(济南益延公司)。DM3000型正置荧光显微镜(Leica)。酶标仪ELX800洗板机(BioTek)。全波长酶标仪(BioTek)。
1.4 模型制备、分组和给药
参照文献报道摘除双侧卵巢,建立绝经后骨质疏松症模型[14]。腹腔注射2%戊巴比妥钠麻醉(40 mg/kg),无菌条件下腹部正中切口进腹,丝线结扎卵巢并摘除。缝合切口前腹腔内注入万古霉素105U。手术后大鼠常规单独饲养,自由饮水和进食。术后2周实验动物伤口完全愈合后合笼,灌胃给药,分为3组:假手术组、模型组(生理盐水,10 mL/kg)、六味地黄丸组(LWDH,六味地黄丸385.7 mg/kg)。
1.5 骨密度和骨生物力学测定
完整分离双侧股骨,标本放置于骨密度测试仪平台上,分析检测整体股骨的骨密度(g/cm2)。同时,通过小动物骨骼强度测定仪,参照文献报道采用三点弯曲法测量骨骼强度[13]。
1.6 苏木素-伊红(HE)染色观察骨组织结构病理变化
用药疗程结束后,取各组大鼠双侧股骨组织标本,4%多聚甲醛固定24 h,用10%EDTA脱钙液(pH值8.0)脱钙15 d后石蜡包埋。切片厚4 μm脱蜡,HE染色30 s,1%浓度盐酸酒精分化后伊红复染。
1.7 负重游泳力竭实验分析六味地黄丸抗疲劳作用
参照文献报道末次给药后1 h进行负重游泳时间的测定[15],主要实验操作如下:对大鼠进行适应性非负重游泳训练5 d,30 min/次;将大鼠尾根部负荷以其体质量5%的重物(铅丝),放入水深35 cm,水温20~25 ℃的游泳缸中,注意鼠的尾巴不接触缸底,大鼠自游泳开始至头部自然沉降超过9 s即为负重力竭游泳时间,每次实验后及时吹干大鼠毛发,注意保温。
1.8 酶联免疫法检测环磷酸腺苷(cGAP)和环磷酸鸟苷(cGMP)
参照文献报道[16]经鼠尾取血置入促凝管,室温静止30 min;1500 r/min,离心20 min,收集上清,制备血清样本备用。按试剂盒操作说明书,采用双抗体夹心ELISA法检测cGAP和cGMP)。主要操作如下:酶标板反应孔加入稀释好后的待测血清样本或标准品50 μL后,加入生物素标记的抗体50 μL,37 ℃孵育45 min;用洗板机洗涤2 次;每孔加入亲和链酶素-HRP 量为100 μL,37 ℃孵育10 min;每孔加入底物50 μL,避免光照,轻轻振荡混匀,37 ℃孵育5 min。取出酶标板,迅速加入终止液50 μL;使用酶标仪测定各孔的A50nm值,绘制标准曲线,并计算cGMP/cGMP比值。
1.9 原代成骨细胞分离和细胞培养
无菌条件下切取鼠的股骨皮质骨骨片,剪成0.5 mm×0.5 mm 大小,约25 块;将其置入含有DMEM 培养基细胞培养6孔板中,加入0.25%胰蛋白酶5 mL,37 ℃二氧化碳细胞培养箱消化20 min 后,用10%胎牛血清终止消化;再加入I型胶原酶10 mL(浓度为1.0 g/L),37 ℃二氧化碳细胞培养箱消化40 min,1000 r/min离心10 min,200目滤网去除骨片,收集原代成骨细胞。
1.10 茜素红染色分析成骨细胞钙结节形成数目
按试剂盒操作说明,配制pH值为4.2的茜素红溶液。原代成骨细胞接种6孔板培养14 d后,以10%中性福尔马林进行细胞固定,进行茜素红染色,显微镜下观察,选取3个视野拍照,计数钙结节形成的数目。
1.11 细胞免疫荧光分析BRD4、MAPK、NF-κB蛋白表达
原代成骨细胞接种6孔板爬片用4%多聚甲醛固定后;PBS缓冲液洗涤3次,2 min/次;滴加封闭兔血清,37 ℃孵育60 min;加入一抗MAPK和NF-κB,工作浓度分别1∶1000和1∶1000,37 ℃孵育60 min;滴加一抗工作浓度分别1∶1000,37 ℃避光孵育60 min;DAPI复染细胞核。封片后显微镜下观察,选取视野拍照,利用Image J软件分析细胞阳性染色率。
1.12 Western blotting分析股骨组织BRD4蛋白表达
称取双侧股骨组织重量约50 mg,用含蛋白酶抑制剂的蛋白提取试剂盒提取总蛋白,并进行热变性制备蛋白样品。在10%SDS-PAGE分离胶中进行电泳,然后将分离的蛋白转移至PVDF膜上。用含0.05%Tween-20和5%脱脂牛奶的Tris缓冲液封闭膜,与一抗4 ℃孵育过夜。一抗BRD4工作浓度为1∶500,内参抗体工作浓度β-actin为1∶2000,与HRP偶联的二抗孵育,用PBS洗涤膜后,加入超敏ECL化学发光试剂在暗室曝光洗片。底片扫描用Image J软件分析灰度值。
1.13 GO分析和KEGG通路富集分析
PMOP相关数据集GSE56116从Gene Expression Omnibus(GEO)数据库下载并用于获得BRD4 信使RNA(mRNA)的差异表达。应用KEGG通路富集分析和GO富集分析预测差异表达的BRD4 mRNA的相关功能。GSE56116 数据集按中医证型将共纳入10 例PMOP患者,分为3组;肾阴虚者4例,肾阳虚者3例,非肾虚者3例[17,18]。
1.14 统计学分析
所有统计均采用SPSS25.0统计软件包进行数据处理分析。结果数据以均数±标准差表示,组间比较采用单因素方差分析,以P<0.05认为差异具有统计学意义。
2 结果
2.1 六味地黄丸对PMOP模型鼠骨组织病理的影响
造模12周结束后,对各组大鼠骨密度、骨强度和骨组织结构进行比较。骨扫描结果见图1A,与假手术组骨密度相比较,PMOP模型组大鼠股骨的骨密度明显降低;六味地黄丸(LWDH)组能有效提高模型组大鼠骨密度(图1B)和骨强度(图1C),但LWDH组的骨密度和骨强度低于假手术组,差异具有统计学意义(P<0.05);中药组与西药组相比较,差异无统计学意义(P>0.05)。各组大鼠股骨干组织HE染色结果显示,假手术组大鼠骨膜完整,骨小梁致密且分布较宽;与假手术组比较,模型组骨小梁稀少且小梁之间距离加大;LWDH组治疗后的大鼠则观察到骨小梁增加(图1D)。

图1 六味地黄丸改善PMOP骨组织病理Fig.1 Liuwei Dihuang(LWDH)Pills improve bone histopathology in PMOP rats.A:Representative bone density scan images.B: Comparison of bone density scans among the 3 groups.C:Comparison of bone strength among the groups.D:HE staining of the bone tissue in each group.**P<0.01,##P<0.01.
2.2 六味地黄丸抗鼠PMOP疲劳症状的作用
造模12周,PMOP模型组鼠表现活动减少,易激怒,饮水量增加。利用鼠负重游泳力竭时间实验比较了各组疲劳症状(图2)。与假手术组相比较,模型组鼠负重游泳时间明显减少,差异具有统计学意义(P<0.01);与模型组相比较,LWDH组能提高模型组负重游泳时间,差异具有统计学意义(P<0.01)。

图2 六味地黄丸对抗PMOP鼠模型疲劳症状Fig.2 Effects of LWDH Pills on fatigue symptoms in PMOP rats shown by comparison of weight-bearing swimming time among the groups.**P<0.01,##P<0.01.
2.3 六味地黄丸对鼠血清环核苷酸水平的影响
通过检测各组鼠的血清核苷酸水平发现,与假手术组相比较,模型组鼠血清cAMP(图3A)、cGMP(图3B)和cAMP/cGMP明显升高(图3C),差异具有统计学意义(P<0.01)。与模型组相比,LWDH组鼠的cAMP和cGMP显著降低(P<0.01)。但是假手术组比较,差异无统计学意义(P>0.05)。
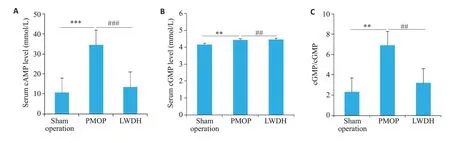
图3 六味地黄丸减轻鼠PMOP血清cAMP和cGMP浓度Fig.3 Effect of LWDH Pills on serum cAMP and cGMP levels in in each group.A:Serum cAMP levels.B:Serum cGMP levels.C:Ratio of cAMP to cGMP.**P<0.01,***P<0.001,##P<0.01,###P<0.001.
2.4 六味地黄丸促进成骨细胞钙结节形成的影响
分离培养获得原代成骨细胞后(图4),进行茜素红染色观察成骨细胞钙结节形成情况。结果显示(图5),与假手术组相比较,模型组成骨细胞钙结节形成数明显减少,差异具有统计学意义(P<0.001)。与模型组相比较,LWDH组钙结节形成数明显增多,差异具有统计学意义(P<0.01)。
图4 股骨成骨细胞原代培养Fig.4 Primary culture osteoblasts from femur(Original magnification:×200).
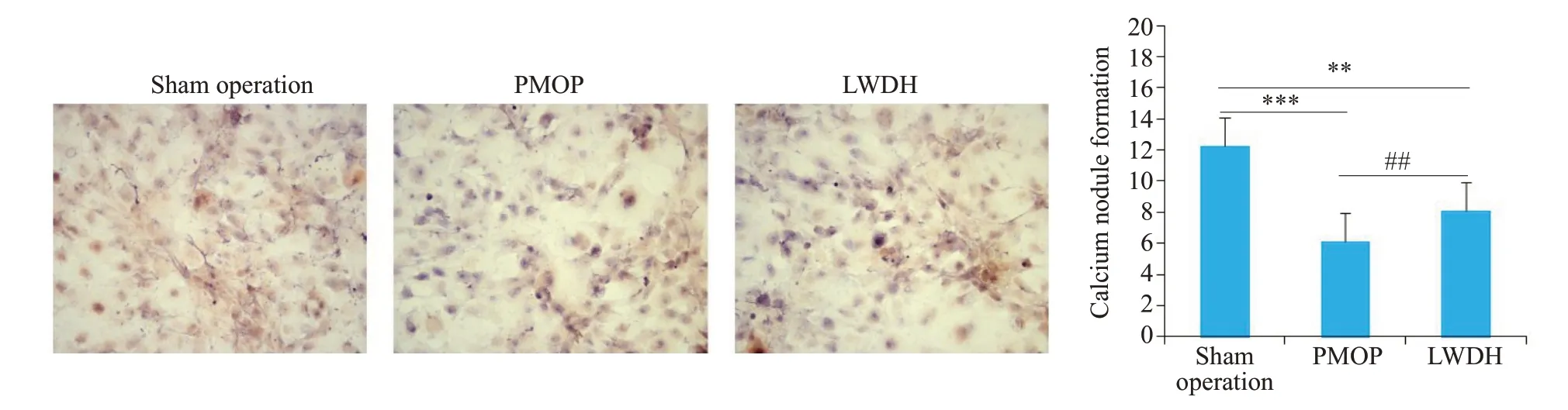
图5 六味地黄丸促进成骨细胞钙结节形成Fig.5 LWDH Pills promote the formation of calcium nodules in osteoblasts(Alizarin red staining,×200).**P<0.01,***P<0.001,##P<0.01.
2.5 六味地黄丸减少POMP骨组织中BRD4蛋白表达的表达
Western blot检测各组骨组织中BRD4蛋白表达结果(图6),与假手术组比较,模型组BRD4蛋白表达升高,差异具有统计学意义(P<0.01);与模型组比较,LWDH中药干预后,BRD4蛋白表达均呈现下降趋势,差异具有统计学意义(P<0.01)。
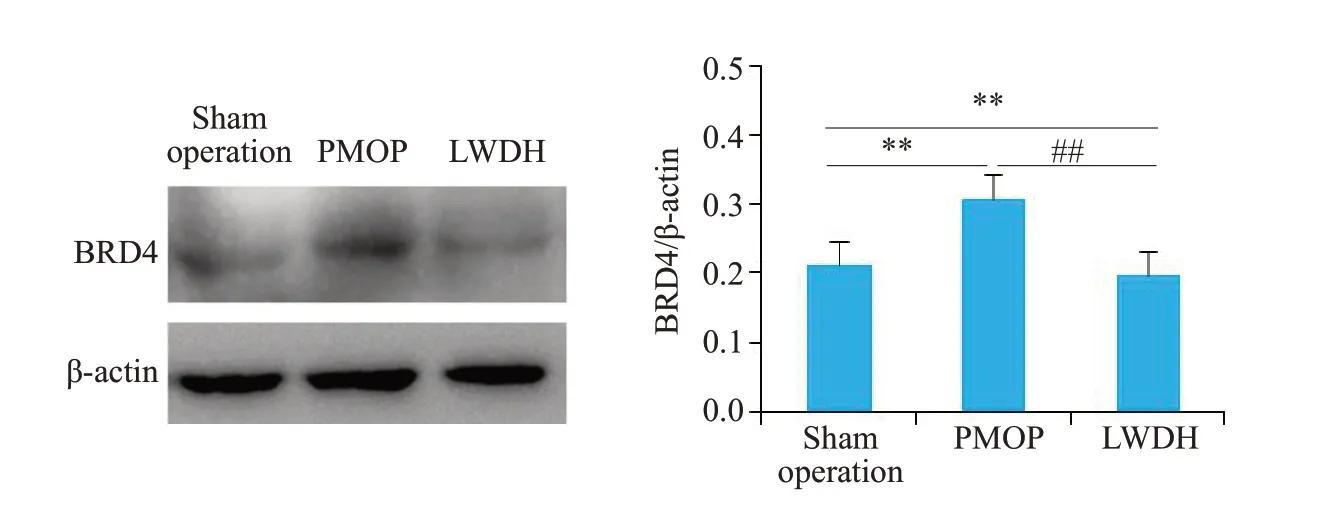
图6 六味地黄丸抑制BRD4蛋白表达Fig.6 LWDH Pills inhibit the expression of BRD4 protein in femoral bone tissues.**P<0.01,##P<0.01.
2.6 六味地黄丸减少POMP成骨细胞中BRD4、MAPK和NF-κB蛋白的表达
成骨细胞免疫荧光染色结果显示(图7A),LWDH干预后,POMP成骨细胞中BRD4蛋白表达水平下调。同时,MAPK(图7B)和NF-κB(图7C)蛋白细胞免疫荧光染色结果显示,与假手术组比较,模型组MAPK和NF-κB蛋白表达升高,差异具有统计学意义(P<0.001);与模型组比较,LWDH干预后,MAPK和NF-κB蛋白表达均呈现下降趋势,差异具有统计学意义(P<0.01)。
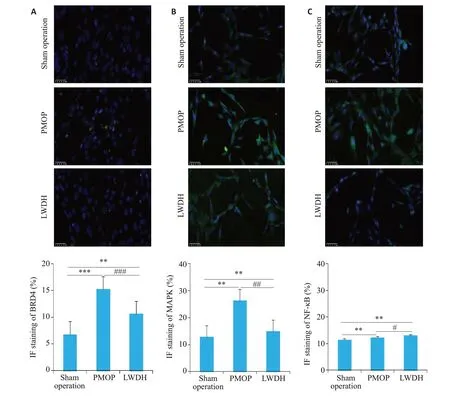
图7 六味地黄丸抑制成骨细胞中BRD4、MAPK和NF-κB蛋白表达Fig.7 Immunofluorescence assay showing the effects of LWDH Pills on subcellular distribution of BRD4(A),MAPK(B)and NF-κB(C)in the osteoblasts(×200).**P<0.01,###P<0.001,##P<0.01,#P<0.05.
2.7 BRD4转录水平与PMOP肾虚分型的分析
将GSE56116 测序数据分为PMOP 肾阴虚、肾阳虚、非肾虚3 组进行比较(图8A)。肾阴虚组BRD4 mRNA表达明显高于肾阳虚组和非肾虚组,差异具有显著性(P<0.05)。为进一步研究BRD4在肾虚型PMOP中的分子作用基础,将PMOP分为BRD4 mRNA高表达组和低表达组(图8B)。BRD4 mRNA 高表达涉及FAAP24、CDH16、PAGE2B、IGSF21 等基因改变;BRD4 mRNA低表达涉及C17ORF97和BTB结构域的16(ZBTB16)基因改变。
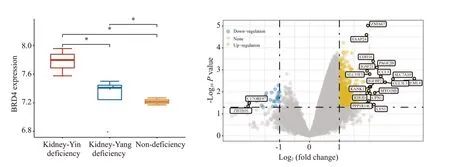
图8 PMOP肾虚分型与BRD4 mRNA的差异表达Fig.8 Analysis of the differential BRD4 mRNAexpressions in PMOP kidney deficiency subtypes.*P<0.05.
2.8 肾阴虚型PMOP及BRD4调控相关信号通路及功能的预测分析
使用GSE56116肾阴虚型PMOP数据进行KEGG通路分析和GO功能富集分析(图9)。KEGG通路分析(图9A),BRD4表达上调涉及神经配体受体反应、细胞骨架重排及细胞因子相互作用等信号通路;BRD4表达下调涉cAMP、局部粘附、胞嘧啶代谢信号通路。GO富集分析(图9B),BRD4表达第二信使介导的信号传导、粒细胞集落刺激因子趋化性等。
3 讨论
六味地黄丸是一种由熟地黄、山药、牡丹皮等药物组成的中成药。尽管六味地黄丸治疗PMOP临床疗效取得肯定[19],但其作用于PMOP多成分、多靶点间的相互关系及作用机制仍有待深入研究。我们的研究结果表明,六味地黄丸干预PMOP动物模型,可下调表观调控分子BRD4蛋白表达。研究发现,BRD4的抑制因子JQ1 参与PMOP 破骨细胞分化和病理性骨丢失的调控。BRD4可读取组蛋白的乙酰赖氨酸,从而改变染色质结构以确定干细胞命运和脂肪形成,敲除BRD4表达显著减轻糖皮质激素介导的对H3K9ac结合Runx2启动子的抑制、提高骨钙素和Runx2的表达、矿化基质堆积[11]。我们通过原代培养的成骨细胞观察成骨细胞钙结节形成情况,发现六味地黄丸治疗组钙结节形成数增多,提示六味地黄丸抑制BRD4蛋白表达,可能通过骨钙素和Runx2信号通路,促进钙结节形成。这可能是六味地黄丸治疗PMOP的新作用分子机制。
LWDH干预PMOP模型后,我们通过Western blot和免疫荧光染色方法检测,研究发现POMP成骨细胞MAPK和NF-κB蛋白表达呈现下降趋势。既往研究表明,破骨细胞的分化和形成依赖于巨噬细胞集落刺激因子和核因子κB受体活化因子配体的激活[10]。RANKL与核因子κB受体活化因子的结合会诱导肿瘤坏死因子受体相关因子6的募集,从而刺激破骨细胞生成所需的下游MAPK和NF-κB信号通路。同时,我们通过生物信息学方法进一步研究六味地黄丸治疗PMOP 中的分子作用基础,发现六味地黄丸下调BRD4蛋白表达,可能涉及FAAP24、CDH16、PAGE2B、IGSF21、C17ORF97 和ZBTB16 基因表达改变。Yu 等[20]研究表明,在成骨过程中成骨细胞基因上的组蛋白被乙酰化,从而使BRD4能够与成骨细胞基因ZBTB16结合。基于BRD4分子研究背景和我们的实验结果,BRD4蛋白表达下调和炎症相关信号通路的抑制,这可能是六味地黄丸作用PMOP的另一新的分子机理。
中医学对骨质疏松认识较早,且发现证型繁多[18]。唐·孙思邀《备急千金要方·骨虚实第六》论曰:“骨虚者,酸疼不安好倦”。华佗《劳伤论第十九》:“劳者,劳于神气也;伤者,伤于形容也”。由此可见,疲劳是引起PMOP患者临床症状的重要病因。契合现代临床上大量研究表明PMOP表现精神疲惫、四肢倦痛乏力等系列疲劳症状[8,21,22]。PMOP疲劳症状是归属多脏器虚损。我们分析了公共数据库中BRD4基因表达与PMOP中医肾虚症候的相关性,发现肾阴虚组BRD4 mRNA表达明显高于肾阳虚组和非肾虚组。此外,血清检测结果显示cAMP/cGMP比例明显升高,也符合肾阴虚的特点。本实验结果显示六味地黄丸能明显提高PMOP鼠的负重游泳时间,符合改善疲劳的特征;BRD4可能是肾阴虚型PMOP疲劳相关基因,其过表达可预测六味地黄丸疗效。中医对PMOP的病因病机、治则治法的认识均认为肾虚为发病的关键。六味地黄丸治疗肾阴亏虚引起的骨质疏松、骨折、骨痛等症状,能够起到一定的治疗效果。在本研究中,六味地黄丸能改善PMOP及疲劳是新的发现。
一般而言,表观遗传调控机制,特别是DNA甲基化,可调节多种疾病的基因表达,包括与骨代谢有关的关键基因[23]。其可能与骨质疏松多个信号通路激活有一定内在联系,诸如PINK1/Parkin 信号通路和PI3K/Akt信号通路等[24,25]。新近研究证据表明,PMOP情志相关的抑郁是疾病发生、进展和合并症的高危因素[26,27]。BRD4的异常表达参与神经炎症,可能和情志失调有关[28]。但是这些致病风险因素与BRD4是否存在关联,尚有待开展体内外实验进一步予以证实。综上所述,鉴于PMOP分子作用机制研究方兴未艾,BRD4的重要作用使其成为骨质疏松症的新兴治疗靶点。

