低鱼粉高脂饲料添加大豆卵磷脂对黄鳝生长、血清生化指标及肠道菌群的影响
汤 哲 林东晓 蔡明浪 张俊智 朱 波 石 勇 钟 蕾 胡 毅
(湖南农业大学水产学院, 长沙 410128)
鱼粉因营养组成均衡、适口性好而被大量应用于水产饲料中。然而目前受海洋气候与贸易形势影响, 全球鱼粉供应紧张, 其价格也呈现迅速上涨的态势, 因此降低饲料中鱼粉的使用迫在眉睫[1]。目前, 生产上倾向从两方面来减少饲料中鱼粉使用。一方面是进行饲料鱼粉的替代, 提高饲料中豆粕等植物蛋白含量, 降低饲料成本。但鱼粉替代比例过高后, 由于植物源性蛋白存在抗营养因子、必需氨基酸不平衡等因素会影响鱼体生长性能且损害肠道健康, 从而限制了低鱼粉饲料的使用[2—4]; 另一方面, 因脂肪对蛋白的节约作用, 适宜提高饲料脂肪水平以提高饲料中蛋白利用, 间接达到降低鱼粉的使用。然而, 过高脂肪的摄入易引发机体脂肪异常沉积, 并影响肠道菌群稳态, 减弱鱼体抗应激能力[5—7]。前期研究表明, 黄鳝(Monopterus albus)在饲料含有51%鱼粉, 且蛋白质/脂质比为(450/40) g/kg条件下生长性能最佳[8], 低鱼粉高植物蛋白饲料会降低黄鳝生长[9], 而适当提高低鱼粉饲料中脂肪水平可促进黄鳝生长[10], 但脂肪水平过高会干扰脂质转运并损害肠道健康, 而蛋氨酸[11]与牛磺酸[12]的添加可减少脂质沉积, 并维护高脂营养压力下肠道健康, 因此低鱼粉高脂饲料的负面影响在一定程度上可由添加剂缓解。
大豆卵磷脂为大豆加工副产物之一, 由多种优质不饱和脂肪酸、脑磷脂及磷脂酰胆碱等营养元素组成。2021年国产大豆产量为1640万吨, 且呈逐年增加的趋势[13], 其衍生产物具有极大的应用潜力。近年, 大豆卵磷脂广泛应用于饲料行业, 有效改善了畜禽对高植源性饲料的利用能力[14], 并促进凡纳滨对虾(Litopenaeus vannamei)[15]生长, 而其促进脂肪乳化的特性可改善动物机体对饲料中脂肪的吸收转运, 缓解团头鲂(Megalobrama amblycephala)[16]鱼体脂类氧化应激。此外, 大豆卵磷脂中磷脂成分可以提高鱼体免疫机能, 修复肠道损伤并增强肝细胞抗脂肪化能力, 改善肠道菌群组成[17—20]。因此本试验以湖南特种鱼黄鳝为研究对象, 在低鱼粉高脂饲料中添加大豆卵磷脂, 探究其对黄鳝生长、血清生化指标及肠道菌群的影响, 以期降低黄鳝鱼粉使用量, 缓解原料供应压力, 并为大豆卵磷脂在低鱼粉高脂饲料中的应用提供参考。
1 材料与方法
1.1 试验饲料
以鱼粉、豆粕为主要蛋白源, 豆油与鱼油为主要脂肪源, 共设4个处理, 以含有42%鱼粉、22%豆粕、6%粗脂肪的饲料为正常鱼粉组(对照组, FM组), 另以含有22%鱼粉、52%豆粕、9%粗脂肪为低鱼粉高脂饲料(SL0组), 分别在低鱼粉高脂饲料中添加1% (SL1组)、2% (SL2组)的大豆卵磷脂, 其饲料组成及营养水平见表1。饲料原料由张家界新瑞生物饲料有限公司提供, 饲料原料经80目超微粉碎后, 按用量逐级混匀, 后加入混合机中, 同步加油,约进行10min; 随后用60目筛网筛选观察是否有大颗粒油脂混合物, 磨碎后反复进行, 直至全部过筛,烘干机风干后-20℃储存备用。
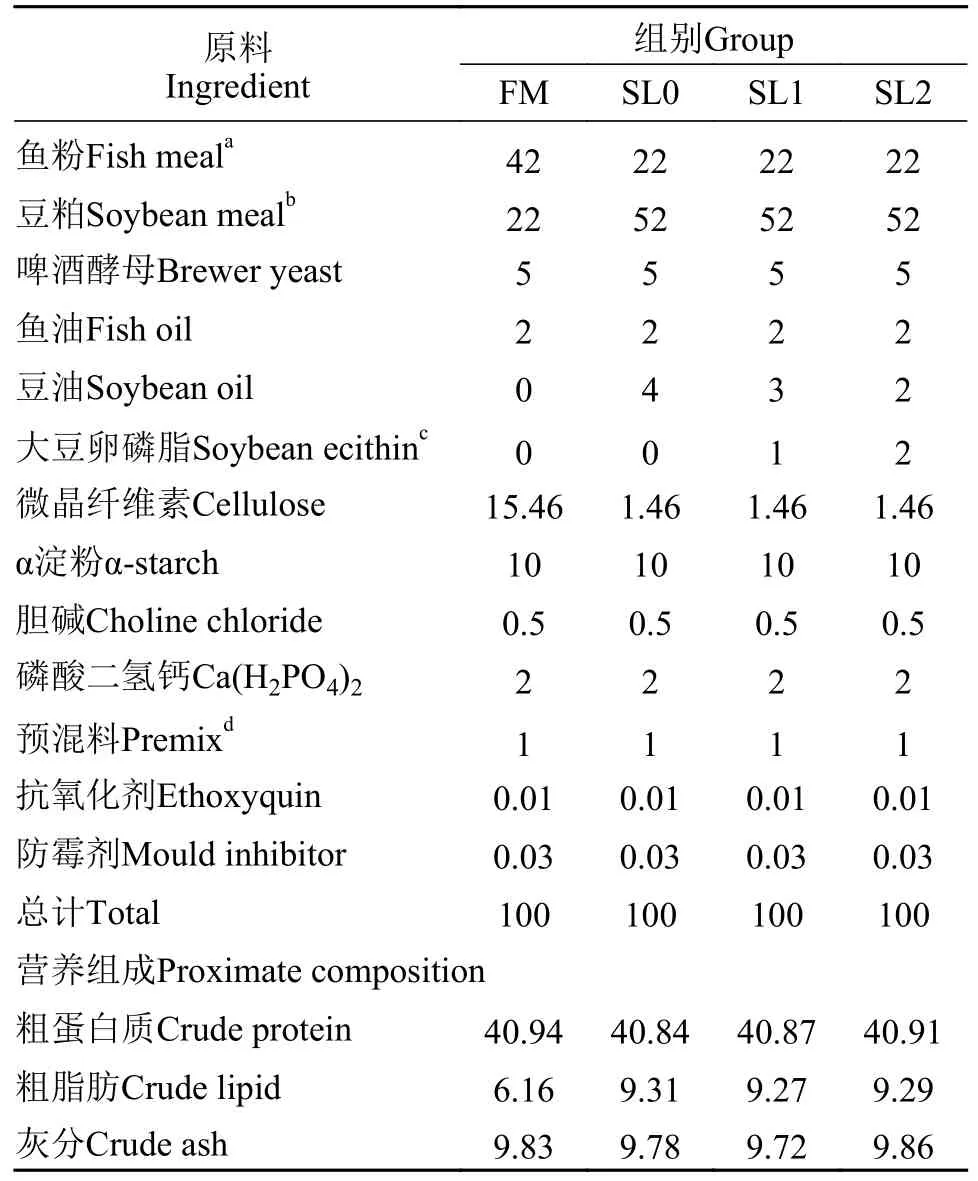
表1 饲料组成及营养水平(风干基础)Tab.1 Feed composition and nutrient level (air-dry basis) (%)
1.2 饲养与管理
实验在湖南常德黄鳝实验养殖基地进行, 实验鱼选自湖南省常德市洞庭湖区, 于实验开展1月前购买, 暂养期间禁食。实验正式开展前, 先用少许蚯蚓投喂驯食, 逐渐加入鲜鱼浆, 蚯蚓与鲜鱼浆达到1∶1后缓慢减少蚯蚓比例, 同时加入等比重的饲料; 每日依据试验调控投喂总量, 并调整诱食饵料与饲料比例, 直至黄鳝可全面摄食饲料, 驯食时间为15d。驯食完成后, 禁食24h, 挑选体格健壮、大小相当的黄鳝(20.03±0.01) g随机分入12个规格一致的网箱中(2.0 m×1.5 m×1.5 m), 试验共设4组, 每组3个重复, 网箱内放养50尾。试验网箱集中设于水域中央, 池塘面积为1亩左右, 网箱内铺设等量水花生, 饲料投喂时划船将粉料加水搓团置于水花生上, 下端接触水面。在养殖试验期间, 日投喂1次(18: 00—19: 00), 定时清理残饵并记录重量, 投喂量为黄鳝体重3%—5%, 每3日调整投喂量, 养殖摄食试验共持续8周(以开始摄食饲料的时间为实验正式开始的时间)。在试验期间, 水温(32.3±4.2)℃, 溶氧含量≥5.0 mg/L, 氨氮含量≤0.5 mg/L。
1.3 生长形体指标
在养殖试验结束后, 禁食24h, 并对黄鳝进行称重和计数, 计算存活率(Survival rate, SR)、增重率(Weight gain rate, WGR)、饲料系数(Feed conversion ratio, FCR)。随机取6尾试验鱼, 测量记录其体重、体长、全长、肝重和内脏团重量, 用于计算肝体比(Hepatopancreas index, HSI)、脏体比(Viscerosomatic index,VSI)和肥满度(Condition factor, CF)。计算方法:
存活率(%)=100×试验末黄鳝尾数(尾)/试验初黄鳝尾数(尾);
增重率(%)=100×[末体重(g)-初体重(g)]/初体重(g);
饲料系数=饲料摄取量(g)/[末体重(g)-初体重(g)];
肝体比=100×黄鳝肝脏重(g)/黄鳝末体重(g);
脏体比=100×黄鳝内脏团重(g)/黄鳝末体重(g);
肥满度(g/cm3)=100×黄鳝体重(g)/黄鳝体长(cm)3。
1.4 营养成分指标
试验饲料的水分、粗蛋白、粗脂肪与粗灰分分别使用105℃恒温干燥法(GB/T5009.3-2003)、凯氏定氮法(GB/T5009.5-1985)、索氏抽提法(GB/T5009.6-1985)与550℃马弗炉测定(GB/T5009.4-1985)。
1.5 血清生化指标
在养殖试验结束后, 每个网箱随机取6尾禁食24h的黄鳝, 用1 mL无菌注射剂于肛门下0.5—1 cm取血, 血样分装于4℃冰箱, 静置2h后, 在3000 r/min离心10min, 吸取上清液并混样, 每组混合样本约有5—6管(200 μL), 储存于-80℃超低温冰箱备用。黄鳝血清生化指标包括甘油三酯(Triglyceride, TG)、总胆固醇(Total cholesterol, TC)、高低密度脂蛋白(High-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白(Low-density lipoprotein cholesterol, HDLC)、谷丙转氨酶(Alanine aminotransferase, ALT)、谷草转氨酶(Aspartate aminotransferase, AST)、尿素氮(Blood urea nitrogen, BUN)、血氨(Blood ammonia, Ba)、酸性磷酸酶(Acid phosphatase, ACP)、碱性磷酸酶(Alkaline phosphatase, ACP)与免疫球蛋白M (ImmunoglobulinM, IgM), 均采用试剂盒测定。试剂盒均购自南京建成生物工程研究所和浙江伊利康生物科技有限公司。
1.6 肠道切片的制备与观察
在养殖试验结束后, 每个网箱随机取3尾禁食24h的黄鳝, 解剖分离出肠道, 于肠道食结之后取0.5 cm3肠组织, 确保切面光滑齐整, 置于4%甲醛溶液中固定24h, 制样时取出, 微流水冲洗, 先由乙醇梯度脱水后置于二甲苯透明, 再由低熔点石蜡包埋, 于包埋机中横向切片, 切片厚度为5 μm, 后使用HE染色,中性树胶封片, 具体参考刘祥等[21]方法。
切片制备完成, 送于艾方生物公司完成白光扫描, 后利用Image J软件随机选定多组区域测量皱襞高度(Fold height, FH)、肌层厚度(Intestinal muscular thickness, IMT)及杯状细胞数目(Amounts of intestinal goblet cells per root, AIGC), 进行数据分析。
1.7 肠道菌群分析
养殖试验结束, 立即从FM、SL0与SL2组的每个网箱中取5尾鱼后肠内容物, 置于2 mL无酶防爆管中, 液氮速冻后, -80℃保存。对FM、SL0与SL2组的肠道内容物样品进行DNA提取, 采用通用引物(正向引物338F: 5′-ACTCCTACGGGAGGCAGCA-3′, 反向引物806R: 5′-GGACTACHVGGGTWTCTA AT-3′)扩增16S rRNA基因V3—V4区域。采用Illumina平台对PCR纯化样品中的DNA片段进行双端(Paired-end)测序, 后续利用派森诺基因云(https://www.genescloud.cn)进行数据分析。
1.8 数据处理与统计分析
试验数据使用Microsoft office Excel 2019进行初步整理分析, 采用SPSS 22软件将符合方差齐质性的数据进行单因素方差分析(ANOVA)。当差异显著时(P<0.05), 采用Duncan’s进行事后多重比较,结果用平均值±标准误(mean±SE)表示。
2 结果
2.1 低鱼粉高脂饲料中添加大豆卵磷脂对黄鳝生长性能的影响
由表2可知, 各组间黄鳝的存活率、脏体比和肥满度均无显著差异(P>0.05)。与FM组相比, SL0组黄鳝增重率显著降低(P<0.05), 而饵料系数、肝体比均显著增加(P<0.05); SL1和SL2组黄鳝饵料系数显著增加(P<0.05), 增重率显著降低(P<0.05)。与SL0组相比, SL1组黄鳝肝体比显著降低(P<0.05);SL2组黄鳝增重率显著增加(P<0.05), 而饵料系数、肝体比显著降低(P<0.05)。

表2 低鱼粉高脂饲料中添加大豆卵磷脂对黄鳝生长性能的影响Tab.2 Effects of supplementation of soybean lecithin to low-fishmeal and high-fat diet on growth performance of Monopterus albus
2.2 低鱼粉高脂饲料添加大豆卵磷脂对黄鳝血清生化的指标影响
由表3可知, 相较于FM组, SL0组黄鳝血清的TC、TG、HDL-C、LDL-C、Ba、BUN、AST、ALT、ACP和IgM水平显著提高(P<0.05), 而AKP水平则显著降低(P<0.05); SL1和SL2组黄鳝血清的HDLc、Ba、BUN和AST也显著高于FM组(P<0.05), 而SL2组的黄鳝血清中TG、TC、LDL-c、ALT、ACP、AKP和IgM则与FM组无显著差异(P>0.05)。相较于SL0组, SL2组黄鳝血清的HDL-C和AKP含量显著增加(P<0.05), 而LDL-C、Ba、BUN、AST、ALT、ACP和IgM含量显著下降(P<0.05)。
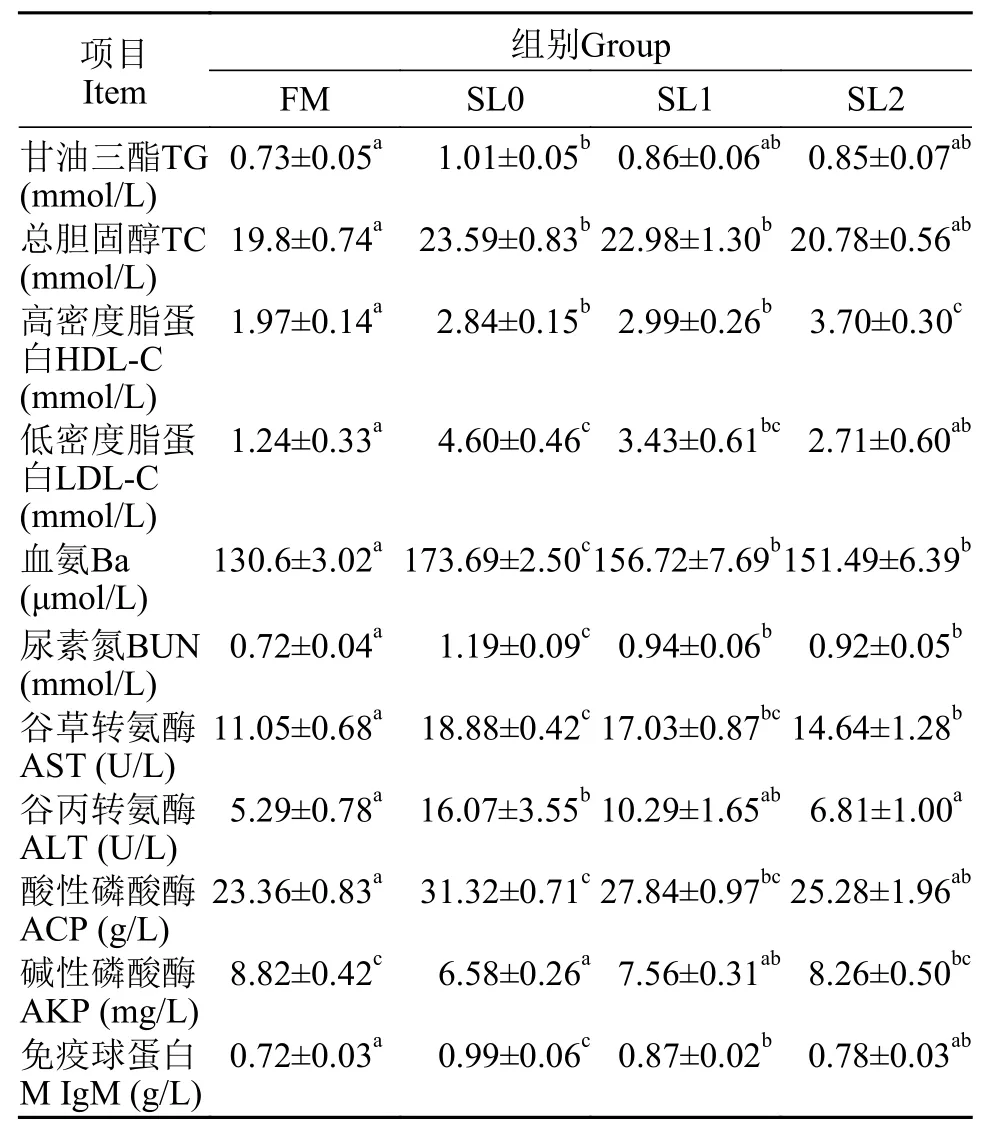
表3 低鱼粉高脂饲料中添加大豆卵磷脂对黄鳝血清生化指标的影响Tab.3 Effects of supplementation of soybean lecithin to low-fishmeal and high-fat diet on serum biochemical indexes of Monopterus albus
2.3 低鱼粉高脂饲料添加大豆卵磷脂对黄鳝肠道结构的影响
由图1可知, 与FM组(图1a)相比, SL0组(图1b)黄鳝肠道皱襞稀疏且部分上皮细胞脱落甚至溶解,皱襞间隙增大, 上皮下方的固有层内细胞排列紊乱。SL2组(图1c)黄鳝肠道皱襞损伤得到修复, 上皮细胞排列整齐, 皱襞轮廓相对清晰, 但肠道完整性仍未及正常鱼粉组。
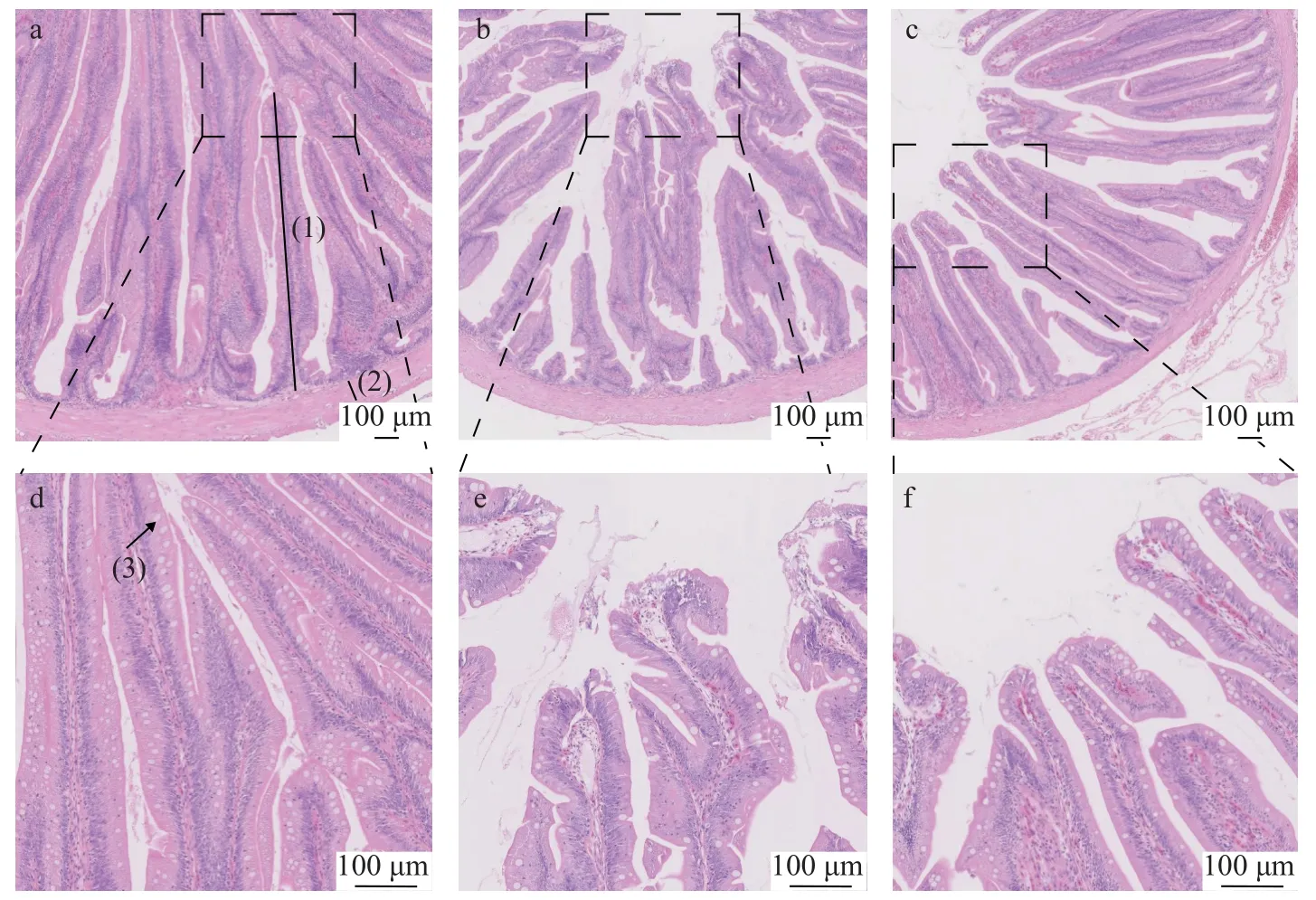
图1 低鱼粉高脂饲料添加大豆卵磷脂对黄鳝肠道切片的影响(HE)Fig.1 Effects of lowfishmeal and high fat diet supplemented with soybean lecithin on gut sections of Monopterus albus (HE)
由表4可知, 各组间在黄鳝肠道皱襞高度、杯状细胞与肌层厚度上存在显著差异(P<0.05)。相较于FM组, SL0组黄鳝肠道皱襞高度与杯状细胞数目显著下降(P<0.05), 而肌层厚度显著上升(P<0.05)。相对SL0组, SL2组黄鳝肠道肌层厚度显著下降(P<0.05),而皱襞高度与杯状细胞数目无显著差异(P>0.05)。
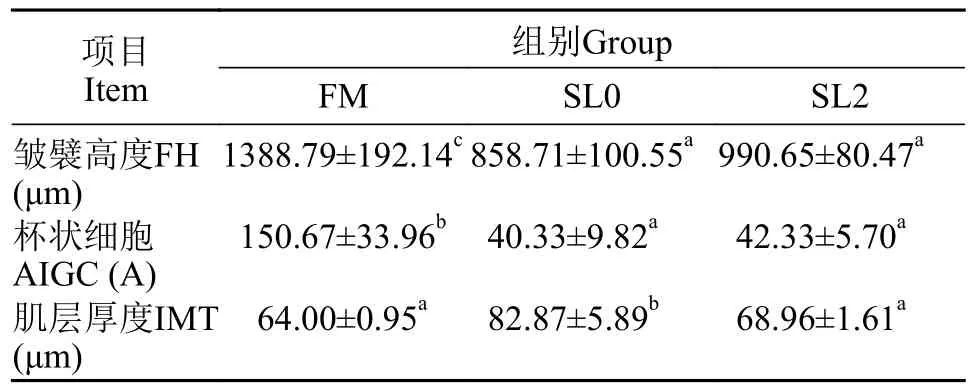
表4 低鱼粉高脂饲料添加大豆卵磷脂对黄鳝肠道切片的影响Tab.4 Effects of low-fishmeal and high-fat diet supplement with soybean lecithin on intestinal sections of Monopterus albus
2.4 低鱼粉高脂饲料添加大豆卵磷脂对黄鳝肠道菌群的影响
低鱼粉高脂饲料添加大豆卵磷脂对黄鳝肠道菌群多样性的影响由图2可知, FM组操作分类单元(OTU)数目为700个, SL0组OTU数目为837个,SL2组OTU数目为1828个, 3组共有的OTU数目为177个, FM组与SL0组共有OTU数目为70个, FM与SL2组共有OTU数目为73个, SL0组与SL2组共有OTU数目为173个, FM组、SL0组与SL2组特有OTU数目分别为380、417和1405个。由图3可知,从黄鳝肠道菌群主坐标分析来看, 各组间单独成簇,组间总体群落结构相似性低。
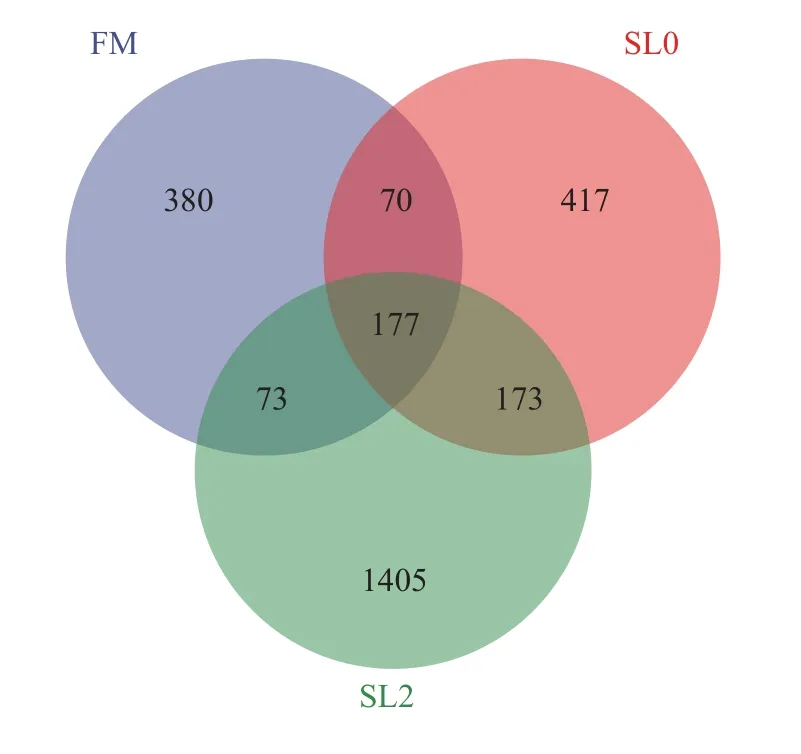
图2 OTU韦恩图Fig.2 OTU Venn chart
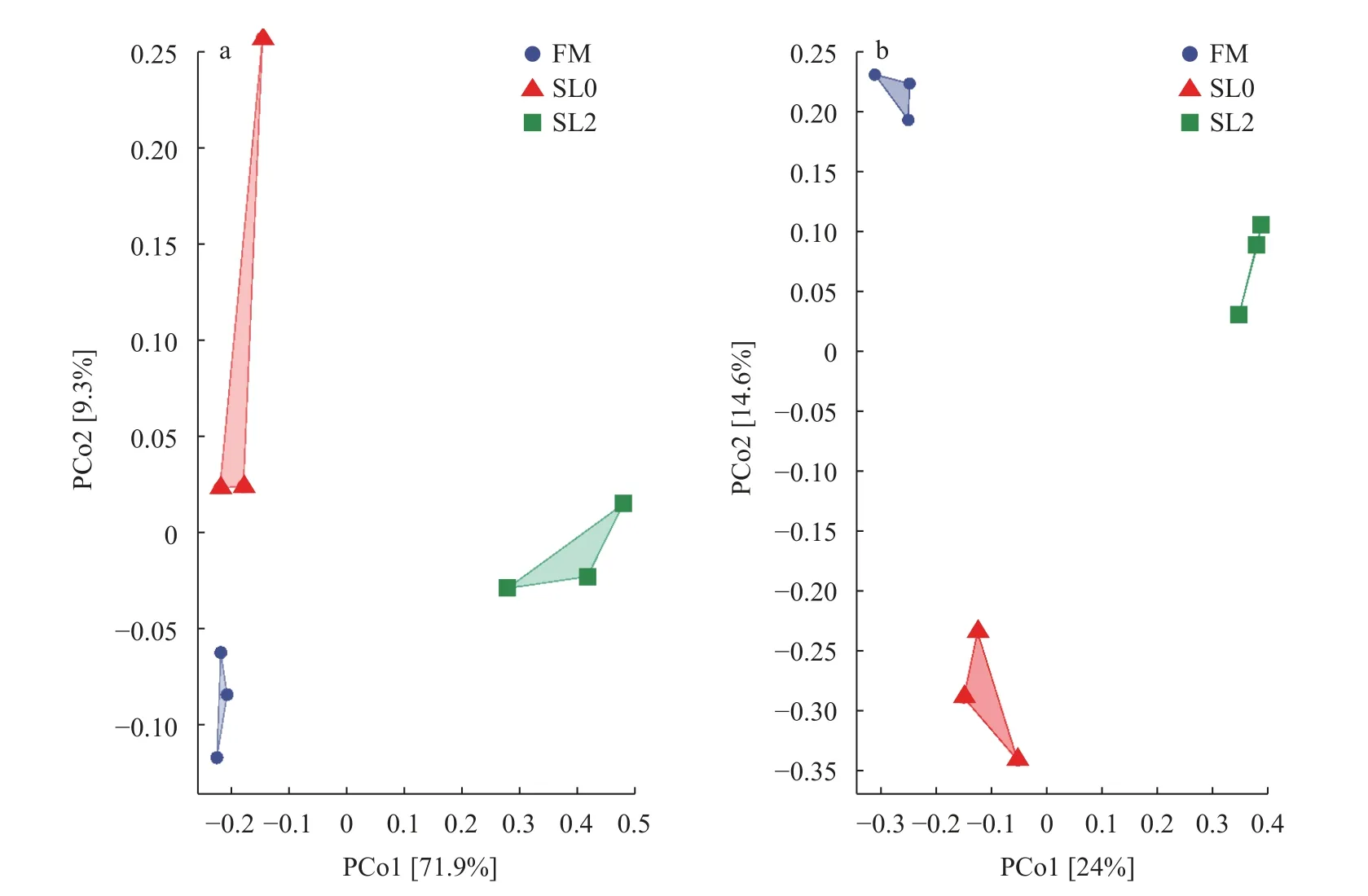
图3 基于Bray_curtis (a)与jaccard (b)算法的不同分组肠道菌群的主坐标分析Fig.3 The Bray_curtis (a) and jaccard (b) algorithms are used to analyze the principal coordinates of intestinal flora in different groups
由表5可知, 相较于FM组, SL0组黄鳝肠道菌群的香农指数与辛普森指数显著增加(P<0.05), 但在Chao1、菌群丰富度指数上无显著差异(P>0.05)。而相较于SL0组, SL2组黄鳝肠道菌群的Chao1、菌群丰富度指数、香农指数与辛普森指数皆显著增加(P<0.05)。
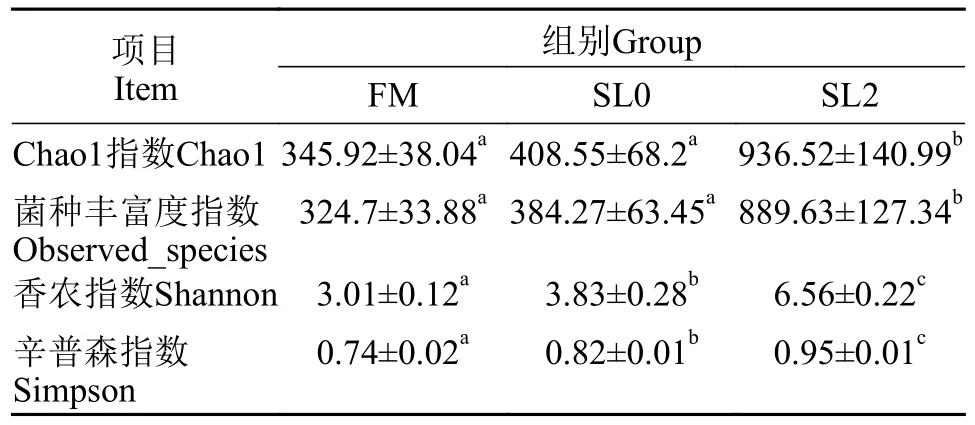
表5 低鱼粉高脂饲料添加大豆卵磷脂对黄鳝肠道菌群Alpha多样性Tab.5 Alpha diversity of intestinal flora of Monopterus albus by supplementation of soybean lecithin to low-fishmeal and high-fat diet
低鱼粉高脂饲料添加大豆卵磷脂对黄鳝肠道菌群物种组成的影响由图4可知, 在黄鳝肠道菌群门水平物种组成上, 物种优势菌门为(相对丰度由高到低)变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)等。对门相对丰度前四的物种分析可得(表6), 各组黄鳝肠道中变形菌门、放线菌门、绿弯菌门存在显著差异(P<0.05), 而厚壁菌门未有显著差异(P>0.05)。其中, 相较于FM组, SL0组在此四类物种的相对丰度上无显著差异(P>0.05); 相较于SL0组, SL2组黄鳝肠道中变形菌门的相对丰度显著下降(P<0.05), 绿弯菌门的相对丰度显著增加(P<0.05), 而厚壁菌门与放线菌门未有显著差异(P>0.05)。
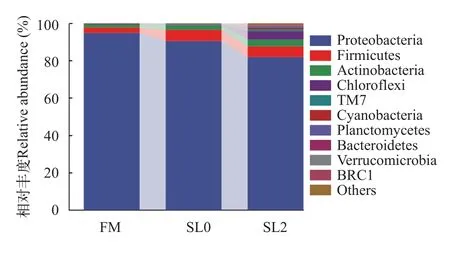
图4 门水平物种相对丰度Fig.4 Relative abundance of species on phylum level
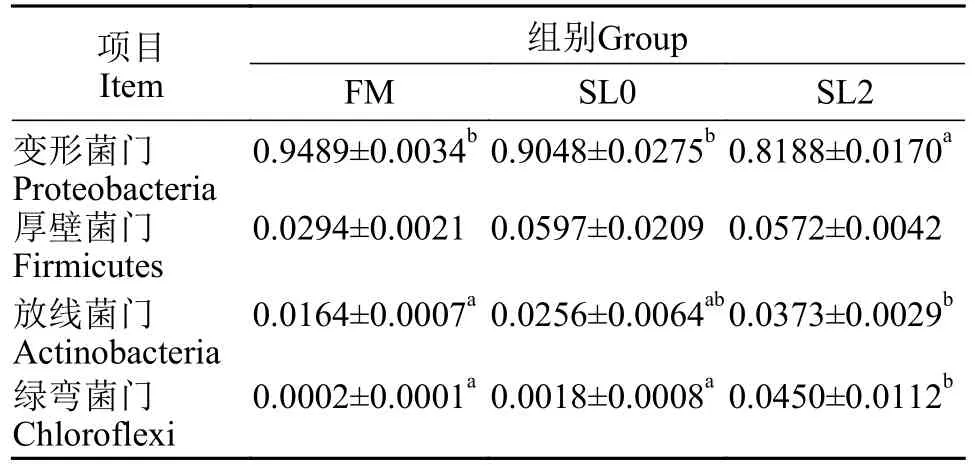
表6 门水平排名前四的物种相对丰度Tab.6 Relative abundance of top 4 species on phylum level
通过对黄鳝肠道菌群属水平物种相对丰度进行分析发现(图5), 其肠道菌群中相对丰度前四的依次为不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、红杆菌属(Rhodobacter)和考克氏菌属(Kocuria)。由表7可知, 相较于FM组, SL0组黄鳝肠道菌群的不动杆菌属相对丰度显著增加(P<0.05), 而假单胞菌属、红杆菌属与考克氏菌属相对丰度无显著差异(P>0.05)。相较于SL0组, SL2组黄鳝肠道菌群的假单胞菌属与红杆菌属相对丰度显著增加(P<0.05), 而不动杆菌属与考克氏菌属相对丰度显著下降(P<0.05)。

图5 属水平物种相对丰度Fig.5 Relative abundance of species on genus level
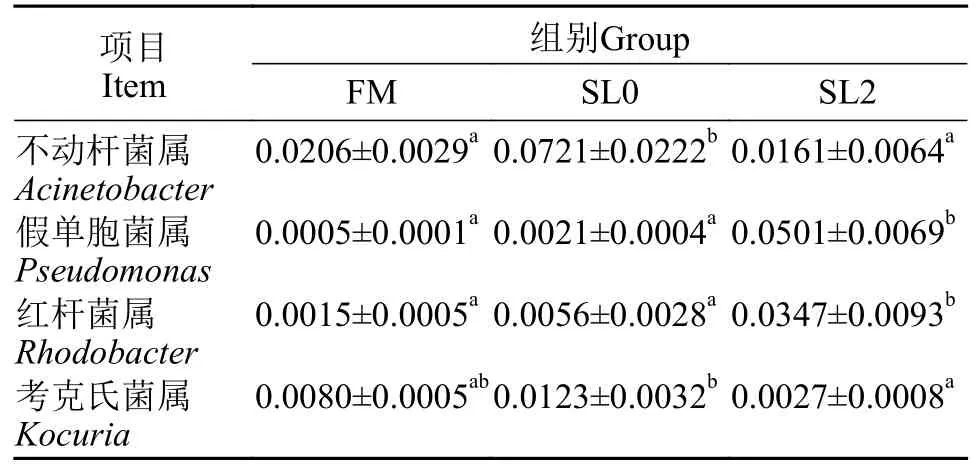
表7 属水平排名前四的物种相对丰度Tab.7 Relative abundance of top 4 species on genus level
3 讨论
3.1 低鱼粉高脂饲料中添加大豆卵磷脂对黄鳝生长性能指标的影响
在本试验中, 降低饲料中20%鱼粉, 提高脂肪水平并不能达到正常鱼粉饲喂的生长效果。本实验室前期研究表明, 黄鳝为偏肉食性鱼类, 高比例鱼粉有利于黄鳝生长发育, 过高鱼粉替代水平会抑制黄鳝生长[9]。而适宜的添加脂肪可改善黄鳝生长[10],但脂肪对蛋白的节约作用是机体营养物质均衡且充足的前提下实现的, 可能因鱼粉替代比例过高干预了脂肪节约蛋白的效果, 进而未达到正常鱼粉饲喂黄鳝的生长水平。值得注意的是, 低鱼粉高脂饲料影响黄鳝生长性能是否与使用豆粕进行替代有关, 有研究表明黄鳝对不同蛋白源的利用不同[22],合理利用其他植物蛋白源是否可以缓解此类现象,有待进一步探究。但在低鱼粉高脂饲料中添加大豆卵磷脂后显著改善了黄鳝生长性能, 可能因大豆卵磷脂充当乳化剂, 可促进黄鳝对饲料中脂肪的消化吸收, 且自身携带较多的长链多不饱和脂肪酸,其长链多不饱和脂肪酸可以竞争性地与不同脂质代谢酶结合[23], 从而改善黄鳝对低鱼粉高脂饲料的利用效果, 提高生长性能。但过高的饲料脂肪水平诱使黄鳝肝脏脂质沉积, 同样在杂交石斑鱼(Epinephelus fuscoguttatus♀ ×Epolyphekadion♂)[24]与罗非鱼(Oreochromis mossambicus)[25]的脂肪水平研究中发现, 过高的脂肪水平导致胞内脂质含量增加,促使鱼体肝体比增加。而在磷脂对中华绒螯蟹(Eriocheir sinensis)[26]脂代谢影响的研究发现, 磷脂可能通过促进脂肪氧化, 抑制肝脏脂肪合成, 从而降低脂肪在肝脏的沉积。因此添加大豆卵磷脂后黄鳝肝体比下降的现象可能与饲料中添加适量的磷脂有关。
3.2 低鱼粉高脂饲料中添加大豆卵磷脂对黄鳝血清生化指标的影响
甘油三酯、总胆固醇、高密度脂蛋白和低密度脂蛋白是衡量机体脂肪沉积的重要指标, 低密度脂蛋白将脂质分子从肝脏运输到全身, 而高密度脂蛋白将脂质从周围组织运输到肝脏[27]。在本试验中, 相较于正常鱼粉组, 低鱼粉高脂饲料中较高的脂肪水平诱使黄鳝血脂水平上升, 并影响肝脏脂质转运相关代谢酶含量,而大豆卵磷脂的添加有效地改善了黄鳝血脂水平, 促进肝脏脂肪转运。此与大豆卵磷脂饲喂斜带石斑鱼(Epinephelus coioides)[28]的研究类似, 可能因卵磷脂的乳化特性, 促进血脂转运, 从而改善鱼体血脂水平[29]。同时大豆卵磷脂通过调控黄鳝脂蛋白产生, 增强黄鳝肝脏与周围组织胆固醇的交换, 进而调控机体脂质分布, 改善低鱼粉高脂饲料引起的黄鳝脂肪紊乱。血氨为氨基酸脱氨作用主要产物, 尿素氮是过量的氨基酸分解成的氨和碳骨架, 而氨会进一步代谢为尿素氮, 间接反映机体蛋白利用程度。从本试验结果看, 低鱼粉高脂饲料组的搭配不利于鱼体对饲料蛋白的利用, 阻碍了蛋白沉积。而在金头鲷(Sparus aurata)[30]幼鱼中已表明大豆卵磷脂可以调控鱼体不饱和脂肪酸代谢的功能, 因此本试验中大豆卵磷脂可能通过促进机体脂质供能, 以降低机体蛋白质分解供能,来减缓低鱼粉高脂饲料对蛋白沉积的抑制作用, 在一定程度上提高对蛋白的利用, 以缓解低鱼粉高脂饲料的负面影响, 此结果也与鱼体的生长指标相印证。
谷草转氨酶和谷丙转氨酶为衡量肝脏损伤的指标。谷草转氨酶和谷丙转氨酶由肝脏产生, 其为大分子蛋白物质, 当肝细胞损坏或细胞膜通透性发生变化时, 血液中含量才会大量提升[31]。与红罗非鱼(Red tilmpa)[32]稚鱼上研究类似, 饲料中过高脂肪水平促使黄鳝肝细胞发生损伤, 血清中谷草转氨酶与谷丙转氨酶含量上升。大豆卵磷脂的添加使黄鳝的肝脏功能得到保护与恢复, 血清中转氨酶减少,推测大豆卵磷脂通过减少肝脏脂肪沉积, 降低肝脏细胞过氧化风险, 从而减缓肝脏细胞的营养压力[33]。碱性磷酸酶、酸性磷酸酶和免疫球蛋白M, 三者为机体重要的免疫指标。碱性磷酸酶为免疫防御重要的磷酸单脂水解酶, 其可增强细菌的异己性, 从而增强吞噬细胞的降解能力, 进而增强机体免疫性能[34], 酸性磷酸酶参与蛋白质胞饮作用和细胞内消化[35], 免疫球蛋白M为机体循环性抗体, 常用于衡量机体感染程度[36]。在本试验中, 相较于正常鱼粉水平, 低鱼粉高脂饲料干扰鱼体免疫代谢, 下调免疫识别机能。而随着大豆卵磷脂加量增加, 其有效提高黄鳝血清中碱性磷酸酶的活性, 改善了黄鳝血清免疫识别的机能, 而酸性磷酸酶活性的下降, 可能因磷脂参与细胞膜构成, 改善细胞膜通透性, 减少了酸性磷酸酶胞外释放量; 同时血清中免疫球蛋白M水平下降, 可能因豆粕的抗原性难以消解[2], 黄鳝对豆粕产生抗性导致免疫球蛋白M水平上升, 而随着大豆卵磷脂添加缓解了此类现象, 但具体机制有待进一步研究。
3.3 低鱼粉高脂饲料中添加大豆卵磷脂对黄鳝肠道结构与菌群的影响
肠道为鱼体营养物质吸收的主要场所, 肠道结构对动物的整体健康状况和营养素的利用具有重要作用[37]。对比正常鱼粉组, 低鱼粉高脂饲料中高豆粕的摄入导致黄鳝肠道皱襞断裂损伤严重, 肠道多处皱襞出现破裂, 从而严重影响黄鳝的肠道健康。而大豆卵磷脂的添加并未显著改善过量豆粕配置引起的肠道结构损伤, 但使肠皱襞完整性与密集性一定程度上得到恢复, 可能因饲料中大豆抗原蛋白等抗营养因子持续破坏肠皱襞结构, 以致大豆卵磷脂难以完全修复肠皱襞其损伤[33]。此外, 适宜的肠刺激可促进杯状细胞分化, 而低鱼粉高脂饲料组由于黄鳝肠结构持续遭受的高豆粕饲料刺激, 使肠道自我防御失衡, 导致肠道杯状细胞数目减少,以至于大豆卵磷脂的添加并不能显著改善其数目;而低鱼粉高脂饲料组的肌层厚度显著上升, 可能是因高纤维素饲料有使肠道肥大的作用[38], 而大豆卵磷脂可润滑肠道内容物, 减轻肠道蠕动压力, 促使肌层厚度适应性下降。总的来说, 大豆卵磷脂改善肠道不利影响的特性在前言已述, 如果选用去除大部分抗原因子的植源性蛋白, 应可缓解黄鳝肠道损伤, 推进低鱼粉高脂饲料的应用。
肠道微生物与机体免疫系统是协同进化的。结合上面的组织结构和免疫指标变化, 本试验中摄食低鱼粉高脂饲料的黄鳝可能发生了肠道菌群失调。研究发现, 营养条件的改变, 诱使肠道菌群失调, 去除互作弱相关的菌种, 筛选或促生互作强相关菌种, 长期干预下形成新的群落稳态[39]。在本试验中, 低鱼粉高脂饲料促使肠道微生物菌落多样性改变, 而低鱼粉高脂饲料中大豆卵磷脂的添加进一步提高了黄鳝肠道微生物群落丰富度与多样性, 促使特有物种数目增多。
本研究中变形菌门、厚壁菌门、放线菌门和绿弯菌门为黄鳝肠道中主要菌门, 其中变形菌门为所有试验组最占优势的菌门。变形菌门多为兼性厌氧性的革兰阴性菌, 可产生脂多糖与促炎症蛋白物质, 影响机体免疫状态[40]。放线菌门的微生物能合成抗生素次级代谢物, 从而抑制肠道中有害菌的生长, 维护肠道健康[41]。绿弯菌门在水生动物上鲜有研究, 其菌属可能参与碳水化合物分解利用, 产生多糖和黄酮类化合物等活性物质, 对肠道免疫系统进行调节[42]。在低鱼粉高脂饲料中添加大豆卵磷促使肠道菌群组成改变, 这与Tilocca等[39]提出的饲料成分可影响机体肠道菌群组成的研究结果相似, 大豆卵磷脂可能通过调控短链脂肪酸分解代谢,来限制兼性厌氧性菌的能量获取, 从而下调肠道菌群内变形菌门的相对丰度, 进而增加放线菌门与绿弯菌门生态空间, 减缓低鱼粉高脂饲料对黄鳝肠道菌群的压力[43]。而在属水平上来看, 相对丰度前四的菌属依次为不动杆菌属、假单胞菌属、红杆菌属和考克氏菌属, 这些菌属皆属于变形菌门。不动杆菌属下多为致病菌, 菌种产生毒力因子, 参与抗生素耐药性与免疫逃避[44], 而考克菌属的菌种能溶解角质, 大多发现于哺乳动物致病部位, 对肠道稳态有胁迫作用[45]。本试验低鱼粉高脂饲料组因饲料中豆粕与高脂的影响, 诱使肠道微生物氧化应激与炎症风险增加, 从而有害菌种丰度上升, 而大豆卵磷脂的添加显著下调此类致病性属相对丰度, 红杆菌属相对丰度显著上升。在中华绒螯蟹[46]中及赵志平等[47]的研究发现, 红杆菌属下菌种多为固氮抗病菌, 可降解多环芳烃等有毒有害物质, 说明大豆卵磷脂的添加可在一定范围内控制有害菌与有益菌的丰度, 从而调控肠道环境, 促使肠道菌群丰富度与多样性增加, 在一定范围内缓解低鱼粉高脂饲料对黄鳝肠道菌群的影响。
综上, 在22%鱼粉、52%豆粕和9%粗脂肪的饲料条件下, 添加2%大豆卵磷脂可促进脂肪代谢和提高机体免疫性能, 并修复肠道组织结构与维持菌群稳态, 进而缓解低鱼粉高脂饲料对黄鳝生长的负面影响。

