草鱼nrf1基因的克隆与表达及其应激响应研究
莫郁坚 易成琳 肖扬波 杨立权 宋世航 湛瑞杰 夏浩云 孙 琳 周罗璟 瞿符发 唐建洲 刘 臻 曹申平
(长沙学院生物与化学工程学院, 水生动物营养与品质调控湖南省重点实验室, 长沙 410022)
应激反应是指动物体在受到内外环境的各种刺激时所产生的非特异全身反应[1]。应激不仅会破坏动物机体的内稳态, 同时, 还对消化系统、呼吸系统和免疫系统造成损伤, 进而影响动物生长性能,甚至危害生命[2]。在水产养殖过程中, 应激反应的来源有很多种。比如, 在高密度集约化养殖过程中,残留饲料和排泄物的氨化作用会使鱼类受到持续性氨氮胁迫, 氨氮胁迫会引发其体内氧化应激反应,并激活其抗氧化应激系统, 清除应激反应产生的自由基[3,4]。此外, 饲料中高含量的植物性粕类, 由于抗营养因子的存在, 往往也会损伤动物肠道上皮细胞, 诱导肠道炎症, 造成应激反应[5]。
跨膜转录因子核因子E2相关因子1 (Nuclear factor-erythroid 2 related factor 1,nrf1)是碱性亮氨酸拉链CNC-Bzip (cap’n’collar basic-region leucine zipper)家族成员之一[6]。CNC-Bzip家族成员目前包 括Nrf1 (Nuclear factor-erythroid 2 related factor 1)、Nrf2 (nuclear factor-erythroid 2 related factor 2)、Nrf3 (Nuclear factor-erythroid 2 related factor 3)、p45-NFE2 (p45 Nuclear factor-erythroid 2)、Bach1 (BTB domain and CNC homolog 1)、Bach2 (BTB domain and CNC homolog 2)、SKn-1 (Skinhead-1)、CNC蛋白[7]。nrf1广泛存在于动物机体各组织[8], 在动物体内有着调节抗氧化应激反应、抗炎症与抗癌症反应, 维持细胞和器官的正常发育等多方面作用[9]。研究表明, 敲除小鼠胚胎中nrf1基因将会导致胚胎死亡[10]; 阎煜等[11]在敲除人肺癌A594细胞nrf1基因时, 发现肺癌细胞增殖速度显著提高; Chen等[12]培育nrf1缺失的小鼠嵌合肝细胞时发现, 缺失nrf1的肝细胞会发生严重的氧化应激反应, 进而引发小鼠肝细胞的大量凋亡和组织坏死。在水产动物中的研究发现, 凡纳滨对虾(Litopenaeus vannamei)体内存在着nrf1介导的抗应激系统, 该系统在应对副溶血弧菌感染引发的氧化应激和内质网应激反应中起着至关重要的作用[13]。大西洋鳉(Atlantic killifish)和金头鲷(Sparus aurata)经低温处理, 代谢速率会迅速下降, 而nrf1的表达量却逐渐增加, 且其表达量增加速率与温度下降速率紧密相关[14,15]。然而,目前尚未有关于淡水鱼类中nrf1基因分子特征与功能的研究报道。
草鱼(Ctenopharyngodon idella), 属鲤形目鲤科草鱼属, 是四大家鱼之一, 是目前中国养殖产量最大的淡水经济鱼类[16]。作为我国高密度集约化养殖模式的代表性品种, 草鱼养殖过程由于养殖密度过高、投饵过量导致养殖水体氨氮和亚硝态氮增多的问题频繁发生; 同时, 作为草食性鱼类, 其配合饲料中植物性成分比例远高于其他养殖品种。本实验以草鱼为实验对象, 克隆草鱼nrf1基因CDS区,进行生物信息学分析; 采用实时荧光定量PCR技术(qRT-PCR)进行各组织中表达量的分析检测; 进而通过急性氨氮胁迫实验和不同蛋白源饲料的营养生长实验, 探究草鱼体内nrf1基因在不同营养和环境应激条件下的变化和调节作用。
1 材料与方法
1.1 养殖实验和组织取样
实验用草鱼购于湖南省水产科学研究所(湖南,中国)。所有鱼类均在4%的盐水中浸泡20min, 然后转移到室内循环水养殖系统。在养殖实验开始前,将所有草鱼置于室内循环水养殖系统2个1500 L养殖缸中暂养驯化2周, 使用商品饲料每天投喂两次(8:30和14:30)。实验鱼饲养在湖南省长沙市长沙学院室内循环水养殖系统中, 光照周期为12 L/12 D(8:00—20:00), 水温为(28±2)℃。每周监测水体溶氧和氨氮,溶氧>7.0 mg/L, 氨氮<0.1 mg/L。pH为6.5—7.2。
养殖实验结束, 实验鱼禁食24h后分别从各缸捞出, 经MS-222 (50 mg/L)麻醉, 冰上解剖取样相关组织。取样后将组织立即放入液氮中冻存, 然后转移至-80℃保存, 直至分析。
1.2 nrf1在各组织中的表达模式和昼夜节律规律
实验草鱼在室内循环水养殖系统驯化2周后,禁食24h, 随机选取大小相近、健康状况良好的5尾鱼(30.00±0.45) g经MS-222麻醉后冰上解剖收集草鱼肝脏、肠道、心脏、肾脏、脾脏、脑和肌肉组织, 以检测nrf1的组织表达模式; 为探究nrf1表达量的昼夜规律, 分别在同1天8个时间点(03:00、06:00、09:00、12:00、15:00、18:00、21:00和24:00)随机取3尾草鱼(30.00±0.45) g解剖取肝脏组织, 通过qRT-PCR分析nrf1的表达水平。
1.3 氨氮胁迫对草鱼肝脏nrf1基因表达的影响
采用氯化铵(国药集团, 上海)调整水体氨氮浓度, 共设置3个处理组: 对照组(经充分曝气的自来水)、低氨氮组(氨氮浓度为5 mg/L)和高氨氮组(氨氮浓度为20 mg/L), 每个处理组分配3个实验养殖缸。实验前将鱼禁食24h, 选取规格均一、健康状况良好的个体(30.00±0.45) g, 称重后放入各实验养殖缸(100 L)中, 每缸15尾实验鱼。分别在实验开始后0、24h和48h, 每缸捞取3尾鱼, 每组9尾鱼, 通过qRT-PCR对所取的鱼肝脏组织样品进行基因表达水平分析。
1.4 不同蛋白源对草鱼nrf1基因表达的影响
实验设计了3种等氮等脂等能但主要蛋白源不同的实验饲料, 实验配方如表1所示, 分别为鱼粉(FM)组, 菜粕(RM)组和豆粕(SM)组。每个处理组3个平行, 每个平行15尾实验鱼(30.00±0.45) g, 采用室内循环水进行养殖, 每日于8:30和14:30饱食投喂2次。在养殖实验开始后14d、21d、28d和35d, 每缸取2尾鱼, 冰上解剖取肠道组织, 使用qRT-PCR分析nrf1基因的相对表达水平。

表1 饲料配方及化学组成(干物质, %)Tab.1 Formula and chemical composition of diets (dry matter, %)
1.5 RNA提取和cDNA合成
使用Trizol试剂(TaKaRa, Kusatsu, 日本)用于从草鱼各组织中分离总RNA。使用1%琼脂糖凝胶电泳测定RNA质量。通过分光光度计(BioPhotometer Eppendorf, Hamburg, 德国)评估RNA的 纯 度 和 浓度。参照PrimeScrip反转录试剂盒(TaKaRa, Kusatsu,日本)说明书合成第一链cDNA。
1.6 nrf1基因克隆
以草鱼心、肝、脾、肌、肠混合组织cDNA作为模板进行nrf1基因克隆。基于NCBI上已公布的草鱼近似物种的nrf1基因编码保守区序列, 利用软件Primer Premier5.0软件设计克隆引物(表2), 并委托擎科生物科技有限公司(湖南, 中国)合成引物。对cDNA模板进行PCR扩增, PCR产物用1%琼脂糖凝胶电泳检测和分离, 用DNA回收试剂盒(艾科瑞,湖南, 中国)回收并纯化目的PCR产物, 将目的产物连接到pMD19-T载体(TaKaRa, Kusatsu, 日 本)上,然后转化到感受态大肠杆菌DH5 α细胞中, 选择阳性克隆由擎科生物科技有限公司测序。PCR反应体系(25 μL): 12.5 μL PremixTaqTMHot Version, 1 μL cDNA, 正反引物各1 μL, 9.5 μL ddH2O。PCR扩增程序为: 94℃预变性3min; 94℃变性30s, 53℃退火30s, 72℃延伸1min, 3个循环; 72℃延伸7min。

表2 用于草鱼nrf1基因克隆和荧光定量PCR的引物序列Tab.2 Primers used for nrf1 cloning and RT-PCR of Ctenopharyngodon idella
1.7 实时荧光定量PCR检测
使用Bio-Rad CFX96TM实时PCR系统(Bio-Rad,Hercules, CA, 美国)检测nrf1基因表达水平。实验选取β-actin作为内参基因, 使用软件Primer Premier 5.0软件设计特异性引物, 引物序列见表2。PCR反应体系(16 μL)为: 1 μL cDNA模板, 8 μL 2× SYBR®Green ProTaqHS Premix(湖南艾科瑞生物工程有限公司, 长 沙), 正反 引 物各0.64 μL, 0.32 μL ROX Reference Dye (20 μmol/L), 5.4 μL ddH2O。扩增程序: 95℃预变性10min; 95℃ 15s, 60℃ 1min, 进行40个循环。qRT-PCR实验数据使用2-ΔΔCt法进行分析[17]。
1.8 草鱼nrf1序列分析
使用NCBI在线程序ORF (Open Reading Frame,开放阅读框) Finder (http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)推测氨基酸序列, 再使用ExPASy (http://www.expasy.org/tools)预测分子量和等电点。利用SMART (http://smart.embl-hei-delberg.de/)预测蛋白结构域。利用MEGA 11软件的邻接法基于多重比对构建系统进化树。
1.9 数据分析
使用SPSS 19.0软件对实验数据进行单因素方差分析(One-way ANOVA), 通过Levene检验对数据进行方差同质性分析, 然后使用Duncan检验进行多重比较,P<0.05表示差异显著; 实验结果均采用“平均值±标准误”(mean±SE)表示。
2 结果
2.1 草鱼nrf1克隆与序列分析
经测序得到长度为2035 bp的草鱼nrf1基因序列(NCBI GenBank登记号: OM867543)。本研究克隆验证的CDS区为64—1645 bp, 编码519个氨基酸。分子量为55470.24 Da, 等电点为5.05。包含1个pfam域, 即Nrf1_DNA-bind。
在NCBI中比对氨基酸序列发现, 草鱼nrf1与团头鲂的一致性高达99.42%。系统进化树显示草鱼(Ctenopharyngodon idella)与团头鲂(Megalobrama amblycephala)聚为一支, 亲缘关系较近, 与其他鱼类聚为一簇, 与智人(Homo sapiens)、小白鼠(Mus musculus)、苏门答腊猩猩(Pongo abelii)等哺乳动物亲缘关系较远(图1)。

图1 基于不同物种NRF1氨基酸序列构建的系统进化树(NJ法)Fig.1 Phylogenetic tree of NRF1 in different species based on NJ method
2.2 草鱼nrf1组织表达模式和昼夜节律表达
采用qRT-PCR分析草鱼nrf1组织分布和昼夜节律表达。草鱼nrf1组织分布结果如图2所示, 草鱼nrf1在肝脏、肠道、心脏、肾脏、脾脏、脑和肌肉均有表达, 各组织中表达量有显著差异(P<0.05)。nrf1在肝脏表达量最高, 其次是肠道与心脏, 然后是脾脏和脑, 肾脏和肌肉他组织中表达水平最低(P<0.05)。

图2 nrf1在草鱼不同组织中的表达情况Fig.2 Relative expression of nrf1 gene in different tissues of Ctenopharyngodon idella
肝脏nrf1基因表达昼夜节律如图3所示,nrf1基因的表达具有一定周期性, 且周期约为24h。nrf1表达量在15:00至24:00呈下降趋势, 在24:00至9:00呈上升趋势, 并在9:00达到一天表达量的最大值(P<0.05)。nrf1的 表 达 水 平 在12:00和24:00较 低(P<0.05)。
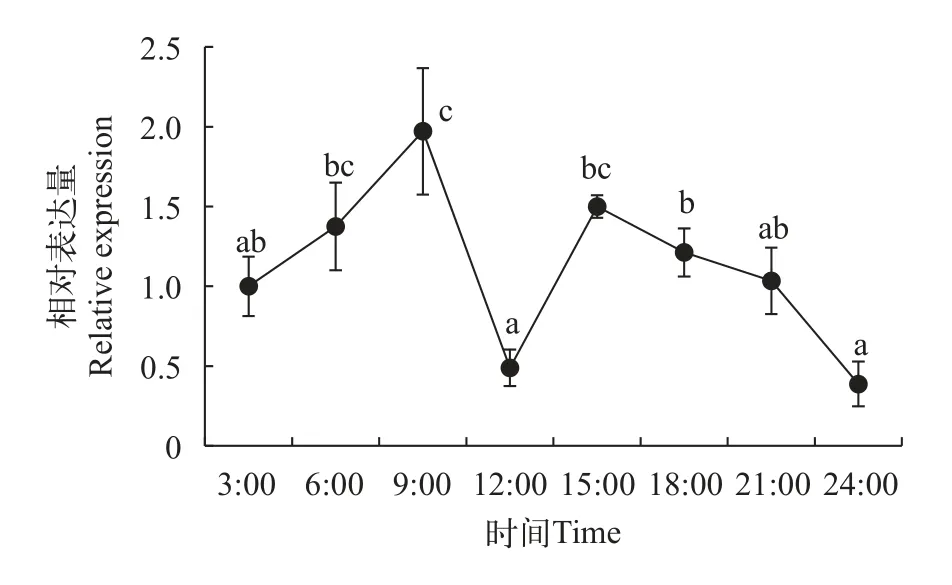
图3 草鱼肝脏nrf1的昼夜变化节律Fig.3 Circadian rhythm of nrf1 in liver of Ctenopharyngodon idella
2.3 氨氮胁迫对草鱼肝脏nrf1基因表达的影响
由图4可见, 经氨氮暴露后24h或48h,nrf1基因无论在低氨氮(5 mg/L)组和高氨氮(20 mg/L)组表达量均显著上升(P<0.05);nrf1在高氨氮胁迫时, 会更早(24h)出现显著上调(P<0.05)。在48h时低氨氮胁迫组nrf1表达量较其24h时的nrf1表达量升高。

图4 氨氮胁迫对草鱼肝脏nrf1基因表达的影响Fig.4 Effect of ammonia nitrogen stress on nrf1 gene expression in liver of Ctenopharyngodon idella
2.4 不同蛋白源对草鱼nrf1基因表达的影响
如图5所示, 饲料蛋白来源对nrf1表达具有显著影响(P<0.05)。在养殖后14d、28d和35d, 草鱼肠道中nrf1基因在菜粕组和豆粕组相对于鱼粉组均出现显著的上调(P<0.05), 其中28d时豆粕组nrf1表达量显著高于鱼粉组和菜粕组(P<0.05), 21d时三者表达量则无显著差异(P>0.05)。
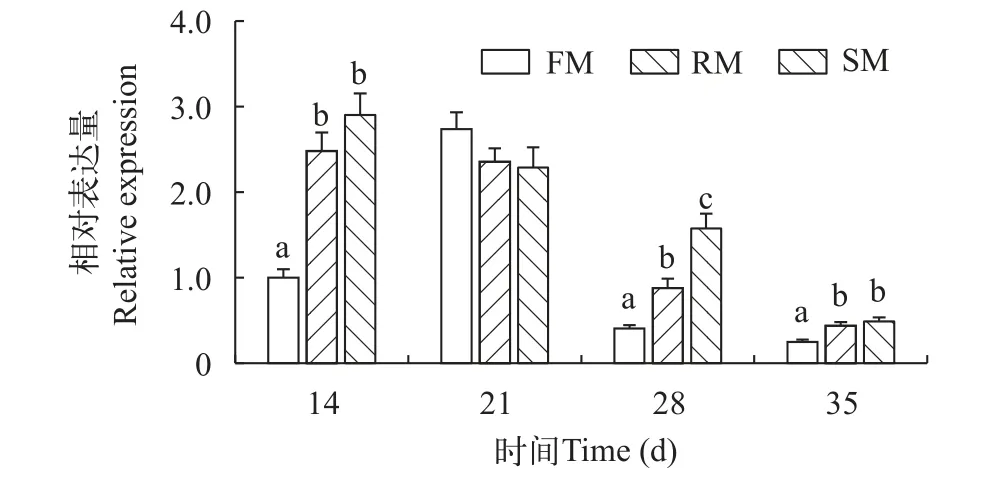
图5 不同蛋白源对草鱼肠道nrf1基因表达的影响Fig.5 Effects of different protein sources on nrf1 gene expression in intestine of Ctenopharyngodon idella
3 讨论
3.1 草鱼nrf1基因序列分析
本研究从草鱼中克隆出nrf1cDNA开放阅读框(Open Reading Frame, ORF)区长度为1560 bp, 编码519个氨基酸, 存在一个Nrf1_DNA-bind保守结构域。鲫(Carassius auratus, XM_026209166)和 鲤(Cyprinus carpio, XM_042740248) ORF区 长 度 均为1518 bp, 斑马鱼(NC_007115) ORF区长度则为1545 bp, 与本文研究相似。NRF1系统发育树结果显示, 草鱼与团头鲂聚为一小支, 其NRF1序列与鱼类的相似性较高, 亲缘较近; 而与哺乳动物的相似性则较低, 亲缘较远。这可能与动物的早期进化过程有关,nrf1在应激过程中发挥着不同的生理功能,以便于动物适应不同环境, 更有利于生存。
3.2 草鱼nrf1基因组织表达及昼夜节律表达分析
NRF1作为转录调节因子[18], 其基因在草鱼体内各组织均有表达, 在肝脏中表达程度最高, 其次是肠道与心脏, 肌肉与肾脏最低。这可能是因为肝脏是动物体内最大的解毒器官, 需要处理各种应激反应, 所以肝脏细胞相较于肌肉与肾脏的细胞更为活跃, 需要nrf1基因高表达以维持肝脏的正常生理功能。但Howe等[19]在斑马鱼上的研究发现,nrf1在斑马鱼卵巢中表达量最高; Brawand等[20]发现nrf1在尼罗罗非鱼(Oreochromis niloticus)肝脏和眼睛中表达量最高, 其次是脑和皮肤, 而在肝脏中的表达量最低, 与本实验的研究结果截然不同。这说明nrf1在不同鱼类中存在组织表达差异性, 可能与nrf1在动物体不同发育时期所发挥功能不同有关。此外, 本实验还研究了草鱼nrf1表达的昼夜变化规律。实验结果显示, 草鱼nrf1表达具有一定的昼夜节律。nrf1表达量在15:00至24:00呈下降趋势, 在24:00至9:00呈上升趋势, 并在9:00达到一天表达量的最大值。nrf1的表达水平在12:00和24:00较低。在本实验养殖期间, 草鱼于8:30、14:30进行投喂,昼夜节律实验期间虽然没有投喂, 但实验鱼还是表现出每日进食后0.5—1h内, 肝脏nrf1基因表达量显著升高。冯军厂等[21]在研究草鱼小肽转运载体PepT1基因时发现, 草鱼中肠端在每日两次投食后,PepT1表达量都会升高; 这是因为PepT1作为肠道小肽转运载体, 草鱼进食后肠道需要增加小肽转运载体的表达量, 满足机体对外源蛋白的消化吸收的需要。Xiao等[22]在研究湘云鲫gls1基因也发现, 喂食后一段时间后gls1基因表达量升高的现象。结合上述研究, 推测这种昼夜节律现象, 可能是由于肝脏作为鱼类体内最大的消化腺和最大的解毒器官, 而草鱼的摄食消化作为一种刺激信号, 诱导其肝脏nrf1基因的表达。
3.3 氨氮胁迫对草鱼nrf1基因表达影响的分析
在大规模集约化的养殖过程中, 投喂的饵料及排泄的粪便会使水体氨氮浓度升高, 较高浓度的氨氮会引起鱼类的氧化应激, 对其生长与健康造成严重损害, 甚至导致死亡[23,24]。氨氮暴露实验结果表明, 草鱼在高氨氮组和低氨氮组均出现nrf1表达量的显著上升, 且高氨氮组则更快速的出现显著上调,但高氨氮组在48h时nrf1表达量出现显著下降, 而低氨氮组则还在上升。与本研究高氨氮组结果相似,黄姑鱼(Nibea albiflora)经96h半致死浓度(20.23 mg/L)氨氮攻毒后, 体内锰-超氧化物歧化酶(Mn-Superoxide dismutase, Mn-SOD)在肝脏与头肾组织中表达水平均呈现先升高后下降的趋势[25]。孙盛明等[26]在团头鲂的研究中也发现谷胱甘肽S-转移酶(Glutathione S-transferase, GST)基因在受到氨氮胁迫后表达水平表现先上升后下降的变化。Cao等[27]对草鱼进行48h氨氮胁迫, 其肠道中抗氧化酶SOD和过氧化氢酶(Catalase, CAT)活性在低氨氮胁迫组(1.7 mg/L)和高氨氮胁迫组(50 mg/L)均显著高于对照组, 且nrf1和hsp90(Heat stress protein 90, 热应激蛋白90)基因在高氨氮组也表现出先显著上调后下调的趋势。结合以上研究结果, 可以推测本实验草鱼经氨氮胁迫后, 高氨氮组nrf1基因之所以表现先升高后下降趋势, 是因为高氨氮浓度的刺激强烈, 使草鱼更快达到氧化应激反应阈值, 肝脏快速表达nrf1, 从而抑制机体氧化应激反应, 至48h时氧化应激反应得到部分抑制, 从而nrf1表达量下降; 而低氨氮胁迫组受到的应激刺激较弱,nrf1表达则相对迟缓,24h时表达水平低于高氨氮胁迫组, 此时机体未能抑制氧化应激反应, 所以低氨氮胁迫组持续表达nrf1至48h。有研究表明, 高密度集约化养殖过程中水体氮浓度最高可达46 mg/L[28], 结合本实验成果进一步探究或可发现nrf1在鱼类抗氧化应激反应过程中的重要作用, 并为解决高密度集约化养殖过程中水体氨氮胁迫提供新的思路。
3.4 不同蛋白源对草鱼nrf1基因表达影响的分析
鱼粉是水产饲料中的优质蛋白源, 但将其用于饲料中的成本较高, 且产量较为有限[29]; 植物性蛋白豆粕与菜粕可以替代鱼粉, 但在生产使用中二者有一定的限制, 植物性蛋白中的抗营养因子如硫葡萄糖苷、单宁、蛋白酶抑制因子等往往会损伤动物肠道上皮细胞, 破坏细胞黏膜层, 诱导肠道炎症,进而对鱼类健康和营养吸收产生毒害影响[30]。养殖实验结果显示, 在14d、28d和35d时, 草鱼肠道中nrf1基因表达水平在菜粕组和豆粕组均显著高于鱼粉饲料组。Krogdahl等[31]以大豆蛋白代替大西洋鲑(Salmo salar)饲料中鱼粉蛋白作为主要蛋白源时,大西洋鲑肠道黏膜酶活性显著下降, 肠道固有层细胞出现炎症反应。进一步研究发现, 以高水平的豆粕替代鱼粉, 不仅会引发大西洋鲑肠道末端炎症,且其肠道末端的胰蛋白酶活性显著升高, 但近侧小肠的胰蛋白酶活性却下降; 此外, 豆粕还能调节鱼体内17个组织胰蛋白酶的转录活性, 对胃、肠道和大脑组织的影响最为显著[32]。血清碱性磷酸酶(Alkaline phosphatase, ALP)活性是判断肝脏损伤的一项重要指标。在吉富罗非鱼(Oreochromis niloticus)中的研究发现, 饲料中添加高水平菜粕会导致罗非鱼血清SOD活性降低, 碱性磷酸酶活性升高, 这表明长期摄食菜粕造成鱼抗氧化能力下降, 生物体内自由基超标, 机体组织器官诱发炎症反应, 进而造成肝脏损伤[33]。分析本研究实验结果, 推测草鱼投喂高菜粕与高豆粕饲料导致nrf1基因表达量显著上调的原因是豆粕和菜粕中存在着多种抗营养因子,造成肠道上皮细胞损伤, 诱发草鱼肠道炎症反应。进而草鱼激活体内的抗氧化反应体系, 上调nrf1等炎症调节因子的表达, 以抑制肠道中炎症反应。然而在本实验21d时, 鱼粉组、豆粕组和菜粕组三者在nrf1基因表达水平上无显著差异。分析原因可能是本次取样期间的气温突然升高引起。有研究表明, 小黄鱼受到高温胁迫时, 其体内热应激蛋白hsp90b1和hspb1表达量显著升高, 应激水平显著上升[34]。因此, 在本实验21d取样时, 可能由于突然高温, 导致草鱼体内应激水平显著上升,nrf1基因的表达显著上调, 甚至掩盖了饲料对其影响, 从而出现nrf1基因在各处理组表达水平无显著差异的实验结果。
4 结论
本研究通过同源克隆得到了草鱼nrf1的基因序列, 该序列编码519个氨基酸。在所有研究的组织中,nrf1在肝脏组织中表达量最高。昼夜节律实验结果表明nrf1在草鱼体内具有一定的昼夜表达周期, 并在9:00出现每日最高表达量。水体中低氨氮浓度(5 mg/L)和高氨氮浓度(20 mg/L)均能显著促进肝脏nrf1基因的表达。分别以鱼粉、豆粕和菜粕为主要蛋白源的饲料投喂草鱼, 在养殖后14d、28d和35d时, 肠道nrf1基因表达水平在豆粕组与菜粕组相对鱼粉组均显著升高。综上所述, 本研究揭示了草鱼nrf1基因的分子特征, 并证实其在氧化应激反应和炎症反应中的响应调节作用。本研究为后续开展nrf1基因调控鱼类应激反应的分子机制的研究提供理论基础。

