黄河调水调沙对河口及邻近海域鱼卵、仔稚鱼群落结构的影响
杨艳艳 朱明明 宋泉清 王秀霞 李 凡 张孝民 逄志伟 苏 博
(1.山东省海洋资源与环境研究院, 山东省海洋生态修复重点实验室, 烟台 264006; 2.海阳市海洋与渔业综合服务中心,海阳 265100; 3.日照市岚山区海洋与渔业监督监察大队, 日照 276808)
黄河是世界上含沙量最多的河流, 属世界第五大长河, 也是中国的第二长河, 具有径流量年际、年内变化大等特点。黄河口位于莱州湾和渤海湾的交汇处, 地处暖温带北缘, 是我国重要的河口之一[1]。受到黄河入海所携带淡水和养分的影响, 黄河口及其邻近海域饵料生物充足, 拥有较高的初级生产力, 使其成为众多海洋生物摄食、生长和繁衍的重要栖息地[2,3]。
鱼卵、仔稚鱼是黄河口生态系统中的重要生物类群, 在黄河口生态系统物质循环和能量流动中发挥着至关重要的作用。黄河口海域鱼卵、仔稚鱼的种类组成、数量分布、群落结构及多样性分布差异等也是评估该海域渔业资源补充量及河口生态系统健康的重要指标[4—6]。调水调沙是由中国黄河水利委员会自2002年开始实施的一项水沙整治计划, 主要目的是为解决黄河水沙过程不协调、下游河道淤积等问题。调水调沙的主要手段是每年夏季(雨季)通过水库的联合调度, 在短时间内向黄河流域输送大量的水沙, 以改善径流和减少黄河泥沙的淤积。调水调沙对黄河口附近海域生态环境影响非常明显, 而这种生境的改变势必对鱼卵、仔稚鱼的群落结构时空分布格局造成一定的影响[7]。有关黄河口及其邻近海域鱼卵、仔稚鱼的研究已有开展, 但其中涉及调水调沙对鱼卵、仔稚鱼群落结构影响的研究相对较少[1,8—11]。
本文基于2017年和2018年黄河口海域鱼卵、仔稚鱼的调查数据, 对该海域非调水调沙年和调水调沙年不同阶段鱼卵、仔稚鱼的丰度、数量变化、空间分布等进行分析比较, 综合探讨了调水调沙对该河口区域鱼卵、仔稚鱼群落结构的影响, 研究结果对于了解黄河水沙通量对鱼卵、仔稚鱼的影响及河口鱼类资源的可持续利用、评估黄河调水调沙生态影响评价等方面具有非常重要的现实意义。
1 材料与方法
1.1 调查时间和站位
本研究的调查区域位于37.67°—38.15°N和119.11°—119.67°E, 黄河入海口附近水深20 m以浅的区域, 于2017年和2018年的6—7月期间开展了6个航次的鱼卵、仔稚鱼调查, 覆盖了非调水调沙年和调水调沙年不同阶段的水排放和输沙变化情况。其中2017年(非调水调沙年)的调查时间为6月18—20日、7月9—11日和7月25—27日, 为了便于进行比较, 将2017年的3次调查分别称为前期、中期和后期; 2018年(调水调沙年)的调查时间为6月20—22日(调水调沙前期)、7月7—9日(调水调沙中期)和7月25—27日(调水调沙后期)。调查期间依据与黄河入海口的距离布设站位, Ⅰ断面(B1、C1 和D1)距入海口 5 km, Ⅱ断面(A2、B2、C2、D2 和E2)距入海口10 km, Ⅲ断面(A3、B3、C3、D3 和E3)距入海口 20 km, Ⅳ断面(A4、B4、C4、D4 和E4)距入海口40 km, 2017年和2018年均设置18个调查站位(图1)。
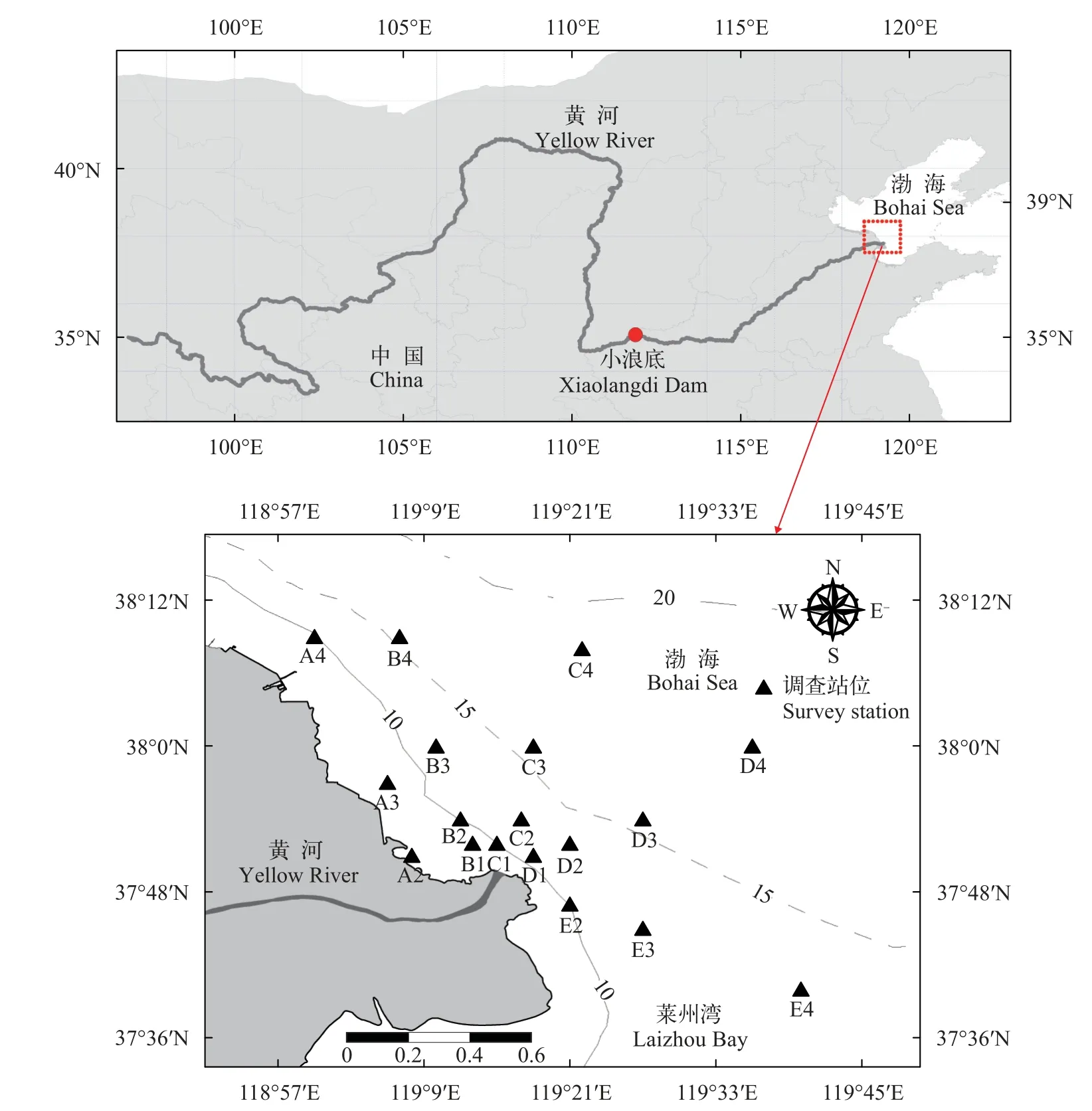
图1 调查站点Fig.1 Sample station
1.2 样品的采集与分析
鱼卵、仔稚鱼样品采集及分析方法严格按照《海洋调查规范 第 6 部分: 海洋生物调查》(GB/T 12763.6-2007)进行[12]。采用大型浮游生物网(口径为 80 cm、长为 280 cm、网目尺寸为0.505 mm)逐站进行表层水平拖网采样, 每站拖10min, 拖速为2 n mile/h, 样品用 5% 福尔马林海水溶液固定保存带回实验室。根据鱼卵、仔稚鱼的形态特征(包括鱼卵和仔稚鱼的外部形态及不同发育时期的个体形态和组织、器官、系统发育特征等)利用解剖镜进行种类鉴定, 并计数[13—15]。定量资料取自水平网采数据, 以每网的实际数量(粒、尾)为指标计算鱼卵、仔稚鱼的密度(粒或尾/网)。
浮游动物(Zooplankton abundance, ZA)和浮游植物(Phytoplankton abundance, PA)样品分别使用浅水Ⅰ型、Ⅲ型浮游生物网由底层至表层垂直拖网采集, 样品均用5%福尔马林溶液现场固定, 带回实验室进行定量定性分析。样品的采集、保存及分析也均按照《海洋调查规范-第6部分: 海洋生物调查》(GB/T 12763.6-2007)执行[12]。
环境因子中的海水表层温度(Sea surface temperature, SST)、海水表层盐度(Sea Surface salinity, SSS)、水深(Depth, DEP)、pH、溶解氧(Dissolved oxygen,DO)及叶绿素a(Chlorophyll-a, Chl.a)等因子均使用XR-420型CTD现场测定, 悬浮物(Suspended particle matter, SPM)样品采集后带回实验室分析, 分析方法参照《海洋监测规范 第4部分: 海水分析》(GB/T 17378.4-2007)执行[16]。
1.3 数据处理
优势种利用相对重要性指数(Index of Relative Importance, IRI)对鱼卵和仔稚鱼的优势种进行计算, 公式[5]:
式中,N%为某一种类个体数量占采获总量的百分比;F%为某一种类出现的站位数占总调查站位数的百分比, IRI 不小于1000的种类为优势种。
生物多样性物种丰富度指数(D)计算公式[17]:
香农-威纳多样性指数(H′)计算公式:
均匀度指数(J′)计算公式:
式中,S为种类数;N为总个体数;Pi为第i种个体数占总个体数的比例。
群落结构分析采用PRIMER6.0对黄河口及邻近水域鱼卵、仔稚鱼的群落结构进行聚类分析。将鱼卵、仔稚鱼数据进行对数转换log2(x+1),得到不同站位间的种类组成Bray-Curtis相似性系数矩阵, 采用等级聚类(Cluster)划分为不同的类群, 研究黄河口及邻近水域鱼卵、仔稚鱼群落空间结构。采用单因子相似性分析(Analysis of similarities, ANOSIM)研究不同类群之间的群落种类组成的差异显著性。应用相似性百分比分析(Similarity percentage analysis, SIMPRE)方法分析造成各类群群落结构相似的典型种和造成组间群落结构差异的分歧种, 以及各鱼种对站位组内相似性和组间相异性的贡献率。
环境因子相关关系分析采用Canoco5.0对鱼卵、仔稚鱼群落结构与环境因子之间的关系进行分析并绘制排序图, 以揭示不同环境因子对鱼卵、仔稚鱼的影响。首先对物种数据进行除趋势对应分析(Detrended correspondence analysis, DCA),根据每个轴的梯度长度(Length of the gradient, LGA)选择适宜的排序方法。当LGA<3选择冗余分析(Redundancy analysis, RDA), 3<LGA<4时, 选择冗余分析(RDA)或者典范对应分析(Canonical correspondence analysis, CCA)均可[18]; 当LGA>4时, 则可运用典范对应分析(CCA)[19]。根据DCA分析结果, 本文均选择冗余分析(RDA)。分析时鱼卵、仔稚鱼丰度数据不做转换, 环境数据除pH外, 其余均做log转换。
图 件 绘 制 使 用ArcGIS 10.6、SURFER15.0、Excel 2016完成。
2 结果
2.1 环境因子变化
调查期间黄河入海水沙通量变化分析据黄河利津站监测数据显示, 2018年的径流量和输沙量远大于2017年(图2)。2018年7月3—30日随着调水调沙计划的实施, 小浪底站开始释放洪水, 利津站在7月11日观测到最大日径流量为3550 m3/s, 最大输沙量为43.4 kg/m3。由于黄河口海域与利津站存在一定距离, 径流和输沙负荷峰值预计10h之后到达黄河口海域。
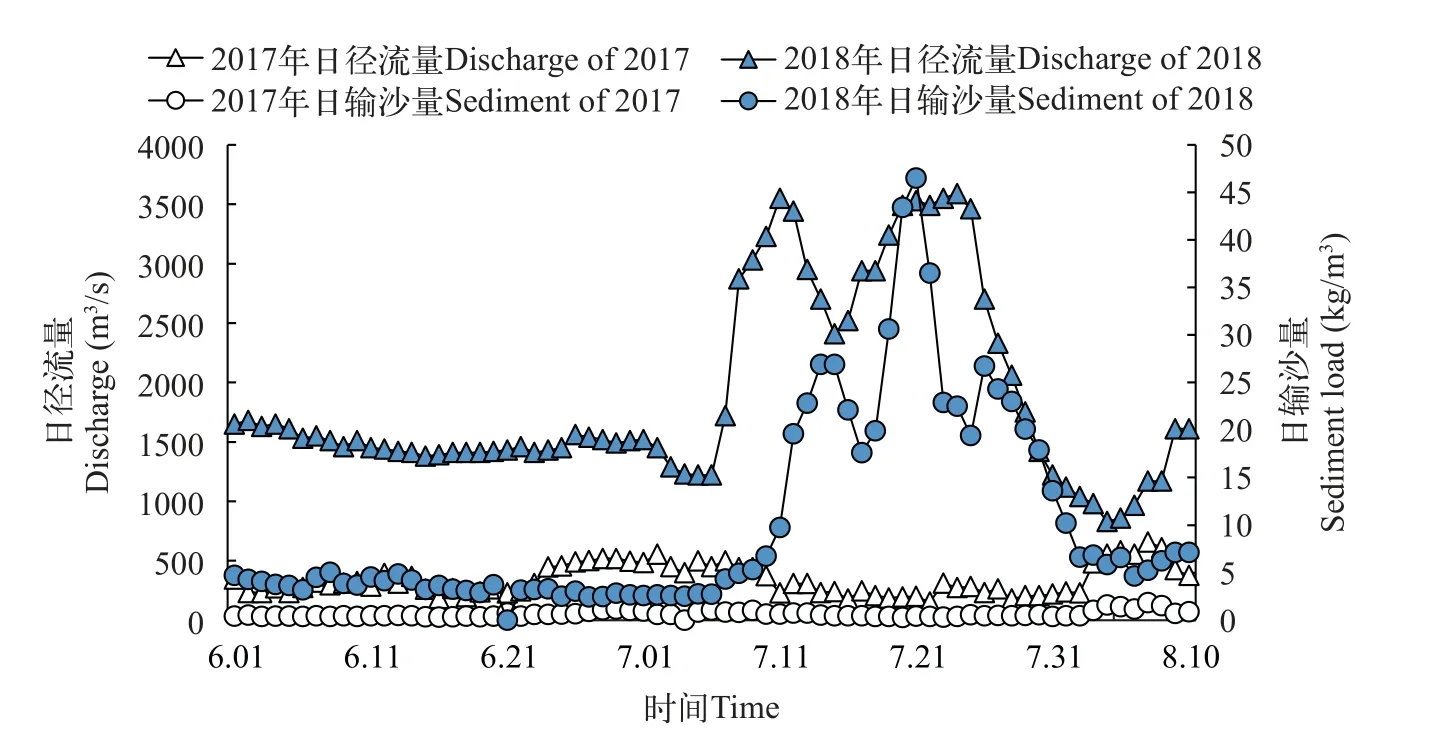
图2 2017年和2018年利津站径流和输沙变化Fig.2 Changes in runoff and sediment transport at Lijin Station in 2017 and 2018
环境因子变化分析2017年, 表层水温由河口向近海呈现出显著的梯度变化, 随着调查时间的推进水温有逐渐升高的趋势, 河口北部水温低于南部; 由于2017年没有实施调水调沙计划, 所以调查期间表层盐度受入海冲淡水的影响相对减少, 整体呈现比较平稳的状态, 从河口向近海呈现逐渐上升的趋势; 叶绿素a浓度在调查前期和中期均在河口东北部海域存在一个高值区, 由于2017年没有调水调沙的干扰, 所以前期和中期叶绿素a浓度整体变化较小, 进入后期河口南部的叶绿素a浓度整体高于北部; 在调查前期和后期, 悬浮物浓度从河口向近海呈现出下降的趋势, 中期则是由河口向外海逐渐升高; pH的高值区在前期主要分布在河口南部海域, 中期开始向北部扩散, 进入后期调查海域的pH均超过8; 调查海域的平均溶解氧浓度以前期最高后期最低, 中期整体呈现由河口向外海升高的趋势(图3和表1)。
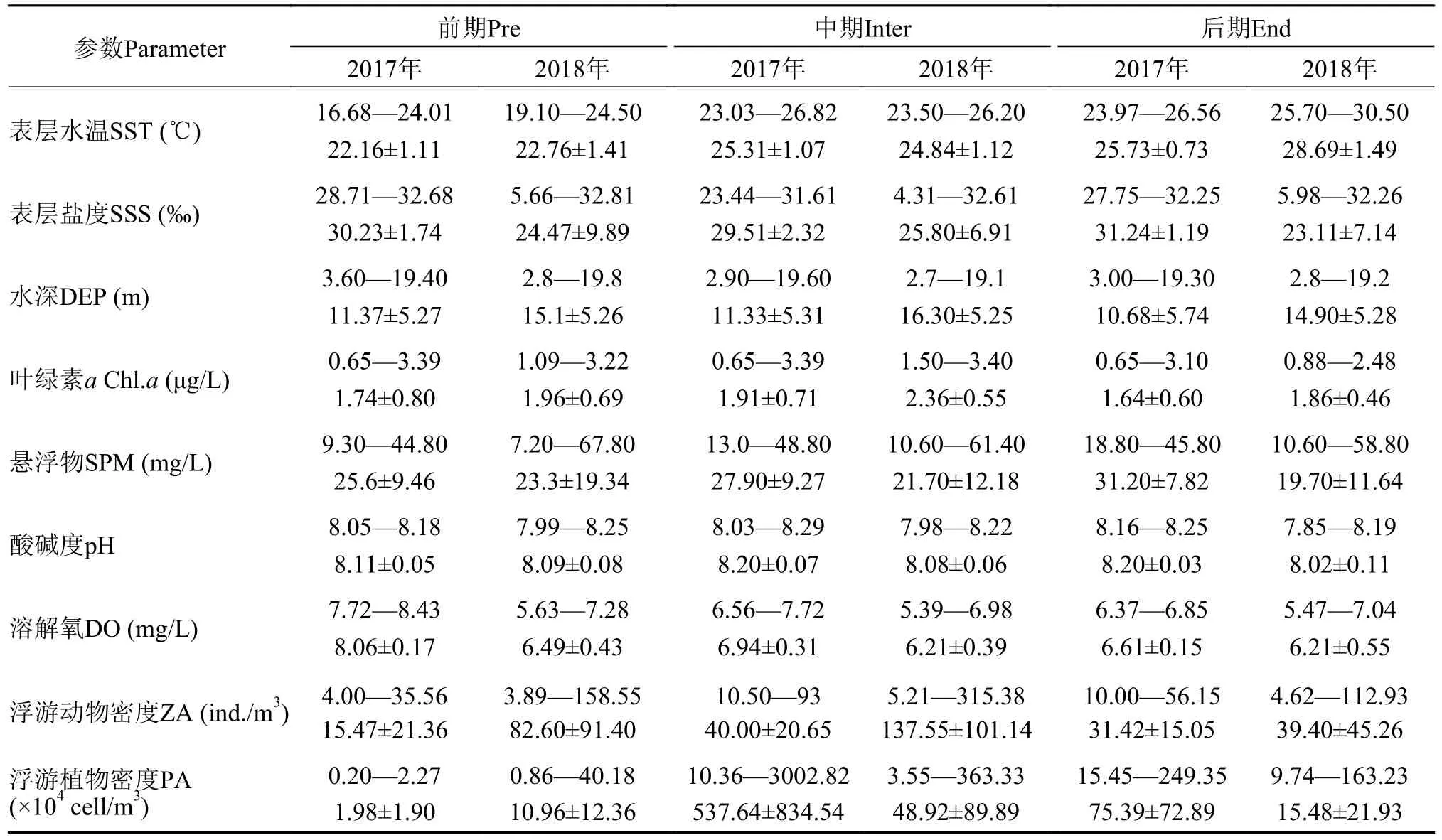
表1 黄河口及邻近海域环境因子组成Tab.1 Composition of environmental factors in the Yellow River estuary
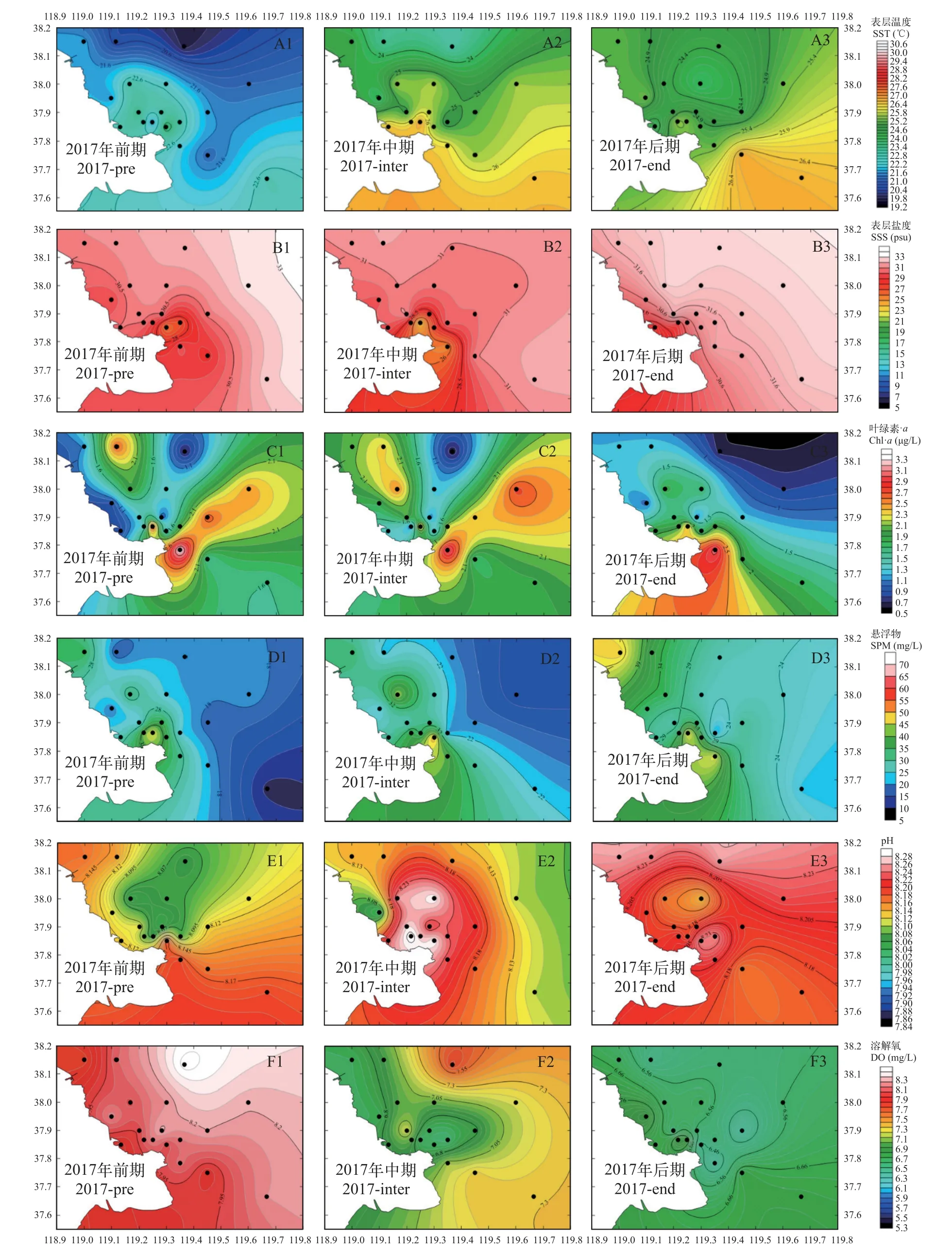
图3 2017年环境因子的分布Fig.3 Temporal and spatial variation of environmental factors in 2017
受调水调沙的影响,整体来看2018年各调查阶段环境因子变化较大。表层水温随着时间的推进呈现出逐渐升高的趋势, 前期水温整体偏低, 平均22.76℃, 进入中期以后平均水温上升至24.86℃,在河口北部海域形成一个小范围高值区, 后期阶段调查海域以高温占据主导, 河口北部的高值区向外海扩散; 表层盐度整体呈现河口附近海域低外海高的趋势, 前期和中期均在河口北部近海形成明显的低盐区, 进入后期受到入海冲淡水的影响, 低盐区范围开始向河口南部海域扩散; 前期叶绿素a浓度整体呈现河口西部低东部高的趋势, 在河口东部形成大范围高值区, 进入中期以后河口西北部的小范围高值区范围扩大, 此阶段仅在河口东北部留有一个低值区, 随着时间的推移后期调查海域的叶绿素a浓度整体呈现下降的趋势, 且从河口近岸向外海逐渐降低; 悬浮物平均浓度以前期最高, 进入中期以后从河口近岸海域向外海逐渐降低, 后期仅在河口北部近岸形成一个小范围高值区; 前期在河口近岸的北部和东部分别形成一个pH的高值区, 进入中期以后受入海水沙通量等因素变化的影响, 调查海域的pH整体呈现由河口向外海升高的趋势; 在整个调查期间, 海域的溶解氧浓度始终呈现由河口向外海升高的趋势, 并且随着调查时间的推进, 溶解氧的低值区范围有扩大的趋势(图4和表1)。
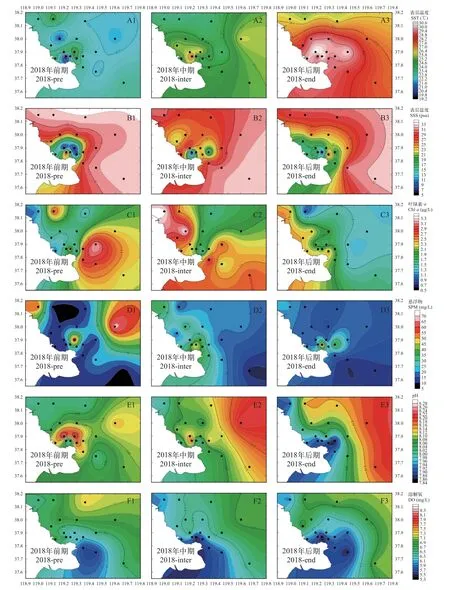
图4 2018年环境因子的分布Fig.4 Temporal and spatial variation of environmental factors in 2018
2.2 种类组成和数量变化
6个航次调查共采集鱼卵、仔稚鱼15种, 隶属于8目12科14属, 有1种虾虎鱼科仔稚鱼鉴定到科(表2)。鲱形目2科4种, 占采集鱼卵、仔稚鱼种类的26.67%; 鲈形目(包括虾虎鱼)3科3种, 占采集鱼卵、仔稚鱼种类的20%; 鲽形目和刺鱼目分别为2科2种, 1科2种, 各占采集鱼卵、仔稚鱼种类的13.33%; 颌针鱼目、鼠目、银汉鱼目和鲉形目各1科1种, 分别占采集鱼卵、仔稚鱼种类的6.67%。调查海域内的鱼卵、仔稚鱼对应的产卵亲体主要以暖温种为主(6种), 暖水种其次(5种), 冷温种最少(3种); 从产卵亲体的栖所类型来看, 主要以浅水中上层鱼类为主要组成, 浅水底层和中底鱼类次之。
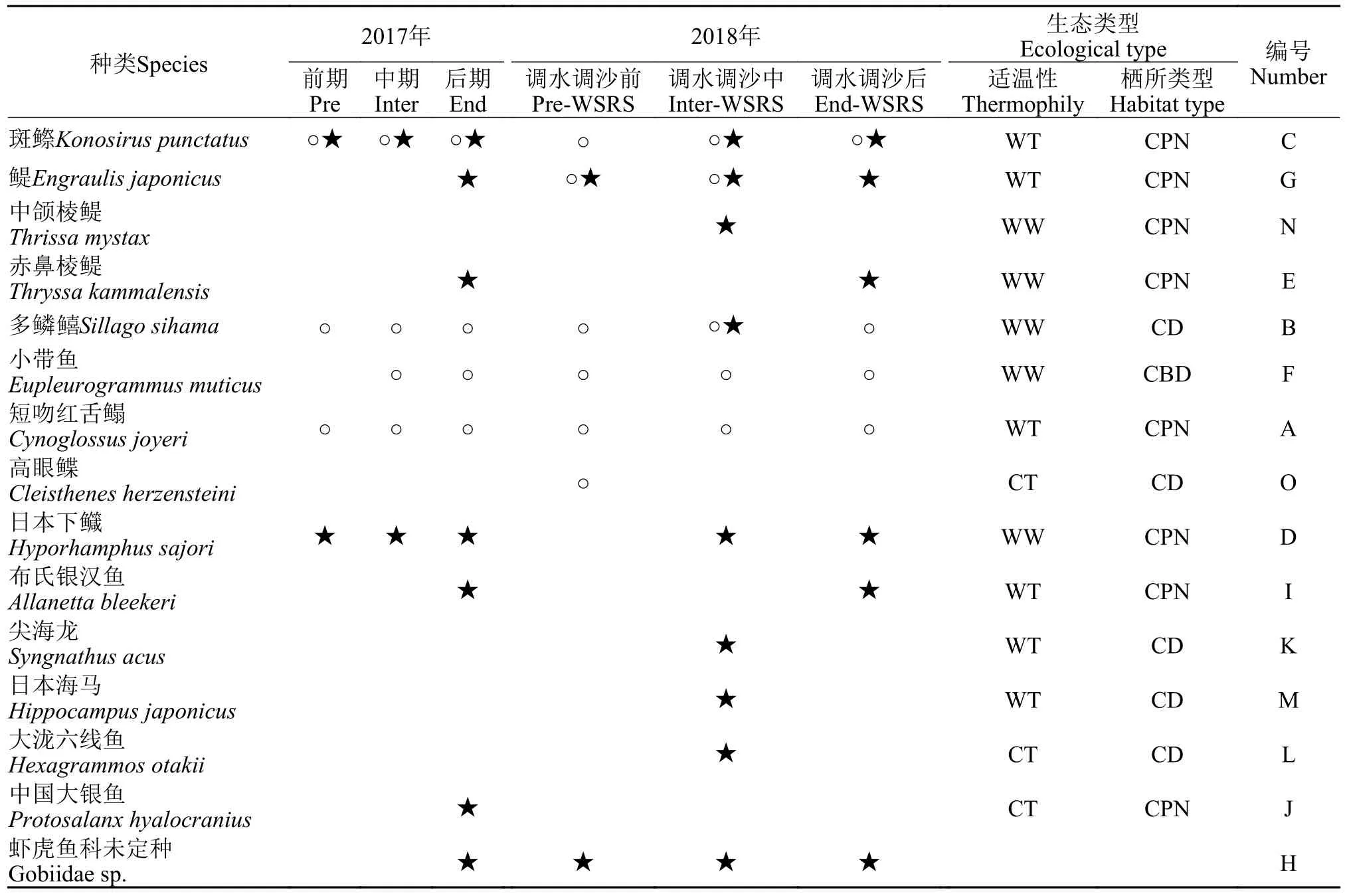
表2 黄河口及邻近海域鱼卵、仔稚鱼种类组成Tab.2 Composition of ichthyoplankton in the Yellow River estuary
调查期间采获鱼卵6212粒, 其中, 2017年3个航次采获鱼卵2108粒, 2018年3个航次采获鱼卵4104粒; 共采获仔稚鱼431尾, 2017年3个航次采获仔稚鱼194尾, 2018年3个航次采获仔稚鱼237尾。从各航次采获鱼卵的数量分布来看, 2017年鱼卵和仔稚鱼数量均是以调水调沙后期最高, 2018年的鱼卵数量以调水调沙中期最高, 仔稚鱼数量则以调水调沙前期最高。2018年采获的鱼卵和仔稚鱼数量均高于2017年(图5)。
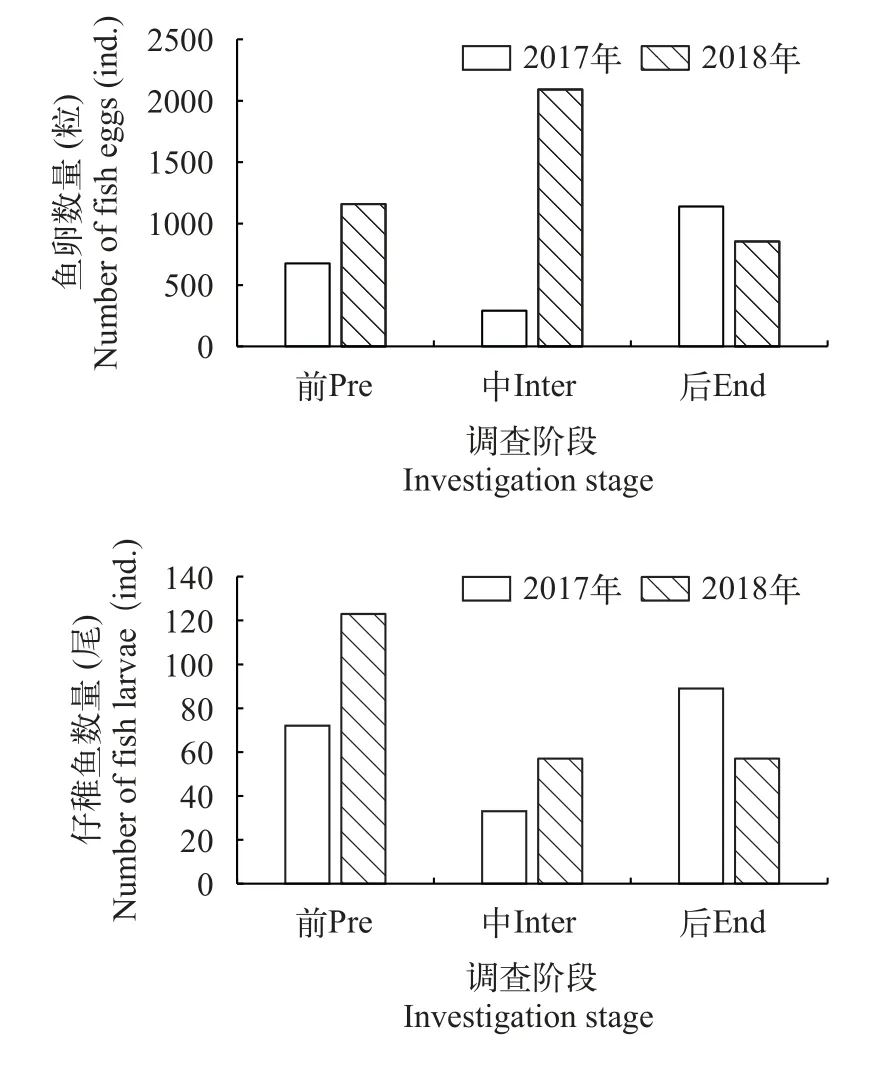
图5 鱼卵、仔稚鱼数量变化Fig.5 Changes in the number of fish eggs and larvae
2.3 鱼卵、仔稚鱼群落的空间分布
2017年, 前期鱼卵主要分布在河口的东南和北部沿海, 以距离河口较远的断面Ⅲ的E3站鱼卵密度最高, 为226粒/站, 短吻红舌鳎(Cynoglossus joyeri)为优势种群, 多鳞(Sillago sihama)和斑鰶(Konosirus punctatus)为重要种群; 中期鱼卵主要分布在河口的北部沿海, 同样以距离河口较远的断面Ⅲ的A3站和断面Ⅳ的D4站密度最高, 均为63粒/站, 短吻红舌鳎、斑鰶和多鳞为这一时期鱼卵的重要种群; 进入后期鱼卵的分布仍主要集中在北部沿海, 断面Ⅳ的B4站为鱼卵密度最高的站位, 为256粒/站, 短吻红舌鳎和多鳞分别为鱼卵的优势种群和重要种群。2018年3个航次的鱼卵均主要集中分布在河口的东南和西北沿海分布, 丰度整体呈现先升高后下降的趋势, 以调水调沙中期鱼卵丰度最高, 调水调沙后期鱼卵丰度最低, 除后期外其余各航次鱼卵丰度均高于2017年。其中, 调水调沙前期以断面Ⅲ的D3站鱼卵密度最高, 为682粒/站, 鳀(Engraulis japonicus)和短吻红舌鳎为鱼卵的优势种群, 多鳞为鱼卵的重要种群; 调水调沙中期以断面Ⅲ的E3站鱼卵丰度最高, 为1260粒/站, 斑鰶和短吻红舌鳎为重要种群; 调水调沙后期鱼卵的丰度呈现显著下降的趋势, 以断面Ⅳ的D4站鱼卵丰度最高, 达233粒/站, 短吻红舌鳎为这一时期的优势种群, 斑鰶和多鳞为重要种群(图6)。
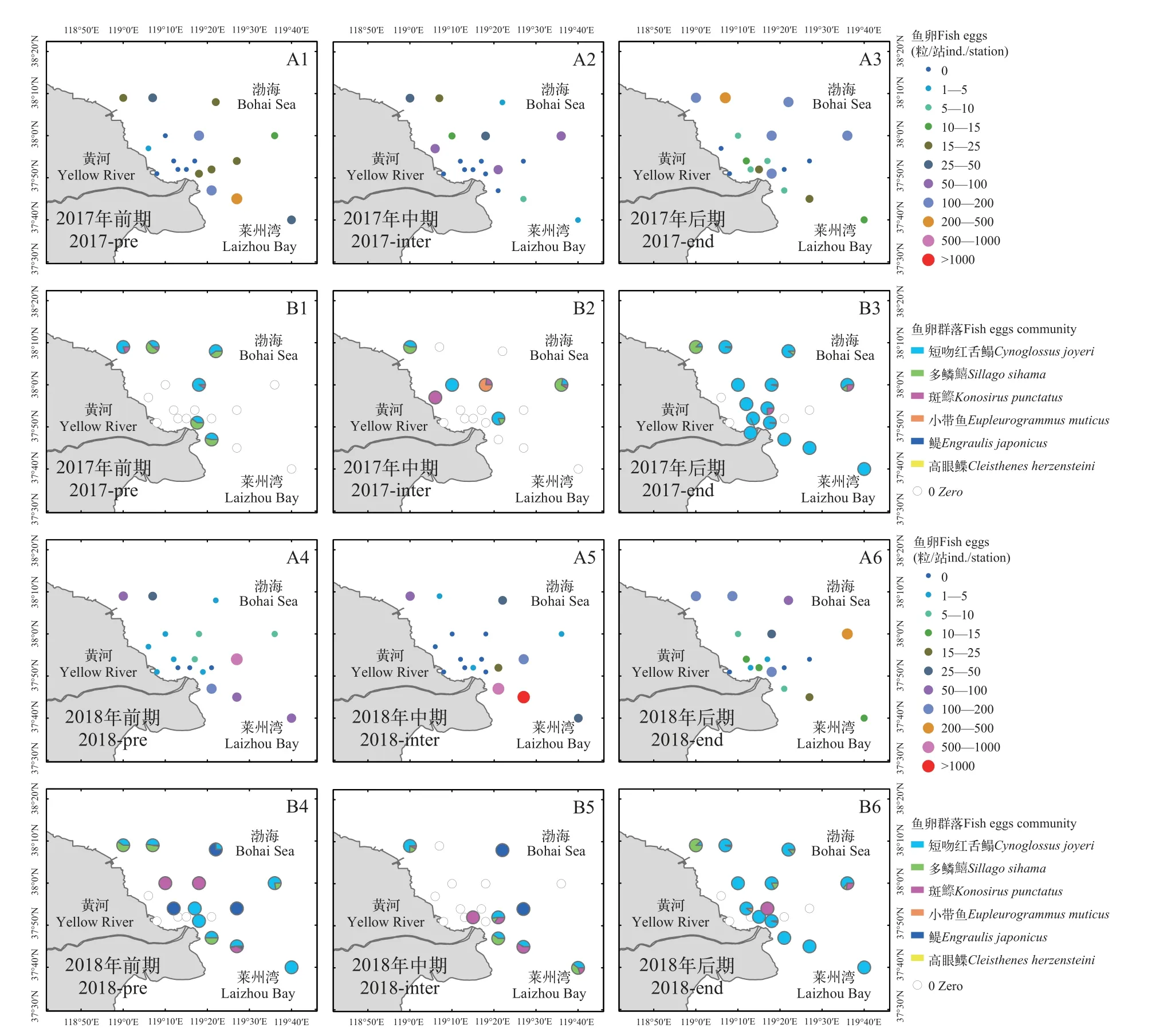
图6 黄河口海域鱼卵的空间分布Fig.6 Spatial distribution of fish eggs
2017年随着调查时间的推进仔稚鱼的丰度整体呈现先下降后上升的趋势, 前期仔稚鱼主要集中在河口东北部沿海分布, 河口附近断面Ⅰ的D1站仔稚鱼密度最高, 为30尾/站, 以斑鰶为优势种群; 中期仔稚鱼主要分布在河口西部沿海, 以断面Ⅰ的C1站仔稚鱼密度最高, 为10尾/站, 斑鰶和日本下鱵(Hyporhamphus sajori)分别为仔稚鱼的优势种群和重要种群; 进入后期仔稚鱼丰度达到峰值, 以距离河口较近的断面Ⅰ的D1站仔稚鱼密度最高, 为36尾/站, 赤鼻棱鳀(Thryssa kammalensis)、日本下鱵和鳀为重要种群。2018年仔稚鱼的丰度整体呈现先下降后持平的趋势, 以调水调沙前期仔稚鱼的丰度最高, 调水调沙中期和后期仔稚鱼的丰度相同。调水调沙前期仔稚鱼主要集中分布在河口的东北沿海分布, 断面Ⅰ的D1站仔稚鱼密度最高, 为120尾/站,鳀为这一时期的重要种群; 进入调水调沙中期, 仔稚鱼丰度开始下降, 平均密度为3.2尾/站, 断面Ⅰ的B1站仔稚鱼密度最高, 为16尾/站, 斑鰶为重要种群;进入调水调沙后期, 仔稚鱼依然主要集中在距河口较近的断面Ⅰ, 以D1站仔稚鱼密度最高, 为16尾/站,赤鼻棱鳀、日本下鱵和虾虎鱼科鱼类为重要种群(图7)。
2.4 物种多样性指数的空间分布
从多样性指数(H′)的空间分布情况来看,2017年, 前期河口东北沿海多样性水平(H′)较高, 进入中期以后高值区向河口东部移动, 后期多样性指数(H′)的空间变化较小, 高值区仍然停留在河口东部沿海, 最高值出现在河口东部的D4站(图8);2018年, 调水调沙前期多样性(H′)整体处于较低水平, 高值区主要集中在河口的东南沿海, 调水调沙中期多样性(H')水平整体上升, 高值区在河口西北和东北沿海均有分布, 调水调沙后期多样性(H′)的高值区向河口东部移动, 最高值再一次出现在东部的D4站。
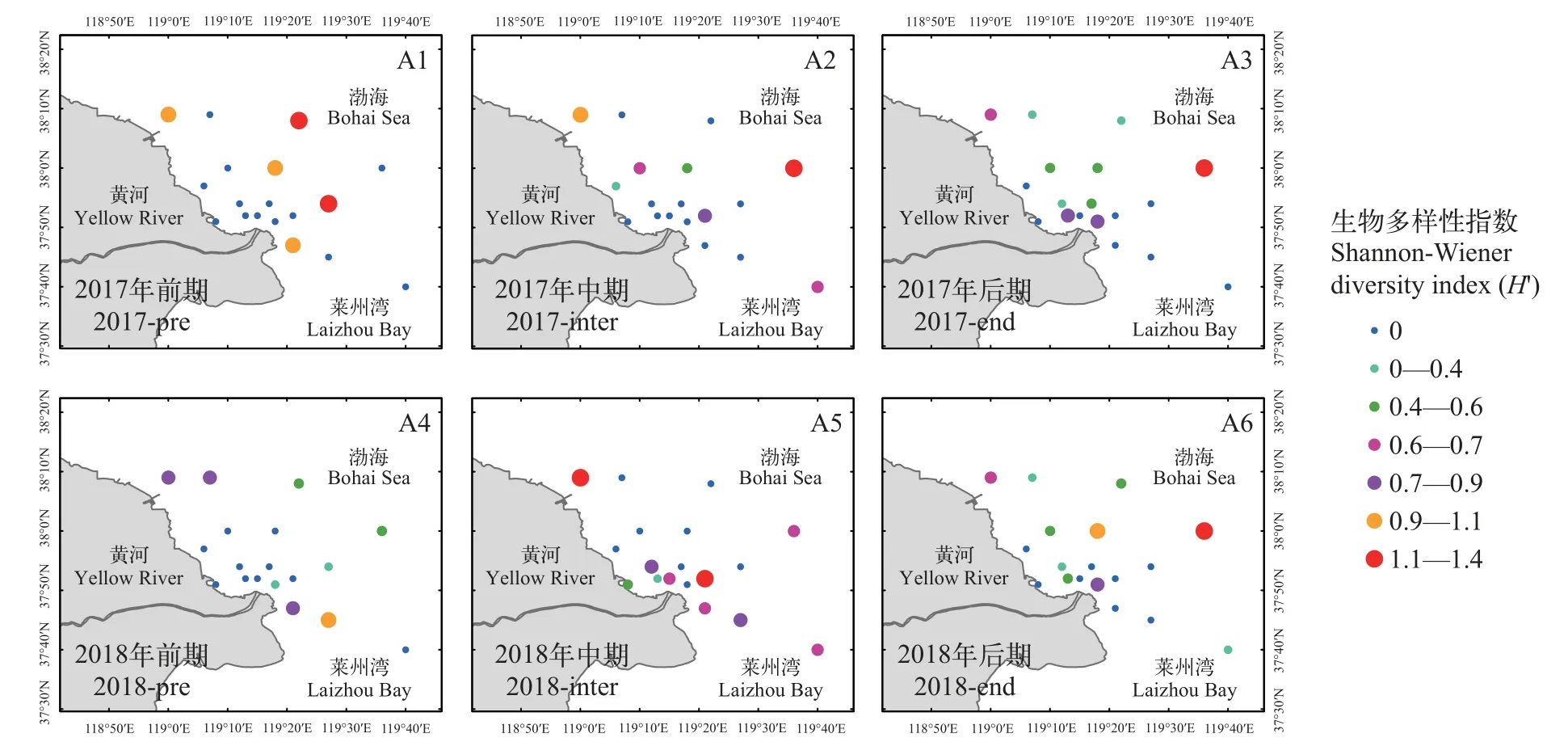
图8 黄河口海域鱼卵、仔稚鱼生物多样性的空间分布Fig.8 Spatial distribution of biodiversity in the Yellow River estuary
2.5 群落空间结构
2017年, 鱼卵、仔稚鱼的群落结构在22.44%(聚类模式: 完全连锁)的相似性指数水平上可分为3个类群(图9), 相似性检验(ANOSIM)结果表明鱼卵、仔稚鱼群落结构之间差异极显著(GlobalR=0.725,P=0.001<0.01)。群落1分布在河口近岸北部和东南沿海, 包括A2、A3、B1、C1和D3五个站位; 群落2主要分布在河口北部沿海, 包括A4、B4、C3、C4、D1、D2、D4和E2八个站位; 群落3主要沿河口近岸北部分布, 包括B2、B3、C2、E4四个站位。相似性百分比(SIMIPER)分析表明,群落1的组内相似性为55.81%, 主要代表种为斑鰶和短吻红舌鳎; 群落2的组内相似性为70.01%, 主要代表种为短吻红舌鳎和多鳞; 群落3的组内相似性为71.21%, 主要代表种为短吻红舌鳎。群落1和群落2的相异性为54.83%, 群落间的主要分歧种为短吻红舌鳎和多鳞; 群落1和群落3的相异性为61.28%, 群落间的主要分歧种为斑鰶和短吻红舌鳎;群落2和群落3的相异性为64.41%, 群落间的主要分歧种为多鳞、短吻红舌鳎和斑鰶。

图9 2017年黄河口海域鱼卵、仔稚鱼群落结构Fig.9 Community structure of ichthyoplankton in the Yellow River estuary in 2017
2018年(调水调沙年), 鱼卵、仔稚鱼的群落结构在13.41%(聚类模式: 完全连锁)相似性指数水平上分为4个类群(图10), 相似性检验(ANOSIM)结果表明鱼卵、仔稚鱼群落结构之间差异极显著(GlobalR=0.704,P=0.001<0.01)。群落1分布在河口东北部沿海, 包括C4、D1和D3三个站位; 群落2主要分布在河口东部沿海, 包括A2、B2、B4、C3、D2、D4、E2—E4九个站位; 群落3主要分布在河口的西部沿海, 包括A3一个站位; 群落4主要分布在河口西部沿海, 包括A2、B1、B3、C1和C2五个站位。相似性百分比(SIMIPER)分析表明, 群落1的组内相似性为57.68%, 主要代表种为鳀、短吻红舌鳎和多鳞; 群落2的组内相似性为57.82%, 主要代表种为短吻红舌鳎、多鳞和斑鰶; 群落3只有1个站位, 无法比较组内相似性; 群落4的组内相似性为52.47%,主要代表种为斑鰶和短吻红舌鳎。群落1和群落2的相异性为57.83%, 群落间的主要分歧种为鳀和短吻红舌鳎; 群落4和群落3的相异性为100%, 群落间的主要分歧种为斑鰶和短吻红舌鳎; 群落4和群落2的相异性为64.29%, 群落间的主要分歧种为短吻红舌鳎和多鳞; 群落3和群落2的相异性为100%, 群落间的主要分歧种为短吻红舌鳎和多鳞; 群落4和群落1的相异性为87.21%, 群落间的分歧种为鳀; 群落3和群落1的相异性为100%, 群落间的主要分歧种为鳀和短吻红舌鳎。
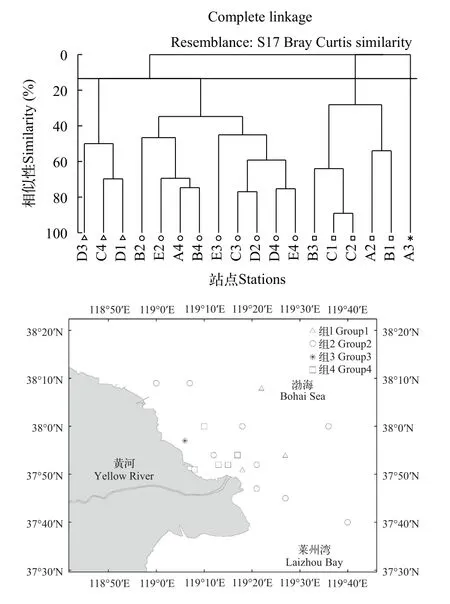
图10 2018年黄河口海域鱼卵、仔稚鱼群落结构Fig.10 Community structure of ichthyoplankton in the Yellow River estuary in 2018
2.6 鱼卵、仔稚鱼群落结构与环境因子关系分析
2017年鱼卵、仔稚鱼的群落结构与浮游植物丰度、溶解氧浓度、表层水温和水深等相关性较大(表3)。优势种短吻红舌鳎偏好水深较深和低温的环境, 重要种多鳞偏好水深较深和低浮游植物丰度的环境, 斑鰶则偏好高pH和低温的环境。RDA排序图显示, 第一和第二排序轴的特征值分别为0.4675和0.0606, 分别解释了87.35%和11.32%的物种变化信息(表3)。
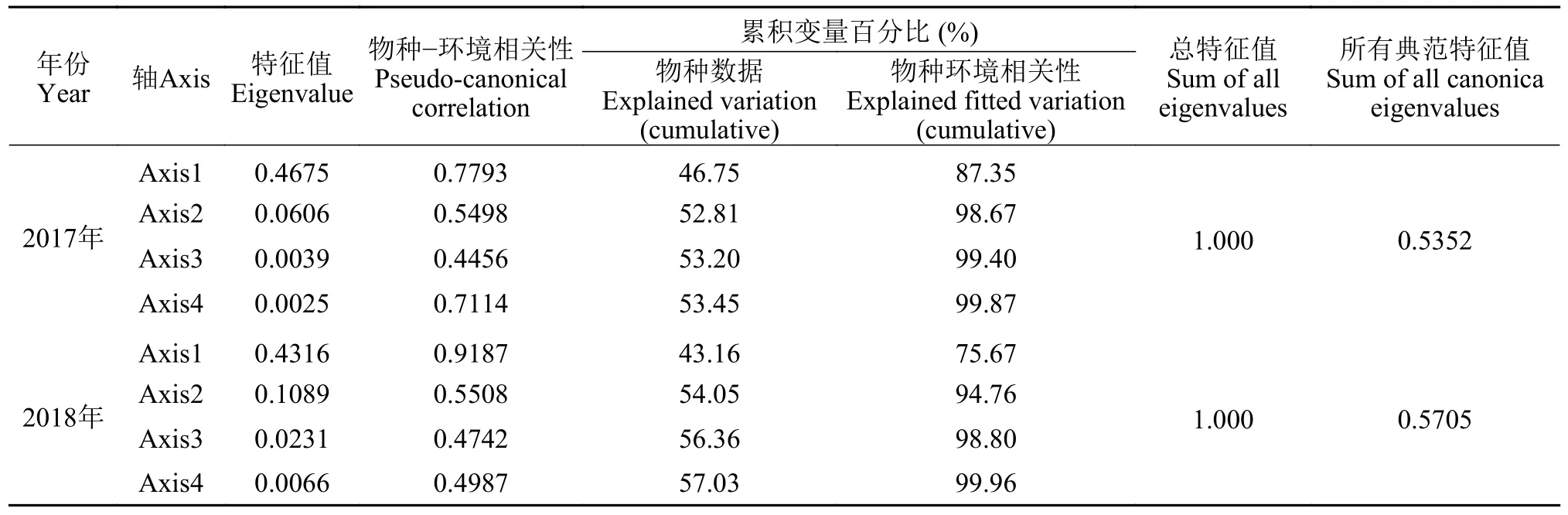
表3 鱼卵、仔稚鱼与环境因子的RDA分析结果Tab.3 RDA analysis results of ichthyoplankton and environmental factors
2018年鱼卵、仔稚鱼的群落结构与盐度、浮游植物丰度和叶绿素a浓度相关性较大(图11)。优势种短吻红舌鳎和重要种斑鰶、多鳞均偏好高浮游植物丰度和低溶解氧浓度环境, 重要种鳀则偏好高pH和低浮游植物丰度的环境。RDA排序图显示, 第一和第二排序轴的特征值分别为0.4316和0.1089, 分别解释了75.67%和19.09%的物种变化信息(表3)。
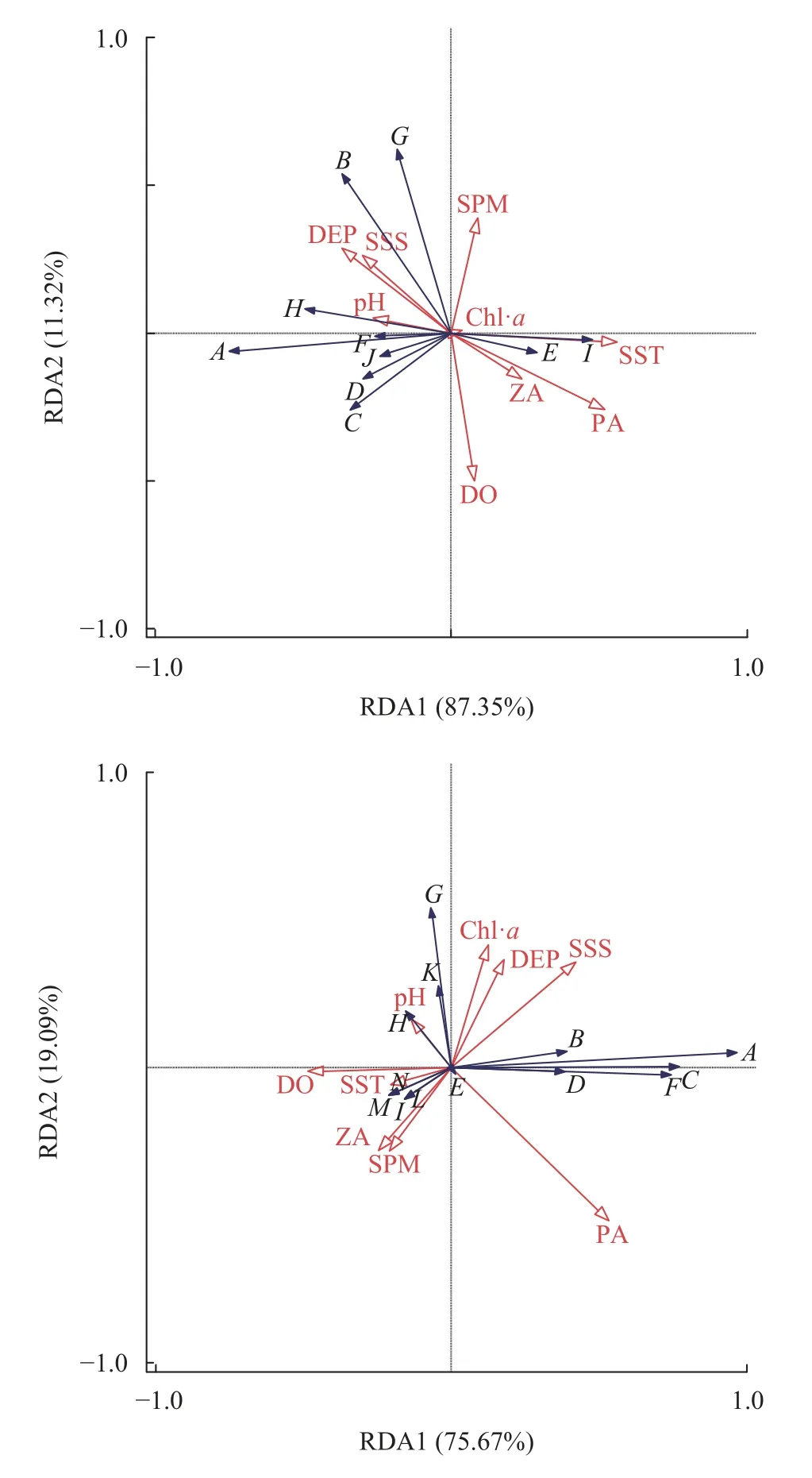
图11 黄河口海域鱼卵、仔稚鱼与环境因子的关系Fig.11 The relationship between ichthyoplankton and environmental factors in the Yellow River estuary in 2017 and 2018
3 讨论
3.1 鱼卵、仔稚鱼的丰度时空分布特征
河口独特的生境特征是河口鱼类资源量变动趋势的重要指示因子, 决定了栖息于河口生物的时空分布[20,21]。从鱼卵和仔稚鱼各调查时期的时空分布来看, 仔稚鱼由于已经具备游泳能力, 能够主动索饵, 并且对低盐度的水流具有强烈的趋流性,所以其在各调查阶段的分布区域相对稳定[10], 趋向于在盐度较低, 浊度较高且饵料丰富的河口近岸海域分布。而鱼卵没有活动能力, 其分布受海流等外界因素的影响较为强烈[11,22]。调查前期入海径流平稳, 变化幅度较小, 此时鱼卵分布主要受黄河三角洲海域环流系统的影响[10,23—25], 2017年鱼卵主要集中分布在河口东南沿海靠近莱州湾一侧的E样带, 2018年集中分布在河口东北部沿海的D样带; 在进入调查中期以后, 在非调水调沙年份, 径流和输沙变化幅度较小, 水文要素整体比较平稳, 此时鱼卵主要集中在河口北部分布, 而2018年受调水调沙的影响, 日均径流量和输沙量大幅增加, 河口区域水文要素的层化现象明显[26], 入海冲淡水形成的低盐区与高盐区的盐度差高达27以上, 河口各区域间温度差值也达4℃以上。此时鱼卵受到环流系统和温、盐跃层的共同影响, 在河口东南沿海余流尾部密集分布; 在后期调查阶段, 2017年鱼卵仍主要集中在河口北部海域分布, 但是高值区移动到了河口西北部的B样带, 而2018年调水调沙结束之后, 黄河三角洲海域内的环流系统又重新对鱼卵的分布占据主导地位, 所以此时鱼卵分布的密集区整体来看又恢复至河口东北部的D样带。此外, 本研究通过对比各调查样带鱼卵和仔稚鱼的采获数量发现, 河口东南部靠近莱州湾一侧E样带和河口东北部D样带的鱼卵采获量超过采获总量的70%, 可能是目前黄河口及邻近海域鱼类浮游生物群落的主要聚集区, 应注意加强对该水域生境和栖息地的保护[27]。
3.2 鱼卵、仔稚鱼的群落结构及其影响因素分析
环境因素通过影响鱼类的生理和行为反应, 直接决定着物种的丰度和分布格局, 从而进一步影响整个群落的结构, 即环境条件在很大程度上决定了鱼类对于栖息地的选择[2,9,28—30], 也塑造了不同的鱼类群落分布格局。有学者在黄河口海域的研究中发现, 入海淡水量越大, 鱼卵、仔稚鱼采获密度越高, 渔业资源种类越丰富,而在黄河入海淡水锐减的年份,海洋中的产卵场萎缩、生物资源量下降,这主要是因为丰富的径流注入能够为海洋生物提供适宜的产卵栖息环境, 带来更加充足的饵料和营养物质, 有利于海洋生物的产卵繁殖[1,10]。Islam等[31]在对日本有明海湾的调查中也发现, 入海径流的扰动能够增加仔稚鱼遇到食物的概率, 所以丰富的径流更加有利于鱼类早期资源的生存。本研究调查结果显示, 2018年采获鱼卵、仔稚鱼的数量接近2017年的2倍, 在分析同步环境和水沙通量数据后发现, 2018年6月和7月的月均径流量分别为2017年的5倍和8倍, 调查海域海水的平均表温比2017年高1.26℃, 平均表盐比2017年低6左右, 该结果与上述已经发表的结论一致。进一步表明调水调沙带来的丰富径流所营造的高温、低盐环境及提供的充足饵料有利于黄河口及邻近海域渔业资源及其早期群体的补充。本研究中在入海泥沙通量较大的2018年,底层鱼类短吻红舌鳎鱼卵的采获数量较高,这种情况同样也出现在2009—2013年、2020年和2021年的调查中, 杨尧尧等[32,33]发现当黄河入海泥沙明显增加时, 底层鱼类数量及生物量资源更加丰富, 鱼卵数量增加, 这主要与调水调沙带来大量的泥沙入海有关, 这些泥沙入海后由于沉降作用迅速沉入海水底层, 为生活在底层的短吻红舌鳎带来了更加充足的养分和饵料[32], 有利于其产卵繁殖。
RDA分析结果显示, 研究区域的鱼卵、仔稚鱼群落结构还与盐度、水温、水深及浮游生物密度等因素息息相关。盐度是决定河口鱼类丰度和时空分布的主导因素, 河口沿岸的水动力过程与不同生活史阶段的协同适应特征共同制约着鱼类群落的时空格局[34]。本研究中河口定居性鱼类短吻红舌鳎在2017年和2018年调查中均为贡献最突出的代表性物种, 可能就与河口水域盐度偏低和短吻红舌鳎适宜低盐的生物学特性密切相关[35]。水温的变化限制和影响鱼卵、仔稚鱼的生理变化和行为反应, 对河口地区鱼类的生长、分布及多样性有重要影响, 水温的变动会引起溶解氧、pH的变化, 还会直接影响到鱼类早期发育过程中必不可少的饵料生物的盛衰, 从而影响到仔鱼的资源补充量和存活率[10,36]。每种鱼都有自己特定的产卵温度阈值,如果温度过高或者过低, 会导致它们的产卵时间提前或者延迟[37]。水深往往不会直接对鱼卵、仔稚鱼的群落结构产生影响, 而是通过水深变化带来的细微环境差异来影响鱼卵、仔稚鱼种类、数量和存活率等。本研究中不同水深断面分布鱼卵、仔稚鱼的数量有所差异, 在平均水深3.6、9、13.4和16.2 m的Ⅰ—Ⅳ断面上分别分布着采获总量9.3%、14.8%、44.2%和33.6%的鱼卵, 可能主要与不同水层之间理化环境因子的差异有关[38]。此外, 受索饵行为的影响, 仔稚鱼中的赤鼻棱鳀、中颌棱鳀(Thrissa mystax)、布氏银汉鱼(Allanetta bleekeri)等与浮游动物丰度的关系十分密切, 从空间分布上看, 仔稚鱼更愿意寻找有稳定且可靠的浮游生物食物供应的海域生活, 仔稚鱼总是聚集在食物浓度较高的区域, 因为大量的浮游动物为幼小的仔稚鱼提供了很好的饵料, 有利于其生长。河口水域鱼类浮游生物的群落结构与其所处的环境条件密切相关, 除上述因子外, 一些本研究未涉及的因子, 如底质类型、离岸距离等水文地理因素及种间捕食和竞争等生物因素[39—40]也与河口生态系统中鱼卵、仔稚鱼的群落分布有一定的联系, 需要在今后的研究中做更细致的调查。
4 结论
(1)在调水调沙的影响下, 2018年(调水调沙年)的径流量和输沙量远大于2017年(非调水调沙年),调查各阶段的环境参数也均出现较大幅度变化;(2)鱼卵受环流和调水调沙的共同影响, 其空间分布在各调查阶段有所不同, 仔稚鱼基于索饵以及躲避敌害等因素则始终趋向于在河口近岸海域分布;(3)河口东南部靠近莱州湾以及河口东北部海域是目前黄河口及邻近海域鱼类浮游生物群落的主要聚集区, 今后应着重加强对该水域生境的保护; (4)调水调沙带来的丰富径流有利于黄河口及邻近海域渔业资源的补充, 同时调水调沙输送的入海泥沙由于沉降作用沉入海水底层, 可以为底层鱼类提供更加充足的养分和丰富的饵料, 有利于其产卵繁殖; (5)盐度、水温、水深及浮游生物密度等因素均与鱼卵、仔稚鱼的群落结构息息相关, 环境因子通过影响鱼类及其早期补充群体的生理和行为反应直接影响物种的丰度, 也塑造了不同的群落分布格局。
虽然本文研究结果表明黄河调水调沙输送的丰富入海淡水和泥沙与其邻近海域的海洋生态环境及海洋生物资源构成了密切的响应关系, 但是海洋生态与调水调沙的作用机制尚未能构建, 还有待今后持续不断的监测。黄河口海域水文变化与海洋生物资源的研究也任重道远。

