许氏平鲉Myomaker通过调控成肌细胞融合促进肌肉肥大生长的调控机制❋
于倩文, 黄可佳, 张全启,2,3, 贺 艳,2❋❋
(1. 中国海洋大学海洋生物遗传学与育种教育部重点实验室, 山东 青岛 266003;2.中国海洋大学三亚海洋研究院 海南省热带水产种质重点实验室, 海南 三亚 572000;3. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237)
细胞融合对多细胞生物的生长发育至关重要。成肌细胞融合是肌纤维发育、肌肉生长和肌肉损伤再生过程中肌纤维形成的基本过程。在肌肉发生过程中,单核成肌细胞(Myoblast)退出细胞周期,表达肌肉特异性转录因子并开始分化。一旦单核成肌细胞分化成为单核肌细胞,则相互融合生成多核肌纤维[1]。
成肌细胞融合过程包括肌肉细胞间相互识别并黏附,相互识别的细胞之间细胞膜的接触增加、黏附增强,从而使细胞膜上的蛋白质分子和脂质重新排布,细胞膜打开,细胞发生融合,细胞间实现物质交换,从而融合成一个多核肌细胞[2-5]。关于肌细胞融合的分子机制,在果蝇中的研究比较透彻。果蝇肌细胞融合调控依赖于细胞表面受体在肌细胞(FCM)和基础细胞(Founder cell,FC)中受体对的排斥作用。受体对是由基础细胞表达的膜受体Kin of IrreC (Kirre)、Roughest (Rst)[6-7]和有融合能力的肌细胞表达的反受体Sticks and stones (Sns)、Hibris (Hbs)[8-11]组成。在斑马鱼中,Nephrin 和Kirrel3分别作为果蝇Sns和Kirre的同源蛋白,对斑马鱼胚胎的肌细胞融合都发挥着重要作用[12-13]。其中,Nephrin也能促进小鼠肌细胞的融合,但Kirrel3蛋白在哺乳动物肌细胞融合中的作用还有待进一步研究[14]。在斑马鱼中,通过突变胚胎表型证明细胞表面受体对Jamb和Jamc(Jam2a和Jam3b)对斑马鱼多核肌纤维的形成也是必要的,但其具体作用机制以及其下游哪些信号分子发挥作用仍有待确定[15]。Myomaker作为直接参与成肌细胞融合的肌肉特异性跨膜蛋白已被证明是小鼠肌细胞融合所必需的,Myomaker在肌发生过程中表达短暂,抑制其表达能阻止多核肌纤维的形成[16]。Myomaker不仅在胚胎骨骼肌发育过程中发挥关键作用,对成年肌肉损伤修复也是必不可少的。当骨骼肌受损时,处于静息状态的肌卫星细胞会被立即激活,同时肌肉细胞myomaker表达量上调能促进融合并对损伤进行修复[16]。功能验证表明Myomaker对鸡的成肌细胞融合也是必不可少[17]。除了高等脊椎动物,myomaker在斑马鱼快肌中也有高表达[18]。对牙鲆仔鱼不同发育阶段的myomaker基因表达模式研究发现,该基因在变态发育及稚鱼期调节肌肉生长过程中发挥关键作用[19]。此外,Myomaker介导的肌肉干细胞融合是小鼠骨骼肌肥大生长所必需的[20],但肌细胞融合对肌肉肥大生长的确切贡献仍有待研究。
许氏平鲉(Sebastesschlegelii)属鲉形目、鲉科、平鲉属,是中国北方重要的海水经济鱼类,其肌肉生长模式同牙鲆(Paralichthysolivaceus)、鳕鱼(Gadusrnorhua)和虹鳟鱼(Oncorhynchasmykiss)等大体型鱼类相似,同时依赖于肌纤维增生和肥大生长[21-22]。褐鳟鱼(Salmotrutta)、孔雀鱼(Poeciliareticulata)和斑马鱼(Daniorerio)等小体型鱼类则主要依赖于肌纤维肥大生长[23-25],均呈现为一种非限定性生长模式[26]。而鸟类和哺乳类其肌肉生长表现为限定性生长[27-29]。作为大型经济型鱼类,其肌肉的良好生长发育关系到其本身健康和经济价值[30]。目前,对于高等脊椎动物尤其是哺乳类的肌肉的生长发育的研究相对来说较多,但是与鱼类相关的研究甚少,主要集中在一些模式生物,如斑马鱼、青鳉。为了探究大型硬骨鱼肌肉肥大生长模式,本研究鉴定了许氏平鲉myomaker基因(Ssmyomaker),对其在许氏平鲉胚胎发育过程中表达模式及肌肉肥大生长方面的功能进行研究。为进一步加深对硬骨鱼类,尤其是许氏平鲉肌肉肥大生长过程相关机制的研究奠定了基础,为从分子方面促进许氏平鲉快速生长、提高养殖效益提供了一定的参考。
1 材料与方法
1.1 材料
本实验中所用到的许氏平鲉来自山东省青岛市贝宝海洋科技有限公司及山东省威海市荣成市中孚水产养殖有限责任公司。
对不同发育时期的许氏平鲉胚胎取样:1细胞期胚胎、32细胞期胚胎、囊胚、原肠胚、体节期胚胎、孵化期胚胎、仔鱼7个时期。将所有样品分两部分:一部分用液氮迅速冷冻后保存于-80 ℃超低温冰箱中,用于总RNA的提取;另一部分加入4%多聚甲醛(PFA)中固定24 h以上,再经甲醇梯度脱水后保存于4 ℃冰箱,之后用于整体原位杂交实验。
过表达实验所用样品:取样两次,第一次为连续投喂处理30 d,第二次为处理30 d后停止投喂并继续培养90 d。每次随机选取30尾,取样前测量体长。经麻醉断椎处理后取背鳍位置骨骼肌,剪碎,一部分经液氮迅速冷冻后保存于-80℃冰箱,用于总RNA的提取;另一部分固定于4% PFA,经甲醇梯度脱水后长期保存于4 ℃冰箱,用于组织切片统计观察。
实验所用到的HEK293T细胞及C2C12成肌细胞均来自中国海洋大学细胞工程技术实验室。
1.2 方法
1.2.1 许氏平鲉myomaker基因克隆和生物信息学分析 按说明书用Trizol(供应商:Takara)提取许氏平鲉肌肉组织及胚胎体节期RNA,再用反转试剂盒All-in-One 5×RT MasterMix(abm)合成cDNA。根据表1设计的引物进行PCR扩增[31]。扩增产物经Gel Extraction Kit试剂盒(康为世纪)回收后,连接转化送测,用Megalign软件比对测序结果,进一步确定序列准确性。
通过检索NCBI(http://www.ncbi.nlm.nih.gov)和Ensembl(http://www.ensembl.org)数据库,收集到7种硬骨鱼的Myomaker氨基酸序列(荫平鲉(Sebastesumbrosus) XP_037633866.1、牙鲆(Paralichthysolivaceus) XP_019964612.1、红旗东方鲀(Takifugurubripes)XP_003974732.1、罗非鱼(Oreochromisniloticus)XP_003444559.1、半滑舌鳎(Cynoglossussemilaevis)XP_008334664.1、虹鳟鱼(Oncorhynchusmykiss) XP_036791554.1、斑马鱼(Daniorerio)XP_017211542.1)和3种哺乳类动物Myomaker氨基酸序列(人(Homosapiens)NP_001073952.1、小鼠(Musmusculus)NP_001153074.1、鸡(Gallusgallus)NP_001305386.1)。通过本地tblastx与本实验室已有的许氏平鲉转录组数据库比对后,PCR扩增获得许氏平鲉myomaker的编码序列。根据基因组和转录组数据并利用Gene Structure Display Server 2.0网站(http://gsds.cbi.pku.edu.cn/)对许氏平鲉与其他硬骨鱼和哺乳动物myomaker基因结构进行对比分析。通过MUSCLE完成核苷酸序列多重比对,再使用MEGA 7.0软件根据Neighbor-Join算法进行聚类分析[32]。并且将自展值(Bootstrap)设为500次,以对进化树的可靠性进行检测,从而构建出许氏平鲉myomaker基因的进化树。
1.2.2 RNA-seq建库表达分析 根据许氏平鲉转录组数据(https://db.cngb.org/search/sample/?Q=CNP0000222, 发布于2021年1月5日)分析myomaker在2.5龄成鱼各组织中和各时期胚胎中的表达模式。将RNA序列在许氏平鲉基因组进行定位,使用clufflinks-cuffmerge-cuffdiff 计算出基因的TPM值。用TBtools软件将myomaker基因表达量结果可视化。
1.2.3 胚胎整体原位杂交 用不同发育时期胚胎进行原位杂交。PCR扩增获得探针模板,测序正确后使用探针标记试剂盒DIG RNA Labeling Mix合成myomaker原位探针,测定探针浓度后凝胶电泳检测探针质量(条带清晰单一),参照标准步骤进行整体原位杂交[33]。用NBT/BCIP Stock Solution对胚胎进行显色后置于甘油中,并在立体显微镜下拍照观察。
1.2.4 过表达载体构建及投喂 根据表1设计的带酶切位点的引物扩增myomaker的编码序列,将其连接至pMD-19T载体,验证序列正确性后,用XhoⅠ和HindⅢ酶对扩增片段和pEGFP-N1载体(供应商:Invitrogen)进行双酶切,连接转化后,测序验证获得pEGFP-N1-myomaker重组质粒。
将许氏平鲉产出的仔鱼平分为两组,分别放入2 m×2 m×1 m的鱼池中,每个鱼池500条。由于产出第一个月的仔鱼太小,故主要以小球藻、卤虫、轮虫作为饵料。产出30 d后,于两组中分别开始投喂混有空载质粒和过表达质粒的饲料,饲料投喂量随鱼体生长逐渐加量,质粒投喂最大量为0.5 mg/d,用Lipo6000转染试剂(Beyotime)将质粒混入饲料中,连续投喂30 d后从2组中挑选健康无病的个体各30条进行肌肉组织取样和体长测量。
1.2.5 实时荧光定量PCR 按说明书用Trizol(Takara)法提取过表达肌肉组织RNA,再用反转试剂盒All-in-One 5×RT MasterMix合成cDNA。
根据表1设计的定量引物,用EIF5A1作为内参基因[34],使用2×SYBR Green PCR Master Mix试剂(Takara)和Lightcycler 480 PCR仪(Roche)进行实时荧光定量PCR扩增。采用2-ΔΔCt的方法进行数据分析,通过GraphPad Prism 7.04软件应用T-test方法进行显著性差异计算,p<0.05具有显著性差异。
1.2.6 组织切片制备及HE染色 将所取部分肌肉组织样品置于4%多聚甲醛(PFA),4 ℃固定24 h,经30%、50%、75%、85%和95%甲醇梯度脱水后放于100%甲醇长期保存,每个梯度至少2 h。脱水后经石蜡包埋制备组织切片,厚度为4~5 μm。经HE染色(hematoxylin-eosin staining)后,用尼康AZ100荧光显微成像系统对染色结果拍照观察并统计比较肌纤维横截面积。
1.2.7 质粒构建、细胞培养、转染及双荧光素酶报告基因实验 利用JASPAR(https://jaspar.genereg.net/)网站进行转录因子MyoD1在许氏平鲉myomaker基因启动子结合位点预测,选取得分高于95%的结合位点进行调控作用验证。用IDT PrimerQuest(http://www.idtdna.com/Primerquest/Home/Index)网站进行引物设计。根据表1设计的带酶切位点的引物分别扩增许氏平鲉MyoD1编码序列和myomaker基因启动子序列,将其连接至pMD-19T载体(TaKaRa),验证序列正确性后,用XhoⅠ和HindⅢ酶对扩增片段和pcDNA3.1载体、pGL3-basic载体(Invitrogen)进行双酶切,连接转化后,测序验证获得pcDNA-MyoD1和pGL3-myomaker重组质粒。
HEK293T细胞及C2C12成肌细胞用含有10%胎牛血清和1%三抗的DMEM培养基(Biological Industries)培养在37 ℃、5% CO2的加湿培养箱中。然后用Lipo3000 Reagent(Thermo Fisher)进行转染。转染48 h后,HEK293T细胞进行双荧光素酶报告基因实验[35],C2C12成肌细胞进行观察拍照。
2 结果
2.1 许氏平鲉myomaker基因结构、共线性及系统进化分析
多重序列比对结果显示,许氏平鲉Myomaker氨基酸序列与其他硬骨鱼一致度较高,其中与荫平鲉、罗非鱼、红旗东方鲀、半滑舌鳎、斑马鱼、牙鲆的序列一致性高于80%;而与人、小鼠和鸡相比,序列一致性均低于70%(见图1)。该基因具有7个跨膜结构域(Transmembrane domain,TMD),含胞外N端和胞内C端。序列中第215~221位氨基酸包括1个亮氨酸L、3个半胱氨酸C和1个丝氨酸S。通过基因结构对比分析发现,Ssmyomaker有6个外显子,5个内含子,同斑马鱼、红旗东方鲀、荫平鲉等硬骨鱼myomaker基因结构相似,而人、鼠和鸡的myomaker基因均包含5个外显子和4个内含子(见图2)。系统进化分析结果表明,硬骨鱼的myomaker基因聚为一支,其他基因聚为另一支,并且Ssmyomaker基因与荫平鲉myomaker基因亲缘关系最近,同牙鲆myomaker和红旗东方鲀myomaker在进化上亲缘关系也较近(见图3)。

(红色三角代表许氏平鲉myomaker基因结构。Red triangle marks the myomaker gene structure of S. schlegelii.)图2 不同物种myomaker基因结构图Fig.2 Gene structures of myomaker in different species
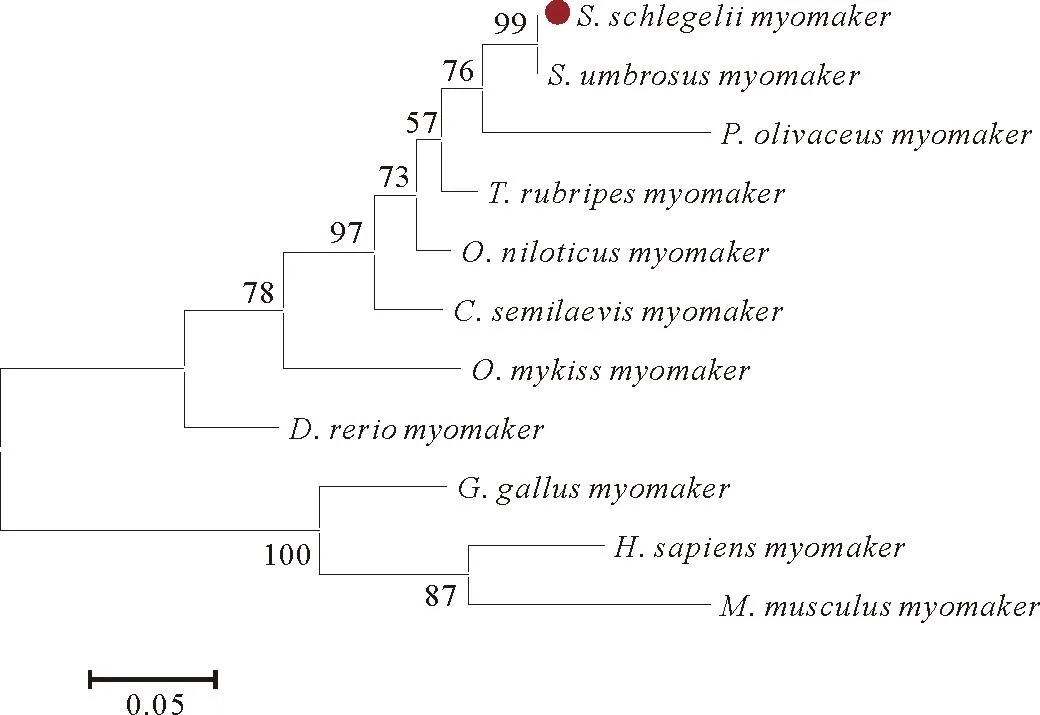
(进化树是通过核苷酸序列多重比对后用Neighbor-Join算法构建的。树枝上数值代表500次重复后的bootstrap值。红色圆圈标记许氏平鲉myomaker基因。The phylogenetic tree was constructed from a multiple alignment of the nucleotide sequences using the neighbour-joining method. The numbers at the tree nodes represent percentage of bootstrap values after 500 replicates. Red circle marks the myomaker gene of S. schlegelii.)图3 四足类和硬骨鱼myomaker基因系统进化分析Fig.3 Phylogenetic analysis of myomaker in tetrapods and teleosts
共线性分析发现,在硬骨鱼中,myomaker基因上、下游基因较为保守,但也存在部分基因的缺失、移位与突变。在哺乳动物和硬骨鱼中没有明显的线性关系,但在该基因两侧也有一定的同源基因(见图4)。这说明该基因在硬骨鱼和哺乳动物中有一定的差异,其发挥功能的作用机制可能不同。

(不同颜色的五边形代表不同的基因,五边形的方向对应于染色体上基因的转录方向。橙色三角标注为许氏平鲉myomaker基因在染色体上共线性。Different colored pentagons represent different genes, and the direction of pentagons corresponds to the transcriptional direction of genes in the chromosome or scaffold. Orange triangle marks the syntenic analysis of myomaker gene of S. schlegelii on the chromosome.)图4 染色体上不同物种myomaker基因共线性分析Fig.4 Syntenic analysis of myomaker gene of different species on the chromosome or scaffold
2.2 许氏平鲉myomaker基因不同组织表达模式分析
根据转录组数据,分析了Ssmyomaker基因分别在2.5龄雌、雄个体不同组织表达模式,发现myomaker基因在成鱼个体中总体表达量较低,在雌鱼肌肉中表达量相对较高,而在雄鱼中主要在肠组织有较高表达,在脑、肌肉和精巢组织中有微量表达(见图5)。

图5 许氏平鲉myomaker基因在雌雄个体不同组织中的表达模式Fig.5 Expression patterns of black rockfish myomaker gene in different tissues from male and female individuals
2.3 许氏平鲉myomaker基因各时期胚胎发育表达模式分析
根据转录组数据分析发现,Ssmyomaker基因在1细胞期、32细胞期、囊胚期以及原肠胚各时期表达量均较低,而从体节期开始表达量增加,仔鱼期表达量达到峰值(见图6A)。通过探究Ssmyomaker基因在各时期胚胎发育表达模式发现,在许氏平鲉胚胎发育的早期没有明显信号出现,在原肠胚有零星信号出现(见图6B,c和c’),体节期胚胎在体节位置有明显信号出现(见图6B,d和d’),在将孵期胚胎和仔鱼信号集中在头部(见图6B,e和e’)和躯干前部(见图6B,f和f’)。这一结果同转录组数据分析较为一致。
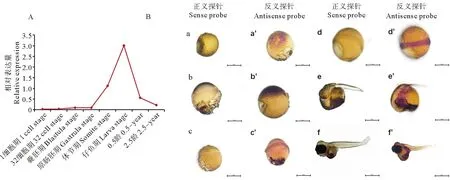
(蓝色位置为杂交信号。A.myomaker基因在许氏平鲉各时期胚胎及0.5龄和2.5龄成鱼肌肉组织表达量。B. myomaker基因在许氏平鲉各时期胚胎发育表达模式: a—f为正义探针;a’—f’为反义探针;a和a’为多细胞期胚胎;b和b’为囊胚期胚胎;c和c’为原肠胚胚胎;d和d’为体节期胚胎;e和e’为将孵期胚胎;f和f’为仔鱼。标尺均为100 μm。The blue position is the hybridization signal. A.The expression of Ssmyomaker gene at different embryonic developmental stages and the muscle tissue of 0.5 and 2.5-year-old adult fish. B. The expression pattern of Ssmyomaker gene in different embryonic developmental stages.:a—f: Sense probes; a’ —f’: Antisense probes; a,a’: Multi-cell stage embryo; b,b’: Blastula stage embryo; c,c’: Gastrula stage embryo; d,d’: Somite stage embryo; e,e’: Pre-hatching stage embryo; f,f’: Larval fish. Scale bars=100 μm.)图6 许氏平鲉myomaker基因在不同发育时期胚胎表达模式Fig.6 Expression pattern of Ssmyomaker gene in different embryonic development stages
2.4 许氏平鲉myomaker基因体内促肌肉融合生长功能研究
通过投喂过表达质粒的方式进行体内诱导myomaker基因过表达,连续投喂30 d体长测量比较发现,处理组体长显著小于对照组(见图7A),实时荧光定量检测结果显示诱导处理使myomaker基因表达量显著升高(见图7B)。对所取肌肉组织进行石蜡切片及HE染色发现,与对照组相比,处理组肌纤维排列更为紧密,单根肌纤维直径更大(见图8A)。取相同位置完整肌节进行统计并比较肌纤维横截面积及数量发现,与对照组相比,处理组<500 μm2的肌纤维数量所占比例较小,>1 000 μm2的肌纤维数量所占比例较大(见图8B),且处理组<500 μm2的肌纤维数量略少于对照组,500~1 000 μm2的肌纤维数量显著少于对照组,>1 000 μm2的肌纤维数量显著多于对照组(p<0.05)(见图8C)。连续投喂30 d后继续培养90 d经肌肉组织切片及HE染色发现,处理组仍保持更为紧密的肌肉生长状态(见图9A)。用上述同样的方法进行肌纤维横截面积统计比较发现,处理组1 000~5 000 μm2的肌纤维比例小于对照组,而>5 000 μm2的肌纤维数量占比大于对照组(见图9B)。

(A.许氏平鲉体内过表达myomaker基因30 d体长统计。数据代表个体体长(n=30),表示p<0.000 1;表示p<0.01。B. 实时荧光定量检测myomaker基因表达量变化。数据代表平均值±标准差(n=4),表示p<0.01。A.Statistical results of body length of Ssmyomaker induction by overexpression in vivo 30 days. The data represent individual body length (n=30), indicates p <0.000 1, indicates p< 0.01; B. Ssmyomaker gene expression changes detected by qRT-PCR. The data represent the mean±SD(n=4),indicates p<0.01.)图7 许氏平鲉体内过表达myomaker基因30 d后体长统计结果和表达量变化Fig.7 Statistical results of body length and expression changes after overexpression of black rockfish myomaker gene for 30 days in vivo
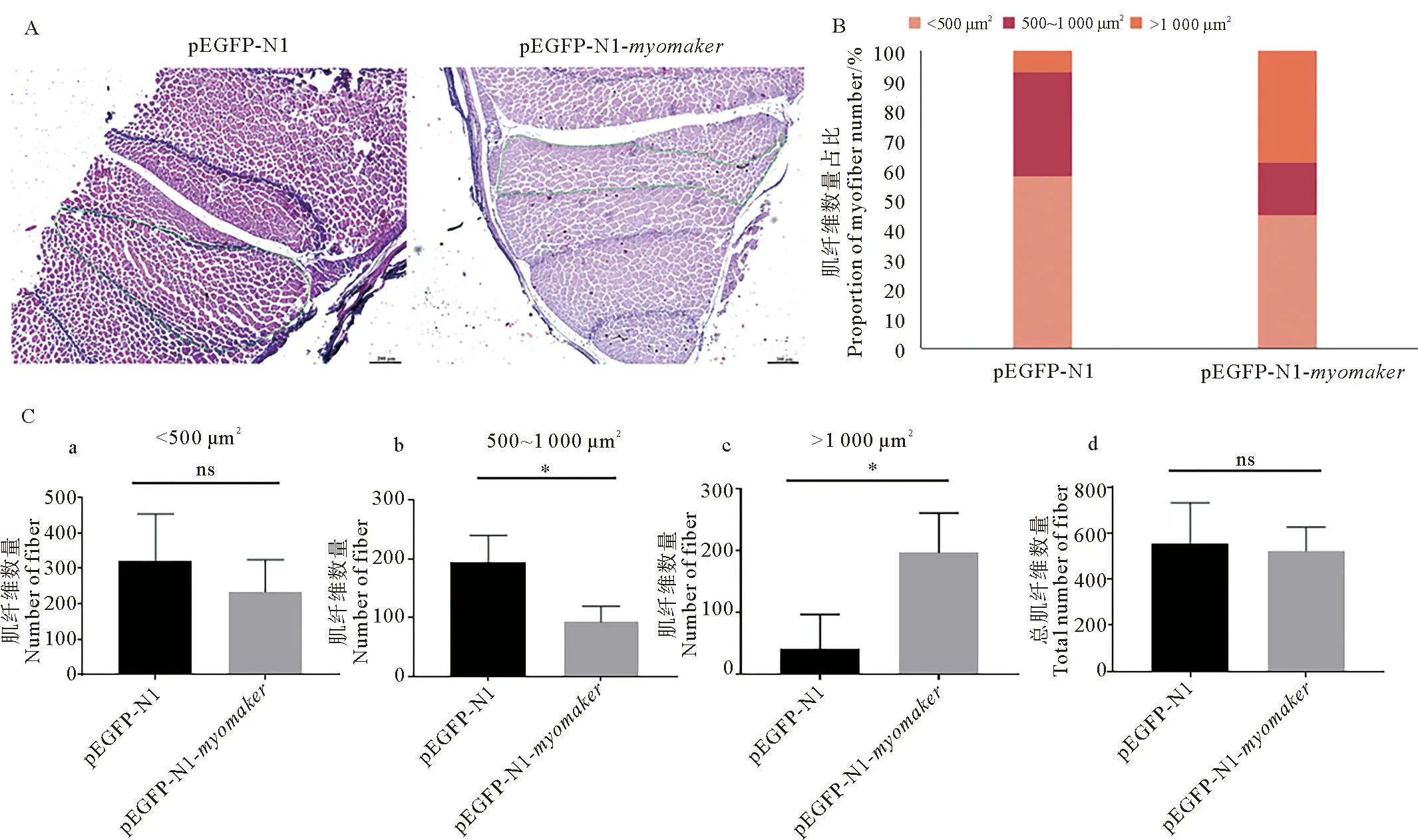
(A. 肌肉组织切片HE染色结果,绿色实线标注为统计范围,标尺均为200 μm;B.不同面积范围肌纤维数量比例;C. 不同面积范围肌纤维数量统计分析,数据代表平均值±标准差(n=6), 表示p<0.05,ns表示p>0.05。A. Results of HE staining of muscle tissue sections, the green solid line marks the statistical range, scale bars=200 μm; B. Proportion of muscle fibres in different area ranges; C. Statistical analysis of the number of myofibers in different area ranges. The data represent the mean±SD(n=6),indicates p<0.05, ns indicates p>0.05.)图8 许氏平鲉体内过表达myomaker基因30 d后肌肉组织观察及肌纤维横截面积统计Fig.8 Histological observation of muscle tissue and statistical results of cross sectional area of muscle fibers after overexpression of Ssmyomaker gene in vivo for 30 days
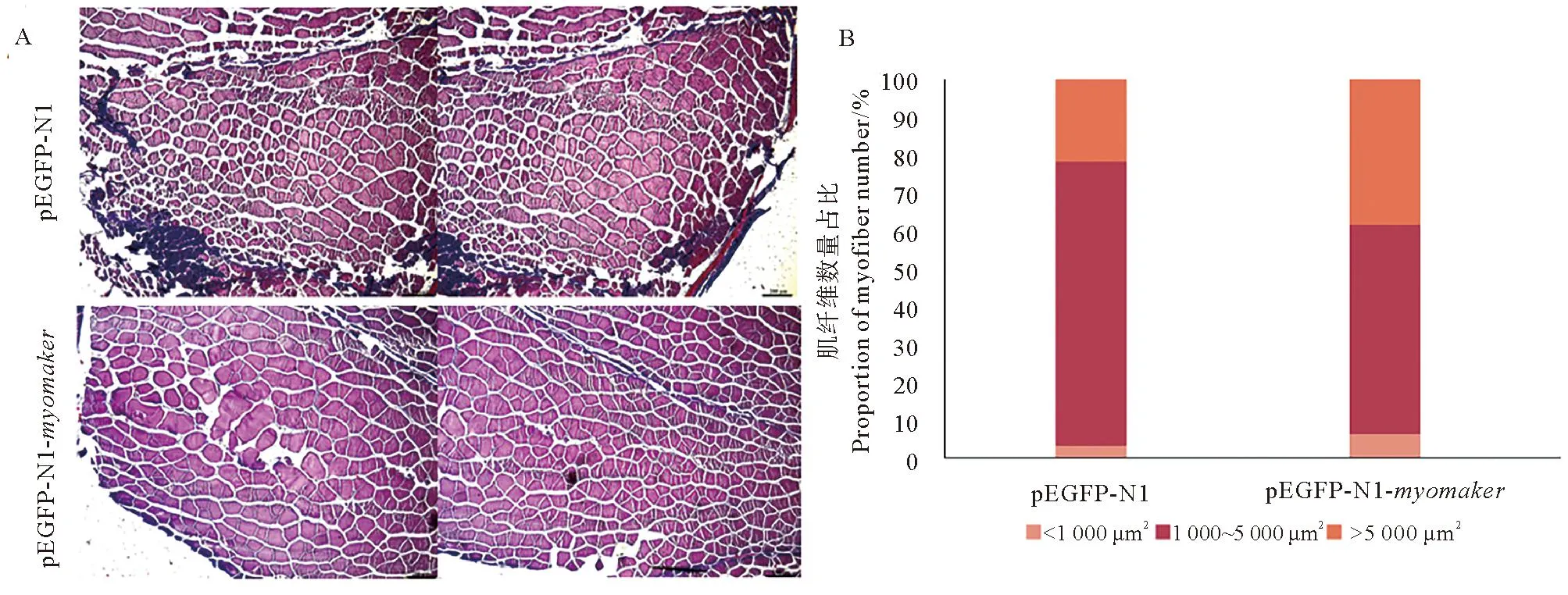
(A.肌肉组织切片HE染色结果,每个肌节分2个4×视野,重复部分不计,所有切片图共用的标尺均为200 μm;B.不同面积范围肌纤维数量比例。A. Results of HE staining of muscle tissue sections, each sarcomere is divided into two 4× visual fields, repetition is not counted, the scale bar shared by all slices is 200 μm; B. Proportion of muscle fibres in different area ranges.)图9 许氏平鲉体内过表达myomaker基因30 d后继续培养90 d肌肉组织观察及肌纤维横截面积统计Fig.9 Histological observation of muscle tissue and statistical results of cross sectional area of muscle fibers after overexpression of Ssmyomaker gene in vivo for 30 days and then cultured for 90 days
2.5 许氏平鲉myomaker基因促C2C12成肌细胞融合生长功能研究
通过体外细胞转染实验探究了许氏平鲉myomaker基因对C2C12成肌细胞融合生长的影响,转染48 h后观察发现,myomaker基因过表达质粒组出现细胞靠近黏附,有融合的趋势,也有双核细胞出现(见图10)。
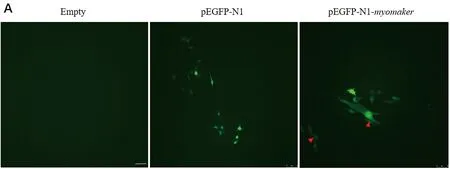
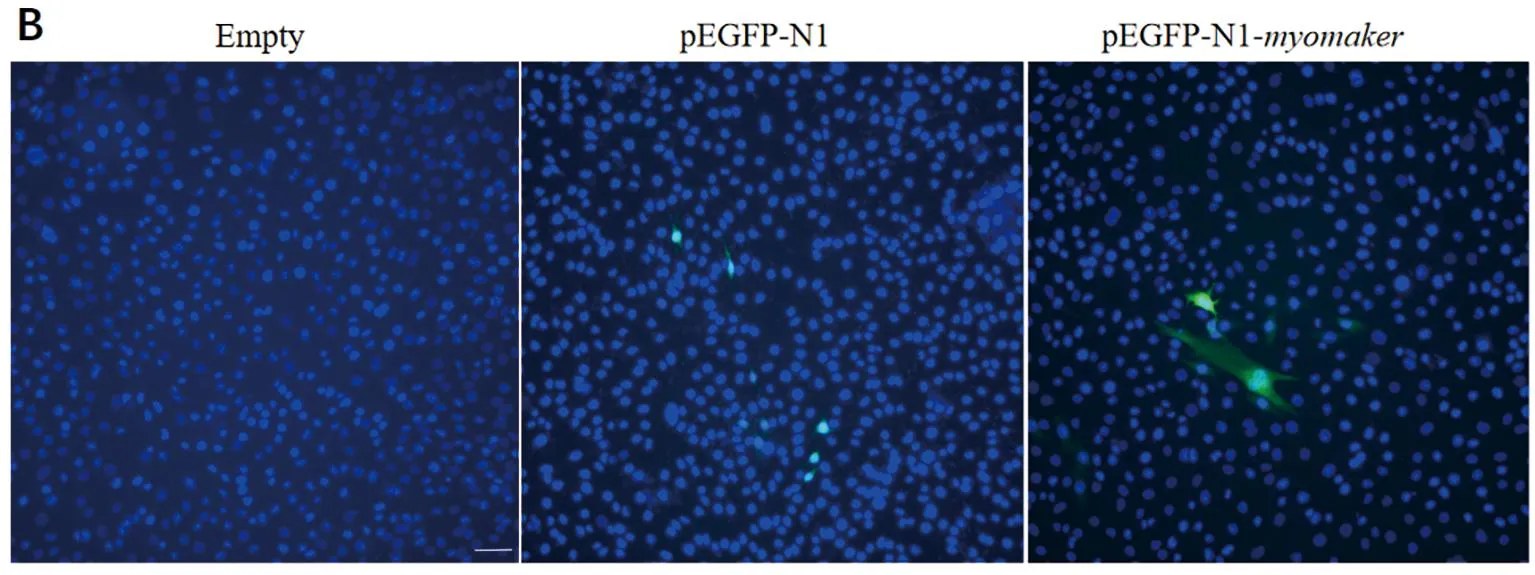
(A.红色箭头标注发生融合的细胞; B.染核后merge结果。Empty为空白组, pEGFP-N1为空载组,pEGFP-N1-myomaker为过表达组。所有图共用标尺为50 μm。A.Red arrow indicates the fused cells; B. The merge results after nuclear staining. Empty was the blank group, pEGFP-N1 was the empty plasmid group, and pEGFP-N1-myomaker was the overexpression group. The scale bar shared by all images is 50 μm.)图10 许氏平鲉myomaker基因过表达可促进C2C12细胞融合Fig.10 Overexpression of myomaker gene of black rockfish can promote the fusion of C2C12 cells
2.6 MyoD1基因对许氏平鲉myomaker基因的调控作用
根据JASPAR(https://jaspar.genereg.net/)网站预测转录因子MyoD1在Ssmyomaker启动子上存在潜在结合位点(Relative profile score threshold>95%)(见图11A)。并通过双荧光报告基因实验验证发现,在许氏平鲉中,MyoD1对myomaker基因没有显著调控作用(见图11B)。
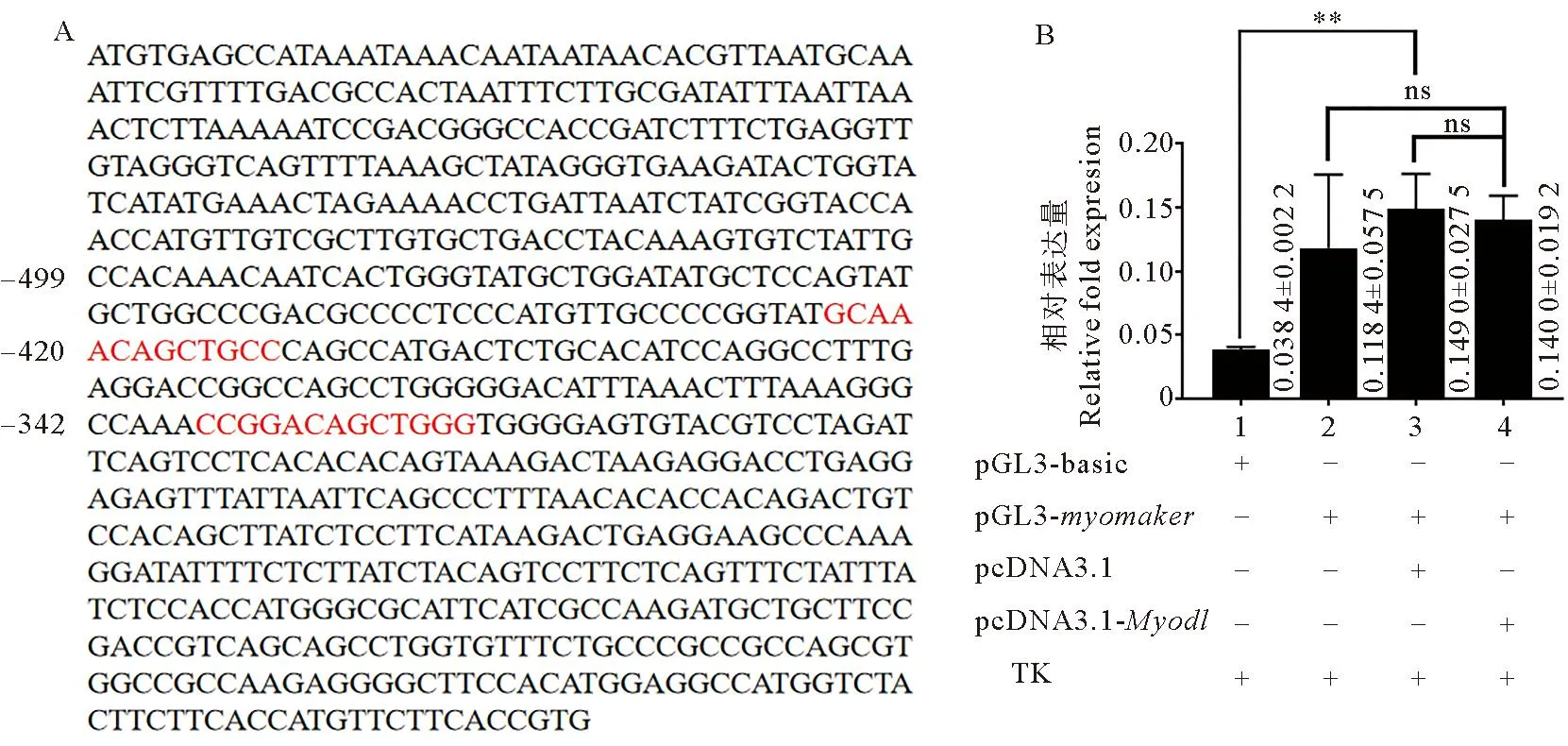
(A. 转录因子MyoD1在Ssmyomaker启动子上潜在结合位点; B. 双荧光素酶报告基因实验结果。柱右侧的数据代表平均值±标准差。表示p<0.01,ns表示p>0.05。A. Potential binding sites of the transcription factor MyoD1 on the Ssmyomaker; B. The results of the dual luciferase reporter gene experiment. The data on the right side of each bar represents the mean±standard deviation. indicates p<0.01, ns indicates p>0.05.)图11 MyoD1对许氏平鲉myomaker基因的调控作用Fig.11 Regulation effect of MyoD1 on myomaker gene of black rockfish
3 讨论
在本研究中,通过氨基酸序列比对和系统进化分析发现Ssmyomaker基因同所分析的硬骨鱼myomaker序列一致性较高,而同人、小鼠和鸡三者的myomaker相比,一致性较低。有研究者通过设计两种定位的Myomaker抗体,发现myomaker不仅定位于细胞膜上,也存在于高尔基体和囊泡中,这揭示了myomaker在细胞中的精确定位及其潜在的细胞间转运功能[36]。在许氏平鲉myomaker的第215—221位氨基酸中有3个氨基酸与小鼠不同,3个保守棕榈酰化半胱氨酸中有1个与小鼠存在差异。这说明该基因在许氏平鲉中的功能与在小鼠中参与调控高尔基体转运的功能可能存在一定的分化。通过许氏平鲉与斑马鱼、红旗东方鲀、荫平鲉等硬骨鱼以及哺乳动物基因结构分析、系统进化分析和基因共线性对比分析可以得出myomaker基因在硬骨鱼和哺乳动物中功能相似,但可能还存在一定的差异。
有研究报道骨骼肌发育最早可能起源于胚胎发育时期的体节期[37-39]。有研究表明在斑马鱼胚胎中,myomaker在快肌细胞中短暂表达。在体节形成早期没有明显信号,在受精后20 h胚胎中出现明显信号,在发育后期,myomaker在大部分体节中都有表达。随着体节形成,myomaker信号逐渐向尾部迁移[18]。与斑马鱼相似,通过转录组数据分析及胚胎原位杂交,发现Ssmyomaker基因在胚胎发育时期表达量较高,尤其在体节期胚胎中有高表达,杂交信号集中出现在体节位置。但在将孵期胚胎和仔鱼中,杂交信号集中在头部和躯干前部,这与斑马鱼不同。这种差异可能与斑马鱼的有限生长以及许氏平鲉的无限生长模式有关。在成鱼中,Ssmyomaker基因总体表达量较低,在雌鱼中主要在肌肉中表达量相对较高,而在雄鱼中主要在肠组织中有较高表达,在雄鱼脑、肌肉和精巢组织中有微量表达。这说明myomaker基因在许氏平鲉成鱼雌、雄个体中调控肌肉生长的模式可能不同,可能与成鱼雌、雄个体的生长二态性有关。这对研究myomaker基因在硬骨鱼骨骼肌肥大生长过程中的分子机制提供了新的见解。
肌肉肥大生长需要myomaker介导的肌肉干细胞融合[20]。在成肌细胞融合的三个关键步骤中,myomaker基因主要在融合起始和半融合中间体的形成发挥重要作用[40]。转录组数据及胚胎原位杂交结果显示,myomaker主要在胚胎期有较高表达,在小鱼及成鱼中表达量较低,并且在呈现无限生长的许氏平鲉(S.schlegelii)中基因编辑手段受限。有研究者通过投喂过表达质粒的方式获得了影响石斑鱼性腺发育[41]及性逆转的发现[42]。在本研究中,同样通过投喂的方式在许氏平鲉体内诱导myomaker基因过表达后发现,myomaker表达量有显著升高。肌肉组织切片及HE染色发现肌纤维排列更紧密;肌纤维横截面积统计显示处理组<500 μm2及500~1 000 μm2的肌纤维数量少于对照组,>1 000 μm2的肌纤维数量占比更大,数量更多,表明在许氏平鲉体内诱导myomaker基因过表达使肌纤维融合增粗,有效促进肌肉肥大生长。而处理组与对照组肌纤维总数没有显著差异,说明还存在肌纤维增生生长,与大体型鱼类肌肉生长方式相符[21]。处理组总体体长显著小于对照组可能说明myomaker过表达后主要对肌肉肥大生长有明显促进作用,使肌纤维横截面积增大,对体长增加的促进作用不显著。此外,还通过体外细胞转染实验探究了许氏平鲉myomaker基因对C2C12成肌细胞融合生长有一定的促进作用。进一步说明调控许氏平鲉肌肉的肥大生长是通过促进成肌细胞融合来实现的。
成肌细胞融合在骨骼肌形成和损伤再生过程中发挥着重要作用,是一个受严格调控的复杂动态过程[43]。有学者研究表明,许多调控因子参与调控细胞融合过程,如 MRFs 家族(主要包括Myf5、MyoD、MyoG和Myf4)[44],该家族基因可以同 E-box 作用元件结合,以调控许多成肌相关基因的转录,其中MyoD被认为是肌肉形成的决定因子。在本研究中,探究了转录因子MyoD1对Ssmyomaker基因有潜在结合位点,但并没有显著调控作用。而在小鼠[45]和鸡[17]中,MyoD可以直接与myomaker启动子结合,调控其转录。

