基于胆汁酸代谢组学探讨芍药苷改善α-萘异硫氰酸酯诱导胆汁淤积的作用机制
邓昕雨,吴和霏,李煜兵,章方玲,胡启超,陈 沅,张雯雯,马 骁
成都中医药大学,西南特色中药资源国家重点实验室,四川 成都 611137
胆汁淤积是指机体胆汁形成异常或胆汁流动障碍,导致胆汁酸无法正常排出而在肝脏和胆管大量蓄积的一种病理状态,临床表现为黄疸、瘙痒等[1]。肝内胆汁淤积由肝内小胆管梗阻性病变或肝细胞功能缺陷引起,病情发展至后期发生胆管炎进一步转化为胆道纤维化、肝硬化,严重者导致肝功能衰竭甚至死亡[2]。胆汁淤积的病因多样,发病机制复杂,严重制约了胆汁淤积相关药物的开发。代表性治疗药物熊去氧胆酸(ursodesoxycholic acid,UDCA)仍存在超40%患者无法响应,约10%患者不耐受的现象。奥贝胆酸能够有效提高UDCA 治疗反应不佳或耐受患者的生存率,但其治疗过程存在严重的瘙痒不良反应[3]。因此,寻找有效治疗胆汁淤积且不良反应小的相关药物仍是当前研究的热点。
传统中医药理论将胆汁淤积归属于“黄疸”范畴,“湿热瘀滞”为其主要病机[4]。赤芍清热凉血、散瘀止痛、清肝火,清泻肝胆湿热,改善脉道瘀阻,益胆汁,能够有效改善胆汁淤积症状[5]。现代研究提示芍药苷是赤芍发挥保肝利胆作用的主要成分,具有广泛的药理活性[6]。相关研究也表明芍药苷能够调控核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)/NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor pyrin domain containing 3,NLRP3)信号抑制肝脏氧化应激和细胞炎症;靶向磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信号和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号抑制肝细胞铁死亡;抑制Toll样受体4(Toll-like receptor 4,TLR4)/髓样分化因子88(myeloid differentiation factor 88,MyD88)/核因子-κB(nuclear factor-κB,NF-κB)信号,缓解多种因素诱导的胆汁淤积[7-9]。然而,胆汁淤积的发生发展机制复杂,涉及多种级联反应和信号的交互,同时伴随胆汁酸组成和比例的变化[10]。
初级胆汁酸以胆固醇为原料在肝脏中直接合成后,进入肠道通过7-α 脱羟作用生成次级胆汁酸[11]。胆汁酸池由储存于胆囊中的次级胆汁酸和菌群代谢后的次级胆汁酸2 部分组成[12]。生理状态下,胆汁酸池的组成和比例趋于稳定状态,但当胆汁淤积发生后,胆汁酸池的稳态被扰乱,一方面,疏水胆汁酸滤过脂质成分破坏细胞膜,造成胆汁酸排出障碍,进一步损伤肝细胞;另一方面,胆汁排泄紊乱伴随着胆汁酸组成和比例的改变,毒性疏水胆汁酸大量蓄积加重胆汁淤积,进而损伤肝细胞[13]。因此,关注胆汁酸在胆汁淤积中的变化有助于了解疾病发展进程,明确药物治疗的影响。
代谢组学能够表征外界干扰或内在因素影响下机体中代谢产物的动态变化,应用信息技术确定细胞、器官或排泄中的代谢变化,能够监测疾病发生发展过程,捕获药物干预疾病的生物标志物,进而阐明药物机制[14]。因此,本研究基于胆汁酸代谢组学技术分析胆汁淤积过程中胆汁酸结构和成分的变化,利用分子生物学方法对相关靶点进行验证,探究其作用机制,有助于进一步阐明胆汁淤积的致病机制,并为胆汁淤积的临床用药提供参考。
1 材料
1.1 动物
SPF 级雄性SD 大鼠,体质量(210±10)g,6~7 周龄,购自斯贝福(北京)生物技术有限公司,动物生产许可证号SCXK(京)2019-0010,合格证号No.110324220102750123。动物饲养于成都中医药大学SPF 级实验动物中心,温度(25±3)℃,相对湿度(50±5)%,12 h 光暗交替环境,动物使用许可证SYXK(川)2020-124,动物在饲养期间可自由获取标准饲料和水源。本研究中所有动物护理和实验程序均经成都中医药大学动物伦理委员会批准(批准号No.TCM-2022-305)。
1.2 药品与试剂
芍药苷(质量分数≥95%,批号CHB190124)购自成都克洛玛生物科技有限公司;α-萘异硫氰酸酯(α-naphthylisothiocyanate,ANIT,质量分数≥98%,批号L2104215)购自上海阿拉丁生化科技股份有限公司;UDCA(批号L21056A)购自德国Losan Pharma Gmbh 公司;丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(批号C009-2-1)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒(批号C010-2-1)、总胆红素(total bilirubin,TBIL)试剂盒(批号C019-1-1)、直接胆红素(direct bilirubin,DBIL)试剂盒(批号C019-2-1)、总胆汁酸(total bile acid,TBA)试剂盒(批号 E003-2-1 )、γ- 谷氨酰转移酶( γglutamyltranspeptidase,γ-GT)试剂盒(批号C017-2-1)均购自南京建成生物工程研究所;胆汁酸检测试剂盒(批号R21006)购自深圳绘云生物科技有限公司;法尼醇X 受体(farnesoid X receptor,FXR)抗体(批号A5942)、β-actin 抗体(批号AC026)购自武汉爱博泰克生物科技有限公司;胆酸盐外排泵(bile salt export pump,BSEP)抗体(批号PB9414)购自武汉博士德生物工程有限公司;引物序列由北京擎科生物科技有限公司合成;Foregene RNA 提取试剂盒(批号RE-03011/03014)购自成都福际生物技术有限公司。
1.3 仪器
超高效液相色谱串联质谱仪(UPLC-MS/MS,美国Waters 公司);Mill-Q 型滤膜超纯水系统(美国Millipore 公司);1600R 型低温离心机(上海力申科学仪器有限公司);FreeZone 4.5 Liter-50C 型冷冻干燥机(美国Labconco 公司);FLX800T 型酶标仪(美国Bio-Tek 公司);Forma900 型超低温冰箱(美国Themo Fisher Scientific 公司);TBS380 型荧光计(美国Promega 公司);JA5003 型电子分析天平(上海舜宇平科学仪器有限公司);CI-S 型倒置显微镜(日本Nikon 公司);MiSeq Sequencing Platform测序仪(美国Illumina 公司);2100 型生物分析仪(美国Agilent 公司)。
2 方法
2.1 药物配制
芍药苷与UDCA 均溶解于生理盐水,振荡摇匀后放置使用。因造模剂ANIT 难溶于水,采用橄榄油溶解,振荡摇匀,以获得黄色澄清透明液体为佳。
2.2 分组、给药与造模
动物适应性喂养1 周后,随机分为对照组、模型组、UDCA(60 mg/kg)组和芍药苷低、中、高剂量(50、100、200 mg/kg)组,每组8 只。除对照组和模型组给予等体积生理盐水外,其余各组ig 相应药物(10 mL/kg),连续给药7 d。给药第4 天,给药2 h 后,除对照组外,其余各组均单次ig ANIT(60 mg/kg)建立胆汁淤积模型,对照组则给予等体积橄榄油。实验第7 天,末次给药1 h 后,各组大鼠ip 乌拉坦,取血清、肝脏组织,−80 ℃冷冻保存。
2.3 生化指标测定
各组大鼠腹部主动脉取血后,于室温、黑暗条件静置,4 ℃、3 000 r/min 离心10 min,分离血清。根据试剂盒说明书测定血清中各肝功能指标。
2.4 肝组织病理染色
各组肝脏样本用4%多聚甲醛保存,于梯度分级乙醇中脱水。将肝脏标本固定并包埋在石蜡块中,依次用苏木素-伊红(HE)染色,并置于显微镜下观察并拍照。
2.5 胆汁样本采集
大鼠ip 乌拉坦溶液麻醉,按照前期实验方法[15]采集大鼠胆总管胆汁,于−80 ℃冷冻保存,以胆汁收集量与流出时间比值代表胆汁体积流量。
2.6 胆汁酸测定
2.6.1 样本处理 取各组胆汁样本,冰浴放置以减少样本降解,并用50%甲醇稀释100 倍。取50 μL稀释后的胆汁样本,加入400 μL 含胆汁酸内标的乙腈-甲醇(8∶2)混合溶剂。振荡离心后取上清液250 μL,冷冻干燥。干燥后的实际样品和质控样本粉末加入40 μL 乙腈-甲醇混合溶液,10 ℃、650 r/min振荡20 min。加入去离子水60 μL,10 ℃、650 r/min振荡20 min,混合样品放在−20 ℃冷冻20 min,4 ℃、1 350 r/min 离心30 min,待测。
2.6.2 色谱条件 流动相A 为10 mmol/L 乙酸铵-0.25%醋酸,流动相B 为乙腈-甲醇-异丙醇(8∶1∶1),梯度洗脱:0~0.3 min,5% B;0.3~0.5 min,5%~10% B;0.5~2 min,10%~15% B;2~3 min,15%~30% B;3~6 min,30% B;6~8 min,30%~35% B;8~9 min,35%~40% B;9~10 min,40%B;10~15 min,40%~75% B;15~15.5 min,75%~100% B;15.5~16.2 min,100% B;16.2~16.3 min,100%~5% B;16.3~17 min,5% B。进样量为5 μL。
2.6.3 质谱条件 电喷雾电离源(ESI−);柱温30 ℃;样品室温度10 ℃;毛细管电压2.0 kV;离子源温度150 ℃;洗脱溶剂温度550 ℃;洗脱溶剂体积流量1 000 L/h。
2.6.4 数据处理 UPLC-MS/MS 原始数据通过Masslynx v4.1 软件处理,对样品所含胆汁酸进行积分、建立标准曲线和定量分析。iMAP v1.0 软件用于统计分析,包括主成分分析(principal component analysis,PCA)、正交偏最小二乘-判别分析( orthogonal partial least squares-discriminant analysis,OPLS-DA)和单维统计检验等。PCA 和OPLS-DA 取VIP>1 且P<0.05 的代谢物交集作为显著差异代谢物。
2.7 分子对接
采用分子对接技术模拟芍药苷与FXR 蛋白的相互作用。通过PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)获取芍药苷(CID:442534)的结构,并从蛋白质数据库(PDB,http://www.rcsb.org/)搜索FXR 的蛋白质信息并以PDB 格式文件下载。获得的PDBQT 蛋白受体文件,在AutoDock4 中通过去除水并以氢原子代替的方法进行纯化,小分子化合物也进行相同操作,并以蛋白质为受体,化合物为配体进行对接模拟,以获得合适的最小结合能。最终使用PyMol 2.5 对PDB 格式的合成文件进行可视化。
2.8 qRT-PCR 检测肝组织FXR 和BSEP mRNA表达
按照试剂盒说明书提取各组肝组织总RNA 并合成cDNA,进行qRT-PCR 分析。引物序列见表1。

表1 引物序列Table 1 Primer sequences
2.9 Western blotting 检测肝组织FXR 和BSEP 蛋白表达
取各组肝组织样本,加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA 裂解液提取蛋白。采用BCA 蛋白检测试剂盒测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,封闭1 h,TBST 清洗3 次,加入一抗孵育过夜,TBST 清洗3 次。加入二抗孵育1 h,TBST 清洗3 次,加入ECL 试剂显影,使用Image J 对条带灰度值进行统计。
2.10 统计学分析
3 结果
3.1 药效学研究
3.1.1 芍药苷对胆汁淤积大鼠的保护作用 记录实验期间大鼠体质量的变化(图1-A),结果显示胆汁淤积模型建立后,大鼠体质量下降,即出现明显的胆汁淤积临床症状,如食欲不振、体质量减轻等。实验第7 天,与对照组比较,模型组大鼠体质量显著下降(P<0.01);与模型组比较,各给药组大鼠体质量下降得到缓解,其中UDCA 组和芍药苷中、高剂量组体质量均明显升高(P<0.05、0.01)。为进一步验证芍药苷对胆汁淤积大鼠的改善作用,测定肝脏中的几种特异性标志物ALT、AST、TBA、TBIL、DBIL 和γ-GT 的含量。如图1-B~G 所示,与对照组比较,模型组大鼠血清中以上标志物水平均显著升高(P<0.01),提示胆汁淤积模型建立成功。与模型组比较,各给药组ALT、AST、TBA、TBIL、DBIL 和γ-GT 水平均显著降低(P<0.01),且呈剂量相关性。
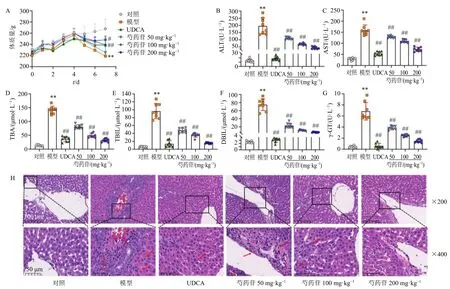
图1 芍药苷对胆汁淤积大鼠药效学的影响Fig.1 Effect of paeoniflorin on pharmacodynamics of rats with cholestasis
病理结果(图1-H)显示,对照组大鼠肝小叶完整,肝细胞呈索状紧密排列,肝窦明显。模型组大鼠肝组织结构紊乱,汇管区和肝窦炎症因子浸润,伴有明显的水肿和胆管增生,清晰可见肝细胞脂肪变性。与模型组比较,各给药组大鼠肝脏水肿和脂肪变性均有明显改善。此外,UDCA 组和芍药苷中、高剂量组胆管增生明显减轻。上述结果提示,芍药苷具有明显的肝脏保护作用,能够改善ANIT 诱导的大鼠肝功能指标升高,抵抗体质量下降,缓解肝组织胆管增生、水肿和脂肪变性,并以200 mg/kg 剂量最佳。
3.1.2 芍药苷对胆汁淤积大鼠胆汁体积流量的影响综合上述实验结果,选择芍药苷高剂量(200 mg/kg)组进行后续实验研究。通过插管法获取对照组、模型组和芍药苷高剂量组的胆汁用于后续的胆汁酸代谢差异分析研究。以总流量与实验时间比值代表每组大鼠胆汁体积流量,结果如表2 所示,与对照组比较,模型组大鼠胆汁体积流量明显降低(P<0.05),提示胆汁淤积模型大鼠胆管阻滞,导致胆汁体积流量下降;给予芍药苷后,胆汁体积流量明显升高(P<0.05),表明胆道阻塞得到缓解。芍药苷能够改善模型大鼠胆道阻塞,恢复胆汁酸正常运行。
表2 芍药苷对胆汁淤积大鼠胆汁体积流量的影响(±s , n = 6)Table 2 Effect of paeoniflorin on bile flow rate in rats with cholestasis (±s , n = 6)

表2 芍药苷对胆汁淤积大鼠胆汁体积流量的影响(±s , n = 6)Table 2 Effect of paeoniflorin on bile flow rate in rats with cholestasis (±s , n = 6)
与对照组比较:*P<0.05;与模型组比较:#P<0.05。*P < 0.05 vs control group; #P < 0.05 vs model group.
组别 剂量/(mg·kg−1) 体积流量/(μL·min−1)对照 — 18.13±1.09模型 — 5.52±0.67*芍药苷 200 11.02±0.83#
3.2 胆汁酸代谢组学分析
3.2.1 胆汁酸代谢组学轮廓分析 采用UPLCMS/MS 采集对照组、模型组和芍药苷高剂量组大鼠胆汁酸数据,质量控制结果见图2-A,所有样本均在控制界限之内,提示实验样本质量可控,数据可靠。分析各组胆汁酸的相对含量(图2-B),结果显示对照组、模型组与芍药苷高剂量组的初级(次级)胆汁酸含量分别为 78.02%(21.87%)、96.14%(12.06%)、87.95%(12.05%),提示ANIT 阻断胆汁酸的转化,而给予芍药苷后能够恢复该过程。
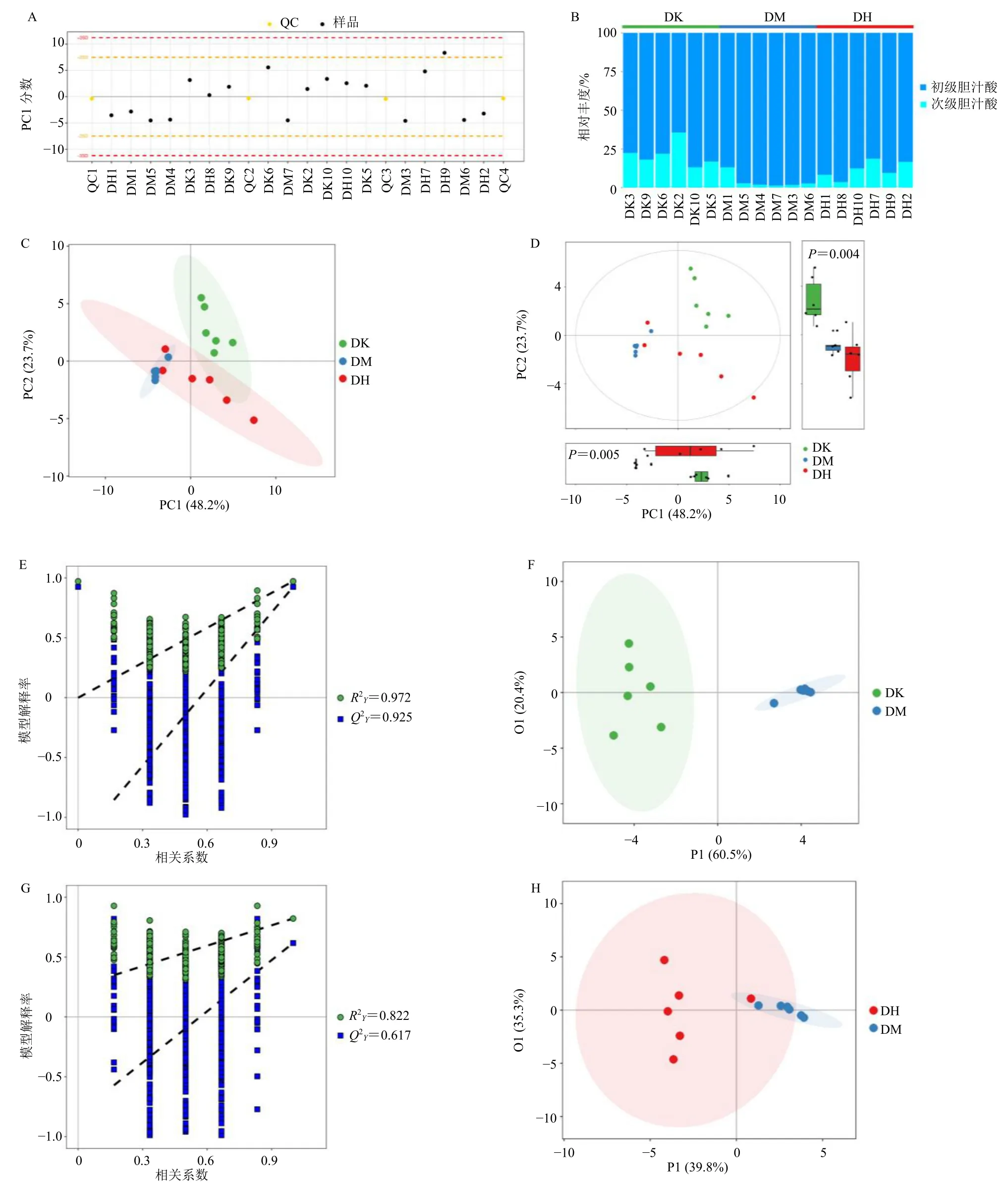
图2 大鼠胆汁酸代谢组学分析 (n = 6)Fig.2 Metabolomic analysis of bile acids in rats (n = 6)
PCA 作为一种降维的统计方法,通过正交变换将一组潜在的相关变量转换为线性不相关变量[16]。首先采用PCA 方法研究对照组、模型组和芍药苷高剂量组之间的差异(图2-C、D)。结果显示,3 组样本组内分析一致,对照组与模型组组间差异显著而在模型组与芍药苷高剂量组组间不明显。
为了最大限度地分离3 组样本,采用OPLS-DA方法分析胆汁酸数据,OPLS-DA 得分图见图2-F、H,结果表明对照组、模型组、芍药苷高剂量组3 组间存在显著差异。置换检验用于判断模型是否过拟合(图2-E、H),结果显示对照组与模型组R2Y=0.972、Q2Y=0.925,模型组与芍药苷高剂量组R2Y=0.822、Q2Y=0.617,均大于0.5,表明模型质量良好且未出现过拟合。这些参数表明各组间差异成分可靠,结果具有准确的预测特征。
3.2.2 胆汁酸差异代谢物筛选及分析 基于VIP≥1 及P<0.05 标准筛选差异数据,通过匹配胆汁酸对照品确认差异胆汁酸,总共获得22 个差异胆汁酸。结果显示,与对照组比较,模型组有17 种差异胆汁酸,其中初级胆汁酸8 种、次级胆汁酸9 种。与模型组比较,芍药苷高剂量组的差异胆汁酸包含9 种初级胆汁酸和7 种次级胆汁酸。进一步分析差异胆汁酸,模型组胆汁酸含量显著降低且特异胆汁酸集中于次级胆汁酸。而芍药苷治疗后,胆汁酸含量明显升高(P<0.05),其中6 个差异胆汁酸回调显著(P<0.01)。聚类分析3 组差异胆汁酸的分布规律,结果显示,差异胆汁酸在不同组间区别明显,组内聚类理想(图3-A)。Z-score 结果显示同一水平下,不同差异胆汁酸含量以模型组最低(图3-B)。

图3 大鼠差异胆汁酸分析Fig.3 Analysis of differential bile acids in rats
差异胆汁酸含量分析(表3、4)结果显示,模型组中,牛磺胆酸(taurocholate acid,TCA)、牛磺α 鼠胆酸(tauro-α-muricholic acid sodium,TαMCA)、胆酸(cholic acid,CA)、牛磺熊脱氧胆酸(tauroursodeoxycholic acid,TUDCA)、甘氨熊脱氧胆酸(glycoursodeoxycholic acid,GUDCA)、甘氨鹅脱氧胆酸(glycochenodeoxycholic acid,GCDCA)、甘氨胆酸(glycocholic acid,GCA)、熊脱氧胆酸(ursodeoxycholic acid,UDCA-7S)、牛磺石胆酸(taurocholic acid,TLCA)、牛磺猪脱氧胆酸(taurohyodeoxycholic acid,THDCA)、甘氨猪胆酸(glycohyocholic acid,GHCA)、甘氨脱氧胆酸(glycodeoxycholic acid,GDCA)、甘氨猪脱氧胆酸(glycohyodeoxycholic acid,GHDCA)、甘氨石胆酸(glycolithocholic acid,GLCA)、熊胆酸(ursocholic acid,UCA)、牛磺脱氧胆酸(taurodeoxycholate acid,TDCA)的含量明显降低(P<0.05、0.01),而牛磺β 鼠胆酸(tauro-β-muricholic acid sodium,TβMCA)的含量升高显著(P<0.01)。给予芍药苷后,初级胆汁酸βMCA、TαMCA、UDCA-7S、UCA、GCDCA、CA、GCA、GUDCA、α 鼠胆酸(α-muricholic acid,αMCA)的含量明显升高(P<0.05),而TβMCA 含量显著减少(P<0.01)。次级胆汁酸TLCA、GHDCA、HDCA、GDCA、GLCA、NorCA 的含量也回调明显(P<0.05)。为进一步明确芍药苷对胆汁酸代谢的影响,分析3 组间的差异胆汁酸,结果显示芍药苷能够提高6 种初级胆汁酸(TαMCA、CA、UDCA-7S、GUDCA、GCA、GCDCA)和5 种次级胆汁酸(GHDCA、UCA、TLCA、GLCA、GDCA)的含量,降低初级胆汁酸TβMCA 的含量。上述结果表明芍药苷能够调节胆汁酸池组成和结构的变化,促进初级胆汁酸向次级胆汁酸转化,降低毒性胆汁酸含量,进而改善ANIT 诱导的胆汁淤积。
表3 差异初级胆汁酸分析 (±s, n = 6)Table 3 Differential primary bile acid analysis (±s , n = 6)

表3 差异初级胆汁酸分析 (±s, n = 6)Table 3 Differential primary bile acid analysis (±s , n = 6)
与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01,表4 同。*P < 0.05 **P < 0.01 vs control group; #P < 0.05 ##P < 0.01 vs model group, same as table 4.
组别 剂量/(mg·kg−1) TαMCA/(μmol·L−1) TβMCA/(μmol·L−1) TCA/(μmol·L−1) TUDCA/(μmol·L−1) αMCA/(μmol·L−1) βMCA/(μmol·L−1)对照 — 2 143.53±140.36 1 788.22±258.08 10 213.76±957.62 379.85±53.38 34.94±11.20 24.84±8.73模型 — 184.97±53.38** 6 738.84±821.15* 3 827.96±597.16** 130.14±18.02** 1.14±0.53** 3.62±1.65*芍药苷 200 1 271.53±342.03## 2 368.79±1 129.25## 3 426.10±864.85 168.47±18.33 49.06±21.25## 21.57±7.01#组别 剂量/(mg·kg−1) CA/(μmol·L−1) GCA/(μmol·L−1) GUDCA/(μmol·L−1) GCDCA/(μmol·L−1) UDCA-7S/(μmol·L−1)对照 — 160.13±48.93 2 895.55±216.73 237.33±33.84 523.67±73.75 4.61±0.80模型 — 4.80±1.93** 85.55±32.26** 11.26±2.16** 37.95±13.51** 0.24±0.03**芍药苷 200 89.84±36.09# 1 604.52±648.53# 315.46±133.80## 653.46±207.07# 2.84±0.62#
表4 差异次级胆汁酸分析 (±s, n = 6)Table 4 Differential secondary bile acid analysis (±s , n = 6)

表4 差异次级胆汁酸分析 (±s, n = 6)Table 4 Differential secondary bile acid analysis (±s , n = 6)
组别 剂量/(mg·kg−1) THDCA/(μmol·L−1) TDCA/(μmol·L−1) TLCA/(μmol·L−1) UCA/(μmol·L−1) GHCA/(μmol·L−1) NorCA/(μmol·L−1)对照 — 3 734.78±815.03 752.38±176.74 8.79±1.55 1.01±0.26 2.06±0.40 0.77±0.31模型 — 201.59±69.99** 51.65±32.75** 0.78±0.33** 0.04±0.01** 0.21±0.15 0.04±0.02**芍药苷 200 715.64±344.90 185.75±75.52 4.04±0.92# 0.59±0.20# 7.53±4.05# 0.84±0.29##组别 剂量/(mg·kg−1) GHDCA/(μmol·L−1) GDCA/(μmol·L−1) GLCA/(μmol·L−1) HDCA/(μmol·L−1) DCA-3S/(μmol·L−1)对照 — 489.67±92.38 155.75±16.62 1.32±0.20 2.09±0.71 0.21±0.06模型 — 4.29±4.83** 1.81±1.42** 0.02±0.02** 0.03±0.01** 0.06±0.01*芍药苷 200 141.44±58.11# 80.87±33.25# 2.61±1.05## 0.55±0.20# 0.30±0.12#
3.3 芍药苷对胆汁淤积大鼠胆汁酸受体的影响
3.3.1 芍药苷与胆汁酸核受体FXR 的分子对接基于上述胆汁酸代谢的结果,进一步探索芍药苷与胆汁酸代谢相关受体的关系。FXR 是调控胆汁酸稳态的核心靶点,既通过激活胆汁酸转运体BSEP 等的表达促进胆汁酸的外排,又抑制胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)的活性进而影响胆汁酸的合成[17]。采用分子对接技术模拟芍药苷与FXR 的结合,对接结果见图4-A。芍药苷通过2 个氢键与FXR 的HIS444 位点发生相互作用。另一方面,受体与配体间的结合能越低,两者亲和力越好,所形成的构象越稳定。二者结合能为−10.11 kJ/mol(<−5 kJ/mol),提示芍药苷与FXR 具有较高亲和力。因此,FXR 可能是芍药苷调控胆汁酸代谢的关键靶点。

图4 芍药苷对胆汁酸受体的影响Fig.4 Effects of paeoniflorin on bile acid receptors
3.3.2 芍药苷对胆汁酸受体FXR、BSEP的mRNA及蛋白表达的影响 为进一步研究胆汁酸受体在芍药苷改善ANIT 诱导胆汁淤积中的作用,对核受体FXR 和外排转运受体BSEP 的表达进行测定。如图4-B~F 所示,与对照组比较,模型组大鼠肝组织FXR和BSEP的mRNA 和蛋白表达水平均显著降低(P<0.05、0.01);与模型组比较,芍药苷高剂量组大鼠肝组织BSEP的mRNA 和蛋白表达水平均显著升高(P<0.05),FXR的mRNA 表达水平显著升高(P<0.01);芍药苷中剂量组FXR 的蛋白表达水平显著升高(P<0.05)。表明芍药苷能够恢复胆汁淤积状态下胆汁酸受体的抑制,改善胆汁酸的合成和转运,发挥肝脏保护作用。
4 讨论
芍药苷是从赤芍中分离提取的水溶性单萜苷类化合物,能够治疗多种肝胆疾病[18]。课题组前期已经确证赤芍及其关键成分芍药苷治疗胆汁淤积效果显著,然而,胆汁淤积致病成因复杂,芍药苷在其中发挥作用的机制尚不完全清楚。本研究在明确芍药苷改善胆汁淤积药效研究的基础上采用胆汁酸代谢组学技术,深入胆汁酸动态变化过程,探索二者的作用关系,进一步说明芍药苷发挥作用的关键机制。
ANIT 是常用的肝内胆汁淤积造模剂,该模型具有较好的重现性。ANIT 能够结合胆汁中的谷胱甘肽造成胆汁分泌和流动的中断,进而破坏胆管上皮细胞细胞膜,引发肝内胆管增殖,阻塞胆管。ANIT与谷胱甘肽结合的同时,大量活性氧被释放,激活炎性因子,诱发胆管炎症而在病理组织中显示出明显的炎症浸润和胆管增生[19-20]。胆汁淤积的早期生化标志物以γ-GT 为主,随后在黄疸阶段出现高水平的DBIL 和TBIL[21]。而ALT 和AST 是肝脏功能损伤的黄金指标,其活性的升高有助于临床诊断肝胆疾病[22]。本研究结果显示,模型组大鼠血清肝功能指标均显著升高,组织病理学能够观察到肝窦及汇管区大量炎性浸润的发生且汇管区周围伴随胆管增生和肝细胞脂肪变性,与文献报道相对应,提示ANIT 诱导的胆汁淤积模型建立成功[23]。芍药苷治疗后,大鼠胆汁淤积症状明显减轻体质量得到恢复,ALT、AST、TBIL 等肝功能指标较模型组呈剂量相关性下降。各给药组肝小叶紧密排列,肝细胞脂肪变性,汇管区增生胆管减少,水肿及炎性浸润被有效抑制。此外,胆汁体积流量测定结果提示芍药苷缓解ANIT 导致的胆道阻塞,提高胆汁体积流量。表明芍药苷能够有效缓解ANIT 诱导的胆汁淤积,发挥肝脏保护作用。
生理状态下,胆汁酸首先在肝窦门静脉中被摄取,由肝细胞内转运,并排泄至胆管,转运过程伴随着胆汁酸的化学修饰,如葡萄糖醛酸化或与氨基酸结合、羟基化、磺化等[24]。分泌到肠道的胆汁酸经过肠肝循环能够高效捕获大约90%的胆汁酸经门静脉返回肝脏并在肝细胞中再摄取[25]。胆汁酸代谢稳态失衡后,以疏水胆汁酸为主的毒性胆汁酸积聚肝脏进而引发胆汁淤积[26]。因此收集各组大鼠胆汁探索给药前后胆汁酸成分及比例的变化。结果显示ANIT 刺激后,包括TCA、GCA 和GCDCA 在内的7 种初级胆汁酸含量明显减少而TβMAC 的含量显著增加。芍药苷治疗能够逆转模型组初级胆汁酸的减少,恢复胆汁酸含量但对TβMAC 呈现降低作用。有趣的是,不同于CA、CDCA,TβMAC 是一种FXR拮抗剂,能够抑制FXR 活性影响胆汁酸合成[26]。针对这一胆汁酸成分的变化,对FXR 受体进行测定,Western blotting 结果显示ANIT 诱导后,该蛋白的表达被明显抑制,给药后该作用被逆转;PCR 实验也提示高剂量芍药苷显著上调FXR 表达。因此,我们推测芍药苷通过降低模型大鼠TβMAC 的含量恢复被拮抗的FXR 活性,促进胆汁酸代谢趋于平衡。
相关研究证实胆汁酸的解毒过程伴随FXR 的激活,激活后的FXR 进一步诱导BSEP 活性的增强加速毒性胆汁酸的外排[27]。BSEP 作为胆汁酸由肝细胞进入胆汁的主要转运体,能够运输包括CA、CDCA 在内的牛磺酸和甘氨酸缀合类胆汁酸[28]。结合代谢组学和分子实验,结果显示CA、CDCA 等胆汁酸的含量在模型组显著降低,BSEP 蛋白和基因表达均受到抑制,提示BSEP 抑制后,CA 等胆汁酸无法由肝细胞转入胆汁而在肝细胞中大量蓄积诱导肝内胆汁淤积。而芍药苷治疗后,胆汁中CA、CDCA 的含量明显增加,BSEP 活性得到改善。这些结果说明ANIT 刺激下,CA 等胆汁酸含量的降低和TβMAC 含量的升高抑制FXR 的激活进而影响转运体BSEP 活性,大量胆汁酸蓄积肝细胞,最终诱发肝内胆汁淤积。而芍药苷能够调节胆汁酸的成分和比例,恢复胆汁酸池稳态从而改善FXR 和BSEP 活性,促进肝内胆汁酸外排而缓解胆汁淤积。
综上,芍药苷能够显著改善胆汁淤积导致的生化指标异常,缓解肝脏病理损伤,通过调节胆汁酸池组成,促进胆汁酸转化,降低毒性胆汁酸含量恢复胆汁酸核受体FXR、胆汁酸转运体BSEP 的活性,改善胆汁酸的合成及转运过程对抗胆汁淤积。然而,胆汁淤积的发生发展涉及多个器官因子的相互串扰,本研究仅从胆汁成分变化反映疾病的机制是不全面的,后续研究应当结合分析血清、尿液中的胆汁酸代谢物组成,进一步明确芍药苷发挥作用的关键成分及其变化趋势。此外,胆汁酸的调控有赖于胆汁酸受体和肠道菌群的共同作用,一方面疏水性胆汁酸在菌群的作用下进行修饰转化为毒性较小的亲水性胆汁酸,另一方面菌群可间接作用于肠道FXR、成纤维细胞生长因子19(fibroblast growth factor 19,FGF19)等受体改善胆汁酸的重吸收,因此后续研究可以结合肠道菌群分析、菌群移植等技术,进一步明确“肝脏-肠道”系统作用下的胆汁酸的动态变化特征。
利益冲突所有作者均声明不存在利益冲突

