川芎调节血脑屏障通透性的作用及机制研究
刘明妍 ,刘力榕 ,冯梦晗 ,朱美霞 ,张银环 ,闫晓宁 ,方 聪 ,屈碧琼 ,贾志鑫, ,刘 洁, ,肖红斌, *
1.北京中医药大学中药学院,北京 102400
2.北京中医药大学 中药分析与转化研究中心,北京 102400
3.北京中医药大学 北京中医药研究院,北京 102400
血脑屏障存在于哺乳动物脑部结构中,为神经元功能创造离子稳态[1],调节营养物质或代谢物在血液和大脑之间的运输,保护中枢神经系统免受外来物质的伤害[2]。相比其他组织屏障,血脑屏障具有低通透性、高选择性及低胞饮特点,其对物质运输的严格调控使得药物的脑靶向运输成为难题[3-4]。适当地调节血脑屏障的通透性是临床中常采用的手段[5]。
川芎ChuangxiongRhizoma是现代临床中治疗头痛的常用中药之一[6-7]。《医学启源》(金·张元素)记载:“川芎属风药,能升散,轻清上达,充塞头顶,引药上行至脑,直达病所[8]”。一项探析风药对血管性痴呆各种证型治疗效果的研究发现川芎可引他药直达脑络[9]。研究发现川芎与复方舒郁健脑方配伍可增加酸枣仁皂苷A 在小鼠脑组织中的蓄积[10],与天麻配伍可提高天麻素苷元在脑内的生物利用度[11]。Zheng 等[12]进一步发现川芎成分藁本内酯、洋川芎内酯A、洋川芎内酯I 可降低MDCK-MDR1 细胞单培养血脑屏障模型的跨细胞内皮电阻值,增加芍药苷、松果菊苷从顶端侧到基底侧方向上的表观渗透系数。川芎具有引导他药通过血脑屏障上行于头部[13]的作用,但目前缺乏具体阐述川芎对血脑屏障通透性的研究数据,且对体外血脑屏障模型通透性的研究只集中在少数成分(藁本内酯、洋川芎内酯A、洋川芎内酯I)。故本研究考察川芎对血脑屏障通透性的作用及机制,以期为相关研究提供依据。
1 材料
1.1 动物及细胞系
SPF 级雄性昆明小鼠118 只,体质量19~22 g,购自北京斯贝福生物技术有限公司,实验动物使用许可证号SCXK(京)2020-0033,饲养于北京中医药大学动物房屏障环境中(伦理批准号1117052400125),24 h 光照和黑暗循环,温度(20±2)℃,相对湿度(50±10)%,正常饮食,自由饮水。
小鼠脑微血管内皮细胞bEnd.3 由北京博奥凯美科技有限公司提供。
1.2 药品与试剂
川芎饮片(批号2104040)购自北京太洋树康药业有限责任公司,经北京中医药大学王学勇教授鉴定为伞形科植物川芎LigusticumchuanxiongHort.的干燥根茎;对照品洋川芎内酯I(批号Y-085-170609)、洋川芎内酯A(批号Y-083-200326)、洋川芎内酯H(批号Y-084-180408)、藁本内酯(批号G01001909024)、欧当归内酯A(批号O002006004)、阿魏酸(批号A-002-161216)均购自成都瑞芬思生物科技有限公司,质量分数>98%;4-羟基-3-丁基苯酞为实验室分离制备得到,经核磁共振波谱与高效液相色谱检测确定质量分数>98%;SDS-PAGE配胶试剂盒(批号20200328)购自北京索莱宝科技有限公司;BCA 蛋白定量试剂盒(批号9232)、RIPA裂解液(批号9116)均购自爱必信(上海)生物科技有限公司;异硫氰酸荧光素-葡聚糖[fluorescein isothiocyanate-dextran,FITC-dextran,批号46944(相对分子质量4×103)、批号FD40S(相对分子质量4×104)、批号46945(相对分子质量7×104)、批号46946(相对分子质量1.5×105)]均购自默克西格玛公司;荧光素钠(fluorescein sodium,Na-F,批号S19188)购自上海源叶生物科技有限公司;CCK-8试剂盒(批号K001062211)购自北京兰博利德生物科技有限公司;嵌入式细胞培养小室(批号665640)购自德国格瑞纳公司;闭锁蛋白(Occludin)抗体(批号27260-1-AP)、闭锁小带蛋白1(zonula occluden-1,ZO-1)抗体(批号21773-1-AP)、血管内皮细胞钙黏合素(VE-cadherin)抗体(批号27956-1-AP)、P 糖蛋白(P-glycoprotein,P-gp)抗体(批号22336-1-AP)、β-actin 抗体(批号81115-1-RR)均购自武汉三鹰生物技术有限公司;埃兹蛋白/根蛋白/膜突蛋白(ezrin/radixin/mesin,ERM)抗体(批号DF12396)购自Affinity Bioscience 公司;p-ERM 抗体(批号ab76247)购自艾博康(上海)贸易有限公司;HRP 标记的山羊抗鼠/兔二抗(批号20040/20039)、蛋白酶抑制剂(PMSF,批号36978)均购自武汉赛维尔生物科技有限公司;磷酸酶抑制剂混合型(批号1861281)、甲醇(批号206403)购自美国赛默飞世尔科技公司;DMEM 高糖培养基(批号8121451)购自Invitrogen 公司;胎牛血清(批号1928700)购自Biological Industries;胰酶蛋白酶-EDTA 消化液(批号202011229)购自江苏凯基生物技术有限公司;人血浆纤连蛋白(批号F-2006)购自默克西格玛公司;0.05 mol/L Tris-HCl(批号R00237)购自北京雷根生物技术有限公司。
1.3 仪器
Milli-Q Advantage A10 型纯水仪制备系统、旋转蒸发仪(东京理化器械株式会社,配备有N-1300型旋转支架、OSB-2200 型水浴锅、WELCH 真空泵);Infinite M200Pro 型多功能酶标仪[帝肯(上海)实验器材有限公司];MM400 型珠式样品匀浆仪(上海弗尔德上海仪器设备有限公司);Mini-PROTEAN Tetra Cell and PowerPac Basic Power 垂直电泳系统套装(伯乐生命医学产品有限公司);Amersham Imager 680 型化学发光成像仪[思拓凡生物科技(杭州)有限公司];SQP-PRACTUM224-1CN 型分析天平(赛多利斯科学仪器有限公司);3K15 型高速冷冻离心机(默克西格玛公司);ERS-2 型跨内皮电阻仪(密理博中国有限公司)。
2 方法
2.1 川芎提取物的制备
川芎饮片分别以12 倍量、10 倍量95%乙醇加热回流提取2 次,滤过,滤渣以10 倍量水加热回流提取2 次,滤过,合并滤液浓缩,得到质量浓度为1 g/mL 的川芎提取液。
2.2 川芎提取物含量测定
2.2.1 样品制备 川芎提取物稀释至1 μg/mL,0.22µm 微孔滤膜滤过,转移至棕色液相小瓶,待测。
2.2.2 色谱条件 Agilent ZORBAX Eclipse Plus C18色谱柱(50 mm×2.1 mm,1.8 μm);流动相A 为0.1%乙酸-10 mmol/L 乙酸铵-水溶液,流动相B 为乙腈,梯度洗脱,正离子:0~5 min,80%~60% A;5~6 min,60%~40% A;6~8 min,40%~20% A;8~10 min,20%~5% A;10~12 min,5% A。负离子:0~3 min,98%~70% A;3~6 min,70%~5%A;6~7 min,5% A。体积流量0.4 mL/min;柱温35 ℃;进样量5 µL。
2.2.3 质谱条件 Dual AJS 电喷雾离子源(electron spray ionization,ESI),正、负离子多反应监测(multiple reaction monitoring,MRM)扫描模式,干燥气温度300 ℃,干燥气体积流量9 L/min,鞘气温度250 ℃,鞘气体积流量11 L/min,毛细管电压+4 kV、−3.5 kV,具体参数见表1。

表1 7 个化合物的质谱参数Table 1 Mass spectrometry parameters of seven compounds
2.3 动物分组与给药
实验前动物禁食12 h,自由饮水。小鼠随机分7 组(n=10),其中1 组为对照组,其他6 组均为给药组。对照组ig 生理盐水后麻醉,给药组ig 川芎提取物(5.8 g/kg,以生药量计),分别于给药0.5、1、2、4、6、8 h 后麻醉,iv FITC-dextran(30 μg/g,相对分子质量4×103),循环5 min,从心脏灌流生理盐水后取脑组织。
另取同一批次的小鼠48 只,随机按FITCdextran 相对分子质量(4×104、7×104、1.5×105)分成3 组(n=16),每组再分为对照组和给药组(n=8),对照组ig 生理盐水0.5 h 后麻醉,给药组ig 川芎提取物0.5 h 后麻醉,iv 不同相对分子质量的FITC-dextran(30 μg/g),循环5 min,从心脏灌流生理盐水后取脑组织。
2.4 脑组织样品处理[14]
脑组织加入等倍量的Tris-HCl(pH 7.6),匀浆10 min,4 500 r/min 离心取上清液,上清液中加入等体积甲醇沉蛋白,15 000 r/min 离心取上清液。采用多功能酶标仪(Ex=485 nm,Em=535 nm,n=3)测定各组脑组织上清液的荧光强度,计算单位脑组织质量含有的FITC-dextran 含量。
2.5 体外血脑屏障模型构建及川芎单体成分透过血脑屏障通透性实验
2.5.1 细胞培养 bEnd.3 细胞用含10%胎牛血清、1%青霉素-链霉素(10 U/mL)的高糖DMEM 培养基,于37 ℃、5% CO2的培养箱中培养,按1∶3 传代,0.25%胰酶(含0.05% EDTA)消化。冻存液为胎牛血清-二甲基亚砜(9∶1),每管细胞数≥1×106个/mL。复苏时在37 ℃条件下快速解冻转移至预热完全培养基中,吹打离心后常规培养。
2.5.2 血脑屏障模型构建及评价 取生长密度80%的bEnd.3 细胞,消化计数,调整细胞密度为2×105个/mL。取内表面铺被人血浆纤连蛋白[15]的Transwell 小室,供给池加入0.5 mL 细胞溶液,接收池加入1.5 mL 完全培养基,细胞沉降后转移至培养箱中。供给池每天换液,接收池隔天换液。
细胞贴壁后使用跨内皮电阻仪检测跨内皮电阻(transepithelial resistance,Teer),计算组织电阻Ω,Ω最高且维持稳定认为血脑屏障基本形成。
Ω=(Ω实验-Ω对照)×S
Ω实验为细胞模型小室Teer 值,Ω空白为对照小室Teer 值,S为小室底膜面积(1.1 cm2)
2.5.3 分组及给药 实验分为对照组和不同浓度的洋川芎内酯A、洋川芎内酯H、阿魏酸、洋川芎内酯I、藁本内酯、欧当归内酯A、4-羟基-3-丁基苯酞给药组。对照组供给池加入含终质量浓度为1 μg/mL Na-F 的完全培养基0.5 mL,接收池加入空白完全培养基1.5 mL;给药组供给池分别加入含终质量浓度为1 μg/mL Na-F 和不同浓度(1、10、100 μmol/L)药物的完全培养基0.5 mL,接收池均加入空白完全培养基1.5 mL。
给药后0.5、1、2、4、6、8 h 于接收池取样100 μL,取样后补充相同体积培养基至接收池。样品采用多功能酶标仪(Ex=485 nm,Em=535 nm)检测,计算Na-F 的表观渗透系数(apparent permeability coefficient,Papp)。
Papp=(dQ/dt)×1/A×1/C0
dQ/dt表示转运时间dt内的药物转运速率(μg/s),A表示小室单层膜表面积(cm2),C0表示初始荧光素钠药物质量浓度(1 μg/mL)
血脑屏障模型成功与否采用Teer[16-17]及Na-F[18]的Papp评价。
2.6 Western blotting 检测蛋白表达
取“2.3”项下给予川芎提取物0、0.5、1、2、4、8 h 的小鼠脑组织,加入含1% PMSF、2%磷酸酶抑制剂的裂解液,低温匀浆静置,4 ℃、12 000 r/min 离心10 min,收集上清。取“2.5.3”项下给予10 μmol/L 洋川芎内酯I 0、0.5、1、2、4、8 h 的bEnd.3细胞,收集细胞沉淀,加入含1% PMSF、2%磷酸酶抑制剂的裂解液吹散,低温静置,4 ℃、12 000 r/min离心10 min,收集上清。采用BCA 试剂盒定量蛋白,沸水浴10 min 使蛋白变性。蛋白样品经4%~15%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,加入5%牛血清白蛋白室温封闭,脑组织蛋白样品孵育Occludin(1∶2 500)、VE-cadherin(1∶300)、ZO-1(1∶6 000)、P-gp(1∶800)一抗,细胞蛋白样品孵育p-ERM(1∶1 000)、ERM(1∶1 200)、ZO-1(1∶6 000)、Occludin(1∶6 000)、P-gp(1∶1 250)一抗,4 ℃孵育过夜。洗涤,加入二抗(1∶10 000),室温孵育1 h,采用化学发光成像仪分析成像。
2.7 统计学分析
3 结果
3.1 川芎提取物对小鼠血脑屏障的作用
3.1.1 川芎提取物各成分含量 采用外标两点法测定得川芎提取物中各成分质量分数由高到低依次为洋川芎内酯A 7.1 mg/g、藁本内酯4.37 mg/g、阿魏酸1.9 mg/g、洋川芎内酯I 1.1 mg/g、欧当归内酯A 0.71 mg/g、洋川芎内酯H 0.21 mg/g、4-羟基-3-丁基苯酞0.057 mg/g。
3.1.2 川芎影响血脑屏障通透性的定量结果 如图1 所示,与对照组比较,给予川芎提取液0.5 h 后,单位脑质量中相对分子质量为4×103的FITCdextran 含量显著增加(P<0.001),随给药时间延长,含量逐渐降低至对照组水平。如图2 所示,与对照组比较,给予川芎提取物0.5 h 后,相对分子质量为4×104、7×104、1.5×105的FITC-dextran 在小鼠脑组织中的含量无显著性差异。

图1 给予川芎提取物不同时间后FITC-dextran(相对分子质量4×103)在脑组织中的透过量 (±s, n = 10)Fig.1 Extravasation of FITC-dextran (molecular weight 4 × 103) in brain tissue after Chuanxiong Rhizoma extract treatment for different time (±s, n = 10)
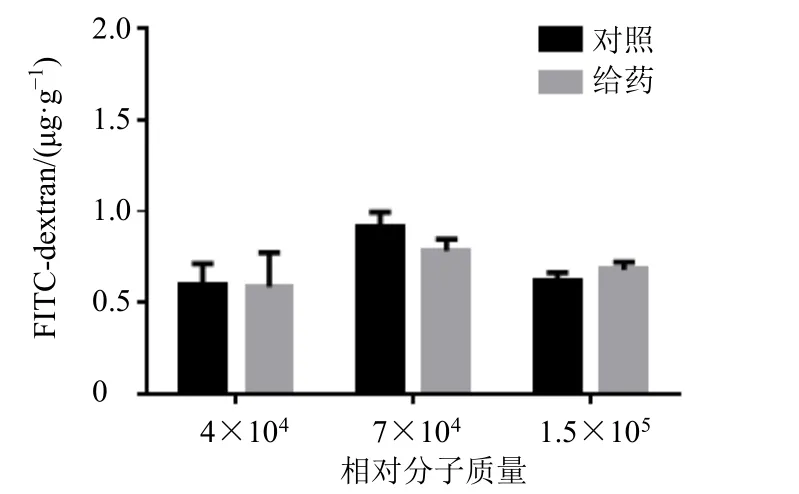
图2 给予川芎提取物0.5 h 后不同相对分子质量FITCdextran 在脑组织中的透过量 (±s , n = 8)Fig.2 Extravasation of FITC-dextran with different molecular weight in brain tissue after treatment with Chuanxiong Rhizoma extract for 0.5 h (±s, n = 8)
3.1.3 川芎提取物不同给药时间脑组织中Occludin、ZO-1、VE-cadherin、P-gp 蛋白表达 如图3 所示,给予川芎提取物0.5、1、2、4、8 h 后小鼠脑组织中Occludin、ZO-1 蛋白表达量呈先降低后增加而后再降低的趋势:给药后0.5 h Occludin 蛋白表达量降低,给药后1、2、4 h 显著增加(P<0.05、0.01),给药后8 h 降低至对照组水平;给药后0.5 h ZO-1 蛋白表达量显著降低(P<0.05),给药后2 h显著增加(P<0.05),给药后8 h 降低至对照组水平;给药后0.5 h P-gp 蛋白表达量升高,给药后2 h显著降低(P<0.01),给药后4、8 h 升高至对照组水平;给药后VE-cadherin 蛋白表达基本无变化。

图3 给予川芎提取物不同时间后小鼠脑组织中Occludin、ZO-1、P-gp、VE-cadherin 蛋白表达的变化 (±s, n = 3)Fig.3 Changes in Occludin, ZO-1, P-gp, and VE-cadherin protein expressions in brain tissue of mice after different durations of administration of Chuanxiong Rhizoma extract (±s , n = 3)
3.2 川芎单体成分对血脑屏障细胞模型的作用
3.2.1 血脑屏障细胞模型评价 采用单层内皮细胞模拟正常状态血脑屏障。bEnd.3 细胞呈多边形,汇合成片后呈现典型的铺路石样结构。模型在培养第5 天时,Teer 值稳定为60 Ω·cm2,(与报道[19]中的70 Ω·cm2基本一致),Na-F 的Papp值为0.5×10−6cm/s,(与报道[20]中甘露醇4.9×10−7cm/s 基本一致),说明本研究中血脑屏障模型构建成功,可用于探究药物对通透性的影响。
3.2.2 川芎单体成分对血脑屏障细胞模型通透性的影响 给予0~100 μmol/L 的洋川芎内酯A、洋川芎内酯H、阿魏酸、洋川芎内酯I、藁本内酯、欧当归内酯A、4-羟基-3-丁基苯酞后,bEnd.3 细胞存活率均大于90%。
川芎7 个单体成分对血脑屏障细胞模型中Na-F 表观渗透系数的影响见图4,给药0.5、1、2、4、6 h 后,1、10、100 μmol/L 洋川芎内酯A、洋川芎内酯H、洋川芎内酯I 及阿魏酸均能显著增加Na-F的Papp(P<0.05、0.01、0.001);给药8 h 后,10、100 μmol/L 洋川芎内酯A、洋川芎内酯H、洋川芎内酯I 及阿魏酸均能显著增加Na-F 的Papp(P<0.01、0.001),随给药时间延长,Na-F 的Papp逐渐降低至对照组水平。给药1 h 后,10 μmol/L 藁本内酯显著增加Na-F 的Papp(P<0.05)。欧当归内酯A、4-羟基-3-丁基苯酞对Na-F 的Papp无影响。

图4 7 个单体成分作用不同时间下Na-F 的Papp (±s, n = 3)Fig.4 Papp of Na-F at different times of action of seven active components (±s , n = 3)
进一步比较给药后0.5 h 洋川芎内酯A、洋川芎内酯H、洋川芎内酯I、阿魏酸的Na-FPapp百分比(给药组与对照组Na-F 的Papp比值)探讨其促透作用的强弱[17],结果见表2,相同浓度下洋川芎内酯I 的Papp百分比最高,表明洋川芎内酯I 在bEnd.3单培养血脑屏障细胞模型中促透效应最强。
表2 不同浓度药物给药0.5 h 时的Papp 百分比 (±s, n = 3)Table 2 Papp percentage at 0.5 h of drug administration with different concentrations (±s , n = 3)
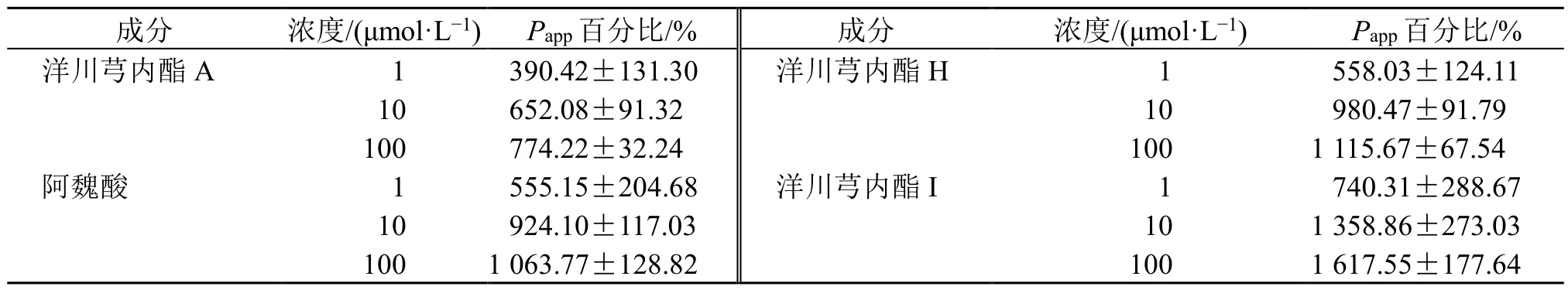
表2 不同浓度药物给药0.5 h 时的Papp 百分比 (±s, n = 3)Table 2 Papp percentage at 0.5 h of drug administration with different concentrations (±s , n = 3)
成分 浓度/(μmol·L−1) Papp 百分比/% 成分 浓度/(μmol·L−1) Papp 百分比/%洋川芎内酯A 1 390.42±131.30 洋川芎内酯H 1 558.03±124.11 10 652.08±91.32 10 980.47±91.79 100 774.22±32.24 100 1 115.67±67.54阿魏酸 1 555.15±204.68 洋川芎内酯I 1 740.31±288.67 10 924.10±117.03 10 1 358.86±273.03 100 1 063.77±128.82 100 1 617.55±177.64
3.2.3 洋川芎内酯I 对bEnd.3 细胞中Occludin、ZO-1、P-gp、p-ERM/ERM 蛋白表达的影响 如图5所示,与对照组比较,洋川芎内酯I(10 μmol/L)作用bEnd.3 细胞0.5 h 时Occludin 蛋白表达量显著降低(P<0.01),给药1、2 h 时表达量显著增加(P<0.05、0.01),给药4、8 h 时,表达量降低至对照组水平;给药0.5 h 时ZO-1 蛋白表达量降低,给药1、2、4 h 时表达量显著增加(P<0.05、0.01),给药8 h 时表达量降低至对照组水平;给药0.5 h 时p-ERM/ERM 蛋白表达量降低,给药1、2、4 h 时表达量显著增加(P<0.05、0.01),给药8 h 时表达量降低至对照组水平。P-gp 蛋白表达量呈先降低后升高趋势。
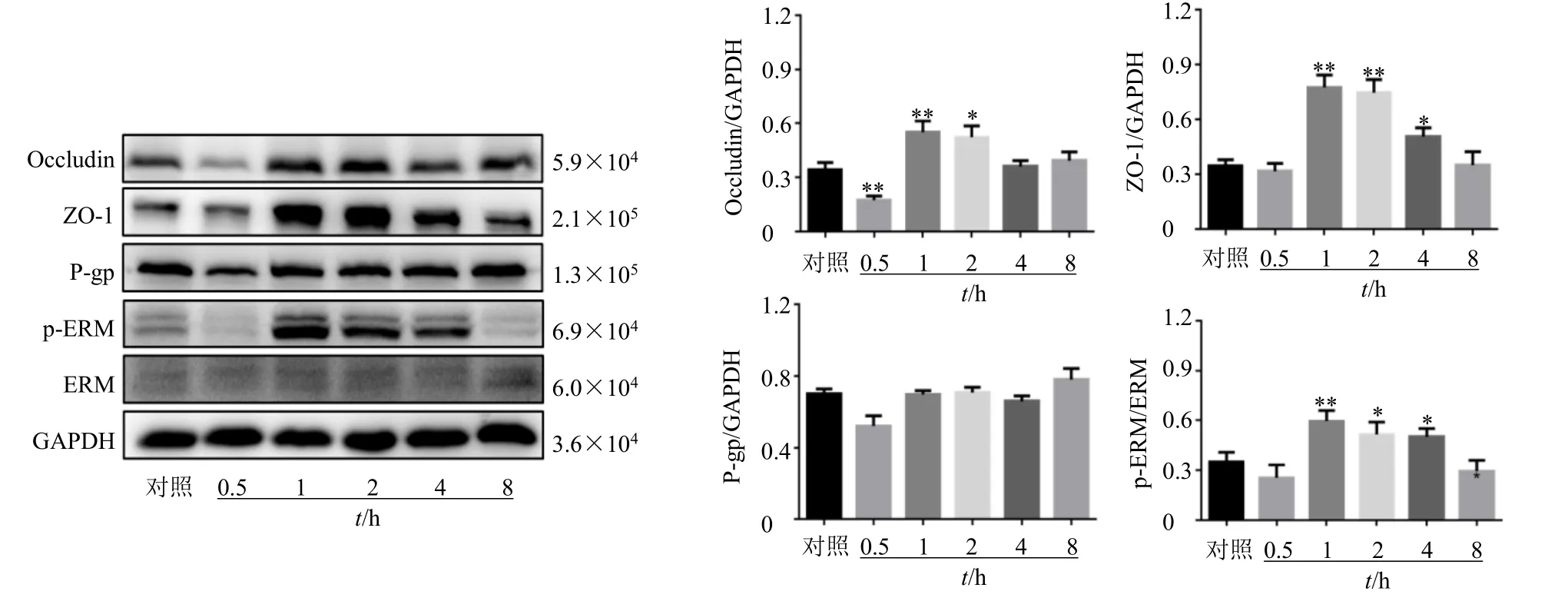
图5 洋川芎内酯I 对bEnd.3 细胞中P-gp、Occludin、ZO-1、p-ERM/ERM 蛋白表达的影响 (±s, n = 3)Fig.5 Effect of senkyunolide I on P-gp, Occludin, ZO-1 and p-ERM/ERM protein expressions in bEnd.3 cells (±s, n = 3)
4 讨论
本研究采用FITC-dextran、Na-F 作为示踪剂,研究川芎提取物及单体成分对血脑屏障通透性的影响,通过Western blotting 检测给药后脑组织或模型细胞中细胞间连接蛋白的表达变化,明确川芎对血脑屏障通透性的作用和机制。
FITC-dextran 是评估体内血脑屏障通透性常用的指示剂,具有分子惰性、检测灵敏度高、体内清除速度快等优势[21],同时具有利用自身不同相对分子质量评价多种物质(溶质、离子和蛋白质)在血脑屏障上通透性的优势[22]。生理状态下0.2%冰片可促进FITC-dextran(相对分子质量4×103)经角膜渗透,这说明了冰片作为眼部药物穿透促进剂的安全性[23]。3 种标志物肌酐、FITC-dextran(相对分子质量4×103)和罗丹明-dextran(相对分子质量7×104)根据不同相对分子质量可对应确定肠道屏障中孔隙途径、渗漏途径和不受分子大小限制的病理性途径的通透性变化,用以区分肠道疾病中屏障特性的丧失属于紧密连接通透性增加还是上皮损伤从而辅助确认病程[24]。本研究结果显示,小鼠给予川芎提取物0.5 h 后,可显著增加FITC-dextran(相对分子质量4×103)在脑组织中的外渗量,但对相对分子质量4×104、7×104、1.5×105的FITC-dextran 外渗量无影响,说明川芎提取物给药后小鼠血脑屏障通透性增加,但对途经血脑屏障的物质分子直径有所限制;给药8 h 后FITC-dextran(相对分子质量4×103)的外渗量降低至对照组水平,说明川芎提取物增加血脑屏障通透性的作用具有时效性,作用强度由强至弱。
体外血脑屏障细胞模型是快速筛选出具有良好血脑屏障渗透性的中枢神经系统疾病候选药物的有力工具。本研究结果显示,川芎中的洋川芎内酯I、A、H 及阿魏酸在给药时间内能显著增加Na-F 的Papp,表明其均具有促透作用。已有研究发现,洋川芎内酯I、A 在MDCK-MDR1 血脑屏障模型中具有促透性,能够增加水溶性物质松果菊苷的Papp[12],与本研究结果一致。洋川芎内酯H 和阿魏酸的促透性为本研究首次报道。洋川芎内酯H 与洋川芎内酯I 互为手性异构体,二者均易入脑,已有研究学者发现洋川芎内酯H 可用于防治脑卒中[25],本研究证明其在血脑屏障模型中具有促透性,但洋川芎内酯H作用强度不如洋川芎内酯I,分析原因可能是二者结构上的差别造成本身活性不同。阿魏酸及其衍生化产物可入脑[26-27],常用于中枢神经系统疾病的治疗[28]。值得注意的是,本研究中藁本内酯未显著改变Na-F 的Papp。然而有研究报道藁本内酯可下调Pgp 的表达,从而增加芍药苷在MDCK-MDR1 血脑屏障细胞模型中的转运[29]。本研究中使用的示踪剂非外排蛋白P-gp 底物[23],这可能是藁本内酯未显著改变Na-FPapp的原因。
血脑屏障对大脑微环境严格的保护作用限制了药物靶向到达脑组织中的病变部位。增大细胞旁通透性是亲水性药物更可能透过血脑屏障的途径[30]。细胞旁通透性由紧密连接蛋白、黏附连接蛋白及彼此间相互作用控制。Na-F 为水溶性小分子物质,主要通过细胞旁途径运输,常将其渗透情况作为评价体外模型旁路通透性的指标[31]。Na-F 在血脑屏障模型中的高透过率与模型的低TEER 值保持一致,表明其渗透情况与模型的紧密程度有关[32]。洋川芎内酯I 作用0.5 h 时,Na-F 的Papp最高,随给药时间延长,其有回到对照组水平的趋势,这与洋川芎内酯I 调节bEnd.3 细胞中紧密连接蛋白ZO-1、Occludin 及pERM/ERM 表达水平的结果基本一致。ZO-1 联结跨膜连接蛋白与肌动蛋白细胞骨架[33],ZO-1 失活将破坏紧密连接的实质结构[34]。Occludin与其他紧密连接蛋白的顺式相互作用增加紧密连接的复杂性,从而增强血脑屏障的屏障完整性[35]。各紧密连接蛋白与肌动蛋白或细胞骨架之间相互作用的改变会导致血脑屏障通透性增加[36],如ERM 蛋白是维持细胞间蛋白质膜定位所必需的锚定蛋白[37],研究报道银杏内酯可通过影响p-ERM/ERM 的表达水平增加Na-F 在HCMEC/D3 和HEB 共培养血脑屏障细胞模型中的透过量[32]。
冰片是应用广泛的紧密连接调节剂。研究表明,大鼠给药冰片0.5 h 时,大鼠血-视网膜屏障中内皮细胞的Claudin-5 和Occludin 发生细胞膜-细胞质向易位,1 h 时胞质中Claudin-5 和Occludin 表达量达到峰值,4 h 时表达量开始下降,8 h 时恢复至对照组水平[38]。本研究表明,川芎提取物给药0.5 h 时Occludin、ZO-1 表达量降低,P-gp 表达量增高;给药2 h 时Occludin、ZO-1 表达量达到峰值,Occludin、ZO-1 表达量达到谷值;给药8 h 时三者恢复至对照组水平。洋川芎内酯I 给药0.5 h 后,bEnd.3 细胞中Occludin、ZO-1、p-ERM/ERM 蛋白表达量降低;给药1 h 后均显著高于对照组水平;给药8 h 后恢复至对照组水平,因此推测川芎具有与冰片类似的可逆性调节血脑屏障通透性的性质,其影响血脑屏障通透性的机制可能与可逆性调节Occludin、ZO-1、P-gp 及p-ERM/ERM 蛋白表达水平有关。
综上,川芎在一定程度上可增加血脑屏障通透性,且该作用具有时效性,是紧密连接调节剂的潜在开发对象,洋川芎内酯I 是良好的候选成分。
利益冲突所有作者均声明不存在利益冲突

