烟草脆裂病毒介导的人参基因沉默体系的构建
李冉琪,李雅淑,汤淼淼,曲正义,郑培和,侯 微*
1.中国农业科学院特产研究所,吉林 长春 130112
2.吉林农业科技学院,吉林 吉林 132109
基因沉默现象是一种由双链 RNA(double-stranded RNA,dsRNA)引起的基因表达受到抑制的现象,是一种基于序列同源性的过程[1]。在真核生物中,基因沉默又称为RNA 干扰(RNA interference,RNAi)。这一现象首次发现于1990 年,Carolyn Napoli 等将花椰菜花叶病毒的35S 启动子与查耳酮合成酶(chalcone synthase,CHS)基因的编码序列融合,将重组的CHS基因通过农杆菌导入矮牵牛中,期望加深矮牵牛花的紫色,但结果却与预期完全相反:转入的基因未表达,且内源CHS的表达水平也发生了下降,笔者将这种现象称为“可逆共抑制”(reversible co-suppression)[2]。对基因沉默现象机制的认识来源于1998年Fire等[3]的线虫实验,实验结果表明外源双链RNA(double-stranded RNA,dsRNA)是基因沉默现象的高效诱发因子。Mansoor 等[4]总结了植物体内3 种不同的RNAi 机制:(1)转录后水平基因沉默(post-transcriptional gene silencing,PTGS),指dsRNA 在细胞质中引起mRNA 的切割降解;(2)microRNAs(MiRNAs)与特定mRNAs 的碱基配对负调控基因的表达,导致内源mRNA 降解或蛋白质翻译停止;(3)转录水平基因沉默(transcriptional gene silencing,TGS),是由于DNA 的序列特异性甲基化导致的基因沉默。基因沉默的过程通常分为3 个步骤:(1)小RNA(small RNA,RNA)的形成。sRNA 由RNase III家族的Dicer 酶通过切割dsRNA 形成,长度一般为19~25 个核苷酸,序列与目标mRNA 互补[5],包括小干扰RNA(small interference RNA,siRNA)、微小RNA(microRNA,miRNA)和Piwi 相互作用RNA(Piwi-interacting RNA,piRNA)[6]。(2)sRNA与RNA 诱导沉默复合体(RNA-induced silencing complex,RISC)结合,RISC 获得剪切活性。部分sRNA 还可以在 RNA 依赖的 RNA 聚合酶(RNA-dependent RNA polymerase,RdRp)的作用下继续合成dsRNA 以放大沉默效果[7]。(3)具有活性的RISC 与目标mRNA 结合,降解目标RNA或抑制其翻译。RISC 不仅可以介导PTGS,还可以介导TGS[8]。利用这一原理,近年来,病毒诱导的基因沉默(virus-induced gene silencing,VIGS)技术在研究植物功能基因方面得到了越来越广泛的应用。VIGS 技术是是一种功能基因组学工具,将目的基因的cDNA 片段通过病毒载体导入植株,引起同源基因mRNA 的降解或基因本身的甲基化修饰,目的基因被沉默进而造成植株产生表型变化,从而达到验证基因功能的目的[9]。八氢番茄红素脱氢酶(phytoene desaturase,PDS)是类胡萝卜素合成途径中的关键酶,该基因被沉默后叶片因失去类胡萝卜素的光保护作用而通常表现出光漂白现象,表型明显,易于观察。因此在多种植物基因沉默体系的构建中,PDS基因常作为沉默靶基因被选用,如拟南芥[10]、小麦[11]、辣椒[12]、高粱[13]等。在病毒载体的选择上,烟草脆裂病毒(tobacco rattle virus,TRV)应用最为广泛,相对于其他病毒载体,其具有沉默效果持续时间长、效率高、症状轻等优点。通常使用农杆菌侵染法将病毒载体导入植物体内。
人参PanaxginsengC.A.Meyer 是五加科人参属多年生草本植物,是一种名贵中药。作为一种根类药用植物,人们对其的关注点大多在人参中的活性成分人参皂苷上,因而通过基因沉默手段研究的多是人参皂苷合成途径中的基因,如达玛烷合成酶(dammarenediol synthase,DDS)基因[14]、角鲨烯环氧酶(squalene epoxidase,SQE)基因[15-16]、β-香树脂醇合酶(β-amyrin synthase,β-AS)基因[17-18]等,实验对象也均为发根农杆菌产生的毛状根。同时,发根农杆菌介导的遗传转化体系也为工业生产人参皂苷提供了新途径[19-21]。但由于目前基于组织培养的人参再生体系尚不成熟[22],在毛状根中建立的基因沉默体系并不能满足对所有基因功能的研究。因此本实验旨在尝试构建人参植株中的基因沉默体系,利用根癌农杆菌转化沉默载体实现侵染,为今后人参中基因功能的验证提供新的方法。
1 材料
1.1 植物材料、菌株与质粒
实验使用4 年生人参种植于中国农业科学院特产研究所温室,大肠杆菌DH5α 购于北京全式金生物技术(TransGen Biotech)有限公司,农杆菌LBA4404 购于北京华越洋生物科技有限公司,病毒侵染载体pTRV1 和pTRV2 购于武汉淼灵生物科技有限公司。
1.2 试剂
EcoRI 限制性内切酶(上海碧云天生物技术有限公司),BamHI 限制性内切酶(上海碧云天生物技术有限公司),TransZolUp Plus RNA Kit(北京全式金生物技术有限公司),pEASY®-T1 Simple Cloning Kit(北京全式金生物技术有限公司),TIANprep Mini Plasmid Kit(北京天根生化科技有限公司),TIANgel Midi Purification Kit(北京天根生化科技有限公司),PerfectStart®Uni RT&qPCR Kit(北京全式金生物技术有限公司)。
2 方法
2.1 人参PDS 基因核心片段的克隆
根据课题组前期转录组数据结果,使用拟南芥AtPDS3基因的cDNA 序列作为参考进行序列对比,选择相似度高的序列作为候选基因。对基因序列进行分析,使用NCBI 的Batch CD-search 工具预测保守结构域,作为核心片段的选取依据。使用Oligo 7 Primer Analysis Software 设计引物用于克隆PgPDS核心片段,引物位于人参PDS 家族基因的共有保守序列部分。上、下游引物分别添加EcoRI 和BamHI 酶切接头序列(表1)。以人参cDNA 为模板进行扩增,切胶回收后进行测序,确认为目的基因片段。

表1 所用到的引物Table 1 Primers used in this study
2.2 pTRV2-pgPDS 侵染载体的构建
使用测序正确的回收片段进行TA 克隆,将TA克隆质粒、pTRV2 空载质粒使用EcoRI 与BamHI分别进行双酶切,切胶回收PgPDS核心片段与线性化的pTRV2 载体,使用T4 DNA 连接酶进行连接;产物测序显示连接正确,热激法转化大肠杆菌DH5α,在含有50 mg/L 卡那霉素的平板上涂板筛选,挑取菌落扩大培养。使用质粒小提试剂盒提取重组质粒pTRV2-PgPDS,根据说明书,将pTRV1、pTRV2 以及重组质粒pTRV2-PgPDS分别转化农杆菌LBA4404,在含有50 mg/L 卡那霉素(Kan)和20 mg/L 的利福平(Rif)的平板上筛选阳性菌落,挑取阳性菌落于含有50 mg/L Kan 和20 mg/L Rif 的LB 液体培养基中,活化培养一段时间后使用对应引物(表1)进行菌液PCR 鉴定。
2.3 沉默体系的建立
分别取1 mL 转化成功的农杆菌菌液加到15 mL 的LB 液体培养基(同样含50 mg/L Kan 与20 mg/L Rif)中扩大培养,摇床设置28 ℃、200 r/min条件。待农杆菌摇菌至A600=0.6 左右时,5 000 r/min离心收集菌体,使用等体积侵染液(含10 mmol/L MgCl2、10 mmol/L MES 和200 µmol/L 乙酰丁香酮)轻轻重悬菌体,使菌液A600仍为0.6 左右,暗处培养4~6 h。后将等体积的pTRV1 农杆菌重悬液与pTRV2 农杆菌重悬液混合作为阴性对照,等体积的pTRV1 农杆菌重悬液与pTRV2-PgPDS农杆菌重悬液混合作为实验组,另设空白对照不做处理。采用菌液注射法,在叶片背面使用无菌注射器针头制造伤口,但不刺透叶片,之后取下针头,用注射器吸取1 mL 重悬菌液,压紧伤口将菌液注射进叶片直至伤口周围区域呈现水渍状,每组设3 个重复,侵染后的植株置于黑暗中24 h,之后于22 ℃、光周期为光照/黑暗12 h∶12 h 的温室培养。
2.4 qPCR 计算人参PgPDS 相对表达量
每株于处理前、处理后第3 周以及处理后第5周采集叶片,提取总RNA,以反转录后的cDNA为模板,使用引物qPDS-F 和qPDS-R(表1),通过 qPCR 检测内源 PDS 基因的表达量,选择PgGAPDH作为内参基因[23],每个样品进行3 个技术重复。为避免个体差异带来的影响,本实验中未采用其他物种研究中以空白组为基准计算阴性组与实验组相对表达量的方法,而是将单株接种前后的表达量进行对比。具体操作如下:选取人参掌状复叶上处于对称位置的2 片大叶片(图1),接种前采集a1,后注射接种a2,一段时间后采集a2,计算表达量时以 a1为参比计算 a2的相对表达量。按照上述流程在每株上选取2 个掌状复叶进行操作,分别用于第3 周和第5 周的样品采集以及表达量的计算。使用DPS 数据处理系统对结果进行处理,采用完全随机设计单因素方差分析中的Duncan 新复极差法进行差异显著性分析,使用Microsoft Excel 2019 进行图表绘制。

图1 人参掌状复叶Fig.1 Palmate compound leaf of Panax ginseng
3 结果与分析
3.1 PgPDS 基因核心片段的克隆
根据序列比对,筛选出2 条符合要求的序列,分别命名为PgPDS1 与PgPDS2。PgPDS1 基因cDNA序列全长1 746 bp,编码581 个氨基酸(图2-A);PgPDS2 基因cDNA 序列全长1 299 bp,编码432 个氨基酸(图2-B)。使用NCBI 中的Batch CD-search工具对2 条序列进行保守结构域预测(图3),结果显示PgPDS1 与PgPDS2 蛋白均具有典型的PDS 蛋白结构域,表示二者都属于PDS超基因家族。使用植物总RNA 提取试剂盒提取人参叶片RNA,使用1%琼脂糖凝胶电泳检测RNA 质量。使用反转录试剂盒合成cDNA,以其为模板,使用引物PgPDS-F 与PgPDS-R(表1)扩增PgPDS家族基因共有核心片段,克隆出的核心片段理论长度为391 bp(图4),片段大小符合预期。使用胶回收试剂盒回收目的基因片段用于后续载体构建。

图2 PgPDS1 (A) 与PgPDS2 (B) 蛋白序列Fig.2 PgPDS1 (A) and PgPDS2 (B) protein sequences
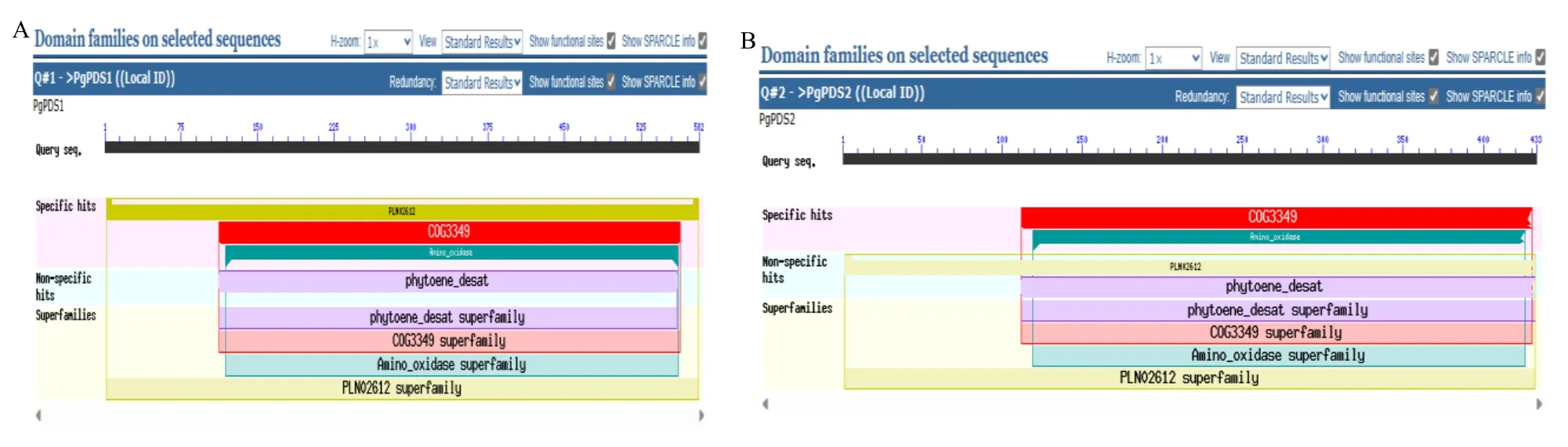
图3 PgPDS1 (A) 与PgPDS2 (B) 的蛋白保守结构域Fig.3 Protein conserved domains of PgPDS1 (A) and PgPDS2 (B)

图4 PgPDS 基因核心片段扩增Fig.4 Amplification of the PgPDS gene core fragment
3.2 pTRV2-PgPDS 侵染载体的构建
使用双酶切法将PgPDS基因片段整合至pTRV2 载体中(图5),将重组质粒转入DH5α,扩大培养后提取质粒,将3 种质粒分别转化农杆菌,使用对应引物(表1)进行菌液PCR,3 种菌液(转pTRV1、pTRV2 和pTRV2-PgPDS)扩增出的PCR产物理论长度分别为572、176、537 bp(图6),说明转化成功。
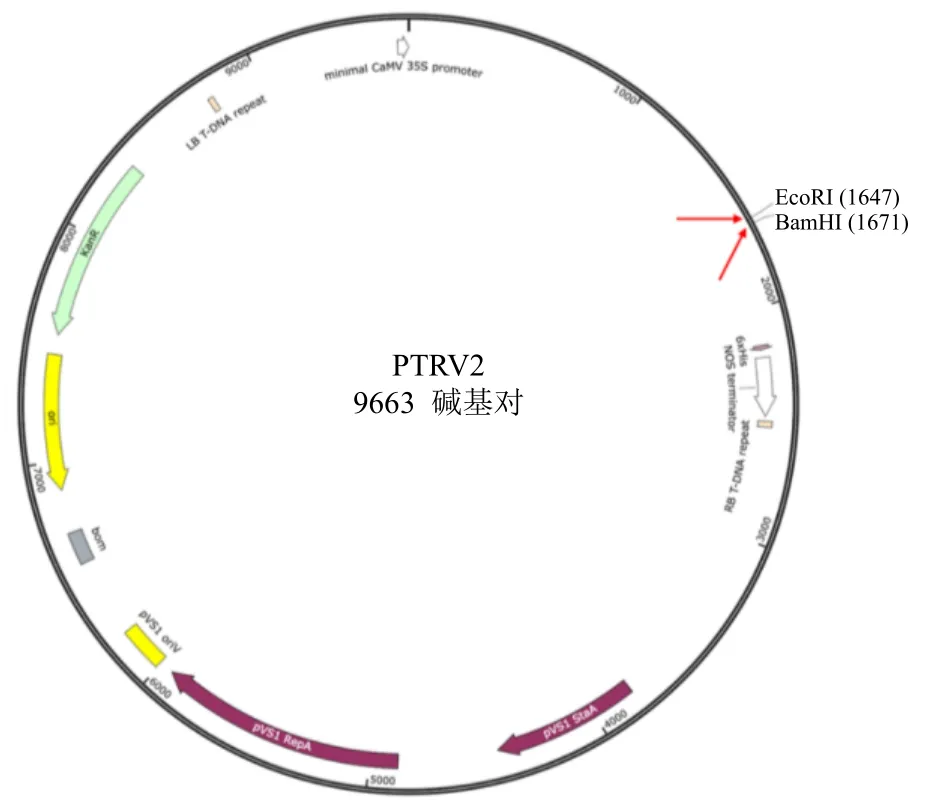
图5 pTRV2 质粒图谱及PgPDS 片段插入位置Fig.5 pTRV2 plasmid map and insertion location of PgPDS fragment

图6 转3 种质粒的菌液阳性克隆检测Fig.6 Positive clone detection of bacteria liquid with 3 kinds of plasmids
3.3 pTRV2-PgPDS 侵染人参叶片的表型观察与表达量分析
选择完全展开的人参叶片,使用含有pTRV2空载与pTRV2-PgPDS重组载体的农杆菌侵染液注射侵染。在接种后3 周观察表型,3 组均未出现叶片白化现象(图7);继续观察至第5 周时,空白对照组与阴性对照组叶片无变化,实验组人参植株部分叶片中间出现褪绿斑点,叶尖、叶缘出现黄化、枯萎等现象(图8)。

图7 第3 周叶片表型Fig.7 Leaf phenotype at week 3

图8 第5 周叶片表型Fig.8 Leaf phenotype at week 5
采集接种前、接种后3 周、接种后5 周的叶片,提取RNA,通过qPCR 方法计算内源PgPDS基因表达水平。从结果(图9)可以看出,空白对照组与阴性对照组3 个时期PgPDS基因表达量变化不大,而实验组则呈明显下降趋势,3 周时PgPDS的基因的表达量是接种前的70.37%,5 周时则降至37.35%,说明在人参植株内成功实现了侵染,且基因沉默载体成功发挥作用。表明了人参中农杆菌介导的基因沉默体系构建成功。

图9 不同组PgPDS 基因的相对表达量Fig.9 Relative expression of PgPDS in different groups
4 讨论
本研究通过序列对比的方式得到了2 条人参PgPDS基因,克隆家族核心保守片段后构建病毒侵染载体,注射转化人参叶片,抑制了人参内源PgPDS基因的表达,表明体系构建成功。在病毒侵染后植株表型变化方面,多数物种会表现出白化现象,且需要的时间与白化程度各不相同:如高粱叶片出现白化需要28 d[13];拟南芥经历21 d,发生白化现象的部位有叶片、茎、花蕾[24];本氏烟Nicotiana benthamiana与柑橘属CitrusL.作物在接种后也均会发生不同程度的白化现象[25]。而有些植物在PDS基因被沉默后叶片并无表型变化,如茶花Camelliasp.在接种后4 周叶片未表现出白化表型,但qPCR 结果显示内源CjPDS基因得到了有效沉默[26]。在本实验中,实验组叶片在接种后5 周叶片上出现褪绿斑点,叶尖、叶缘出现了黄化与枯萎现象,而空白对照组与阴性对照组均未出现。查阅资料发现在其余物种中没有枯萎现象出现,初步判断是由于叶片局部失去光保护作用后,植株处于持续光照下引起的。对实验组进行后续的生长观察,叶片枯萎面积占比并未继续增大,且植株未见其他异常,生长状态良好,这可能与沉默效果持续时间有限以及病毒在植物体内的不均匀分布有关[27]。但此现象出现的具体原因需今后进一步研究才能确定。
本实验构建的沉默体系对内源PgPDS基因的抑制率为62.65%,相较于文中提到的其他物种来讲并不高。沉默效率与多种因素有关,首要因素就是插入片段与目的基因的同源性,沉默效率与二者的同源性呈正相关[28]。其次是片段的长度以及插入方向,实验表明以靶基因反向互补序列的形式构建载体会提高沉默效率[29]。再者是病毒载体的选择,不同的病毒对宿主亲和力不同,且工作的适宜温度不同。另外,接种方法对侵染效率有着一定的影响。人参叶片薄,在注射接种过程中发现能够进入叶片的菌液量有限,这可能是影响沉默效率的一个重要因素,除注射接种法外,现有的侵染方法还有真空渗透法[30]、根部浸润法[31]以及萌芽真空浸润法(sprout vacuum-infiltration,SVI)[32]等。李文辰等[33]研究了不同接种方法对大豆不同组织基因沉默效率的影响,结果显示注射方法对叶片沉默效率最高,注射加灌根结合方法对根部沉默效率最高。今后可以验证上述方法在人参基因沉默相关研究中的可行性,且可以根据不同的实验目的选择不同的接种方法。总之,在后续的研究中若想提高沉默效率,则可以从以上几个方面入手。
VIGS 技术作为一种反向遗传学技术,具有操作简便,成本低,见效快等优点。在研究中无需进行突变体筛选,且对人参这种尚无成熟组培体系的物种十分友好,今后可以应用于人参抗病、抗逆基因以及生长发育相关基因的鉴定。最新研究发现,TGS 与PTGS 均存在可遗传现象[34-36],因此VIGS技术还有望应用于人参育种中。随着人们对VIGS技术机制的研究加深,可以逐渐解决其存在的一些弊端和不足,如基因沉默不完全、沉默效率及表型不稳定、易受病毒侵染症状影响等[37],将其更好地应用于人参功能基因组学研究中。
利益冲突所有作者均声明不存在利益冲突

