苯磺酸氨氯地平片体外溶出度一致性评价及体内生物等效性研究
池王胄 胡旭华
(上海天慈国际药业有限公司 上海 201315)
苯磺酸氨氯地平片属于外周动脉血管扩张剂,适用于高血压患者(单独用药或与其他抗高血压药物合用)和慢性稳定性心绞痛及变异型心绞痛患者(单独用药或与其他抗心绞痛药物合用),机理是作用在血管平滑肌来降低外周血管阻力和血压[1-2]。根据2016年《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》、2015年《国务院关于改革药品医疗器械审评审批制度的意见》的文件规定,为有利于提升药品质量,促进仿制药与原研药的相互替代,对已上市品种苯磺酸氨氯地平片进行质量一致性评价。现行生产的苯磺酸氨氯地平片采用湿法制粒压片工艺制备,操作繁琐,且活性成分苯磺酸氨氯地平对湿热敏感[3],采用粉末直压工艺减少原料药因湿度而降解,同时也简化了工艺流程,提高生产效率和产品质量。本研究以Pfizer Labs生产的苯磺酸氨氯地平片(Norvasc)为参比制剂,进行体内外的质量和疗效一致性评价,其中体外评价指标是溶出曲线相似性f2或累积溶出度,体内评价指标通过生物等效性(BE)[4]评价,以此为临床用药提供参考。
1 材料与方法
1.1 试剂和仪器
苯磺酸氨氯地平片受试制剂(规格5 mg,批号170815511、170818511、170821511,辰欣药业股份有限公司);苯磺酸氨氯地平片参比制剂(规格5 mg,批号R93379,Pfizer Labs)。
1260 VWD高效液相色谱仪(美国Agilent公司);API 4000串联质谱仪(美国AB Sciex公司);RC8MD溶出仪(天津市天大天发科技有限公司);MS105DU电子天平(美国梅特勒托利多公司);MIKRO22R冷冻高速离心机(德国Hettich公司)。
1.2 体外溶出度方法的建立
1.2.1 方法的选择
苯磺酸氨氯地平片溶出度方法在中国药典[5]、美国药典[6]、日本橙皮书[7]均有收载,都采用了桨法,故本品溶出曲线测定选用桨法操作。
1.2.2 溶出介质体积的选择
参照日本生物等效性溶出方法,选用900 mL作为介质体积进行溶出曲线测定。
1.2.3 转速的选择
已收录的溶出度标准转速为75 r/min[8],本研究采用50 r/min[9],相较于75 r/min条件更为苛刻。
1.2.4 取样时间的选择
如果您有遗尿的宝宝,首先应调整的是自己的心态。有些妈妈会过度保护宝宝,即使就医,也是偷偷告诉医生“我家孩子尿床”;也有些妈妈总是当着外人的面责骂自家孩子尿床。
根据指导原则,按照表1设定的取样时间进行取样、测定。
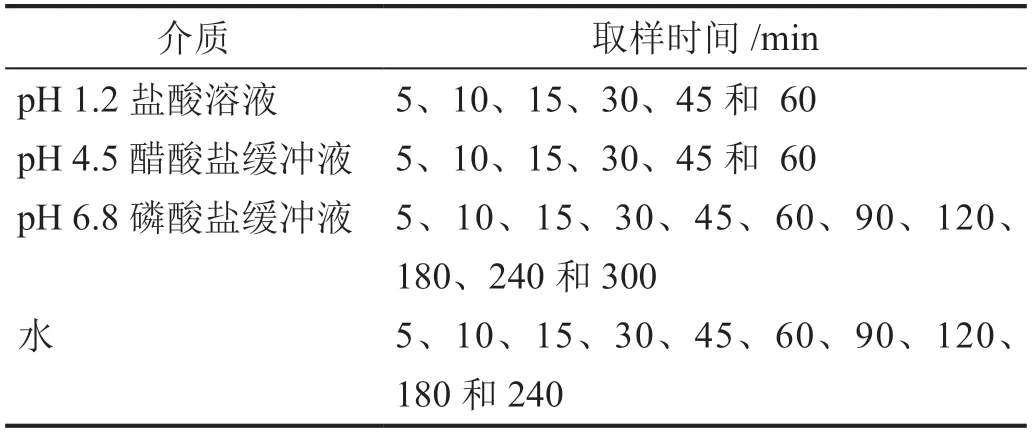
表1 各溶出介质取样时间
1.3 体内生物等效性研究
1.3.1 临床研究方法
本体内生物等效性研究是委托上海市徐汇区中心医院进行,试验过程严格按照GCP及相关规定进行。研究采取单中心、开放、随机、单次口服给药、两制剂、两周期交叉、空腹/餐后条件下的生物等效性试验。受试者在每周期给药前0 h至给药后72 h间共15个时间点采血,每次采集静脉血3 mL,置于有相应标记的肝素化试管中,分离血浆,用于测定氨氯地平片的血药浓度以评估其生物等效性。
1.3.2 血样测定方法
1)液质联用色谱条件 采用高效液相色谱-串联质谱进行分析,Acquity UPLC®HSS T3(2.1 mm×50 mm,1.8 μm)色谱柱;流动相A为含0.1%甲酸的水溶液,流动相B为0.1%甲酸乙腈溶液;柱温40 ℃;流速0.6 mL/min;选用电喷雾离子源,在正离子模式下,采用多反应监测(MRM)的质谱扫描方式。
2)血样处理 取血浆加入适量内标工作液、标准添加工作液/含40%乙腈水溶液,混旋10 s,加甲基叔丁基醚1 mL振荡后,于1 500 r/min、4 ℃离心10 min,吸取全部上清液吹干,加入50%甲醇的水溶液,振荡后进样分析。
1.3.3 统计学处理
药动学参数及统计分析均采用SAS 9.4 软件,采用非房室模型药动学参数的计算药代动力学参数, 其中Cmax、AUC0~72h为主要参数、Tmax、t1/2、λz为次要参数。本试验为等效性试验,将药动学主要评价参数对数转换后进行方差分析(ANOVA),计算几何均值比(GMR)、90% CI。
2 结果
2.1 体外溶出曲线测定方法的方法学验证
结果显示,空白溶剂、空白辅料、苯磺酸不干扰氨氯地平含量测定;系统适用性溶液中,杂质D与主峰分离度均>4.5,说明系统适用性良好(图1)。
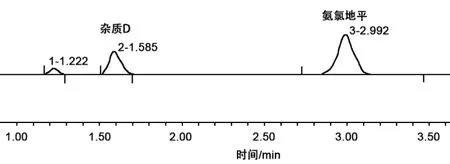
图1 体外溶出测试典型色谱图
2.1.2 滤膜吸附
结果显示,使用孔径为0.45 μm的水系微孔滤膜时,弃去滤液2~4 mL时回收率在98.0%~102.0%,可直接取滤液测定。
2.1.3 线性和范围
线性验证范围至少为供试品溶液浓度的10%、20%、50%、80%、100%、120%,即每1 mL约含氨氯地平0.5~6 µg。回归分析结果表明,氨氯地平在各溶出介质中浓度在10%~120%范围内线性关系良好,线性方程分别为:pH 1.2介质中Y=12.65X-0.035 7(r=0.999);pH 4.5介质中Y=13.046X-0.203 2(r=0.999);pH 6.8介质中Y=12.649X+0.322 7(r=0.999);水介质中Y=12.756X-0.400 1(r=0.999)。
2.1.4 供试品溶液稳定性
结果显示,苯磺酸氨氯地平片在不同介质中室温放置4 h内稳定。
2.1.5 准确度试验
结果显示,苯磺酸氨氯地平片在不同介质中回收率良好,平均回收率(n=9)在98.9%~100.1%范围内,RSD<2.0%。
2.2 体外溶出曲线的相似性
对3批受试制剂与一批参比制剂采用非模型依赖法中的相似因子(f2)法进行了加速稳定性溶出曲线相似性的比较,通常,当两条溶出曲线f2数值不小于50或15 min累积溶出度大于85%时,可认为溶出曲线相似。结果显示,苯磺酸氨氯地平片在pH 4.5、pH 6.8和水介质中溶出相似因子f2分别为60、80、54;在pH 1.2介质中15 min累积溶出度均大于85%,表明其在四种介质中的溶出行为均相似(图2)。
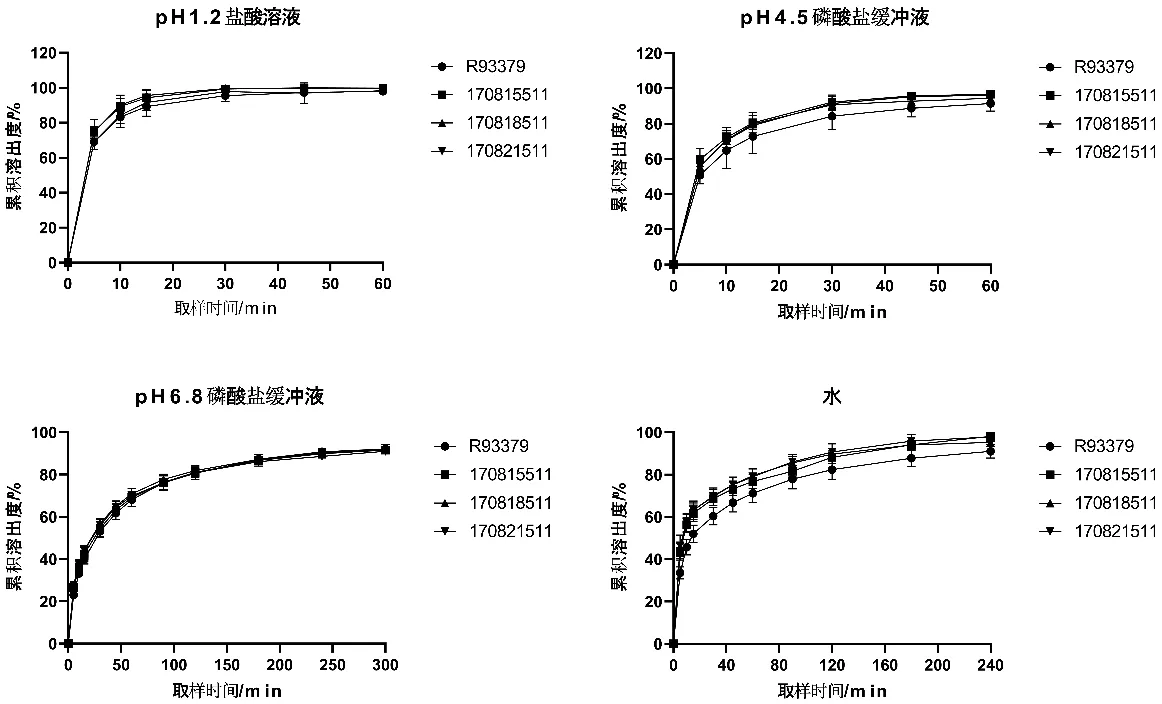
图2 苯磺酸氨氯地平片在不同介质中的体外溶出曲线(n=12)
2.3 体内生物等效性研究
2.3.1 血样方法学验证结果
最低定量下限质控、低、中、高浓度质控样品的批间准确度偏差在−7.474%~3.099%之间;低、中、高浓度质控样品提取回收率均为76.30%、精密度范围为4.037%~4.533% CV(变异系数)、准确度偏差范围为3.442%~5.406%。
2.3.2 生物等效性结果
空腹、餐后试验受试制剂与参比制剂Cmax的GMR分别为100.72%、97.21%;受试制剂与参比制剂AUC0~72h的GMR为100.38%、100.24%;90% CI均在92%~104%内;均在NMPA《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》以及本次试验方案规定的生物等效范围之内。统计结果显示,两个给药序列之间、两周期之间,两制剂之间差异均无统计学意义(表2,P>0.05)。

表2 空腹/餐后主要药动学参数几何均值比值评价结果
3 讨论
本品原工艺为湿法制粒法,改变后生产工艺为粉末直压法,该工艺是结合改变后的处方及对参比制剂进行分析及试验后确定。采用高效液相法经过系统的方法学验证,苯磺酸氨氯地平片受试制剂与参比制剂在各溶出介质中的溶出曲线相似性均较好,表明体外溶出基本一致;在临床60个受试者参加的生物等效性研究结果也表明受试制剂与参比制剂没有统计学差异,说明受试制剂产品质量与参比制剂具有一致性,且粉末直压法工艺简单,降低了生产成本,提高了生产效率。
致谢:非常感谢上海市徐汇区中心医院在苯磺酸氨氯地平片体内生物等效性研究临床试验中所做的工作。

