蚕丝基小口径人工血管研究进展
曾 姚, 吕金凤, 王介平, 刘 彬, 周 婵
(1.重庆市畜牧科学院 蚕业研究所,重庆 402460; 2.西南大学 生命科学学院,重庆 400715)
心血管疾病(Cardiovascular Disease,CVD)是一类由心脏和血管异常引起的疾病,包括心肌梗塞、心力衰竭、心律异常、主动脉瘤、外周动脉疾病、血管栓塞性疾病和静脉血栓等[1],它具有高患病率、高致残率和高死亡率的特点,约占全世界死亡人数的1/3[2]。引发该类疾病的因素包括过度饮酒、吸烟、肥胖、高胆固醇及高血糖等[3-5],这表明衰老并不是心血管疾病的唯一诱因[6]。并且统计结果显示,预计2030年全球心血管病死亡人数将上升至2 340万人[7]。因此,寻找合适的预防和治疗手段来应对心血管疾病迫在眉睫。
心血管疾病治疗方式广泛,当血管堵塞程度较轻时,药物治疗和保持良好生活方式是最佳的治疗方案。他汀类药物的降脂疗效常被用于心血管疾病的防治[8]。支架植入是将球囊导管扩张或金属支架置入冠状动脉病变处,以膨胀的方式支撑血管壁,从而使狭窄、闭塞的血管扩张保持血流通畅,它是处理急性血管闭塞最有效的手段[9]。旁路移植是取自体动静脉或人工血管移植物,绕过动脉闭塞部位,连接阻塞部位的上下端,从而直接建立一条新的血流通路的方法,目前包括大隐静脉、乳内动脉和桡动脉等在内的动静脉移植物仍然是血管重建的“金标准”[10]。但是,自体移植会对患者造成二次伤害,并且血管的来源有限,因此人工血管移植治疗是目前心血管疾病最有希望的疗法。
研究表明,涤纶[11]、聚四氟乙烯[12]和聚氨酯[13]等材料被广泛应用于大口径血管(内径≥6 mm)移植手术,但是它们在小口径人工血管(内径<6 mm)的应用上存在较大的局限。如小口径的涤纶管状织物会与血液形成纤维—血栓复合体从而引发血管阻塞,最终导致机体死亡[14],使用组织纤溶酶原选择性经导管溶栓启动激活剂([tPA]阿替普酶)对血栓溶解后进行移植[15],可大幅度提高血管通畅率。聚四氟乙烯制备的狗静脉移植物在植入动物体内后,狗的存活率只有36%,死亡原因主要是血管栓塞[16]。聚氨酯移植物用于Sprague-Dawley(SD)大鼠的肾下主动脉移植手术,在植入后存在易形成血栓、长期顺应性不强等问题[17]。涤纶、聚四氟乙烯和聚氨酯等材料用于小口径血管移植,如何保持其长期通畅性一直是外科手术的难题。同时,这些材料制备的血管难以在体内促进血管内皮化,从而导致移植效果不佳。近年来的研究结果显示,桑蚕丝具有良好的生物相容性、机械性能、可降解性和促进细胞黏附等特性而被广泛应用于生物医学工程领域[18-19],并且它在小口径血管移植手术方面也显示出独特的修复作用[20]。基于此,本文综述了蚕丝基人工小口径血管的应用现状及其性能优势,同时也讨论了存在的问题和未来发展,以期为改进小口径血管研究及转化提供参考。
1 蚕丝性能及生物医学应用
蚕丝是一种天然蛋白质纤维,由家蚕五龄幼虫分泌,包含丝胶蛋白和丝素蛋白。丝蛋白具有重复性一级结构,包括无规卷曲、α-螺旋、β-转角和β-折叠等在内的二级结构和晶体网格结构,这些多级结构是影响力学性能的关键[21]。蚕丝具有吸湿性被用于伤口缝合[22],同时它还具有良好的生物相容性、可调控的降解性和优秀的机械性能而被广泛用于骨、软骨、韧带、肌腱和骨骼肌等运动系统中[23]。研究结果表明,家蚕丝纤维具有良好的机械性能(拉伸强度4.3~5.2 g/den,拉伸模量84~121 g/den,断裂应变10%~23.4%)[24]常被用作组织工程材料。因此,蚕丝是一种极具潜力的生物医用材料。
2 蚕丝基小口径人工血管的应用与优势
蚕丝是一种来源丰富、性质优良的天然蛋白质纤维,它被广泛用于制备生物医用材料,人工血管是其中之一。以蚕丝为原料制备人工血管,具有制备方式多样、生物相容性良好、抗血栓形成和促进血管内皮化等优势。
2.1 制备方式多样
人工血管的制备需具备快捷、方便、批量生产、合理的制造成本,以及制备出的血管要接近天然血管性能等特点[25]。具备一定降解率的蚕丝基组织工程材料能够为细胞生长和组织形成提供良好的环境[26]。研究表明,蚕丝具有可控的降解性,通过控制溶解、水解条件等方法来改变制备的组织工程移植体的降解速率,其降解产物可以促进内皮细胞增殖[27]。因此,可使用蚕丝通过凝胶纺丝、编织和浸渍、双拉舍尔针织、静电纺丝、冷冻干燥和塑模及3D打印等方式制备小口径人工血管,如表1所示。利用蚕丝或蚕茧制备血管移植体时,首先需要将其进行脱胶和溶解,该过程通常使用0.02~0.05 M的碳酸钠和9.3 M的溴化锂来实现。
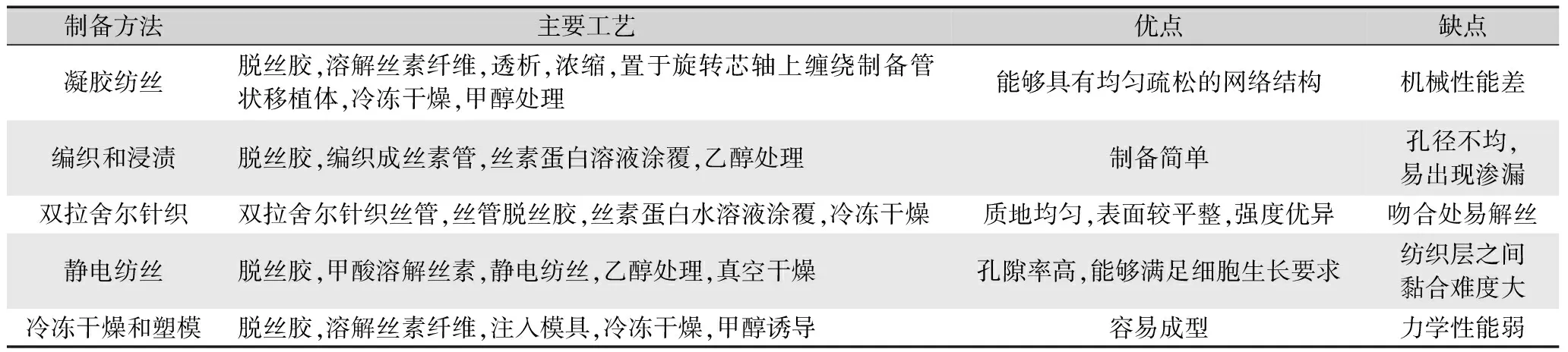
表1 蚕丝基血管移植体的制备方法Tab.1 Preparation method of vascular graft based on silk
凝胶纺丝程序是利用0.02 M碳酸钠溶液对蚕茧进行脱丝胶处理得到丝素纤维,将丝素溶于9.3 M溴化锂,再经过透析、浓缩得到25%~35%的丝素水溶液,所得溶液通过27或30号针排出并缠绕在旋转的芯轴上得到管状物,该管状物需进行冷冻干燥和甲醇处理后用于移植[28]。编织和浸渍获得的血管移植物通常也需要碳酸钠或马赛皂进行脱丝胶处理,随后在编织机上借助聚氯乙烯棒编织丝素纤维以形成管状物,同时将丝素管浸入丝素蛋白水溶液,最后浸入50%乙醇使涂覆的丝素蛋白不溶[29]。以生丝为原料,使用双拉舍尔针织机制备蚕丝管后经过脱丝胶处理,然后用含有聚乙二醇二缩水甘油醚的丝素蛋白水溶液涂覆丝管,冷冻干燥得到血管移植体[30]。生丝脱丝胶得到丝素纤维,将其溶解、透析和浇铸获得丝素膜,再将丝素膜溶于甲酸混匀获得纺丝液,将其注入注射泵输送至喷丝头,喷丝头在电压差的作用下产生纤维被圆柱形旋转收集器收集,形成管状移植物,再将管状物浸入乙醇,最后真空干燥[31]。为了避免有机溶剂在制备生物医用材料过程中的大量使用,Zhou等[32]的研究结果表明,水可以作为一种优良溶剂用于静电纺丝制备人工血管,并且使用水作溶剂可以获得连续纤维,同时可以将水溶性生物活性分子混合赋予移植物基本功能。Chan等[33]对比了水纺制和六氟异丙醇纺制的移植体,结果显示水纺制的移植物从3周到6周的新生内膜面积急剧增加,然后达到稳定水平。相比之下,六氟异丙醇纺制的移植体从3周逐渐增加到24周,比水纺制具有更长的稳定周期,并且在移植时细胞的渗透速度显著高于水纺制,这得益于六氟异丙醇纺制比水纺制具有更高的孔隙率(45.1%±1.2% vs 23.3%±1.7%)。虽然静电纺丝技术被广泛用于制备人工血管,但是在静电纺丝和纺织层之间实现强黏合可能是一个挑战,因为沉积静电纺丝纤维的纺织品表面不是均匀平坦的,而是存在微观的粗糙或凹陷的部位,这阻止了两个表面之间的连续接触[34]。用Na2CO3溶液进行脱丝胶获得丝素纤维,再将丝素纤维溶于溴化锂,透析获得丝素蛋白水溶液。将水溶性有机溶剂加入丝素蛋白水溶液,混合后注入模具,在低温(-20 ℃,-70 ℃,-196 ℃)下进行冷冻和干燥处理,浸入甲醇诱导丝素蛋白结晶,最终形成管状移植体[35]。与其他工艺获得的丝素管相比,冻干管增加了孔隙率,有助于细胞向管内迁移[28],但有研究发现,经过冷冻干燥制备的血管支架在力学性能上难以达到预期目标[32]。Kim等[26]利用甲基丙烯酸缩水甘油酯化学改性丝素蛋白能够制备出有效的数字光处理3D生物打印墨水,该墨水能够根据设计的CAD图像打印出血管,但是通过打印的方法制备组织工程材料需要克服生物相容性和结构稳定性等问题,并且丝素蛋白没有合适的光固化位点。Cheng等[36]将猪颈动脉脱细胞后所得细胞外基质作为支架制备的组织工程血管移植体显示出巨大的潜力,这提示蚕丝基或可用于脱细胞组织工程制备血管移植体。人工血管表面孔隙率是诱导血小板聚集的重要因素,冷冻干燥丝素管表面粗糙并具有高孔隙率能够有助于细胞生长迁移,在冻干管中制备过程中加入肝素能够抑制平滑肌细胞的增殖,同时能促进新血管形成,这与高孔隙率和温和的制造工艺(如使用乙醇作为制备溶剂)密不可分[35]。综上,不同制备工艺对于人造血管的孔径、力学性能、细胞迁移速率、细胞附着率等影响较大,如调节静电纺丝参数(溶剂、纺丝液浓度和流速等)以增加丝血管移植物的纤维和孔径可增强宿主的体内重塑[33]。增加静电纺丝制备丝素管过程中甲醇的处理时间,材料结晶度增加,这对丝素血管移植体的生物降解速率产生了显著的影响[37]。调节凝胶纺丝过程中丝素蛋白溶液的浓度可以提高丝素管的孔隙率,这有利于细胞的进入和移植体的降解[38]。以蚕丝基为原料利用不同的制备方法生产的血管移植体具有多种尺寸和孔径可以更好地满足外科手术,这得益于蚕丝独特的生物可控降解性,但是在方法的选择上要综合考虑是否能够保持良好的力学性能及良好的生物相容性(如静电纺丝)。选择六氟异丙醇和乙醇作为溶剂能够有效地控制丝纤维的厚度和孔隙率,这对移植后血管重塑具有深远的影响。
2.2 生物相容性良好
具备良好的细胞相容性通常是血管移植体在进行植入手术前的基本要求。以蚕丝基为基础的小口径血管移植体在与人冠状动脉平滑肌细胞、人主动脉内皮细胞、人脐静脉内皮细胞、平滑肌细胞、小鼠成纤维细胞、NIH 3T3细胞和人脐动脉平滑肌细胞等[39-43]进行共培养时显示出极佳的细胞相容性。静电纺丝制备的丝素血管移植体有利于细胞黏附、存活和生长,在将成年人冠状动脉内皮细胞、人主动脉平滑肌细胞和人主动脉不定纤维细胞接种至移植体后3 h检测到每种细胞类型的黏附率为61%±5%,三种细胞类型显示出活跃的新陈代谢(葡萄糖和谷氨酰胺的消耗,乳酸的释放)和长达20 d的增殖时间[34]。Shayan等[44]利用静电纺丝技术将薄层镍钛诺和丝素蛋白组合以制备复合移植物,当移植物与平滑肌细胞和内皮细胞共培养48 h后细胞以梭形形态扩散,并稳定地附着在移植体上,并且附着的内皮细胞数量及其在移植体上扩散形态均优于涤纶和膨体聚四氟乙烯。Marcolin等[18]的研究结果表明,涂覆明胶的丝素蛋白管状移植体与L929小鼠成纤维细胞系共培养24 h后细胞就已经扩散变平,经过7 d的培养细胞密度变大,与脐静脉内皮细胞共培养3 d和7 d后细胞黏附及生存状态良好[45]。Liu等[40]通过与氯磺酸反应制备了硫酸化丝素蛋白,并用硫酸化丝素蛋白海绵修饰了针织丝素蛋白支架,提高了血管移植体的血液相容性。
研究表明,丝素蛋白管上接种NIH 3T3细胞24 h后,细胞黏附到管上,细胞活力随着培养时间的增加呈线性增加,并且时间越长细胞更加扁平和扩展[37]。Ma等[43]将NIH 3T3细胞与丝素蛋白纳米纤维、低聚原花青素纳米纤维和聚氨酯纳米纤维共培养7 d后检测细胞生长状况,除了聚氨酯纳米纤维表现出很低的细胞生长数,另外两者共培养后的细胞数呈对数级增长,均显示出良好的细胞相容性。即使是在动态培养的条件下,将血管细胞(人冠状动脉平滑肌细胞和人主动脉内皮细胞)接种到模拟血管结构的管状电纺丝素蛋白支架上,细胞也能在支架上增殖和排列,细胞有效分配营养和氧气方面动态流动也优于静态培养[39]。同时,人冠状动脉平滑肌细胞与静电纺丝丝素蛋白支架共培养36 d后,细胞生长状态仍良好[42]。有研究显示,在移植体中掺入胶原蛋白可以进一步促进细胞生长和增殖,提高生物相容性,但是过量的胶原蛋白则会导致移植体机械性能降低[32]。这些结果表明,以蚕丝基为基础制备的血管移植体具有良好的细胞相容性,细胞与支架共培养后生长状况良好,并且能够在材料上定植生长,共培养结果显示出蚕丝基血管支架具有使细胞短期高效定植的特点,这些特性有利于移植后血管内皮化的进程,但是也要预防在这个过程中细胞发生过度增殖的现象。
2.3 抗血栓形成
在血管移植手术后,移植物中形成血栓易引起血管堵塞,这对于手术的成功是极大的阻碍因素,也极易造成死亡[14]。从制备材料上着手降低血栓形成的风险对于血管置换手术至关重要。
Lovett等[28]将蚕丝和聚四氟乙烯这两种血管移植材料制备的管状物与天然大鼠腹主动脉力学性能相比,聚四氟乙烯(弹性模量(918±52.9) MPa,极限抗拉强度(43.4±4.6) MPa)相较于蚕丝(弹性模量(2.20±0.90) MPa,极限抗拉强度(0.273±0.11) MPa)显示出更好的强度,将其用于治疗血流量较高且阻力低的大直径血管移植是有益的,但是蚕丝更能与小直径的大鼠主动脉(弹性模量(2.44±0.76) MPa,极限抗拉强度(0.519±0.11) MPa)的机械性能匹配,从而降低血栓形成的可能性。结合编织和静电纺丝技术,以丝素为原料制备出包括内部和外部静电纺丝层和中间纺织层的仿生血管移植体具有良好的血液相容性,在体内试验期间未观察到血栓形成[34]。Yagi等[30]通过彩色多普勒成像和脉冲波监测SD大鼠体内丝素蛋白制备的血管移植物通畅性,结果显示,植入大鼠腹主动脉21周后的移植物几乎没有血栓形成。同样地,Enomoto等[46]也通过彩色多普勒成像和脉冲波监测到10个聚四氟乙烯移植物有4个在第4周时堵塞,相比之下27个丝素蛋白移植物只有3个发生了堵塞,丝素移植物的通畅率(85%)显著高于聚四氟乙烯(48%),并且堵塞的聚四氟乙烯移植物中有血栓形成。通过端到端吻合的方式将丝血管移植物植入SD大鼠的腹主动脉,大鼠没有表现出急性血栓、凝血和下肢缺血的现象,并且蚕丝膜上黏附的蛋白量低于聚四氟乙烯膜[38]。蚕丝基血管移植物在植入犬颈动脉3个月后的评估中,移植物的腔内层中观察到充分的胶原化和内皮化,这表明该移植物具有高效的抗血栓形成作用[47]。膨体聚四氟乙烯血管移植体在第4周的通畅率(80%)低于丝素蛋白血管移植体通畅率(100%),通畅性的丧失是由于血栓形成,因为红细胞和纤维蛋白积聚在管腔内[48]。为了实现小口径血管移植的长期通畅和结构完整性,理想的血管移植体应该具有抗血栓表面,多项研究结果均表明蚕丝基的抗血栓能力较强,这与其良好的生物相容性和机械性能密不可分。但是蚕丝基人工小口径血管也显示出平滑肌细胞的过度增生问题[28],这是导致血栓的潜在因素之一,未来或可通过将丝蛋白与抗凝剂如肝素、水蛭素,以及抗血栓形成靶因子如紫杉醇、华法林、阿司匹林和氯吡格雷等混合,以提高抗血栓形成性。
2.4 促进血管内皮化
天然血管有三个解剖层:内膜、中膜和外膜。内膜由单层内皮细胞组成,中膜主要包含平滑肌细胞和弹性蛋白纤维,外膜由胶原蛋白、弹性蛋白、成纤维细胞及最主要的结缔组织成分组成(图1)[49]。其中,内皮细胞参与血栓溶解和凝血过程,并且在正常稳态条件下内皮细胞可防止血栓形成[50]。健康的内皮发育对于血管移植手术的成功是有利的[51],内皮细胞的正常生长对于血管重塑十分必要。

图1 血管结构Fig.1 Vascular structure
利用丝素网与内皮细胞共培养,细胞可沿着丝素网黏附和扩散,并且这些细胞在丝素网上形成微血管样结构[29]。通过静电纺丝的方法利用丝素蛋白溶液制备的血管移植体,植入动物体内7 d后,支架内表面的弹性蛋白表达量约为天然血管中定量的50%[52],1个月时,宿主细胞沿着移植物内腔快速迁移,并形成融合内皮[38],3个月时,移植体管腔中有内皮细胞稳定定植[31]。通过冷冻干燥制备的丝素蛋白多孔血管支架,植入SD大鼠皮下2周后可以明显地观察到新生毛细血管[35]。将水凝胶纺丝技术生产血管移植物,植入SD大鼠腹主动脉4周后,管腔表面产生了血管细胞重塑的融合内皮[28],在聚四氟乙烯移植物上并未观察到血管细胞较为活跃的增殖现象。通过双拉舍尔针织机制备丝素纤维管状物,再将移植物表面进行硫酸化处理,结果显示移植体上内皮细胞能够稳定存在14 d以上,这有利于血管移植物的内皮化及加速形成融合功能性内皮单层[40]。针织获得的丝素管状移植物植入动物体内3周时,移植体内表面出现明显的内皮细胞定植[47],植入4周后,移植物的内部被血管内皮细胞覆盖,CD31阳性内皮细胞数量显著多于膨体聚四氟乙烯组[48],3个月在移植物表面聚集了平滑肌细胞和血管内皮细胞[53]。通过编织的方法制备的丝素血管移植体在植入动物体内1个月,在移植体外部形成了一层薄再生组织[54],植入3个月后,所有移植物都有血管内皮细胞生长[55],在3个月和12个月时,移植体中CD31的基因表达水平分别为自体血管的45.8%和75.3%[56],1年后,丝素蛋白移植物的组织学分析显示移植物内形成内皮层和介质样平滑肌层,这显示正常血管中血管细胞产生了迁移[46],内皮细胞和平滑肌细胞迁移到丝素移植体中,并组成内皮和中膜样平滑肌层[29]。蚕丝基血管移植体植入体内后,血管内皮细胞能够顺利地迁移并定植到移植体内腔,同时,管腔表面能够产生融合内皮这对于进行血管置换手术后的血管重塑具有重要意义,也表明利用丝素蛋白制备的血管移植体有望成为天然血管的有效替代品。但是,通过研究可以发现,蚕丝基血管移植物产生的内皮化过程主要集中在血管移植体和天然血管的缝合部位[57],少有研究可以直接证实内皮化过程可以在血管移植物中心进行。因此,如何加快整个蚕丝基小口径血管移植体的内皮化和提高内皮化的完整性,尚需要进行深入研究。
3 结 语
在外科血管移植手术领域,对于人工血管的需求越来越大,特别是小口径的血管移植体,因为它通常与血栓形成的高发生率相关,最终导致移植失败。蚕丝具有可控的生物降解性使它可以通过多种方式制备血管移植体,良好的细胞相容性能让它在体内逃过免疫系统的视线,它的抗血栓形成能力可以最大限度地避免移植体植入体内后的栓塞,并且近似天然血管的机械性能和顺应性保证移植体与宿主的适应,从而保证短期和长期内移植处血液的通畅性。这些研究结果表明,蚕丝基人工小口径血管具有独特的优势,也显示出了极大的临床应用前景,蚕丝基小口径人工血管在不久的将来或许能够用于临床治疗。此外,可以从基因工程改善蚕丝性能、脱细胞基质、新型梯度多层片和丝织物表面改性等方面入手制备组织工程血管移植体。虽然,众多研究都验证了蚕丝基血管移植体的有效性,但它在动物体内的应用中也存在一定缺陷:1) 在制备移植体时脱胶和溶解丝素蛋白的试剂残留对于体内的长期植入是否存在副作用,以及是否影响了血管移植物的有效性缺乏验证;2) 对于植入动物体内的远期通畅率来说,缺乏足够长的时间和移植物数量来验证;3) 关于移植体的临床应用,缺乏与人类亲缘关系相近的物种作为试验动物模型;4) 蚕丝具有可降解性,降解过程大多需要借助炎症反应,如何平衡降解和机体炎症之间的关系需要更深入的研究;5) 蚕丝基血管移植体降解过程要能保持合适的力学性能和抵抗长期变形的能力以便满足组织重塑的要求,这是保证较高远期通畅率的因素之一,但目前缺乏相关的参考数据;6) 蚕丝基小口径血管能够有效地促进内皮增生,但是如何控制这种增生的速度和预防过度增生也是一个问题;7) 目前常用的制备方法中丝素血管移植体表面普遍存粗糙和不平整等问题,这可能会导致移植体表面吸附蛋白质和聚集血小板,从而影响血流。因此,今后可以着重从改进制备方式优化研制工艺入手来提高丝素血管移植体质量,同时对于蚕丝的可控降解性也需要更深入地研究,这有利于诠释降解与机体炎症和组织重塑之间的内在联系,也能为蚕丝在生物医学材料领域的应用提供有力的参考数据。

《丝绸》官网下载

中国知网下载

