多脏器功能受累的青少年起病的成人型糖尿病5型一例
林丹红 全会标 莫泽纬 陈开宁
患者,男,27岁,因“发现血糖升高3年余”于2020年3月24日收入我科。患者3年前体检空腹血糖>7 mmol/L,餐后2 h血糖12 mmol/L,无“三多一少”症状,仅饮食、运动控制治疗。1年前测空腹血糖9~10 mmol/L,开始服用西格列汀0.05 g每日1次、二甲双胍0.5 g每日2次降糖治疗,监测空腹血糖6~8 mmol/L,餐后2 h血糖8~14 mmol/L,为寻求进一步诊治遂来我院就诊。既往史:16年前十二指肠溃疡大出血,就诊消化内科后间断服用泮托拉唑,仍有反复胃部不适;9年前因腹股沟疝至胃肠外科手术治疗,术前检查发现孤立肾;3年前发现高尿酸、肝功能不全;3年前发现血压、肌酐升高,血压最高160/90 mmHg,肌酐130.0~140.0 μmol/L(59.0~104.0 μmol/L,括号内为正常参考值范围,以下相同),至肾内科就诊,长期服用缬沙坦降压,百令胶囊护肾;1年前开始服用多烯磷脂酰胆碱护肝。家族史:奶奶60岁发现糖尿病,现年80岁;父亲35岁发现糖尿病,现年58岁,肌酐385 μmol/L,伴肾囊肿、肝功能不全,目前使用胰岛素降糖;大姑妈50岁发现糖尿病,现年60岁,肾功能正常;二叔30岁发现糖尿病,现年53岁,目前肾功能正常;小叔16岁发现糖尿病,有肾囊肿,现年50岁,已进入尿毒症期,行透析治疗。患者家系图见图1。体格检查:BMI 21.1 kg/m2,腰围 75 cm,血压 132/70 mmHg。剑突下轻压痛,心肺及腹部体格检查余均未见异常。辅助检查:糖化血红蛋白 7.8%,尿微量白蛋白/尿肌酐(UACR)178.0 mg/g(0~30.0 mg/g),24 h尿蛋白0.61 g/24 h(0~0.15 g/24 h),肌酐 132.0 μmol/L,估算的肾小球滤过率(eGFR)59 ml·min-1·(1.73 m2)-1,尿酸 526 μmol/L(208~428 μmol/L),ALT 182.6 U/L(9.0~50.0 U/L)、AST 140.5 U/L(15.0~40.0 U/L)、谷氨酰转肽酶(GGT)89 U/L(7~45 U/L)。血氨、总胆红素、白蛋白、血酮体、抗谷氨酸脱羧酶抗体(GADA)、抗胰岛细胞抗体(ICA)、胰岛素自身抗体(IAA)及凝血功能检查结果均正常。C肽释放试验(0 min、30 min、60 min、120 min、180 min)依次为0.54 nmol/L、1.19 nmol/L、1.75 nmol/L、2.26 nmol/L、1.9 nmol/L。各肝炎病毒标志物、铜蓝蛋白、自身免疫性肝病6项(抗核抗体、抗平滑肌抗体、抗线粒体抗体、抗肝肾微粒体抗体、抗肝细胞胞质Ⅰ型抗体、抗可溶性肝抗原抗体)检查结果均正常。肝功能Child-Pugh分级为A级。腹部彩色超声检查示轻度脂肪肝。泌尿系彩色超声检查示左侧孤立肾,左肾弥漫性损害声像。眼底照相、肌电图均未见异常。胃镜检查结果示:1.非萎缩性胃炎伴胃窦糜烂;2.十二指肠溃疡。14C呼气试验检查结果为阴性。2020年4月3日取得患者及家属知情同意后,行基因检测结果示患者及其父亲HNF1B基因上发现1个杂合无义变异c.529C>T:p.R177X;ACMG变异评级为致病性,患者及其父亲均为杂合子(图2),其母亲、弟弟、妹妹均未发现该基因的变异。最终诊断:1.青少年起病的成人型糖尿病5型(MODY5);2.慢性肾脏病3期;3.孤立肾;4.肝功能不全;5.高尿酸血症;6.消化道溃疡?患者因个人原因,不接受胰岛素治疗,遂改用卡格列净100 mg每日1次、西格列汀0.05 g每日1次、瑞格列奈0.5 mg每日3次降糖治疗,继续予缬沙坦降压、多烯磷脂酰胆碱联合还原型谷胱甘肽护肝、百令胶囊联合复方α酮酸治疗肾病。出院3个月后随访:监测空腹血糖6~7 mmol/L,餐后2 h血糖8~9 mmol/L,糖化血红蛋白6.3%。尿酮体及WBC计数均处于正常范围,肌酐130 μmol/L、UACR 172 mg/g、ALT 116 U/L、AST 102 U/L、GGT 80 U/L,均较前略有下降。

图1 先证者家系图(Ⅰ-2:奶奶;Ⅱ-1:父亲;Ⅱ-2:姑妈;Ⅱ-3:二叔;Ⅱ-6:小叔;Ⅲ-1:先证者)
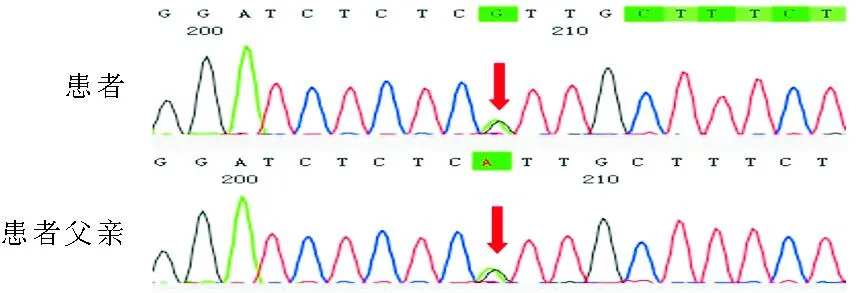
图2 先证者及其家系基因测序图(突变位点 HNF1B:NM_000458:exon 2:c.529C>T:p.R177X,如箭头所示)
讨 论
MODY5为HNF1B基因缺失或突变导致,为常染色体显性遗传。HNF1B基因位于染色体17q12,广泛表达于胰腺、肾脏、肝脏、胃肠道、卵巢、睾丸、肺脏、胆管[1],其突变可导致相关脏器受累。MODY5占所有MODY亚型的2%~5%[2],常在青少年或成年早期发生糖尿病,高血糖的机制包括胰腺发育不全导致胰岛素分泌减少、肝脏胰岛素抵抗和葡萄糖敏感机制失调[3-5]。
Horikawa等[6]首次在一个MODY家系中发现HNF1B突变,并将其命名为MODY5,其突变位点与本例患者相同。该突变可产生一个含有176个氨基酸的缺乏转录活性的截断蛋白,导致HNF1B功能缺失。Montoli等[7]报道具有同样突变位点的家系,其成员多存在糖尿病、肝功能不全、肾功能不全、肾囊肿。
本例患者有腹股沟疝史,十二指肠溃疡10余年,溃疡治疗效果欠佳,14C呼气试验检查结果为阴性,无非甾体类抗炎药物使用史,无酗酒、应激等病史,考虑HNF1B突变导致胃肠道损害。HNF1B在肠道分化中发挥作用,其突变可导致胃肠道发育不良。Goumy等[8]报道1例HNF1B基因缺失患者存在先天性膈疝和胃食管返流。Du等[9]报道1例MODY5合并十二指肠闭锁。在小鼠中,HNF1B的表达对于内脏内胚层的分化及肠、肝和胆道的形态形成是必要的[10]。在斑马鱼胚胎中,HNF1B在前肠和后肠内胚层中表达。HNF1B突变的斑马鱼胚胎在受精后72h出现多肠腔或无可辨肠腔[11]。HNF1B基因的失活直接或间接影响肠上皮细胞中细胞系的终末分化,并通过调节肠道关键因子的表达调控细胞功能[12]。
在HNF1B缺失患者中,有65%可出现肝功能障碍[13],轻者仅肝酶升高,组织学研究结果显示胆管萎缩、脂肪变性和门脉周围纤维化,严重时可导致新生儿或成人胆汁淤积性肝肿大。本例患者肝功能不全3年余,无酗酒、肝毒性药物使用史,各肝炎病毒标志物、自身免疫性肝病相关抗体、铜蓝蛋白阴性,无肥胖,排除相关因素后,考虑为HNF1B突变导致肝脏损害。
胰腺来源于原始肠管的前肠,从内胚层萌发。小鼠模型显示,在胚胎第2周,HNF1B在胰腺芽、前肠-中肠区和肝脏中均有高表达[3]。HNF1B是转录因子网络的关键成员,该网络将胰腺多能细胞分化为内分泌腺体、导管和腺泡细胞[14]。HNF1B突变常导致肾畸形、多囊肿、孤立肾、肾功能不全。HNF1B在集合管、肾盂和输尿管的生长及后肾间充质的分化中起重要作用,是肾单位和集合系统发育的关键因素。本例患者存在高尿酸血症,这是由于HNF1B对尿调节蛋白基因转录的调控,该基因参与尿酸盐的转运[15]。部分患者可出现早期痛风发作。
本例患者为HNF1B突变导致的胰腺、肾脏、肝脏、胃肠道多脏器损害,实属罕见。患者与父亲携带相同的突变基因,但发病年龄、肾畸形特点与父亲不同。HNF1B相关疾病的表型-基因型无相关性,在家族中,相同遗传突变的临床表现甚至会有显著差异[16]。这可能与微环境修饰因子、HNF1B基因表达的随机变异、其他协同基因的影响均有关[3]。
考虑患者体型偏瘦,存在胃肠道不适,剑突下有压痛,ALT超过正常值3倍,且为独肾,eGFR<60 ml·min-1·(1.73 m2)-1,故治疗上停用二甲双胍,患者存在尿蛋白,降糖方案优选有肾脏保护作用的药物卡格列净。复查尿酮体、WBC计数均正常,说明卡格列净的使用是安全的。
HNF1B突变导致胰腺发育异常,大部分MODY5患者胰岛功能差[17],甚至被误诊为1型糖尿病[18]。故推荐使用胰岛素治疗MODY5[19]。本例患者胰岛储备功能尚可,不同意使用胰岛素,临床医生需兼顾患者意愿、肝功能、肾功能、胃肠道不良反应,个体化使用降糖药物。患者eGFR<60 ml·min-1·(1.73 m2)-1,肝功能Child-Pugh分级为A级,存在胃肠道不适,综合考虑,停用二甲双胍,选择卡格列净、西格列汀、瑞格列奈治疗,取得较好的降糖疗效。
本例患者先后因消化道出血在消化内科就诊、腹股沟疝在胃肠外科就诊、肾功能不全在肾内科就诊,后因血糖高至内分泌科就诊明确诊断并优化治疗方案,充分说明MODY5可表现为多系统疾病,值得各科医生重视学习。

