血清HBsAg持续低水平与慢性乙型肝炎患者临床治愈相关进展
高林 姜倩倩 鲁凤民
慢性乙型肝炎(CHB)的临床治愈(即功能性治愈)是指在接受有限疗程的抗病毒治疗后,患者的血清乙型肝炎病毒(HBV)DNA持续低于检测下限并于停药后维持应答,HBV e抗原(HBeAg)转为阴性(简称阴转)或者血清学转换(对于阳性患者),血清HBV表面抗原(HBsAg)持续阴性,肝脏组织炎症和组织病理学得到显著改善[1-5]。获得临床治愈的患者,其终末期肝病的发生率和病死率明显降低。遗憾的是,现有常用的两类抗病毒药物核苷(酸)类似物(NAs)与聚乙二醇干扰素(PEG-IFN)虽然能够显著抑制病毒复制和改善肝组织炎症活动度,但很少能使患者的血清HBsAg消失。总之,CHB的临床治愈仍是一项巨大的临床挑战。近年来,越来越多的临床实践[6-10]以及部分新药临床试验结果[11-12]均提示,经NAs治疗或慢性HBV感染自然进程所致血清HBsAg低值的部分患者更易通过转换治疗策略实现临床治愈。为此,我国学者相继提出了CHB的治疗策略与路径图建议[13-14],并且开展了以血清HBsAg低值阳性(<1 500 IU/ml)为主要入组指征、以临床治愈为主要目标的研究项目[15-16],对于提高CHB的临床治愈率具有重要意义。本文进一步对血清HBsAg低水平患者HBsAg的表达特征、对应的宿主免疫状态及其利于临床治愈的相关机制进行综述。
一、CHB患者血清HBsAg的来源及其意义
1.HBsAg的不同来源及对临床治愈的影响:目前多个指南均推荐对CHB患者治疗的理想终点为实现以血清HBsAg消失为指标的功能性治愈[2-4]。然而,即使是长期使用NAs治疗的患者,其血清HBsAg清除率依然很低。CHB患者的血清HBsAg有共价闭合环状DNA(cccDNA)和整合于宿主基因组的HBV DNA两个来源。而随着疾病进展与持续的宿主特异性、非特异性抗HBV免疫,特别是HBeAg阴转后,患者肝组织cccDNA池显著降低,病毒载量也随着复制的持续被抑制而显著下降。此时,广泛存在的HBV DNA整合片段成为血清HBsAg的主要来源[17]。众多研究表明,无论是血清HBsAg自发阴转[18-19],还是长期NAs治疗后临床治愈[20],均可显著降低肝细胞癌(HCC)发生风险。我国香港地区一项纳入4 568例血清HBsAg阳性患者的随访研究结果显示,与50岁后才发生血清HBsAg阴转的患者相比,50岁前发生阴转的患者其HCC发生风险下降更为显著[21],提示CHB患者越早达到临床治愈,其远期获益越大。
2.HBsAg对维持慢性HBV感染的作用:HBV复制过程中会产生超量的HBsAg表达,免疫耐受期的慢性HBV感染者血清HBsAg水平可高达1014IU/ml(约为1016molecules/ml),远超形成感染性病毒颗粒所必须的水平[22]。其中仅一小部分参与构成Dane颗粒的病毒囊膜,更多HBsAg则以小球型或管状的亚病毒颗粒形式存在于患者循环血液中。目前已知持续高水平的HBsAg刺激会导致机体获得性免疫反应(包括HBV特异性T细胞及B细胞反应)功能受损和耗竭[23]。不仅如此,游离HBsAg还可通过不同机制对肝组织内的自然杀伤细胞、具有吞噬作用的库普弗细胞及驻留的B细胞、T细胞等功能活性产生抑制[24-25]。与之一致的,近期有研究发现携带HBV DNA整合片段且能表达整合来源HBsAg的克隆性扩增肝细胞的数量随着年龄增长呈增长趋势,而机体的HBsAg特异性T细胞数量却随着年龄增长呈现降低的趋势[26]。
综上所述,我们倾向认为随着HBeAg阴转,其对宿主免疫的抑制作用被解除,此时HBsAg对宿主固有免疫及抗HBV特异性细胞免疫的抑制作用可能是维持HBV慢性感染所必须的[24]。
3.血清HBsAg显著降低常见于HBeAg阴转的患者:尽管HBeAg本身并不参与病毒复制,但HBV活跃复制往往会有大量HBeAg产生。已知高水平的HBeAg能够诱导宿主(尤其是T细胞)的免疫耐受[27]。此外,HBeAg前体蛋白p22cr还能够通过竞争性结合核转运因子Kα1,抑制pSTAT入核,使得IFN刺激基因(ISGs)等效应蛋白无法有效的表达[28]。有研究将HBeAg特异性细胞毒性T细胞(CTL)过继给HBeAg转基因小鼠,HBcAg特异性CTL过继给HBcAg转基因小鼠,通过对比两者间的ALT峰值出现时间,发现尽管两者间氨基酸序列有很大的重叠,HBeAg特异性CTL发挥杀伤表达病毒抗原肝细胞的起效时间比后者晚48小时,显示可分泌的HBeAg具有抑制宿主抗HBV特异性免疫反应的作用[29]。同样,尽管使HBeAg表达抑制的前核心区(PC)和基本核心启动子(BCP)突变在青春发育期即已存在[30],但无论是母婴垂直传播还是成年人间的水平传播,建立慢性感染的均为正常表达HBeAg的野生型病毒株,而存在PC/BCP等能显著抑制HBeAg产生的突变的病毒株一旦传播,多导致婴幼儿或成人急性暴发型肝炎[31]。
基于转基因小鼠过继性转移模型的研究结果发现,HBeAg单表达可引起与HBcAg单表达同等强度的抗原特异性免疫反应,且单表达HBeAg转基因小鼠的肝脏炎症和损伤更为持久[29],证实了HBeAg具有免疫原性,能够诱导一定的免疫应答。我国邓国宏教授团队一项基于CHB患者的研究也提示,可分泌IFN-γ的Core蛋白特异性CD4+T细胞与患者HBeAg阴转有关[32],即在免疫耐受打破后HBeAg的表达会引起抗原特异性免疫反应,促进表达HBeAg的感染肝细胞被清除。随着年龄的增长,持续的抗HBV免疫增强往往会导致慢性HBV感染者体内的HBV发生使HBeAg表达抑制或阴转的A1762T/G1764A双位点突变、G1896A突变或联合(PC/BCP)突变积累,由于这些突变可一定程度上增强HBV DNA的复制[33],以致在HBeAg阴性患者中,携带了PC/BCP突变的患者HBV DNA水平均高于携带野生型病毒患者[30]。我们的Meta分析结果也证实了这一现象[34]。上述研究均提示,使HBV DNA复制能力增强的PC/BCP突变有利于HBeAg阴性患者低水平cccDNA池的维持。不仅如此,携带PC/BCP突变的感染肝细胞因HBeAg的表达缺如也有助于其逃逸宿主针对HBcAg/HBeAg的T细胞介导的CTL反应,从而获得免疫选择优势[31]。另一方面,近期一项研究利用肝细胞人源化小鼠的实验证明,PC/BCP突变的HBV病毒株感染相对野生型病毒株具有更强的病毒复制能力且可通过内质网应激引起感染细胞死亡[35]。这一现象与PC/BCP突变HBV病毒株感染所致成人或儿童急性暴发性肝炎发生是否有关值得关注。
二、血清HBsAg低值阳性有利于免疫调节治疗下的临床治愈
1.血清HBsAg低值阳性有利于宿主免疫功能恢复:众所周知,与急性HBV感染不同的是,慢性HBV感染状态下,因超量的病毒抗原长期持续刺激,HBV特异性的T细胞和B细胞应答缺陷,宿主常处于抗HBV免疫功能耗竭状态[36-37]。有研究发现,HBV特异性T细胞功能与血清HBsAg水平和病毒载量呈负相关[38-39]。一项慢性HBV感染者免疫细胞分析的研究结果发现,HBsAg特异性T细胞的数量与血清HBsAg水平相关[36]。病毒抗原的持续低水平可能会减少病毒抗原的刺激,利于宿主免疫功能的恢复[25]。与之一致,我国学者的Switch、New Switch临床研究[10,40]及“珠峰”真实世界项目研究结果均显示,血清HBsAg持续低值阳性的NAs经治患者在序贯/联合长效IFN治疗后往往有较高的临床治愈率,且入组时HBsAg水平越低,HBsAg清除率越高[41]。
2.NAs停药诱发的临床治愈与停药点HBsAg低值阳性相关:从“无限期治疗”治疗模式到“有限疗程”治疗模式的尝试,让人们观察到部分符合亚太肝病学会停药规则的HBeAg阴性CHB患者在NAs停药后发生了HBsAg的自发清除和临床治愈[2,42-43]。基于此,Berg等[44]结合台湾学者的建议,于2021年将治疗策略完善为“安全停药-观察-治愈”。累积的数据显示,HBsAg阴转与停药点HBsAg水平密切相关。其中RETRACT-B的研究结果表明[45],NAs停药时HBeAg阴性、HBsAg<1 000 IU/ml的白种人或HBsAg<100 IU/ml的亚洲黄种人,分别在停药4年后有超过41%和33%发生HBsAg清除。
3.血清HBsAg低值阳性患者在新药临床试验中更易于实现临床治愈:近期,新英格兰杂志发表了CHB新药反义寡核苷酸(ASO)的鼓舞人心的最新临床试验数据[11]。在该研究中,队列1(每周皮下注射bepirovirsen 300 mg,持续24周)在治疗结束时分别有26%NAs经治患者和29%初治患者实现了HBsAg清除,但在随后的24周随访结束时,这一比例分别降低至12%和14%,复阳率高达50%。在基线HBsAg≤3 000 IU/ml的患者中,随访结束时有12%的NAs经治患者和25%的初治患者仍能维持HBsAg清除且HBV DNA阴转。值得注意的是,尽管基于RNAi技术的在研新药相比ASO有更强的抑制HBsAg转录表达的作用,但却没有观察到治疗过程中或停药后出现持续的HBsAg消失。故此不排除ASO可能是通过免疫调节作用诱发患者HBsAg表达细胞的免疫清除。此外,通过阻断程序性死亡受体1(PD-1)/程序性死亡-配体1(PD-L1)通路实现CHB功能性治愈的新药——恩沃利单抗(ASC22)的临床试验,其亚组的7例基线HBsAg≤100 IU/ml的患者中,有3例在治疗24周内出现了血清HBsAg清除,并在随访结束时保持清除状态[12]。这些临床观察的结果均提示,血清HBsAg越低越容易实现临床治愈。
三、问题与展望
对现行治疗策略或在研新药临床试验治愈患者的共性特征进行总结可以发现,特别是在自然或经治后HBeAg阴转的CHB患者中,肝组织和外周循环血HBsAg水平较低有利于HBsAg特异CTL功能的恢复[46]。因此,血清HBsAg低值的CHB患者可成为临床治愈的优势人群(图1)。但需要提醒的是,包括ASO在内的RNA干扰药物,通过以碱基互补方式与HBV目标基因转录本结合,激活宿主细胞的多聚酶核酸(RNase H)酶活性,加速病毒mRNA降解或阻止病毒蛋白的翻译合成,从而使包括HBsAg在内的血清病毒蛋白水平显著降低,但这并不能代表cccDNA池或整合HBV DNA片段的减少或消失,且短时间的血清病毒蛋白水平下降并不一定可带来耗竭的细胞免疫功能恢复。
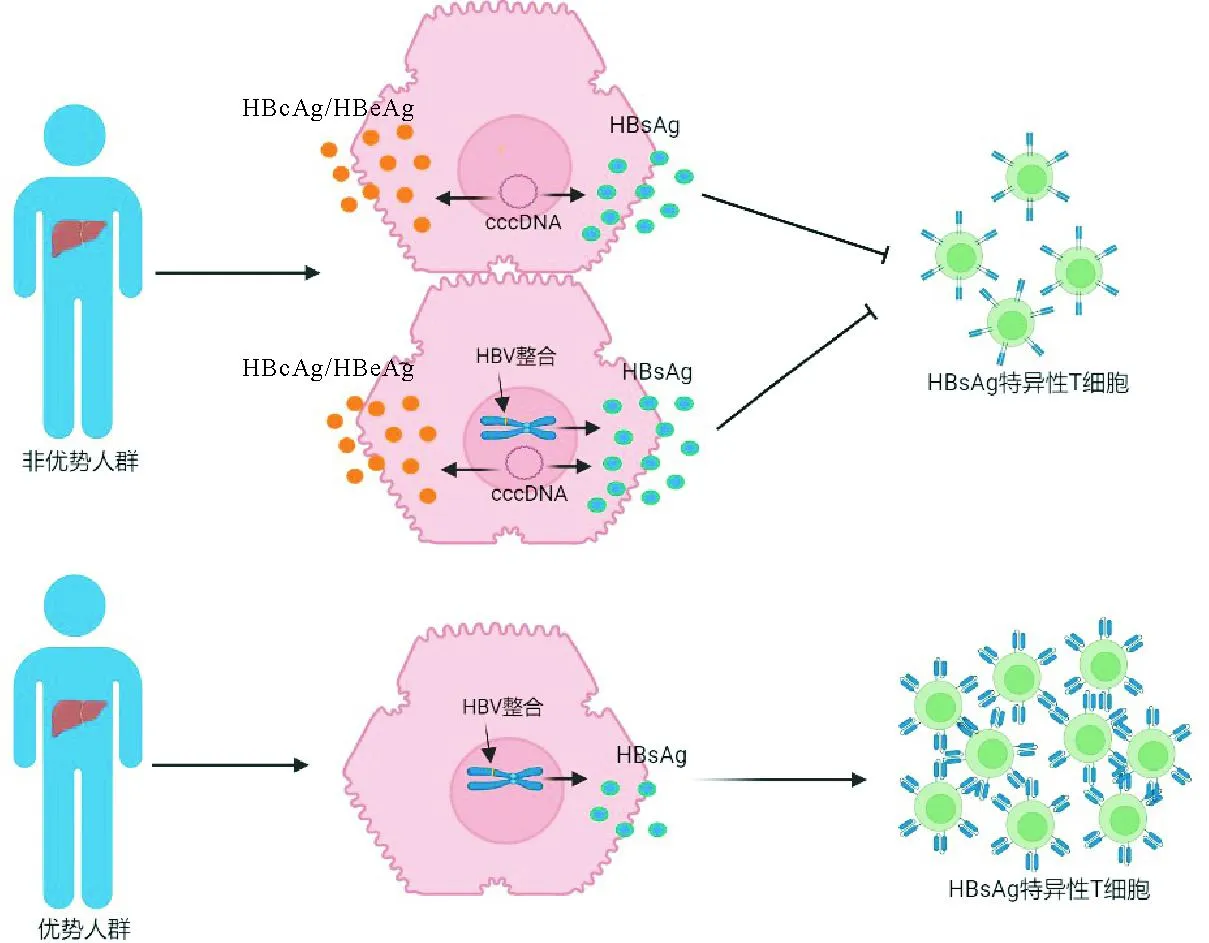
图1 低值HBsAg的CHB患者可成为临床治愈的优势人群(对于HBeAg阴性的HBsAg低值CHB患者,其血清HBsAg主要来源于整合的HBV DNA,随着HBsAg表达水平降低,其对HBsAg特异性T细胞的免疫抑制减弱,宿主免疫功能逐渐恢复,从而有利于实现功能性治愈)
目前,对于患者血清HBsAg的低值界定为多少才能达到比较理想的临床治愈率还有待进一步研究明确。此外,由于现有的一线抗病毒药物难以实现HBsAg的有效清除,开发新的治疗药物,改善联合治疗或免疫治疗策略,或许能有效提高HBsAg的清除率。

