急性髓系白血病基因突变谱及其与首次诱导疗效的关系
袁杰铖,蔡晓虹,陈禹欣,4,5,穆亚飞,刘玲玲,陈涛,蒙裕欢,范喜杰,林俊维,沈茂婷,于世辉,4,5
(1.广州医科大学金域检验学院,广东广州 510182;2.广州市金域转化医学研究院有限公司,广东广州 510320;3.中山大学血液病研究所中山大学附属第三医院血液科,广东广州 510630;4.广州金域医学检验中心有限公司临床基因组检测中心,广东广州 510320;5.广州金域医学检验集团股份有限公司,广东广州 510320)
急性髓系白血病(acute myeloid leukemia,AML)是一组异质性很高的造血系统肿瘤,在成人急性白血病中占比可达80%,是成人急性白血病最常见的亚类[1]。目前AML 的诊断标准是结合细胞形态学、免疫学、细胞遗传学和分子生物学的世界卫生组织(WHO)诊断体系[2]。近年来对除急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)之外的其他AML 亚型患者,临床诱导化疗方案主要依赖于蒽环类药物联合阿糖胞苷方案(“3+7”方案)[3]。AML 临床疗效与多种因素包括年龄、基础疾病、诱导方案等相关,不同AML 患者疗效往往存在一定差异[4⁃5],如接受了相同的诱导治疗方案,60 岁以下AML 患者的完全缓解(CR)率(60%~80%)显著高于60岁以上患者(40%~60%)[6⁃7]。
近年来随着二代测序技术在血液肿瘤临床治疗中的广泛应用,许多与AML 相关的基因突变也被不断发现[8]。研究表明,基因突变与AML 首次诱导治疗疗效存在着显著相关性,如NPM1突变与AML患者首次诱导治疗取得完全缓解具有显著正相关关系[9]。因此,探讨基因突变对AML 临床治疗和管理具有重要意义。此外2022 版欧洲白血病网络(ELN)指南首次将未取得CR 的AML 患者进一步分为部分缓解(PR)和未缓解(NR)[10],诱导治疗后获得CR 的患者可以选择进行巩固治疗或骨髓移植,而PR 或NR 患者可以选择无交叉耐药的新药组成联合化疗方案或者骨髓移植等方案进行治疗。本研究按AML 患者的首次诱导疗效进行分组,并探讨组间临床特征的差异,以期为AML 的临床治疗提供参考。
1 对象与方法
1.1 研究对象
回顾性收集2018 年1 月至2021 年12 月中山大学附属第三医院收治的AML 患者的临床资料,所有患者均符合2016版WHO 造血和淋巴组织肿瘤分类诊断标准[2]。本研究经中山大学附属第三医院医学伦理委员会批准(伦理审批号:中大附三医伦[2022]02⁃018⁃01)。
1.2 AML相关检测
1.2.1 形态学检测 收集患者骨髓样本,显微镜下使用瑞氏染色法观察细胞形态,并计算200~500 个细胞中各类细胞所占的百分比。
1.2.2 免疫学检测 使用Cytomics FC500 流式细胞仪(美国Beckman Coulter)进行骨髓样本流式细胞术检测,在单激光或双激光条件下对多种不同的荧光色素进行荧光参数分析,最后使用FCS Express 软件(美国De Novo Software)分析数据。
1.2.3 核型检测 收集骨髓样本进行细胞培养、制片后,使用G显带的方法进行染色体条带分析,选择染色体分散良好、显带清晰、染色良好的核型进行分析,计算染色体总数,观察有无染色体的数量异常或结构畸变,并对染色体核型结果进行描述。
1.2.4 基因突变检测 采用本实验室血液及造血系统肿瘤175 相关基因靶向深度测序技术(175 genes deep target sequencing,175⁃Panel)进行患者基因突变检测,并对检测结果进行肿瘤体细胞突变的分子病理学协会(Association for Molecular Pathology,AMP)分级[11],保留AMP 分级中具有强临床意义的突变(TierⅠ)和潜在临床意义的突变(TierⅡ)进行下一步的统计分析。
1.3 诱导治疗方案
初诊AML 患者采用以下方案进行首次诱导治疗:IA±D[去甲柔红霉素(IDA)+阿糖胞苷(Ara⁃c)±地西他滨)、CAG±D[Ara⁃c+阿克拉霉素(Acla)+粒系集落刺激因子(G⁃CSF)±地西他滨]、DA±D[柔红霉素(DNR)+Ara⁃c±地西他滨]、维甲酸±三氧化二坤/IA(APL 治疗方案)及其他方案,包括MA±D[米托蒽醌+Ara⁃c±地西他滨]、TA±D[吡柔比星+Ara⁃c±地西他滨]、HA[高三尖杉酯碱(HHT)+Ara⁃c]、单用低剂量Ara⁃c±D、单用去甲基化剂阿扎胞苷或地西他滨等。本研究将IA±D、DA±D、MA±D 等蒽环类联合阿糖胞苷药物定义为高强度治疗方案,将CAG±D、单用去甲基化剂或地西他滨等定义为低强度化疗方案。
1.4 诱导疗效评估
AML 患者首次诱导疗效评估依据欧洲白血病网络(ELN)指南(2022年版)[10],CR定义为治疗后骨髓原始细胞<5%、无髓外疾病、中性粒细胞计数≥1.0×109/L、血小板计数≥100×109/L;PR 定义为治疗后骨髓原始细胞比例降至5%~25%,或治疗后相比于初诊时原始细胞比例降低50%及以上;NR 定义为疗效可评估但不符合CR、PR标准。
1.5 统计学处理
采用R 软件(版本4.1.0)及RStudio 软件进行统计分析。计量资料以表示,组间比较采用t检验;计数资料组间比较采用χ2检验或Fisher 精确检验。数据整理使用R 软件包“tableone”,变异分析使用R 软件包“maftools”,使用“oncoplot”函数分析AML 患者基因突变谱,使用“somaticInteractions”函数分析基因间共存与互斥关系。以P<0.05 为差异有统计学意义。
2 结果
2.1 患者一般资料
共收集AML 患者140 例,其中男68 例、女72例;年龄16~87岁,中位年龄47岁。140例AML患者的一般资料见表1。AML 伴重现性遗传学异常98例(70.0%),其中AML 伴NPM1亚型患者最多(28例,20.0%);AML 非特指型42 例(30.0%),以急性原始单核细胞和单核细胞白血病较为常见(17 例,12.1%)。

表1 140例AML患者的一般资料
2.2 基因突变谱及共存互斥分析
采用二代测序(next⁃generation sequencing,NGS)共检出451个基因突变位点,分布在60个基因上,其中突变频率最高的突变基因分别为CEBPA(20.0%),NPM1(20.0%)和WT1(15.0%)。见图1。由于AML的遗传复杂性及不稳定性,AML患者往往同时发生几个突变且突变基因之间存在广泛共存及互斥情况。突变基因共存与互斥分析显示,102例(72.9%)患者存在两种及两种以上的突变基因,NPM1与DNMT3A、TET2、IDH2存在显著的共存关系,常共同发生基因突变,此外RUNX1与BCOR、CSF3R也存在显著的共存关系。见图2。
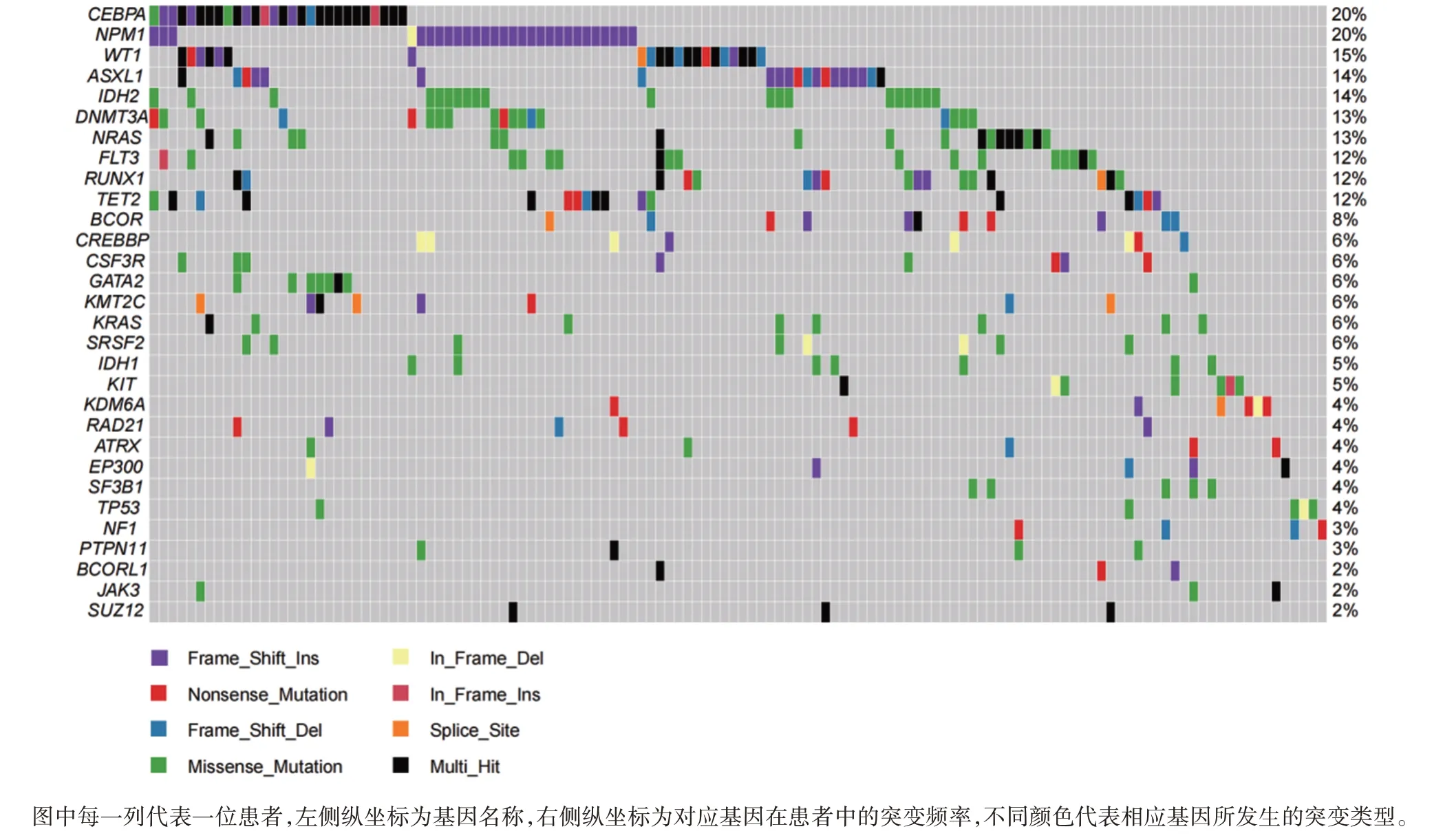
图1 140例AML患者基因突变谱
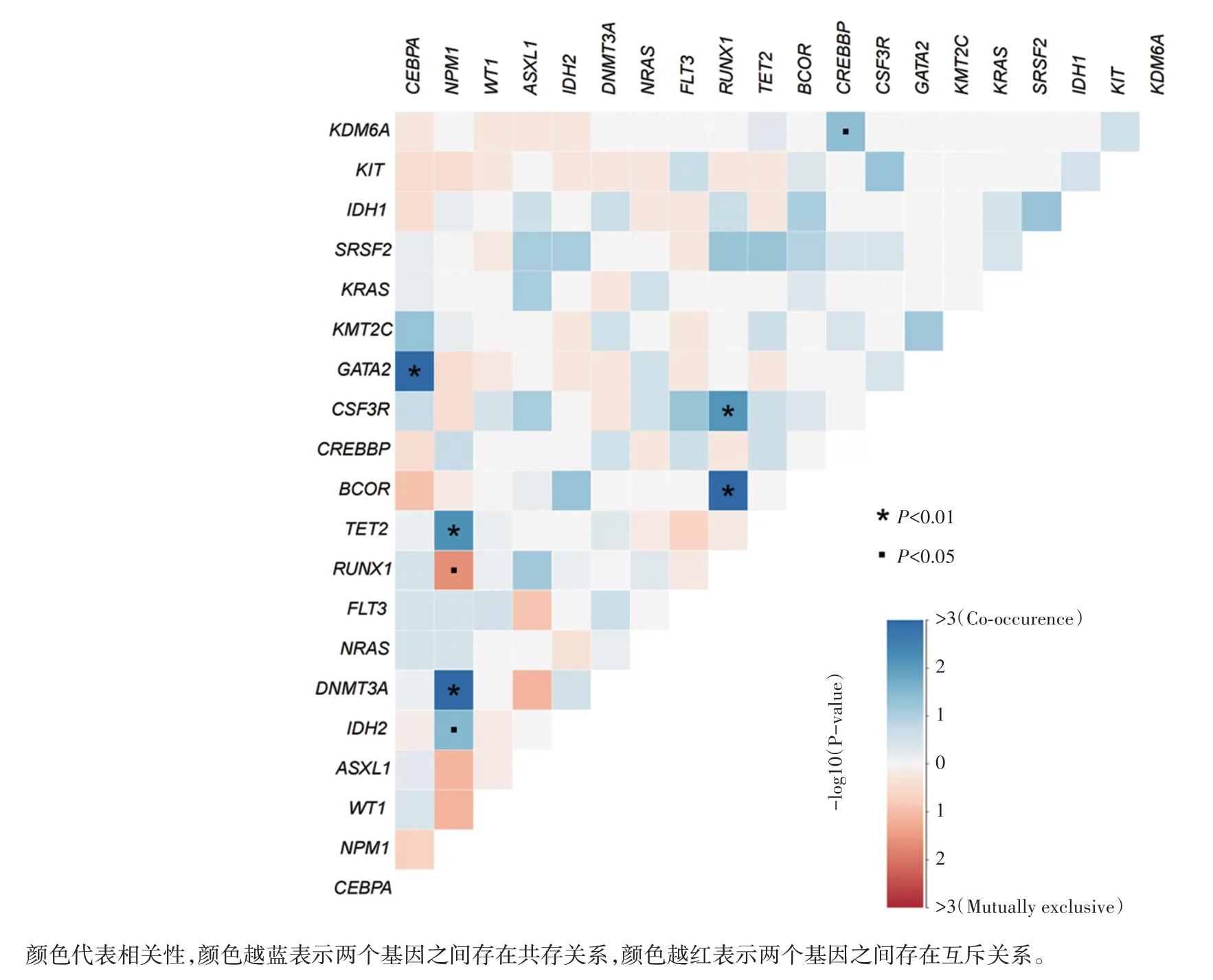
图2 基因间共存与互斥关系图
2.3 首次诱导疗效影响因素分析
本研究对140 例AML 中非APL 亚型患者82 例进行下一步首次诱导疗效评估,其中54 例(65.9%)获得CR,19 例(22.9%)获得PR,9 例(11.0%)获得NR。患者首次诱导疗效的影响因素分析显示,患者初诊时血小板数目(P<0.05)和TET2突变频率(P<0.001)组间差异显著,NR 组PLT 值高于CR 组和PR组,NR组TET2突变频率显著高于CR组。见表2。

表2 不同首次诱导疗效组AML患者的临床特征
2.4 TET2 突变降低NPM1 突变AML 患者首次诱导疗效
既往研究表明NPM1突变AML 患者首次诱导疗效较好[2,9],但本研究首次诱导疗效影响因素分析中并未发现NPM1突变存在显著组间差异,提示存在可能影响NPM1突变患者首次诱导疗效的其他因素。本研究基因共存互斥分析结果显示TET2突变与NPM1突变存在共存关系,且TET2突变频率在首次诱导疗效影响因素分析中组间差异显著,提示TET2突变潜在影响NPM1突变AML 患者首次诱导疗 效。通过对 比NPM1共突变 组(NPM1与DNMT3A、NPM1与TET2、NPM1与IDH2)之间的首次诱导疗效,结果显示NPM1伴TET2突变患者的诱导完全缓解率最低,不伴TET2突变时NPM1突变患者的诱导完全缓解率有一定的提升,见图3。
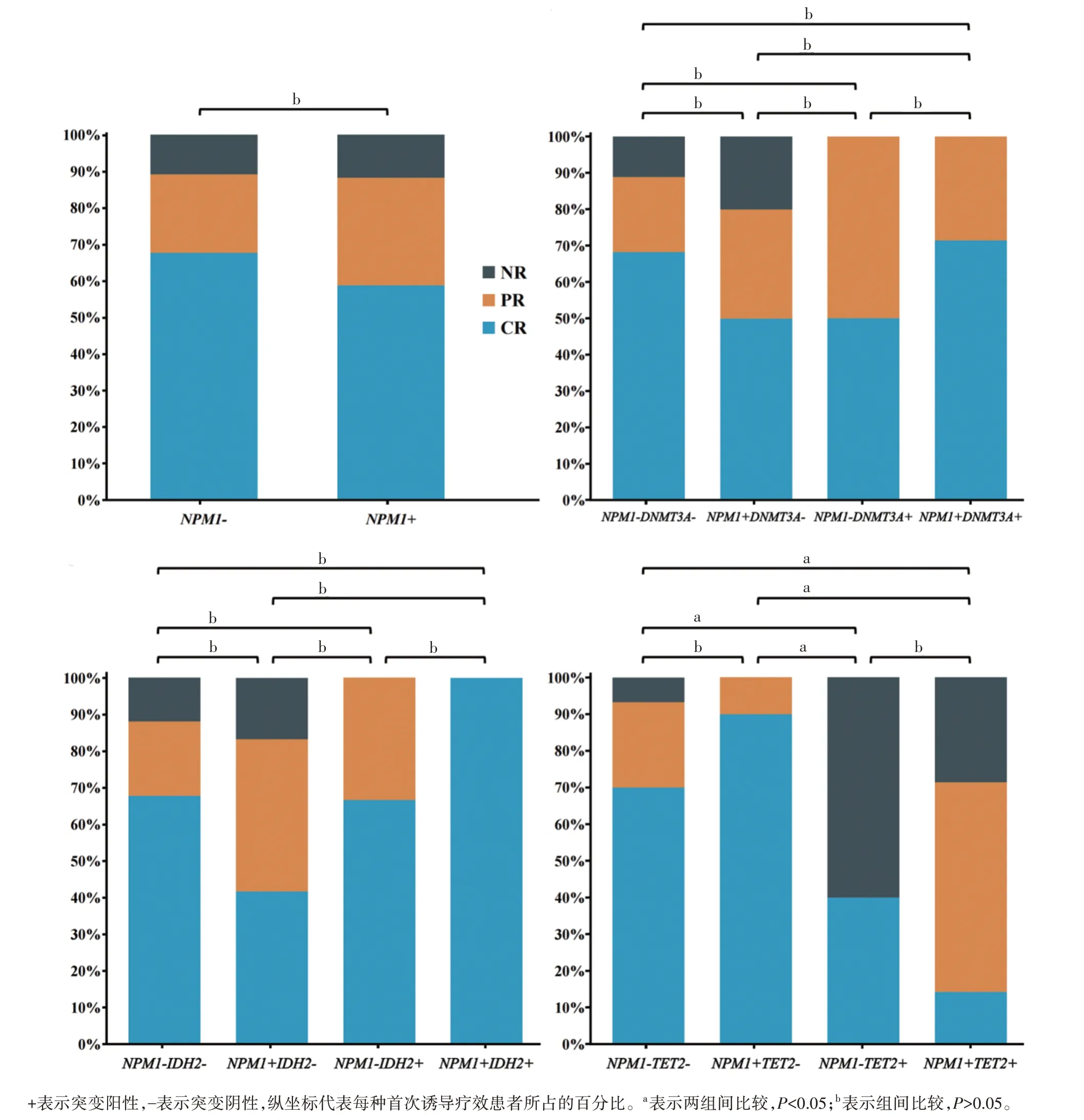
图3 82例非APL亚型AML患者的首次诱导反应率比较
3 讨论
采用本实验室175⁃Panel 的NGS 技术检测AML患者的基因突变,分析140 例AML 患者基因突变谱显示,CEBPA(20.0%)、NPM1(20.0%)与WT1(15.0%)是最常发生突变的基因。从整体上看,本研究中AML 基因突变谱与既往中国人群或其他地区人群相关研究结果基本一致[12⁃14]。另外,本研究还揭示了基因之间存在的一些共存与互斥的关系,本研究结果与既往研究结果相比亦大致相同[15],但是部分基因显示出了不同的共存情况。本研究中RUNX1与CSF3R基因存在较显著的共现关系,这一对基因的共存关系在严重先天性中性粒细胞减少症的研究中较常见[16⁃17],而在AML 相关研究中尚未见报道,这一对基因共存关系的发现可能对AML 致病机制的研究有一定的参考价值。
AML 患者首次诱导疗效受年龄、诱导方案、初诊时白细胞数目、核型危险度和基因突变等多种因素影响,其中基因突变对患者首次诱导疗效的影响具有重要作用。NPM1是一种肿瘤抑制因子,具有核糖体蛋白的组装和运输、中心体控制复制、调控肿瘤抑制因子等多种功能。多项研究表明,伴NPM1突变的AML 患者对诱导治疗具有较好的反应[2,9,18],提示NPM1突变是AML 患者诱导治疗后获得完全缓解的有利因素。TET2是一种与DNA 去甲基化功能相关的肿瘤抑制因子[19],TET2突变导致功能丧失,与克隆扩增有关,被认为是白血病发生的早期事件[20]。目前,TET2突变与AML 诱导疗效的相关性仍存在争议,有研究认为TET2突变不会对AML 患者诱导治疗的反应和长期生存产生显著影响[21⁃22]。然而另有研究表明,TET2突变的AML患者诱导完全缓解率显著降低[23⁃24]。
本研究发现TET2基因在NR 组的突变频率最高,且显著高于CR 组,提示TET2突变显著降低了AML 患者首次诱导完全缓解率。另外,本研究并未发现NPM1突变患者存在显著组间差异,与以往研究结果不一致[9,18]。有研究表明,基因间的相互作用可能影响AML 患者的治疗效果[25]。通过对比NPM1与DNMT3A、NPM1与TET2、NPM1与IDH2三组共突变组的首次诱导缓解率,NPM1伴TET2突变患者的诱导CR 率最低,仅当不伴TET2突变时NPM1突变患者首次诱导CR 率升高。该结果显示一个基因对AML 患者首次诱导疗效的影响会由于另一个基因的共同突变而发生改变,由单基因突变解释的患者首次诱导疗效可能存在局限性,提示我们需要多基因组合来评估患者诱导疗效及长期预后,值得进一步研究。
总之,本研究分析AML 患者整体基因突变谱,显示CEBPA、NPM1的突变率较高,同一患者可发生多种基因突变,这些基于中国人群遗传背景下的AML基因变异研究发现对中国人群AML的发生、功能研究及临床应用具有重要意义。此外,本研究还分析了基因之间的共存与互斥关系,发现RUNX1与CSF3R在AML 患者中存在显著的共存关系,有助于在分子水平上揭示AML 的发病机制。最后,本研究发现NPM1突变亚型的AML 患者在同时伴有TET2突变时,会降低患者的首次诱导CR 率,提示基因之间的共存关系会影响AML 患者的首次诱导疗效,为多基因联合评估患者预后提供了参考。

