定量CT预测内科胸腔镜下巨型肺大疱减容术疗效
梁婷婷,余耀华,李振华,李国燕,张新娜,张 华*
(1.新乡医学院研究生院,河南 新乡 453000;2.郑州大学附属郑州中心医院呼吸与危重症医学科,河南 郑州 450000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)合并巨型肺大疱(giant emphysematous bulla, GEB)时,由于病情复杂、肺功能损害重,患者生活质量差、病死率高,内科保守治疗效果多不佳,而外科肺减容术难以用于肺功能较差者[1]。内科胸腔镜下GEB减容术创伤小、疗效好、风险低[2],术前有效筛选适应证及预测疗效甚为重要,而术前通过人工阅读CT图像筛选适应证存在一定主观性。定量CT(quantitative CT, QCT)能准确、客观地量化分析肺组织密度及容积[3],辅助诊断COPD[4-5]。本研究观察QCT预测内科胸腔镜下GEB减容术疗效的价值。
1 资料与方法
1.1 研究对象 收集2021年5月—2022年12月于郑州大学附属郑州中心医院接受内科胸腔镜下GEB减容术的26例COPD合并GEB患者,男25例、女1例,年龄43~79岁、平均(61.6±9.0)岁。纳入标准:①年龄<80岁;②符合COPD临床诊断标准[6];③治疗前胸部CT显示靶肺大疱占一侧胸腔容积1/3以上;④戒烟时间>6个月,经内科保守治疗后仍有严重呼吸困难;⑤于治疗GEB后 6个月接受复查胸部CT及检测肺功能。排除标准:①肺部或胸腔严重感染、粘连、气胸、支气管扩张、肺结核、肺动脉高压等其他严重肺部疾病;②心、肝、肾等重要脏器严重病变;③不能配合检查。本研究经院伦理委员会批准(202259),检查前患者均签署知情同意书。
1.2 仪器与方法
1.2.1 CT检查 治疗前及治疗后6个月于接受肺功能检查当日采用Siemens Somatom Emotion 16层螺旋CT机行胸部CT扫描。嘱患者仰卧,于最大吸气末屏气接受扫描,范围自肺尖至肺底;参数:管电压130 kV,管电流150 mA,层厚1.5 mm。采用骨算法重建图像,层间隔为0.8 mm。
扫描结束后将基线胸部CT以DICOM格式导入FACT医学影像量化诊断系统(神州德信医学成像技术有限公司),由该系统自动分割肺部组织,去除肺组织以外其他结构如气管、大血管等;行三维重建及QCT分析,评估肺容积和密度,通过设定肺密度阈值(通常为-950 HU[7])识别肺大疱区域(图1),软件自动计算得出治疗前靶肺叶容积、非靶肺叶容积、全肺肺容积、肺大疱容积及肺气肿指数(即肺气肿低衰减区容积百分比)等。
1.2.2 肺功能检查 采用Master Screen型肺功能仪器行肺功能检查,记录第1秒用力呼气容积(forced expiratory volume in one second, FEV1)。参考文献[8-9]方法,以FEV1较基线变化≥15%为最小临床显著差异,根据治疗后6个月FEV1改善率[(治疗后6个月FEV1-治疗前FEV1)/治疗前FEV1×100%]将患者分为显著改善组(FEV1改善率≥15%)和非显著改善组(FEV1改善率<15%)。
1.2.3 内科胸腔镜下GEB减容术 术前完善血常规、血气分析、肺功能、心电图、胸部CT等相关检查。于CT引导下定位靶肺大疱,常规于GEB内置管,必要时行人工气胸术。根据CT评估胸膜粘连程度,适当选择入路。嘱患者健侧卧,予全身麻醉并行单侧肺通气;针对术前靶肺大疱定位点进行内科胸腔镜检查,寻找目标肺大疱并使其充分暴露,存在胸腔粘连时分离粘连带;以16 G穿刺针(德国宝雅医疗公司)刺入靶肺大疱,快速注入15~30 ml医用胶α-氰基丙烯酸正丁酯(1.5 ml/支,北京福爱乐科技有限公司),抽气至大疱几近完全萎陷后行膨肺验证,确认无漏气后撤出胸腔镜,留置胸腔引流管;待胸腔引流管无气体逸出时复查胸部CT,观察肺复张程度,确定无胸腔积气、积液后拔除胸腔引流管。于治疗后6个月随访复查肺功能及胸部CT。
1.3 统计学分析 采用SPSS 26.0和GraphPad Prism 8.3.0统计分析软件。以Fisher精确概率法比较计数资料。以±s表示符合正态分布的计量资料,行t检验;以中位数(上下四分位数)表示不符合正态分布者,行秩和检验。采用Pearson相关或Spearman相关系数观察组间差异有统计学意义的QCT参数与FEV1改善(治疗后6个月FEV1-治疗前FEV1)程度的相关性;绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),评估上述参数预测内科胸腔镜下GEB减容术疗效的效能。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 显著改善组20例,非显著改善组6例;组间患者年龄、性别、有吸烟史者占比及体质量指数(body mass index, BMI)差异均无统计学意义(P均<0.05)。见表1。
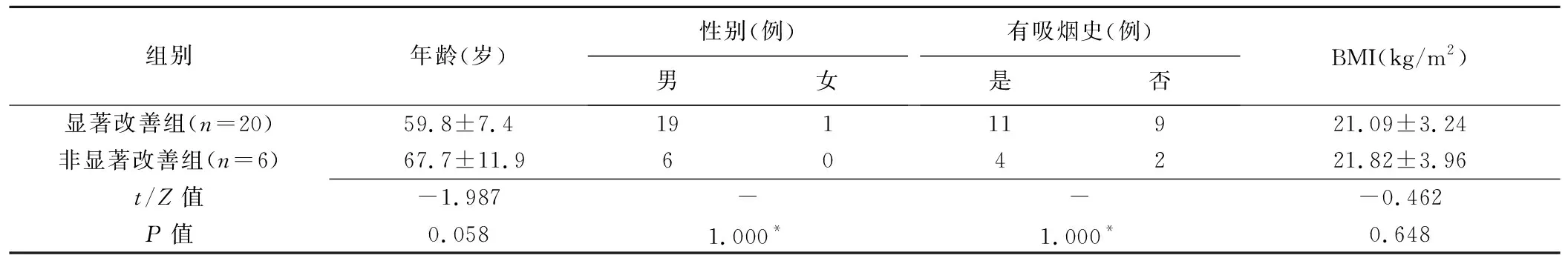
表1 26例COPD合并GEB患者一般资料
2.2 QCT参数及相关性分析 治疗前,组间靶肺叶肺容积、全肺肺容积、靶肺叶肺大疱容积及全肺肺大疱容积差异均有统计学意义(P均<0.05),其余QCT参数差异均无统计学意义(P均>0.05)。见表2。
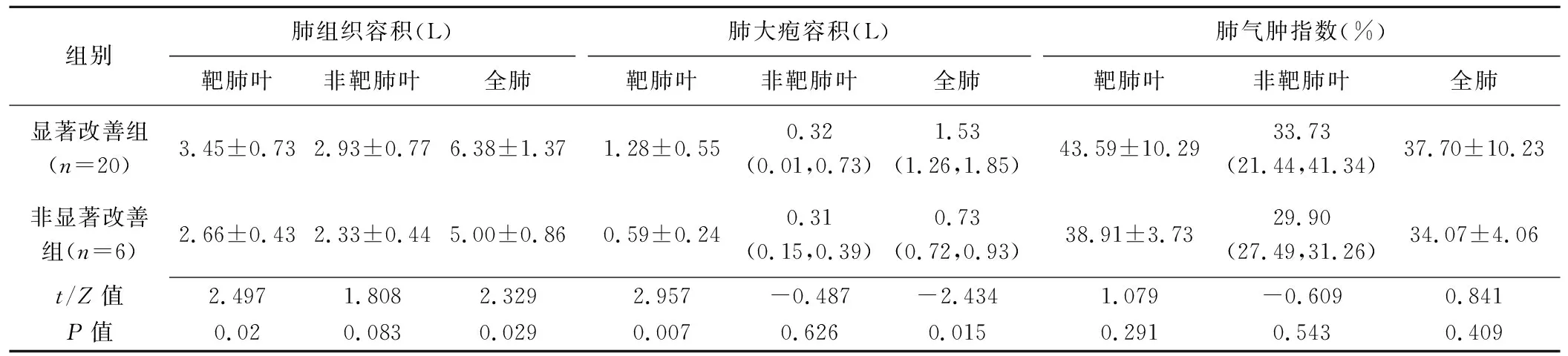
表2 26例COPD合并GEB患者治疗前QCT参数
治疗后6个月FEV1改善0.02~0.40 L、平均(0.23±0.12)L。治疗前靶肺叶肺容积(r=0.600,P=0.001)、全肺肺容积(r=0.470,P=0.015)、靶肺叶肺大疱容积(r=0.699,P<0.001)及全肺肺大疱容积(rs=0.523,P=0.006)均与治疗后FEV1改善呈正相关。
2.3 ROC曲线分析 以治疗前靶肺叶肺容积、全肺肺容积、靶肺叶肺大疱容积及全肺肺大疱容积预测内科胸腔镜下GEB减容术后6个月COPD合并GEB患者FEV1改善的AUC分别为0.817、0.817、0.892及0.833(P均<0.05)。见表3及图2。

表3 治疗前QCT参数预测内科胸腔镜下GEB减容术疗效的效能
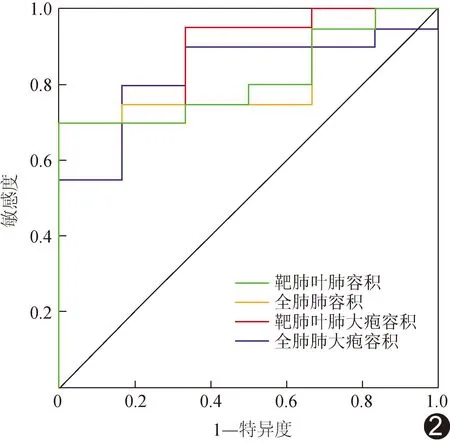
图2 治疗前QCT参数预测内科胸腔镜下GEB减容术疗效的ROC曲线
3 讨论
COPD是临床常见疾病,进展至晚期常合并GEB,严重影响患者日常生活甚至导致死亡。既往研究[1,10]
认为外科肺减容术可有效干预GEB,但手术风险高,且部分患者难以耐受。利用内科胸腔镜通过“一镜加一针”实现肺减容已成为治疗GEB的新兴手段,适用于部分外科干预受限者,但仅凭人工阅读胸部CT筛选适应证具有一定局限性。
QCT可直接显示肺脏内部结构及其功能,能定量评估全肺及各肺叶的形态、功能,已成为当前COPD领域的研究热点[11],主要用于诊断病变及评估其严重程度。本研究观察QCT参数预测内科胸腔镜GEB减容术疗效的价值,以期帮助临床筛选可能受益于内科胸腔镜GEB减容术的COPD合并GEB患者。
既往研究[7]表明,以吸气相-950 HU为密度阈值界定的肺气肿区与病理学结果的相关性最佳。据此本研究以吸气末密度<-950 HU的肺区域为肺气肿区,基于QCT量化分析得到全肺肺容积、肺大疱容积及肺气肿指数等参数,并以治疗后6个月FEV1相比基线改善率≥15%为阈值而将26例COPD合并GEB患者分为显著改善组20例及非显著改善组6例;组间比较结果显示,显著改善组靶肺叶容积、全肺肺容积及肺大疱容积均大于非显著改善组,即治疗前靶肺叶容积、全肺肺容积和肺大疱容积越大,内科胸腔镜下GEB减容术后6个月肺功能改善越显著,而QCT有助于筛选胸腔镜下GEB减容术适应证。
QCT参数与肺功能的相关性较佳,可反映肺功能改善程度[12]。本研究发现,COPD合并GEB患者治疗前靶肺叶容积、全肺肺容积和肺大疱容积均与其治疗后6个月FEV1改善程度呈正相关,各参数预测内科胸腔镜下减容术疗效的AUC均大于0.8,提示QCT参数对于评估COPD合并GEB患者病情及预测内科胸腔镜下GEB减容术疗效具有良好的临床应用价值。
综上所述,QCT能有效预测内科胸腔镜下GEB减容术疗效,有利于指导临床实现个体化治疗。但本研究为单中心回顾性分析,样本量有限、组间分布不均,且随访时间较短,有待积累更多病例后开展多中心前瞻性研究进一步观察。

