肝细胞癌患者经导管动脉化疗栓塞术前后血清HIF-1α、VEGF水平变化及其意义
宋淑莉,王淑娇,李红梅,薛芝敏
沧州市人民医院本部消化内科,河北 沧州 061002
肝细胞癌(HCC)是世界范围内癌症相关死亡的主要原因,其发病率和癌症特异性死亡率仍在不断升高。经导管动脉化疗栓塞术(TACE)能够将高剂量的细胞毒性药物选择性地施用于瘤床并予动脉栓塞,诱导肿瘤组织缺血、缺氧和坏死,是目前治疗HCC 的常用手段[1-2]。缺氧诱导因子1α(HIF-1α)是对缺氧做出适应性反应的关键调节因子,可激活血管内皮生长因子(VEGF),促进血管生成,从而有利于肿瘤进展[3]。有研究报道,HIF-1α 过表达的HCC患者更易发生侵袭和转移,预后非常差[4]。一项荟萃分析亦显示,约50% HCC 患者HIF-1α 过表达,并与较差的总体生存率相关[5]。HIF-1α 和VEGF作为肿瘤血管生成的重要因子,在HCC的发生、发展中发挥重要作用,对HCC 患者TACE 的疗效评价和个体化治疗具有重要意义。因此,监测肝癌组织HIF-1α、VEGF 表达变化是评价HCC 疗效的一部分。但TACE治疗前后血清HIF-1α、VEGF水平变化与HCC患者预后的关系尚不明确。鉴于此,本研究观察了HCC 患者TACE 治疗前后血清HIF-1α、VEGF 水平变化,并探讨其临床意义。现报告如下。
1 资料与方法
1.1 临床资料 选择2016 年10 月—2019 年10 月在沧州市人民医院接受TACE 治疗的HCC 患者142例,男108 例、女34 例,年龄38~62(59.5 ± 8.4)岁。纳入标准:①符合HCC 诊断标准;②肝功能Child-Pugh 分级A、B 级;③ECOG 评分0~2 分;④预计生存期>3 个月;⑤具备TACE 治疗适应证且无相应禁忌证[6]。排除标准:①合并肝性脑病、难治性腹水、肝肾综合征等导致肝功能障碍的疾病者;②门静脉主干完全被癌栓栓塞且侧支血管形成少者;③合并活动性肝炎者;④合并肾功能障碍者;⑤合并其他部位肿瘤者。本研究经沧州市人民医院伦理委员会批准(审批编号:20190521),所有研究对象或其家属知情同意并签署书面知情同意书。
1.2 治疗方法 所有研究对象入院后完善相关检查,禁食4~6 h,常规建立静脉通路、留置导尿管。患者取平卧位,采用Seldinger法经皮穿刺股动脉,放置导管鞘插入导管行肝动脉造影,明确肿瘤的位置、大小、数目及供血情况,再将导管选择性插入肿瘤的供血动脉,顺铂、5-氟尿嘧啶灌注化疗,然后吡柔比星和超液化碘油混合制成乳剂栓塞肿瘤血管,术后予保肝、止吐、镇痛等对症治疗。
1.3 血清HIF-1α、VEGF 检测 TACE 治疗前和治疗后3天,采集所有研究对象空腹肘静脉血5 mL,待血液自然凝固,取上清液,3 000 r/min 离心10 min、离心半径16 cm,留取上层血清,-80 ℃冰箱保存。采用ELISA 法检测血清HIF-1α、VEGF。ELISA 试剂盒购自武汉赛培生物科技有限公司,所有操作严格按试剂盒说明进行。
1.4 随访 所有研究对象经TACE 治疗,病情好转出院。出院后以电话和门诊复查形式定期随访3年,随访截至2022年10月,以患者死亡为终点事件,记录患者生存状况。
1.5 资料收集 收集HCC 患者入院后临床资料,包括性别、年龄、BMI、肿瘤数量、肿瘤最大径、TNM分期、ECOG评分、肝功能Child-Pugh分级,是否合并血管侵犯、转移、静脉癌栓、门静脉高压、腹水以及ΔHIF-1α、ΔVEGF。其中,ΔHIF-1α=治疗前血清HIF-1α 水平-治疗后血清HIF-1α 水平,ΔVEGF=治疗前血清VEGF水平-治疗后血清VEGF水平。
1.6 统计学方法 采用SPSS21.0 统计软件。正态分布的计量资料以xˉ±s表示,结果比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,结果比较采用秩和检验。计数资料比较采用χ2检验。危险因素分析采用多因素Cox 回归模型。生存分析采用Kaplan-Meier 法,生存率比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后血清HIF-1α、VEGF水平比较 截至2022年10月,所有研究对象随访8~36个月、中位随访28个月,随访期间死亡40例(死亡组)、存活102例(存活组)。两组治疗前后血清HIF-1α、VEGF水平比较见表1。死亡组与存活组血清ΔHIF-1α 水平分别为0.11(0.06,0.98)、0.36(0.12,1.15)ng/mL,血清ΔVEGF 水平分别为26.28(13.21,98.32)、56.25(23.21,135.30)pg/mL。死亡组血清ΔHIF-1α、ΔVEGF 水平均低于存活组(Z分别为4.210、12.632,P均<0.05)。
2.2 HCC 患者TACE 治疗后3 年死亡的危险因素分析结果 两组临床资料比较见表2。将表1、2 中差异有统计学意义的指标纳入多因素Cox 回归模型,结果显示肿瘤最大径、TNM 分期Ⅲ期、ECOG 评分2分、血管侵犯、转移、ΔHIF-1α、ΔVEGF是HCC患者TACE 治疗后3 年死亡的危险因素(P均<0.05),见表3。
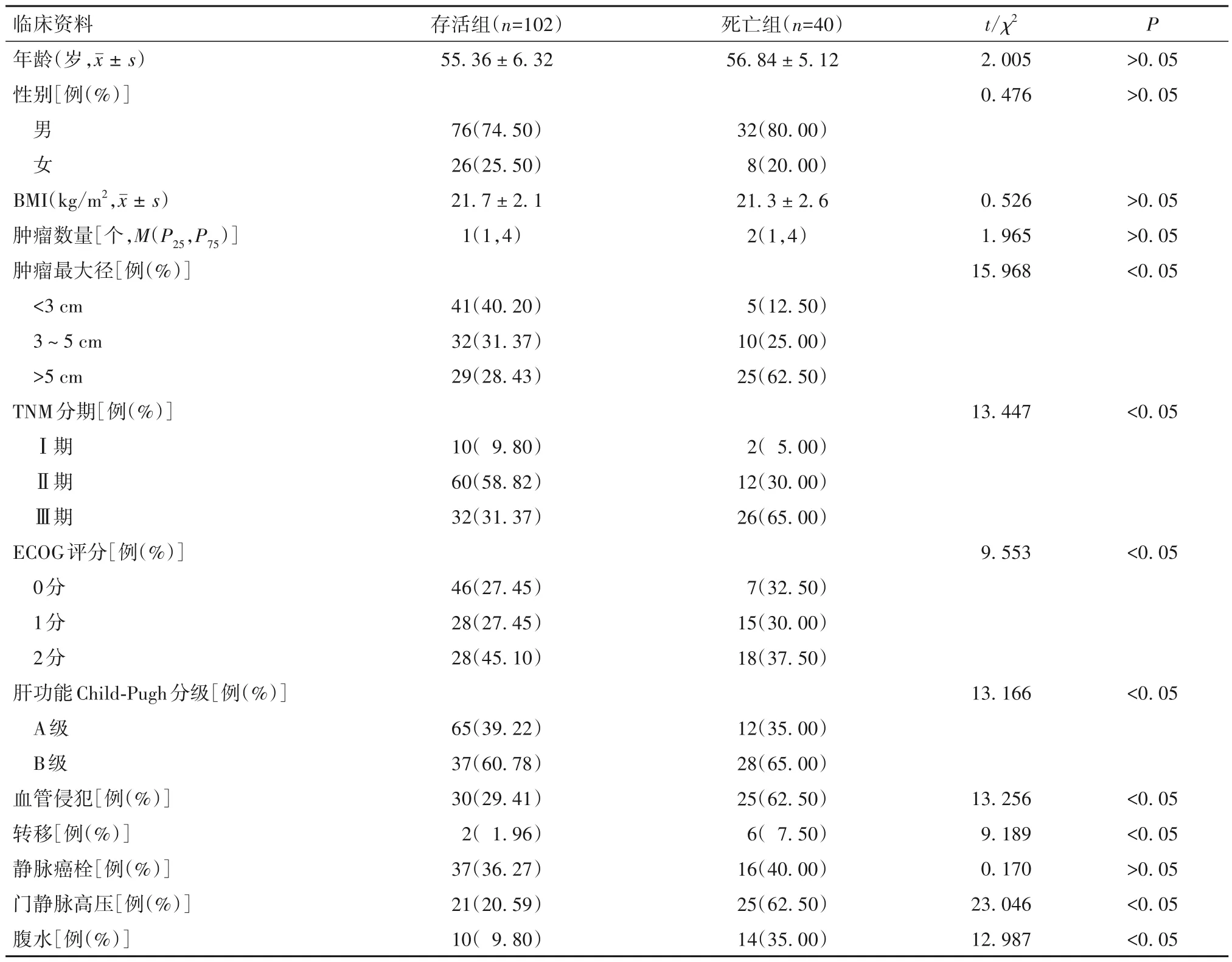
表2 两组临床资料比较

表3 HCC患者TACE治疗后3年死亡的多因素Cox回归分析结果
2.3 不同血清ΔHIF-1α、ΔVEGF 水平HCC 患者TACE治疗后3年累积存活率比较 以血清ΔHIF-1α水平的中位数为临界值,将患者分为血清ΔHIF-1α高水平者82例和低水平者60例,血清ΔHIF-1α高水平者与低水平者TACE 治疗后3 年累积存活率分别为73.2%、53.3%,血清ΔHIF-1α 高水平者与低水平者生存曲线比较差异有统计学意义(Log-rankχ2=6.287,P<0.05)。以血清ΔVEGF 水平的中位数为临界值,将HCC 患者分为血清ΔVEGF 高水平者74例和低水平者68 例,血清ΔVEGF 高水平者与低水平者TACE 治疗后3 年累积存活率分别为73.0%、55.9%,血清ΔVEGF 高水平者与低水平者生存曲线比较差异有统计学意义(Log-rankχ2=5.312,P<0.05)。
3 讨论
肝癌是消化系统常见的恶性肿瘤之一,预后较差,5 年生存率不足15%。HCC 是肝癌最常见的病理类型,占原发性肝癌的75%~80%。HCC 起病隐匿,大多数患者就诊时已处于中晚期,错过了根治性手术的最佳时机。TACE 是中晚期HCC 的重要治疗手段,已被推荐为肝癌的一线疗法[7-8]。
HCC 的恶性程度较高,易发生门静脉侵袭和远处转移。而抑制侵袭和转移是目前HCC 治疗的难题之一[9]。HCC 是一种高度血管化的实体肿瘤,肿瘤血管生成在其发生、发展中具有至关重要的作用。HIF-1α 和VEGF 是肿瘤血管生成的重要因子。HIF-1α通过激活人VEGF 基因转录,在促进HCC 的侵袭、转移和血管生成中发挥重要作用[10]。LIN等[11]研究报道,HCC 患者TACE 治疗后3 天血清HIF-1α 水平显著降低,并且其水平变化可反映TACE 的治疗效果。有研究还发现,在原发性肝癌中HIF-1α 表达与整体生存率显著相关,是TACE 疗效和肿瘤转移的预测指标[12]。有研究认为,恶性肿瘤患者血管生成和缺氧状况可通过检测血清HIF-1α水平来评估[13]。较高的ΔHIF-1α、ΔVEGF 水平表明TACE 治疗后血清HIF-1α、VEGF 水平显著降低,提示治疗效果较好[11]。
本研究结果显示,死亡组和存活组TACE 治疗后血清HIF-1α、VEGF 水平均低于治疗前,但死亡组血清ΔHIF-1α、ΔVEGF 水平均低于存活组。结果表明,血清ΔHIF-1α、ΔVEGF水平降低有利于改善HCC患者预后。本研究多因素Cox回归分析显示,ΔHIF-1α、ΔVEGF均为HCC患者TACE治疗后3年死亡的危险因素。有研究报道,靶向HIF-1α/VEGF 信号通路的药物可抑制HCC 生长,是一种非常有前景的治疗策略[14-15]。本研究以血清ΔHIF-1α、ΔVEGF 水平的中位数为临界值,将HCC 患者分为血清ΔHIF-1α 高水平者与低水平者、血清ΔVEGF 高水平者与低水平者。经TACE 治疗后,血清ΔVEGF、ΔHIF-1α 低水平者TACE治疗后3年累积存活率均低于其高水平者,表明血清ΔHIF-1α、ΔVEGF 高水平与HCC 患者TACE治疗后预后不良密切相关。
综上所述,HCC 患者TACE 治疗后死亡者血清HIF-1α、VEGF水平均高于存活者,并且血清ΔHIF-1α、ΔVEGF 高水平与HCC 患者TACE 治疗后预后不良密切相关。

