食管癌组织DPP3、SMAC 表达变化及其与临床病理特征和预后的关系
朱强,孙彦龙,武毅,王海,王玉璇
1 山西白求恩医院(山西医学科学院 同济山西医院) 山西医科大学第三医院胸外科,太原 030032;2 华中科技大学同济医学院附属同济医院胸外科
食管癌是全球第八大常见癌症和第六大癌症相关死亡原因。据报道,2020 年全球食管癌新发病例约60.4 万例、死亡病例约54.4 万例,其中超过一半的新发病例和死亡病例发生在中国[1]。食管癌预后较差,通常5 年生存率不足30%。目前,临床尚缺乏评估食管癌预后的生物标志物。研究表明,金属肽酶异常表达和线粒体功能障碍在肿瘤的发生、发展中具有重要作用[2-3]。二肽基肽酶Ⅲ(DPP3)是一种锌依赖的金属肽酶,可作为重要枢纽与蛋白产生交互作用,从而参与调控细胞的增殖、迁移和凋亡等生物学过程[4]。第二个线粒体衍生的半胱氨酸蛋白酶激活剂(SMAC)是一种线粒体膜间隙蛋白,可通过拮抗细胞凋亡抑制蛋白(cIAP)而促进细胞凋亡[5]。有研究报道,DPP3、SMAC 异常表达与食管鳞癌细胞的恶性增殖、侵袭和迁移等有关[6-7]。但目前鲜有食管癌组织DPP3、SMAC 表达变化的报道。鉴于此,本研究探讨了食管癌组织DPP3、SMAC 表达变化及其与临床病理特征和预后的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2016 年8 月—2020 年8 月山西白求恩医院胸外科收治的101 例食管癌患者。纳入标准:①符合食管癌诊断标准;②初诊,入院前未接受任何抗肿瘤治疗;③接受根治性或姑息性手术治疗;④年龄≥18 岁;⑤临床病理资料完整。排除标准:①合并胃食管反流、反流性食管炎、感染性食管炎等其他食管疾病者;②合并重要脏器严重疾病者;③合并急慢性感染性疾病、自身免疫性疾病者;④合并其他部位恶性肿瘤者;⑤合并精神疾病者。其中,男72 例,女29 例;年龄29~75(65.54 ± 7.66)岁,≥60 岁64 例、<60 岁37 例;有吸烟史47 例,有饮酒史45例;肿瘤部位:颈段14例,胸上段21例,胸中段59例,胸下段7 例;TNM 分期:Ⅰ、Ⅱ期50 例,Ⅲ期51例;病理类型:腺癌10例,鳞癌91例;组织分化程度:低分化46 例,中高分化55 例;有淋巴结转移37 例。本研究经山西白求恩医院伦理委员会批准(审批编号:YXLL-2022-130)。所有研究对象或其家属对本研究知情并签署书面知情同意书。
1.2 DPP3、SMAC表达检测 采用免疫组化法。取术中切除的食管癌组织及其癌旁组织(距肿瘤组织边缘>2 cm,经组织病理检查确定为正常食管组织),常规固定、脱水、透明、浸蜡、包埋,3 µm 厚连续切片。然后将切片置于60 ℃烤箱烤片30 min,脱蜡至水,柠檬酸盐缓冲液高温高压修复抗原,3% H2O2甲醇溶液封闭内源性过氧化酶。5%山羊血清封闭,然后滴加DPP3、SMAC一抗,4 ℃孵育过夜。次日,滴加HRP标记的二抗,37 ℃孵育30 min。DAB 显色,苏木素复染,自来水冲洗返蓝,梯度乙醇脱水,二甲苯透明,中性树胶封固,显微镜下拍照观察。以磷酸盐缓冲液代替一抗作为阴性对照,以已知阳性切片作为阳性对照。
由两位病理科医师采用双盲法独立阅片。DPP3阳性染色定位于细胞质和细胞核,呈棕黄色颗粒;SMAC 阳性染色定位于细胞质,呈棕黄色颗粒。染色强度评分:以阳性细胞呈色反应为准,无着色为0 分、浅黄色为1 分、棕黄色为2 分、棕褐色为3 分。每张切片随机选择5个200倍视野,计数阳性细胞数和细胞总数,计算阳性细胞比例。阳性细胞比例评分:无阳性细胞为0 分、阳性细胞比例<5%为1 分、阳性细胞比例5%~<30%为2 分、阳性细胞比例30%~<50%为3分、阳性细胞比例≥50%为4分。根据染色强度和阳性细胞比例半定量分析,以染色强度评分与阳性细胞比例评分的乘积综合评价。二者乘积≥4为阳性表达。
1.3 随访 食管癌患者出院后通过电话、门诊、网络等方式定期随访3年,随访截至2023年8月31日,统计患者生存情况。终点事件为患者死亡、失访或至随访截至日期。
1.4 统计学方法 采用SPSS28.0 统计软件。计数资料比较采用χ2检验。生存分析采用Kaplan-Meier法,生存率比较采用Log-rank 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 食管癌组织与癌旁正常组织DPP3、SMAC阳性表达率比较 食管癌组织DPP3、SMAC 阳性表达率分别为78.22%(79/101)、54.46%(55/101),癌旁正常组织分别为28.71%(29/101)、90.10%(91/101)。食管癌组织DPP3 阳性表达率高于癌旁正常组织,SMAC 阳性表达率低于癌旁正常组织(χ2分别为49.744、32.020,P均<0.05)。
2.2 食管癌组织DPP3、SMAC 阳性表达与临床病理特征的关系 见表1。
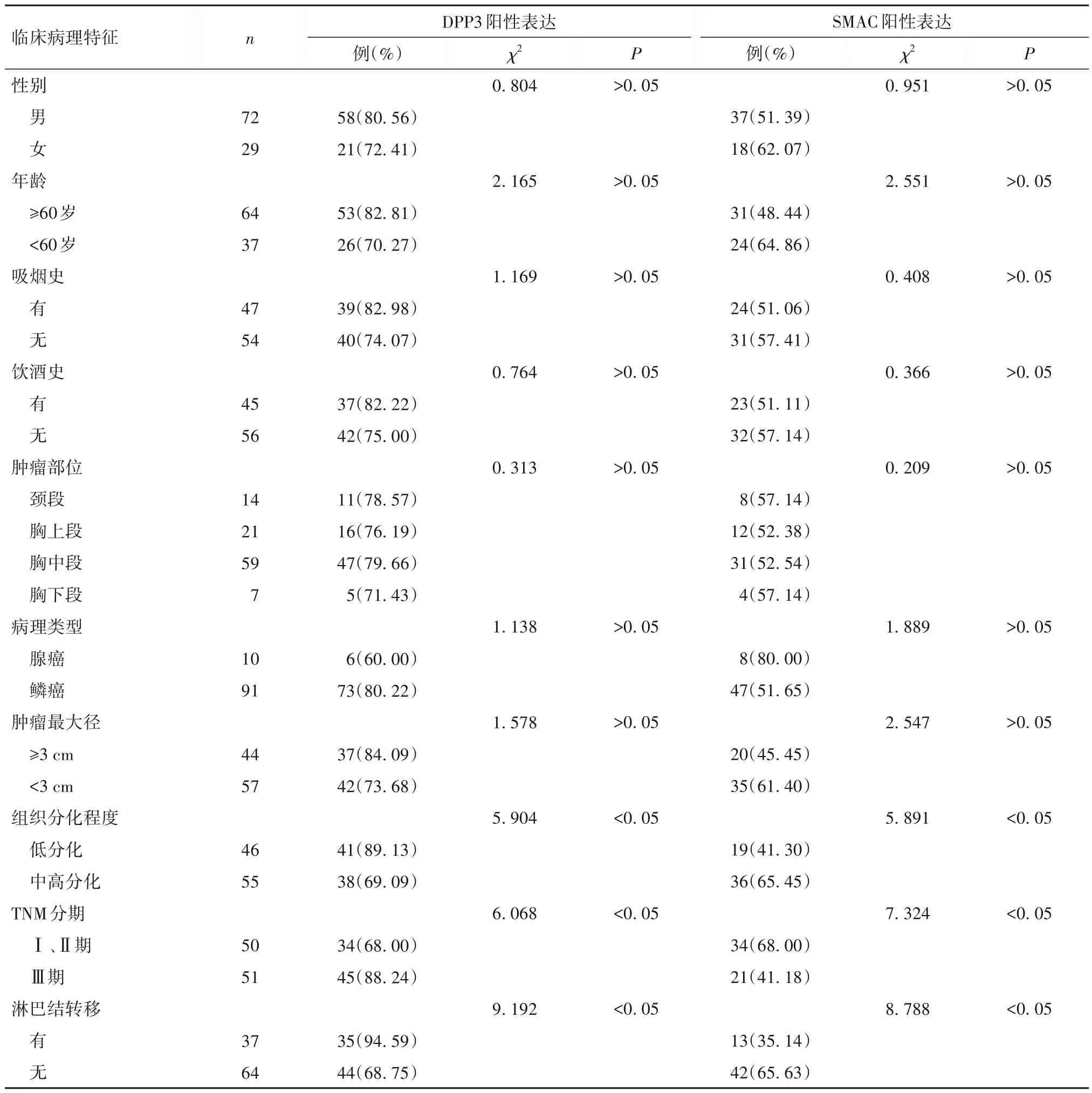
表1 食管癌组织DPP3、SMAC阳性表达与临床病理特征的关系
2.3 食管癌组织DPP3、SMAC表达与预后的关系 随访3年,101例食管癌患者无失访病例,期间死亡33例,总生存率为67.33%(68/101)。生存曲线分析显示,DPP3阳性表达者3年生存率为60.76%(48/79),其阴性表达者为90.91%(20/22);SMAC 阳性表达者3年生存率为80.00%(44/55),其阴性表达者为52.17%(24/46)。DPP3 阳性表达者3 年生存率低于其阴性表达者,SMAC阳性表达者3年生存率高于其阴性表达者(Log-rankχ2分别为6.342、10.811,P均<0.05)。
3 讨论
食管癌是我国发病率较高的一种消化系统恶性肿瘤,其恶性程度较高,预后较差。根治性手术仍然是目前食管癌的首选治疗方法。但食管癌早期症状不明显且无特异性,超过50%患者就诊时已进展至中晚期,往往错过了根治性手术的最佳时机,即使经多种方法综合治疗,5年生存率也仅30%左右[8]。目前,食管癌的病因和发病机制尚不完全清楚。因此,深入探索食管癌发病的分子机制对其早期诊断、靶向治疗和预后评估具有重要意义。
金属肽酶是一类催化蛋白质中肽键水解的蛋白酶,一直被认为在蛋白质更新代谢中的作用微不足道。但近年研究发现,金属肽酶可调控细胞的增殖和凋亡,其失调会导致肿瘤、心血管疾病、神经损伤等一系列疾病发生[9]。DPP 属于锌依赖性水解酶家族,DPP3是该家族中唯一在金属结合基序中具有独特螺旋部分的成员。这种结构使得DPP3 中的锌离子配位几何结构高度灵活,能更好地与其他蛋白相互作用,从而参与多种病理生理过程[10]。DPP3最早被认为是氧化应激的调节剂,能够通过激活Kelch样ECH 相关蛋白1/核因子红系2 相关因子2(NRF2)信号通路发挥抗氧化应激作用,从而参与心血管疾病的发生、发展[11]。LU 等[12]研究报道,DPP3能够通过上调NRF2 下游基因的表达而增强乳腺癌细胞的恶性生物学行为,并且与乳腺癌患者预后不良有关。TONG 等[13]研究报道,DPP3 能够通过上调细胞周期蛋白依赖性激酶1促进结直肠癌细胞的增殖、迁移并抑制其凋亡,并且与结直肠癌患者预后不良有关。而ARORA 等[6]研究指出,DPP3 高表达能够促进食管鳞癌细胞的增殖、侵袭和迁移。因此推测,DPP3表达可能与食管癌患者预后有关。本研究结果显示,食管癌组织DPP3 阳性表达率高于癌旁正常组织;食管癌组织DPP3 阳性表达与组织分化程度、TNM 分期、淋巴结转移有关;DPP3 阳性表达者3 年生存率低于其阴性表达者。本研究结果与ARORA 等[6]报道基本一致,提示DPP3 高表达可能与食管癌的恶性进展有关。究其原因,DPP3高表达能够上调细胞质接头体相关蛋白2、胰岛素样生长因子结合蛋白2、肿瘤坏死因子相关凋亡诱导配体等抗凋亡蛋白表达,下调p53等促凋亡蛋白表达,导致食管癌细胞的恶性生长和增殖,从而促进食管癌的发生、发展[14];同时,DPP3 高表达还能激活NRF2信号通路,通过维持肿瘤细胞内氧化还原稳态和增强肿瘤细胞代谢重编程,促进食管癌细胞增殖并抑制其凋亡,从而导致食管癌的发生、发展[6]。
线粒体被称为细胞的“动力工厂”,其稳态对维持机体生理功能至关重要。线粒体结构或功能异常则会导致包括肿瘤在内的多种疾病发生[3]。线粒体凋亡通路是构成细胞凋亡信号传导的重要通路之一,在不同环境中发挥促进细胞存活或诱导细胞凋亡的功能。但肿瘤细胞内线粒体数量、结构和功能异常改变导致其诱导凋亡的能力降低,进而促进了肿瘤的发生、发展[15]。SMAC 是近年新发现的一种线粒体蛋白质,在线粒体凋亡程序启动时释放。SMAC 能够通过与半胱氨酸蛋白酶竞争性结合cIAP1、cIAP2 并通过自身泛素化降解cIAP1、cIAP2,通过与cIAP相互拮抗而发挥促细胞凋亡作用[6]。在胰腺癌、结直肠癌细胞模型中,上调SMAC 表达能够激活线粒体凋亡通路,增强阿霉素的抗肿瘤作用[16]。此外,上调SMAC 表达还能激活卵巢癌细胞半胱氨酸蛋白酶3 凋亡通路,抑制卵巢癌细胞的增殖、侵袭并诱导其凋亡[17]。本研究结果显示,食管癌组织SMAC 阳性表达率低于癌旁正常组织;食管癌组织SMAC阳性表达与组织分化程度、TNM分期、淋巴结转移有关;SMAC阳性表达者3年生存率高于其阴性表达者。本研究结果与既往研究[8]报道基本一致,提示SMAC 低表达可能与食管癌的发生、发展密切相关。究其原因,SMAC 低表达抑制了线粒体凋亡通路介导的细胞凋亡作用,导致食管癌细胞的恶性生长和增殖;而线粒体作为参与能量代谢的重要细胞器,肿瘤细胞内线粒体功能异常不仅能抑制线粒体凋亡通路,还能增强线粒体介导的Warburg 效应,持续为食管癌细胞恶性生长和增殖提供所需的能量,以满足其在缺氧或酸性环境中快速生长和增殖的需要[18]。
综上所述,食管癌组织DPP3 高表达、SMAC 低表达,二者表达变化与组织分化程度、TNM 分期、淋巴结转移和预后不良密切相关。

