miR-7靶向调控KLF4对结肠癌干细胞生物学行为的影响
常云丽,胥明,陈国裕,汤杰,陈玲玲,季洁如
上海市浦东新区人民医院消化内科,上海 201299
结肠癌是全球范围内发病率和死亡率均居前五位的恶性肿瘤,好发于40 岁以上中老年人,并且男性多于女性[1-2]。目前,针对结肠癌的治疗方法有多种,但总体预后仍然较差[3]。因此,深入探索结肠癌发病的分子机制,从而实现精准治疗,对提高患者预后具有重要意义[4]。既往研究报道,遗传因素是导致结肠癌出现家族聚集的重要原因[5]。微小核糖核酸(miRNA)是一类长度为21~25 个核苷酸的非编码小分子RNA,可在表观遗传学水平上调控基因的表达。miRNA 异常表达与多种肿瘤的恶性生物学行为密切相关,并对肿瘤干细胞的功能维持和分化方向具有重要的调节作用[6]。作为miRNA 家族成员之一,miR-7 能够调控多种靶基因的表达,从而抑制肝癌、肺癌、胰腺癌等恶性肿瘤的发生、发展[7]。Krüppe样因子4(KLF4)是诱导多潜能干细胞形成所需的关键因子之一,在维持胚胎干细胞自我更新和多向分化潜能中发挥重要作用。有研究发现,miR-7/KLF4 信号轴能够参与牙周膜干细胞的成骨与分化[8]。但目前鲜见miR-7/KLF4 信号轴在结肠癌干细胞中作用的研究报道。2020年1月—2022年12月,本研究探讨了miR-7靶向调控KLF4对结肠癌干细胞生物学行为的影响。现报告如下。
1 材料与方法
1.1 材料 结肠癌干细胞,由本院外科手术切除的结肠癌组织中分离获得,并于液氮罐中保存备用。引物序列、miR-7 mimics 质粒及其空载质粒(NC mimics)均由上海生工生物工程股份有限公司设计合成。倒置显微镜,购自日本OLYMPUS 株式会社;微孔板阅读器,购自美国GE HealthCare公司;iBright凝胶成像系统、流式细胞仪,购自美国Thermo Fisher Scientific 公司。原代细胞质粒DNA 转染试剂盒,购自湖北艾普蒂生物工程有限公司;CCK-8,购自赛默飞世尔科技(中国)有限公司;Annexin V-FITC 细胞凋亡检测试剂盒,购自北京普利莱基因技术有限公司;RNA 转录、提取及荧光定量试剂盒,购自美国Sigma 公司;KLF4、β-actin 一抗,购自美国Abcam 公司;HRP 标记的山羊抗兔IgG 二抗,购自上海优宁维生物科技股份有限公司。
1.2 细胞培养 取出液氮罐中保存的结肠癌干细胞,37 ℃水浴复苏。将复苏后的结肠癌干细胞接种于含10% FBS 的RPMI 1640 培养基,置于37 ℃、5% CO2的细胞培养箱常规培养。每3天更换一次培养基。当细胞生长至70%以上融合时,0.25%胰蛋白酶消化,按1∶3传代。
1.3 细胞转染 取传15代、对数生长期、生长状态良好的结肠癌干细胞,接种于6孔板,每孔1 × 106个,随机分为对照组、NC mimics组、miR-7 mimics 组,每组设6 个复孔。将6 孔板置于37 ℃、5% CO2的细胞培养箱常规培养。培养24 h,按原代细胞质粒DNA转染试剂盒说明,NC mimics 组和miR-7 mimics 组分别转染空载质粒、miR-7 mimics 质粒;对照组常规培养,不予转染。转染48 h,收集细胞,按RNA 提取试剂盒说明提取细胞总RNA,经紫外可见分光光度计鉴定,提取的总RNA浓度和纯度合格。按RNA逆转录试剂盒说明,将总RNA 逆转录合成为cDNA。以cDNA为模板,按实时荧光定量PCR试剂盒说明进行PCR 扩增。引物序列:miR-7 上游引物5'-CGTAGTGCTGTAGCTAGTCGTA-3'、下游引物5'-TTGTGCTAGTGCTAGTCCGT-3',GAPDH 上游引物5'-AACGTGAGATAGCTGCTGTGAT-3'、下游引物5'-CTGATGTGTTAATATTCGTGTCA-3'。PCR 反应体系共30 µL:SYBR Green qPCR SuperMix 15.00 µL,cDNA 模板3.50 µL,上下游引物各1.50 µL,DEPC水8.50 µL;反应条件:96 ℃ 3 min,96 ℃ 10 s、65 ℃ 4 s、72 ℃ 40 s共40个循环。PCR 扩增反应完成后,绘制熔解曲线,获取循环阈值(CT)数。以GAPDH 为内参,采用2-ΔΔCT法计算目的基因相对表达量。
1.4 细胞活力检测 采用CCK-8 法。收集各组转染48 h 结肠癌干细胞,接种于96 孔板,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。常规培养24 h,每孔加入CCK-8 溶液10 µL,室温孵育3 h。然后通过微孔板阅读器检测450 nm 波长处各孔的光密度(OD)值,按公式计算细胞存活率。细胞存活率=(实验孔OD450值-空白对照孔OD450值)/(对照孔OD450值-空白对照组OD450值) × 100%。
1.5 细胞迁移能力检测 采用细胞划痕实验。收集各组转染48 h 结肠癌干细胞,按5 × 105/mL 密度接种于6孔板。将6孔板置于37 ℃、5% CO2、饱和湿度的细胞培养箱常规培养48 h。用微量加样器枪头垂直在各培养孔中央作一划痕。继续培养48 h,倒置显微镜下拍照观察,按公式计算细胞迁移率。细胞迁移率=(0 h 划痕距离-48 h 划痕距离)/0 h 划痕距离 × 100%。
1.6 细胞侵袭能力检测 采用改良Boyden 小室法。收集各组转染48 h 结肠癌干细胞,取1 × 105个接种于用Matrigel 基质胶包被的Boyden 小室上室,Boyden小室下室加入含10% FBS的RPMI 1640培养基。然后将Boyden 小室放入6 孔板中,置于37 ℃、5% CO2的细胞培养箱培养。常规培养24 h,取出滤膜,用棉签擦去上室面残留细胞,甲醇固定,结晶紫染色,倒置显微镜下拍照,随机选取5 个不重叠视野,计数每视野穿膜细胞数。
1.7 细胞凋亡检测 采用流式细胞术。收集各组转染48 h 结肠癌干细胞,接种于6 孔板,置于37 ℃、5% CO2、饱和湿度的培养箱培养。常规培养24 h,用1 × Binding Buffer 重悬,制成密度为1 × 106/mL 细胞悬液。取细胞悬液100 µL,加入Annexin V-FITC 5 µL混匀,室温避光孵育15 min;再加入PI 10 µL混匀,4 ℃避光孵育5 min;最后加入1 × Binding Buffer 400 µL混匀,1 h内上流式细胞仪检测细胞凋亡率。
1.8 miR-7与KLF4的靶向结合位点预测与验证 通过TargetScan 在线网站(http://www.targetscan.org)预测miR-7 与KLF4 的结合位点。取传15 代、对数生长期、生长状态良好的结肠癌干细胞,接种于96孔板,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。常规培养24 h,按原代细胞质粒DNA 转染试剂盒说明,将KLF4-WT(野生型)、KLF4-MUT(突变型)分别与NC mimics 或miR-7 mimics 共转染结肠癌干细胞。转染48 h,按双荧光素酶报告基因检测试剂盒说明检测荧光素酶活性。
1.9 KLF4 表达检测 ①KLF4 mRNA 表达检测:收集各组转染48 h 结肠癌干细胞,采用RT-qPCR 法检测KLF4 mRNA 相对表达量,具体步骤参照1.3。引物序列:KLF4 上游引物5'-GTTCGTAGCTGATCGTCGTAGCTA-3'、下游引物5'-TATGTAGTGTCGTGCTGTAGC-3',GAPDH 上游引物5'-AACGTGAGATAGCTGCTGTGAT-3'、下游引物5'-CTGATGTGTTAATATTCGTGTCA-3'。②KLF4 蛋白表达检测:收集各组转染48 h结肠癌干细胞,提取细胞总蛋白,经BCA 法蛋白定量合格。加入上样缓冲液,100 ℃水浴充分变性。取变性蛋白,SDS-PAGE 分离。电泳结束,转印至PVDF 膜上。然后用脱脂奶粉室温封闭,分别加入KLF4、β-actin 一抗,4 ℃孵育过夜。次日,加入HRP 标记的山羊抗兔IgG 二抗,室温孵育2 h,iBright凝胶成像系统曝光并分析结果。
1.10 统计学方法 采用SPSS22.0 统计软件。符合正态分布的计量资料以xˉ±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 转染效率验证结果 对照组、NC mimics 组、miR-7 mimics 组miR-7 相对表达量分别为1.00 ±0.00、1.02 ± 0.07、1.89 ± 0.17。miR-7 mimics 组miR-7相对表达量高于对照组和NC mimics组(P均<0.05),而对照组与NC mimics组比较差异无统计学意义(P>0.05)。
2.2 三组细胞活性、细胞迁移和侵袭能力以及细胞凋亡率比较 见表1。
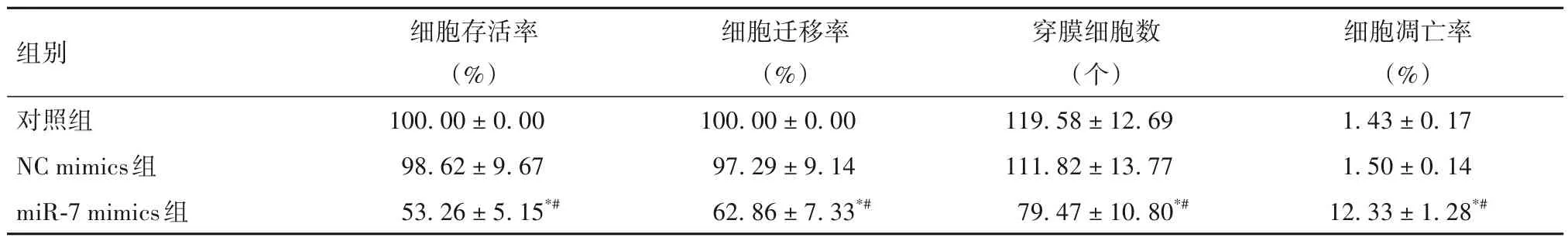
表1 三组细胞活性、细胞迁移和侵袭能力以及细胞凋亡率比较(xˉ± s)
2.3 miR-7 与KLF4 的靶向结合位点预测与验证结果 经TargetScan在线网站预测,KLF4基因的3'非翻译区存在miR-7的结合位点,见图1。双荧光素酶报告基因实验结果显示,共转染NC mimics 与KLF4-WT及共转染miR-7 mimics 与KLF4-WT 的结肠癌干细胞荧光素酶活性分别为1.04 ± 0.05、1.53 ± 0.12,二者比较差异有统计学意义(P<0.05);共转染NC mimics 与KLF4-MUT 及共转染miR-7 mimics 与KLF4-MUT 的结肠癌干细胞荧光素酶活性分别为1.01 ± 0.07、1.04 ± 0.06,二者比较差异无统计学意义(P>0.05)。
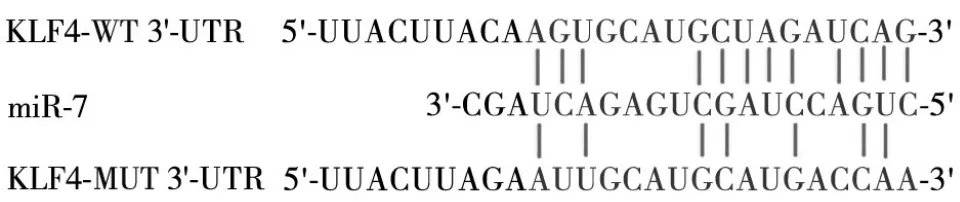
图1 miR-7与KLF4的靶向结合位点示意图
2.4 三组KLF4 mRNA和蛋白表达比较 见表2。

表2 三组KLF4 mRNA和蛋白相对表达量比较(xˉ± s)
3 讨论
据报道,在全球范围内结肠癌是发病率和死亡率均居前五位的恶性肿瘤,每年新发病例超过190万例、死亡病例超过90 万例[9]。我国是结肠癌负担较重的国家,结肠癌的发病率为15/10 万~25/10万、死亡率为7/10 万~13/10 万[10]。目前对于结肠癌的发病机制尚未完全阐明。因此,深入探索结肠癌发病的分子机制,对寻找早期诊断的生物标志物和治疗靶点具有重要意义。
遗传因素在结肠癌的发生、发展中起重要作用。miRNA 是一类非编码单链小RNA 分子,目前已证实其与肿瘤的发生、发展密切相关。miR-7 是miRNA 家族成员之一,定位于人9 号染色体异构核蛋白K 基因的第一个内含子中。miR-7 可在大脑、眼睛和胰腺等部位高表达,提示miR-7 在这些器官的发育中具有重要作用[11]。有研究发现,在胶质母细胞瘤中miR-7低表达,而miR-7过表达则可通过靶向EGFR、AKT 而抑制肿瘤细胞的增殖和迁移[12]。但目前鲜见miR-7 在结肠癌干细胞中作用的报道。本研究结果发现,miR-7 mimics组miR-7相对表达量高于对照组和NC mimics 组,而对照组与NC mimics组比较差异无统计学意义,提示该方法成功将miR-7转染至结肠癌干细胞中。进一步研究发现,miR-7 mimics组细胞存活率、细胞迁移率、穿膜细胞数均低于NC mimics组和对照组,细胞凋亡率高于NC mimics组和对照组;NC mimics 组与对照组细胞存活率、细胞迁移率、穿膜细胞数、细胞凋亡率比较差异均无统计学意义。结果表明,miR-7 能够参与结肠癌干细胞的恶性生物学行为,上调miR-7 表达则可抑制结肠癌干细胞的增殖、侵袭、迁移并促进其凋亡。
KLF4 是诱导多潜能干细胞形成所需的关键因子之一,在维持胚胎干细胞自我更新和多向分化潜能中发挥重要作用。有研究发现,miR-7/KLF4信号轴能够参与牙周膜干细胞的成骨与分化[8]。但目前鲜见miR-7/KLF4 信号轴在结肠癌干细胞中作用的报道。本研究在筛选miR-7 作为靶基因后,发现miR-7 的下游靶点较多,如KLF4、EGFR、IRS-1、PAK-1、RAF-1 和SATB1 等,它们均参与肿瘤发生、发展中的关键信号传导[13]。因此,本研究将miR-7的调控机制锁定在其上下游靶基因中。有研究报道,沉默KLF4 可降低肿瘤干细胞比例,而其过表达则可导致肿瘤干细胞比例增加,表明KLF4 在肿瘤的发生、发展中具有强大的致癌作用,但其具体作用机制尚不清楚[14]。有研究在结肠癌中发现KLF4 过表达,并将其确定为早期侵袭性表型的标志[15]。作为一种转录因子,KLF4 可通过抑制p53 转录来阻止细胞衰老和凋亡,这可能是KLF4 过表达后肿瘤细胞凋亡率降低的原因之一[16]。本研究结果发现,KLF4基因的3'非翻译区存在miR-7 的结合位点;经双荧光素酶报告基因实验验证,miR-7 能够靶向调控KLF4。进一步研究发现,miR-7 mimics 组KLF4 mRNA 与蛋白相对表达量均低于NC mimics 组和对照组,而NC mimics 组与对照组比较差异均无统计学意义。提示miR-7 可能通过靶向下调KLF4 表达而抑制结肠癌干细胞的恶性生物学行为。
综上所述,miR-7 可能通过靶向下调KLF4 表达而抑制结肠癌干细胞的增殖、侵袭、迁移并促进其凋亡。

