腹腔镜和开腹手术治疗急性阑尾炎的效果
刘振伟,高兴民,孙明磊
济南市第七人民医院急诊科,山东济南 250000
急性阑尾炎在临床中并不罕见,属于常见急腹症,临床特点包括发病急、进展快等[1]。患者患病后,经常会表现出右下腹部疼痛难忍,在阑尾点按压能感受痛感强烈等。现阶段,急性阑尾炎的发病率在急腹症中位居首位,严重威胁到患者的机体健康。一般在发病后,需要对患者实施有效的临床治疗,否则随着病情的不断进展,会提升治疗难度,甚至对生命安全构成威胁[2]。临床多采取手术方法进行治疗,但具体涵盖两种方式,一种是开腹手术,另一种是腹腔镜手术,不同手术方法所产生治疗效果也存在着一定的区别[3]。本文为了进一步探讨两种手术方案的临床价值,随机选取2021 年3 月—2022年10 月济南市第七人民医院急诊科收治的80 例急性阑尾炎患者展开对照研究,现报道如下。
1 资料与方法
1.1 一般资料
随机选取本院收治的80 例急性急性阑尾炎患者为研究对象,按照单双号分组的方式分为对照组与研究组,各40 例。对照组中男27 例,女13 例;年龄24~53 岁,平均(38.34±2.47)岁;发病时间8~37 h,平均(19.25±3.54)h。研究组中男26 例,女14 例;年龄22~56 岁,平均(38.51±2.53)岁;发病时间9~36 h,平均(19.42±3.49)h。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审批通过。
1.2 纳入与排除标准
纳入标准:经过影像学检查,确诊患有急性阑尾炎的患者;对研究内容知情同意,并在告知书上签字的患者;首次发病的患者;有正常认知功能的患者。
排除标准:曾经接受过腹部手术治疗的患者;重要脏器存在严重的功能障碍的患者;有严重凝血功能障碍的患者;病历资料记录不完整的患者。
1.3 方法
两组患者在收治入院后,分别应用开腹手术(对照组)和腹腔镜手术(研究组)治疗。
对照组接受开腹手术。手术切口的长度为3~7 cm,具体位置在右侧髂前上棘和脐连线中外1/3处做麦氏点斜切口。逐层切开皮肤,在对阑尾系膜痿进行明确后,结扎阑尾动脉处,并对其进行切断处理。然后将阑尾在距离结扎绳远端5 mm 的位置切断。使用碘伏对阑尾残端位置进行消毒处理。在开展开腹手术治疗的过程中,需要密切关注患者各项生命体征变化情况,并结合其实际病情采取抗感染治疗以及留置引流管。
研究组接受腹腔镜手术。将患者体位调整成头低脚高的状态,术前实施气管插管全麻处理,麻醉生效后。建立直径为10 mm 手术切口,具体位置在肚脐下方,将Trocar(10 mm)置入其中,然后构建人工气腹,维持人工气腹压力在12~15 mmHg。然后在左麦氏点和右麦氏点分别构建手术切口,长度在0.5~1 cm。确保在提起阑尾时不会对其造成损伤。打结处理阑尾根部,并在成功结夹后将阑尾切断,缝合过程中,采用“8”字缝合的方式。手术完成后,结合患者是否出现化脓、积液等情况来展开引流、止血、消炎处理,并在手术完成后的2~3 d 将引流管拔除,实施抗感染治疗。
1.4 观察指标
①比较两组手术相关指标。包括手术时间、术中出血量、住院时间、肛门排气时间、下床活动时间、进食时间。
②比较两组免疫应激指标。包括免疫球蛋白G、免疫球蛋白M、前清蛋白。指标的测定时间为术前、术后3 d,分别抽取3 mL 患者空腹状态下的肘静脉血液样本,通过离心处理后,得到上层血清,然后借助免疫散射比浊法对以上指标进行测定。
③比较两组炎症因子指标。包括白细胞介素-6、C 反应蛋白、肿瘤坏死因子-α,指标的测定时间包括术前、术后3 d,分别抽取3 mL 患者空腹状态下的肘静脉血液样本,通过离心处理后,得到上层血清,借助酶联免疫吸附法对以上指标进行测定。
④比较两组疼痛指标。具体评价时间在术前、术后6 h、术后12 h、术后24 h,使用视觉模拟疼痛量表视觉模拟评分法(Visual Analogue Scale, VAS)打分,分数0~10 分,分数越高,说明患者疼痛症状更加严重。
⑤比较两组并发症发生率。包括腹腔肿胀、肠梗阻、切口感染。
1.5 统计方法
采用SPSS 20.0 统计学软件处理本次研究中的有关数据,符合正态分布的计量资料以(±s)表示,组间比较采用t检验;计数资料以例数(n)和率(%)表示,组间比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者手术相关指标比较
研究组术中出血量少于对照组,手术时间、住院时间、肛门排气时间、下床活动时间、进食时间短于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组患者手术相关指标比较(±s)
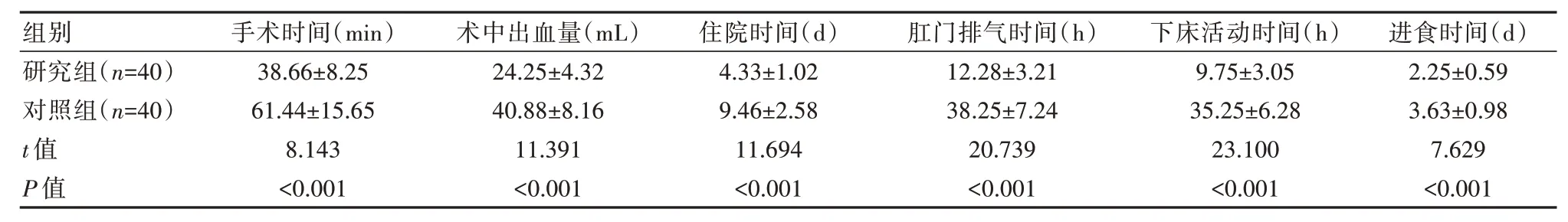
表1 两组患者手术相关指标比较(±s)
组别研究组(n=40)对照组(n=40)t 值P 值手术时间(min)38.66±8.2561.44±15.658.143<0.001术中出血量(mL)24.25±4.3240.88±8.1611.391<0.001住院时间(d)4.33±1.029.46±2.5811.694<0.001肛门排气时间(h)12.28±3.2138.25±7.2420.739<0.001下床活动时间(h)9.75±3.0535.25±6.2823.100<0.001进食时间(d)2.25±0.593.63±0.987.629<0.001
2.2 两组患者免疫应激指标比较
术后3 d,两组各项免疫应激指标均低于术前,但研究组高于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者手术前后免疫应激指标比较[(±s),g/L]

表2 两组患者手术前后免疫应激指标比较[(±s),g/L]
注:与同组术前数据相比,*P<0.05。
组别研究组(n=40)对照组(n=40)t 值P 值免疫球蛋白G术前11.89±1.6912.15±2.030.6220.535术后3 d(10.45±1.54)*(8.87±1.32)*4.926<0.001免疫球蛋白M术前1.82±0.451.89±0.490.6650.507术后3 d(1.35±0.44)*(1.02±0.21)*4.280<0.001前清蛋白术前0.62±0.120.65±0.200.8130.418术后3 d(0.41±0.11)*(0.25±0.08)*7.439<0.001
2.3 两组患者炎症因子指标比较
术前,两组各项炎症因子指标比较,差异无统计学意义(P>0.05);术后3 d,两组各项炎症因子指标均高于术前,但研究组均低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者手术前后炎症因子指标比较(±s)

表3 两组患者手术前后炎症因子指标比较(±s)
注:与同组术前数据相比,*P<0.05。
组别研究组(n=40)对照组(n=40)t 值P 值白细胞介素-6(ng/L)术前40.45±4.2441.03±3.820.6420.522术后3 d(51.01±1.03)*(57.15±1.17)*24.912<0.001 C 反应蛋白(mg/L)术前44.38±2.1644.45±2.340.1390.889术后3 d(55.45±1.34)*(61.03±1.32)*18.762<0.001肿瘤坏死因子-α(ng/L)术前14.19±1.3614.27±1.330.2650.791术后3 d(21.78±1.42)*(26.84±1.55)*15.223<0.001
2.4 两组患者疼痛指标比较
术前,两组患者疼痛指标比较,差异无统计学意义(P>0.05);两组术后不同阶段均低于术前,且研究组低于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组患者手术前后疼痛指标比较[(±s),分]
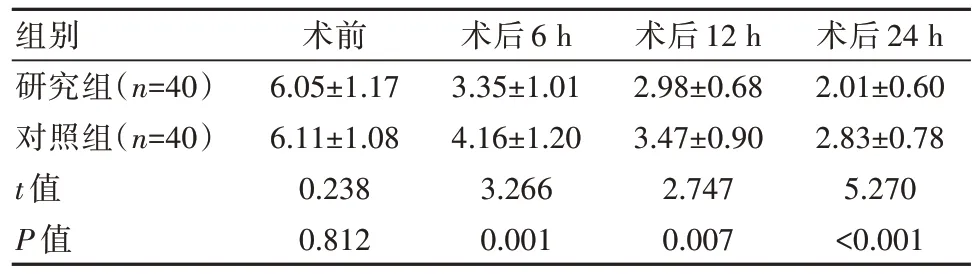
表4 两组患者手术前后疼痛指标比较[(±s),分]
组别研究组(n=40)对照组(n=40)t 值P 值术前6.05±1.176.11±1.080.2380.812术后6 h 3.35±1.014.16±1.203.2660.001术后12 h 2.98±0.683.47±0.902.7470.007术后24 h 2.01±0.602.83±0.785.270<0.001
2.5 两组患者并发症发生率比较
研究组并发症发生率为2.50%,低于对照组的20.00%,差异有统计学意义(P<0.05),见表5。

表5 两组患者并发症发生率比较
3 讨论
急性阑尾炎是一种外科急腹症,在临床上较为常见,胃肠功能障碍引起的内脏神经反射、感染、肠梗阻等都容易导致该疾病的产生。同时,急性阑尾炎也会受到饮食习惯、便秘、家族遗传等因素的影响[4]。该疾病在发病时,经常会表现出阑尾压痛、反跳痛、右下腹痛等临床症状,应当对其采取科学的临床治疗。同时,很多患者还会伴有中性粒细胞增加、阵发性右下腹痛、恶心呕吐等症状,根据疾病严重程度划分,具体可划分为急性单纯性阑尾炎、急性化脓性阑尾炎、阑尾周围脓肿、坏疽和穿孔阑尾炎4种[5]。
一般在对患者实施治疗时,手术是最为常见的方法,大致可分两个类型,即开腹手术、腹腔镜手术[6]。前者在应用的过程中,虽然可以使患者疼痛症状得到缓解,但是往往需要建立较大的手术切口,术后需要经历较长的恢复时间,提升了肠粘连等并发症发生风险[7]。后者属于一种微创手术治疗方法,相比开腹手术,能够在一定程度上缓解患者疼痛症状,从而缩短其康复时间,因此总体效果更为理想[8]。本研究主要是针对两种方法的临床效果展开对照,最终数据结果显示:研究组各项手术指标均优于对照组(P<0.05),这一结果和高海楠[9]在其相关报道中提出的结论一致。分析原因:在应用腹腔镜手术治疗的过程中,通常只是在患者腹部建立3 个穿刺孔,将相关手术器械置入其中展开操作,借助腹腔镜的直接观察,为患者展开阑尾切除术治疗。在手术开展期间,医生能够对阑尾周围渗出液进行直接观察,因此可以尽量减少对其他脏器组织的损伤,这对缩短患者住院时间,提高康复效果具有一定积极意义[10]。本次结果显示,术后3 d,两组各项免疫应激指标均降低,但研究组的降低幅度小于对照组(P<0.05)。根据这一结果可以看出,患者应用腹腔镜手术治疗对其机体产生的应激反应相对更小,也能够看出其具有较好的安全性。治疗后,研究组炎症因子水平低于对照组(P<0.05),其主要是以为腹腔镜手术对患者机体造成的损害相对更小,因此炎症因子指标也会显著降低。本文中,术后各个阶段,研究组术后疼痛评分低于对照组(P<0.05)。分析原因:开腹手术在应用的过程中,不仅需要建立较大的手术切口,同时在逐层切开腹壁时,还会应用到钝性分离的操作,会使患者机体组织受到较大损伤,因此在术后也会有很明显的疼痛感受[11]。而腹腔镜手术治疗所建立的手术切口明显更小,所以其对机体产生的损害相对更小[12]。另外,由于在实施腹腔镜手术治疗之前,需要先建立人工气腹,也会减小对脏器造成的损伤,使患者疼痛症状也会得到更好缓解[13]。另外,研究组并发症发生率为2.50%显著低于对照组的20.00%(P<0.05)。这一结果和纪孝国[14]在其研究中提到腹腔镜组并发症发生率为6.00%低于开放组的18.00%(P<0.05)的结果一致。分析原因:由于腹腔镜手术治疗属于一种微创治疗手段,所构建的切口很小,因此术后护理更加方便,患者康复效果也会提升。因此,对减少并发症的发生率具有一定积极意义[15]。此外,为进一步提升患者术后康复效果,还应当在腹腔镜术后从以下几个方面加以重视:①要密切关注术后切口变化情况。②还需要关注患者排便是否正常。③还要定期关注其生命体征变化,在饮食方面也需要对患者进行科学指导,尽量减少消化系统负担,从而提高机体恢复速度。
综上所述,在对急性阑尾炎患者实施临床治疗时,通过采取腹腔镜手术的方式可以产生更为理想的治疗效果,无论是从手术指标方面,还是在免疫应激指标方面,其结果均较开腹手术更优。同时,腹腔镜手术治疗方法在调节炎症因子指标、缓解疼痛、降低并发症发生率等诸多方面都有更多优势。

