高糖环境下miR-96-5p对人角质形成细胞的影响及相关机制研究
朱艳 江芳芳 熊累累 盛霞 秦淑兰 宗明
糖尿病是临床常见基础疾病,好发于老年群体[1]。流行病学研究显示,我国老龄化进程加快,60岁以上人口总数已超过2.2亿,其中合并糖尿病总数超过1亿人[2]。持续的高糖环境可诱发多种并发症,其中糖尿病足是糖尿病常见且严重的并发症[3]。糖尿病足合并的慢性难愈创面可对患者日常生活质量产生严重负面影响,严重者可危及生命[4]。血管生成受损、慢性炎症、缝隙连接异常和受损的角质细胞迁移和增殖是导致糖尿病病足创面难愈的主要原因,其中角质细胞的功能紊乱是导致糖尿病创面愈合不良的核心靶点[5]。前期实验发现,miR-96-5p的差异化表达与糖尿病足病情发展密切相关,然而miR-96-5p的具体作用机制仍未完全明确。基于此背景,本次研究以期采用人角质形成细胞构建体外模型并采用高糖培养基处理以模拟糖尿病病理环境,旨在深入阐明miR-96-5p的差异化表达对人角质形成细胞增殖、侵袭、迁移等机制的影响,为后续临床靶向治疗提供思路。
1 材料与方法
1.1 实验材料
1.1.1 人角质形成细胞(human keratinocytes, hKCs)的分离、培养及高糖处理:①人角质形成细胞分离、培养 取正常人群经环状切除术后的包皮皮肤,将组织置入75%的乙醇中消毒,角度完成后采用PBS进行冲洗,随后将结缔组织、血管和皮下脂肪组织剔除,将处理后的组织处理成1 cm×1 cm块并置入3.3 mg/ml dispase Ⅱ中进行消化,消化维持14 h,环境温度保持于4℃。次日取消化完成组织将真皮层和表皮层分娩,并将表皮置入离心管中进行离心,离心完成后再次消化15 min。随后再次进行离心(5 min,1 500 r/min),并在离心完成后进行震荡,并过滤吸取细胞悬液,移液至0.1% Ⅰ型牛胶原的培养皿中,将培养皿中细胞调整至3×106个。标准环境下再次进行培养,环境为5% CO2,37℃。次日待细胞生长融合至80%时终止消化并离心采集细胞,并继续进行传代操作。②高糖损伤细胞模型构建:以50 mmol/L葡萄糖终浓度模拟高糖环境,并设置12.5 mmol/L葡萄糖浓度的作为正常对照。培养72 h后进行后续实验。
1.1.2 主要试剂及仪器:CELLnTEC表皮细胞培养基:北京百奥创新科技有限公司;MesenCult-XF Medium无血清培养基:上海抚生实业有限公司;TrypLE Express消化酶、DNase I酶、Annexin V/FITC凋亡检测试剂盒:上海赛培森生物科有限公司;Ⅱ型dispease酶:上海华蓝化学科技有限公司;CCK-8试剂:上海炎熙生物科技有限公司;倒置荧光显微镜:上海木森生物科技有限公司;CO2培养箱:北京赛瑞福科技有限公司;酶标仪:山东善达仪器有限公司。
1.1.3 分组:取对数生长期的细胞,以1×104/孔的密度接种于96孔培养板中,待细胞贴壁生长后进行分组。共5组,其中2组分别为高糖培养组+ miR-96-5p minic、高糖培养组+ miR-96-5p minic 2组。高糖培养均为培养基葡萄糖浓度为50 mmol/L,且经lipo3 000转染试剂要求分组处理细胞。并设立空白对照组(培养基葡萄糖浓度5.5 mmol/L),正常培养组(培养基葡萄糖浓度12.5 mmol/L)及高糖培养组(培养基葡萄糖浓度50 mmol/L)作为对照。每组实验设置4个复孔。
1.2 方法
1.2.1 细胞形态检查:倒置显微镜下观察细胞形态。
1.2.2 细胞划痕实验:培养板背面画横线标记,用移液枪将细胞吸取后铺满整个底板,并采用10 μl枪头垂直于孔板制作划痕,划痕的刻画尽可能保持宽度一致。随后将细胞培养液吸弃,并采用PBS进行冲洗,冲洗操作重复3次。并加入无血清培养基后每12小时拍照记录,参考并计算划痕面积。
1.2.3 处理后24、48、72 h时使用CCK-8法检测细胞增殖活力:采用TrypLE Express消化处理对数生长期细胞,并置入计数板上计数,并按照每100 μL中3 000个细胞的参数将细胞移至96孔板中,并在标准条件下培养2 h,待细胞贴壁后取细胞加入10 μL CCK-8溶液并再次置入标准培养箱中培养4 h,采用酶标仪检测450 nm波长处OD值,上述实验均重复3次,结果取平均值。
1.2.4 细胞迁移能力:Transwell小室铺胶,待细胞转染24 h后在Transwell小室的下室和上室中加入750 μl的培养基(20%胎牛血清)和200 μl细胞悬液,并在标准培养箱中培养48 h,培养箱环境同上,培养操作完成后用棉签小心擦掉上室的基质胶和细胞,并采用PBS进行冲洗,PBS冲洗操作反复进行3次。随后对细胞进行染色(0.1%结晶紫)和固定(4%多聚甲醛),并拍照采集细胞迁移细胞数。
1.2.5 Western blot检测BNIP3、FAK、FAK磷酸化蛋白(p-F AK)蛋白的表达水平:首先提取细胞中总蛋白(提取液配置:V组织裂解液∶V蛋白酶抑制剂=100∶1),随后采用BCA法进行蛋白定量,并进行浓缩胶和分离胶的配置,配置操作完成后进行凝胶电泳(每孔滴入40 μg蛋白),电泳操作完成后湿转到PVDF膜上,并进行封闭2 h(环境为:5%脱脂奶粉),随后置于4℃冰箱孵育过夜。次日采用5%脱脂奶粉对一抗与二抗原液进行稀释(V一抗原液:VTBST溶液=1∶1 000)。取出样本后进行1 h复温,并采用TBST进行洗涤,10 min/次,共洗3次。再次在室温下进行1 h孵育,并再次进行洗涤,15 min/次,共3次。随后采用ECL化学发光法显色,并分析条带灰度值(软件为:Image J),计算BNIP3、FAK、p-F AK蛋白的相对表达水平。
2 结果
2.1 细胞形态检查 50 mmol/L高糖处理后角质细胞的形态变化,24 h后可见细胞折光性降低,同时出现空洞,72 h后细胞失去贴壁性,并出现褶皱。见图1。
图1 细胞形态检查;A 50mmol/L处理24 h;B 50mmol/L处理72 h
2.2 细胞划痕实验结果分析 与空白组和正常培养组比较,高糖培养组、高糖培养+ miR-96-5p minic组和高糖培养+ miR-96-5p inhibitor组的各时间点细胞迁移量明显更低(P<0.05),且高糖培养+ miR-96-5p inhibitor组细胞迁移量明显高于高糖培养组和高糖培养+ miR-96-5p minic组(P<0.05)。见表1。
表1 细胞划痕实验结果分析 ×107,
2.3 细胞增殖实验结果分析 与空白组和正常培养组比较,高糖培养组、高糖培养组+ miR-96-5p minic和高糖培养组+ miR-96-5p inhibitor的各时间点细胞增殖量明显更低(P<0.05),且高糖培养组+ miR-96-5p inhibitor细胞增殖明显高于高糖培养组和高糖培养组+ miR-96-5p minic(P<0.05)。见表2。
表2 细胞增殖实验结果分析 ×105,
2.4 细胞侵袭实验结果分析 与空白组和正常培养组比较,高糖培养组、高糖培养组+ miR-96-5p minic和高糖培养组+ miR-96-5p inhibitor的各时间点细胞侵袭量明显更低(P<0.05),且高糖培养组+ miR-96-5p inhibitor细胞侵袭明显高于高糖培养组和高糖培养组+ miR-96-5p minic(P<0.05)。见表3。
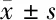
表3 细胞侵袭实验结果分析 ×105,
2.5 BNIP3、FAK、p-F AK蛋白表达结果分析 与空白组和正常培养组比较,高糖培养组、高糖培养组+ miR-96-5p minic和高糖培养组+ miR-96-5p inhibitor的各时间点BNIP3、FAK、p-F AK蛋白表达量明显更低(P<0.05),且高糖培养组+ miR-96-5p inhibitor的BNIP3、FAK、p-F AK蛋白表达量明显高于高糖培养组和高糖培养组+ miR-96-5p minic,差异均有统计学意义(P<0.05)。见表4。
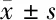
表4 BNIP3、FAK、p-F AK蛋白表达结果分析
3 讨论
创面愈合需要多个生物学进展配合,如炎症、重塑、收缩、再上皮化和凝血等,其中再上皮化是影响创面愈合的重要环节[6]。再上皮化的核心靶点是角化细胞的迁移和增殖,是促进糖尿病病足创面愈合的核心靶点。本次研究结果显示,角质细胞经高糖处理后出现折光性降低,胞体变大,细胞胞体中出现空洞的表现,提示高糖环境可破坏角质细胞功能,表明改善高糖环境下角质细胞功能可能为糖尿病足的创面愈合提供新靶点。
近来,microRNAs(MiRNAs)已逐渐成为多种疾病研究中的核心靶点,如在恶性肿瘤、心脑血管疾病、神经系统疾病的调控中发挥着尤为重要的作用[7]。miRNAs是一种非编码的小RNA,由大约22个核苷酸组成,通过靶向3’-非翻译区(UTR)调节基因表达[8]。新近研究证实,miRNAs在创面愈合的调控机制中扮演着重要角色,其中有研究证实,miRNA可通过影响角质细胞功能从而影响创面愈合[9]。miR-96-5p是miRNAs家族中的一员,被证实与创面愈合相关。Zhu等[10]研究证实,miR-96-5p的表达抑制有助于促进伤口愈合。角质细胞的迁移、增殖和侵袭能力降低是影响创面愈合的核心靶点。本次研究结果显示,靶向下调miR-96-5p的表达可改善因高糖引起的角质细胞迁移能力、增殖能力和侵袭能力降低,提示miR-96-5p可作为调节角质细胞迁移能力的新靶点。Bcl-2/adenovirus E1B19-kDa interacting protein (BNIP3)是调控机体细胞功能的重要因子[11]。既往研究证实,BNIP3可通过调控相关信号通路的表达从而促进心脏疾病、肝脏损伤和恶性肿瘤病情发生发展[12]。近来研究发现,低氧环境角质细胞中BNIP3的表达上调有利于促进角质细胞的迁移和侵袭能力增强,从而加强伤口愈合[13]。FAK是一种相对分子质量为125 kD的酪氨酸激酶,在细胞通讯尤其是细胞信号系统中起着至关重要的作用[14]。既往研究证实,FAK在多种恶性肿瘤细胞的侵袭、迁移和增殖过程中发挥着重要作用[15]。Wang等[16]研究显示,FAK是一种非受体酪氨酸激酶,FAK的表达可有效促进胃肠道肠道黏膜愈合。Wang等[17]研究显示,胃肠道黏膜愈合需要上皮片迁移,激活FAK的表达可有效加速黏膜伤口愈合。Wang等[18]研究显示,靶向激活FAK的表达可有效促进伤口愈合。本次研究结果显示,高糖处理后BNIP3、FAK、p-FAK蛋白的表达被抑制,靶向下调miR-96-5p的表达后BNIP3、FAK、p-FAK蛋白的表达水平升高,提示miR-96-5p对角质细胞增殖、侵袭和迁移的影响可能通过靶向调控BNIP3、FAK、p-FAK的表达实现。考虑高糖环境下角质细胞的增殖、侵袭和迁移能力受到负面影响并影响糖尿病病足的创面愈合,靶向下调miR-96-5p的表达可激活BNIP3/FAK信号通路的表达,BNIP3/FAK信号通路的表达上调可促进角质细胞的增殖、迁移和侵袭能力,提示临床可针对角质细胞功能调控的上游靶点开发靶向干预措施从而为糖尿病足患者的临床治疗提供新思路。
综上所述,miR-96-5p可通过靶向调控BNIP3/FAK信号通路的表达从而影响角质细胞的增殖、侵袭和迁移能力,进而发挥影响糖尿病足创面愈合的作用。然后本次实验仍存在不足,即本次实验未进一步构建糖尿病活体模型以进一步验证miR-96-5p靶向调控BNIP3/FAK信号通路后对糖尿病足创面的愈合能力改变情况,故今后仍需进一步开展相关实验予以验证。

