超声造影和超声弹性成像对不可触及BI-RADS 4类乳腺肿块的附加诊断价值研究
赵 磊,李 凡,杜联芳,贾 超,李 刚,蔡应娱,牛庆华
上海交通大学医学院附属第一人民医院超声科,上海 201620
世界卫生组织2022年研究数据[1]显示,乳腺癌已成为全球女性发病率第一位的恶性肿瘤。乳腺癌的早期诊治直接关系患者的预后和生存率。超声是乳腺癌早期筛查的重要影像学手段,其优势是图像分辨率高、操作便捷、无放射性、对肿块型病变检出敏感及不受乳腺质地的影响,特别适用于亚洲女性致密型乳腺[2]。但超声检查的缺陷是对操作者依赖性高,不同年资或经验的医师对图像的获取和识别有所差异,诊断一致率不高。2013年,美国放射学会(American College of Radiology,ACR)发布了第5版乳腺影像报告和数据系统(Breast Imaging Report and Data System,BI-RADS),其中对乳腺病变的超声征象进行了细节性描述和定义,并给出相应诊断分级和临床决策的指导建议,目前广泛应用于临床。其中BI-RADS 4类病变恶性风险存在较大跨度(2%~95%),对其亚分类的判定直接关系到患者后续的诊治方案。但研究[3]显示,对于小体积不可触及的乳腺病变,BI-RADS 4类的亚分类效能不高。
随着超声造影(contrast enhanced ultrasound,CEUS)和超声弹性成像(elastography,ES)技术的快速发展,这两种技术目前已成为临床上乳腺常规超声检查的良好补充。前者对微血管显示极为敏感,可敏感捕捉肿瘤内新生血管状况[4-5];后者以组织弹性系数变化为基础进行成像,根据脉冲发射方式不同分为应变式弹性成像与剪切波弹性成像(shear wave elasticity,SWE)技术,可反映由钙化、纤维或胶原成分增加而导致的硬度增高。既往研究[6-7]表明,CEUS和ES分别或联合应用可提高BI-RADS 4类病变的诊断效能,减少不必要的穿刺活检,但对于不可触及病变的研究尚少[8],亦少见对于其亚分类的研究。本研究拟探索CEUS和ES对不可触及的BI-RADS 4类中各亚分类乳腺病变的附加诊断效能。
1 资料和方法
1.1 资料
回顾并分析2019年1月—2022年9月因乳腺肿块入院患者的临床和影像学资料。纳入标准:① 患者因体检筛查发现乳腺肿块,临床不可触及;② 患者具有常规超声、SWE和CEUS检查的图像,图像完善且质量好;③ 常规超声由高年资超声科医师按照第5版BI-RADS标准诊断为BIRADS 4类的病变,并给予亚分类;④ 超声检查前未行肿块穿刺活检或放化疗;⑤ 有术后病理学检查结果;⑥ 超声检查资料和手术时间间隔不超过1个月;⑦ 多发病灶患者,行时钟法定位标记,超声标记肿块需与手术记录及术后病理学检查结果符合。不符合以上条件的则排除。
1.2 仪器与方法
采用日本Canon公司的Aplio 500及Aplio i900彩色多普勒诊断仪,14-5L及14-8L探头频率分别为5~14及8~14 MHz。超声以肿块纵切面和横切面存贮动态和静态图像,以能充分显示病变中央及边缘征象为宜;彩色多普勒血流成像(color Doppler flow imaging,CDFI)图像以尽可能显示低速血流并减少噪声溢出为宜,充分显示病灶内及边缘血流信号。
超声采集图像后开启SWE行规范化检查。选择病灶最大径线切面固定探头,采用双幅模式对病变进行准确定位,深度设置为4 cm以内,彩阶范围为0~55 kPa。将超声探头轻置于乳房表面,避免对皮肤施压,保证病变及其周围正常乳腺组织都在取样框内,病变位于屏幕中央,连续采集3~5 s,待彩色完全充填后冻结图像并储存,重复操作3次。
SWE检查结束行CEUS检查。选择病灶最大径线切面固定探头,采用双幅模式对病变进行定位。机械指数(mechanical index,MI)为0.07,启用Qscan一键优化,造影剂为意大利Bracco公司生产的声诺维(SonoVue),按厂家推荐方式配制,肘静脉团注4.8 mL,尾推5 mL生理盐水冲管,造影剂推注时开始录像,持续观察1 min,冻结并存贮图像,以DICOM格式存贮。以上操作由1名具有18年超声诊断经验的医师完成。
1.3 图像分析
由1名高年资超声科医师对常规超声和SWE图像进行读图分析。常规超声图像按BI-RADS标准进行读图并给予4a、4b及4c亚分类诊断。SWE图像上,分析指标包括颜色构成(蓝色为主、绿色为主及橙色/红色为主)、分布均匀性(均匀、欠均匀及不均匀)[9]、肿块边缘是否有硬环征[10],以及按照颜色分布特征进行4分法评分[1分为病灶边缘或病灶内部没有观察到与病灶周围颜色存在差异(均为蓝色),2分为病变边缘或内部观察到与病变周围颜色不同的颜色,但其延伸超出病变,并在皮肤侧或胸壁侧垂直延伸,3分为病变边缘出现局部彩色区域,4分为病变边缘及内部均有彩色区域[11]]。将彩色完全充填后的冻结图像进行测量,将直径2~3 mm的感兴趣区放置于病变最硬处及同深度周围正常乳腺组织或脂肪组织自动获得最大弹性值(Emax)和弹性比值(Eratio),测量3次后取平均值。
由1名高年资及1名低年资超声科医师对CEUS图像进行图像分析,并作观察者间一致性分析。在CEUS动态图像上,将肿块与周围乳腺组织进行对比并评价:① 肿块开始增强时间,早于、同于或晚于周围乳腺组织;② 肿块内造影剂增强顺序,向心性或非向心性;③ 肿块达峰增强程度,与周围正常乳腺组织相比呈高增强,或等/低增强;④ 在静脉期肿块是否存在造影剂滞留现象,即注射造影剂40 s后肿块增强程度明显高于周围乳腺组织;⑤ 肿块增强后边界,包括清晰或不清晰(>50%的病变边界不清晰);⑥ 增强形状,包括规则或不规则(大于3个大分叶、微分叶、成角或毛刺);⑦ 增强后范围是否增大,以横径大于3 mm为界进行判定;⑧ 肿块边缘是否有穿支样滋养血管;⑨ 肿块内造影剂分布均匀或不均匀;⑩ 肿块内造影剂灌注缺损区存在或不存在。当肿块动脉期增强程度高于或同于周围乳腺组织时,采用机器自带的造影剂到达时间成像(arrival-time parametric imaging,At-PI)模式对以上⑤~⑩指标进行分析[12],At-PI模式能够增强征象辨识度,其原理是以不同的颜色表示不同微泡到达时间,彩色编码阶梯为红橙黄绿蓝紫,红色代表早到达,紫色代表最晚到达,图像叠加时间为12 s。
1.4 统计学处理
采用SPSS 26.0及Medcalc 12.7软件进行数据分析。年龄及病灶最大径符合正态分布的计量资料以±s表示,组间比较采用独立样本t检验。弹性定量数值不符合正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-Whitney U检验。计数资料以n(%)表示,组间比较采用χ2检验。采用多因素logistic回归分析对差异有统计学意义的单因素变量进一步分析,P<0.05为差异有统计学意义,计算比值比(odds ratio,OR)和95% CI。对照病理学检查结果绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under curve,AUC)。不同模态间显著性检验采用DeLong检验。At-PI观察者间一致性采用Kappa检验,当Kappa系数为0.80~1.00说明一致性程度很强。
2 结 果
2.1 患者临床资料及超声评估结果
患者纳入流程见图1,最终101例患者(共101个肿块)纳入本研究。所有患者均为女性,年龄25~82岁,平均年龄(47.67±13.53)岁。经术后病理学检查证实为恶性病变42个,其中浸润性导管癌20个,导管原位癌16个,实性乳头状癌4个,黏液癌1个,大汗腺癌1个;良性病变59个,其中纤维腺瘤24个,腺病18个,导管内乳头状瘤13个,管状腺瘤2个,炎性病变2个。病变最大径5.5~13.0 mm,平均(8.17±1.95)mm,病变大小在良恶性组间差异无统计学意义(表1)。恶性病变患者年龄高于良性病变患者,且良性病变患者多为未绝经状态(P<0.05)。
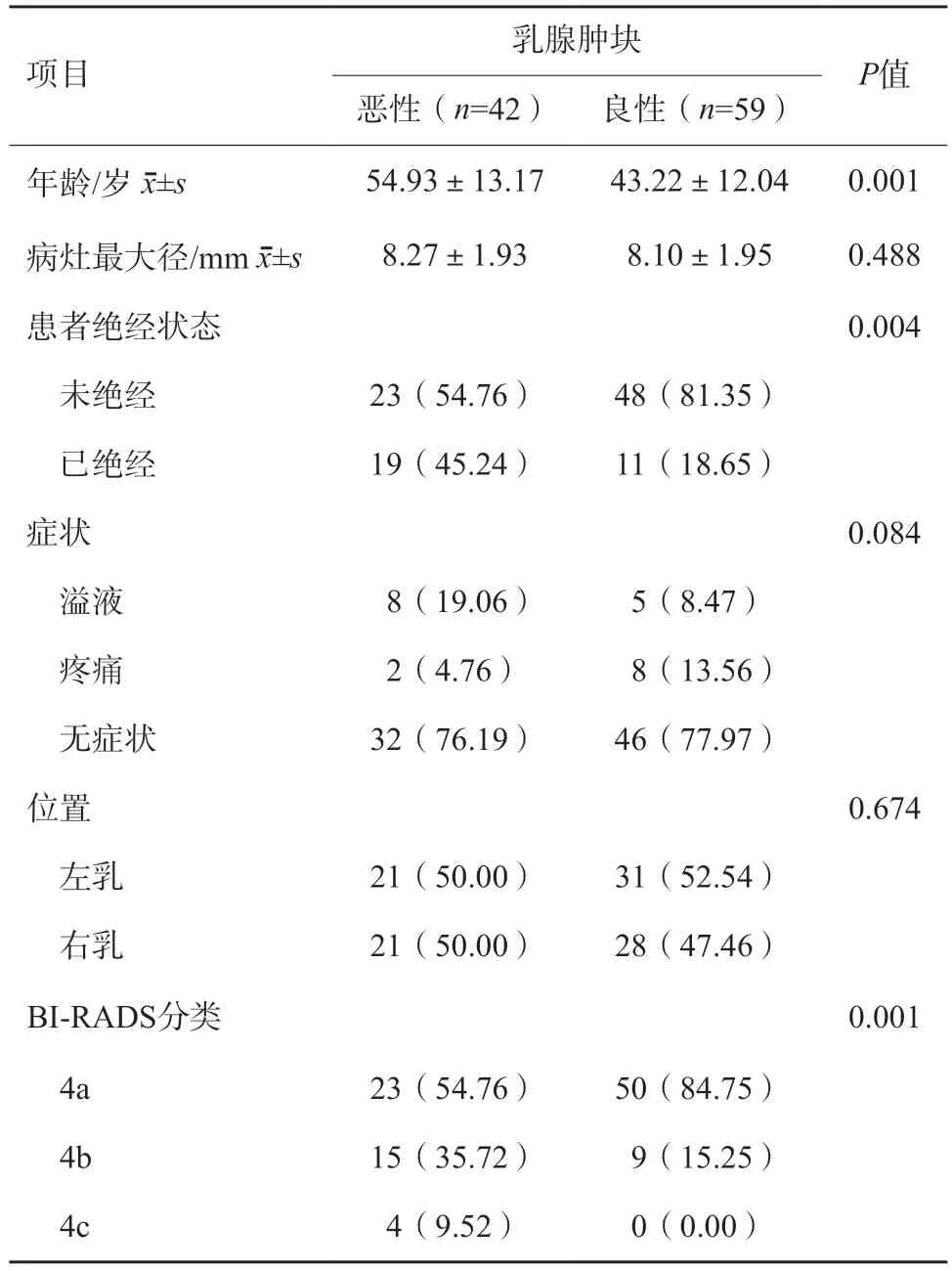
表1 BI-RADS 4类不可触及乳腺肿块的临床及病理学资料n(%)
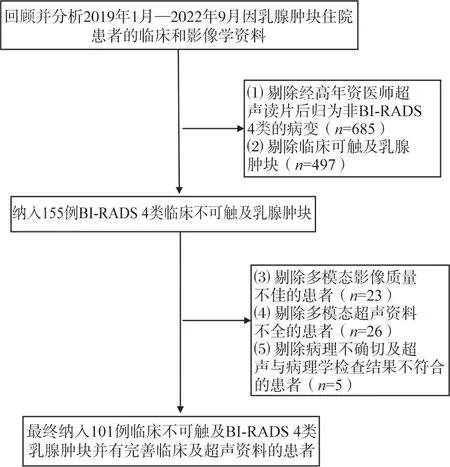
图1 研究对象纳入及排除流程图
2.2 BI-RADS 4类不可触及乳腺肿块的SWE表现
如表2所示,SWE征象中除“硬环征”外,其他征象在良恶性组间差异均有统计学意义(P<0.05)。以At-PI模式读图,观察者间一致性强相关(表3)。多因素logistic逐步回归分析结果表明,SWE对预测此类恶性病变的有效指标为颜色欠/不均匀及Emax≥20.45 kPa,其OR分别为3.423及1.036;CEUS对应的有效指标为增强后形态不规则、造影剂有灌注缺损及静脉期造影剂滞留现象,OR分别为25.383、22.976及17.113(表4)。

表2 BI-RADS 4类不可触及乳腺肿块的SWE表现n(%)
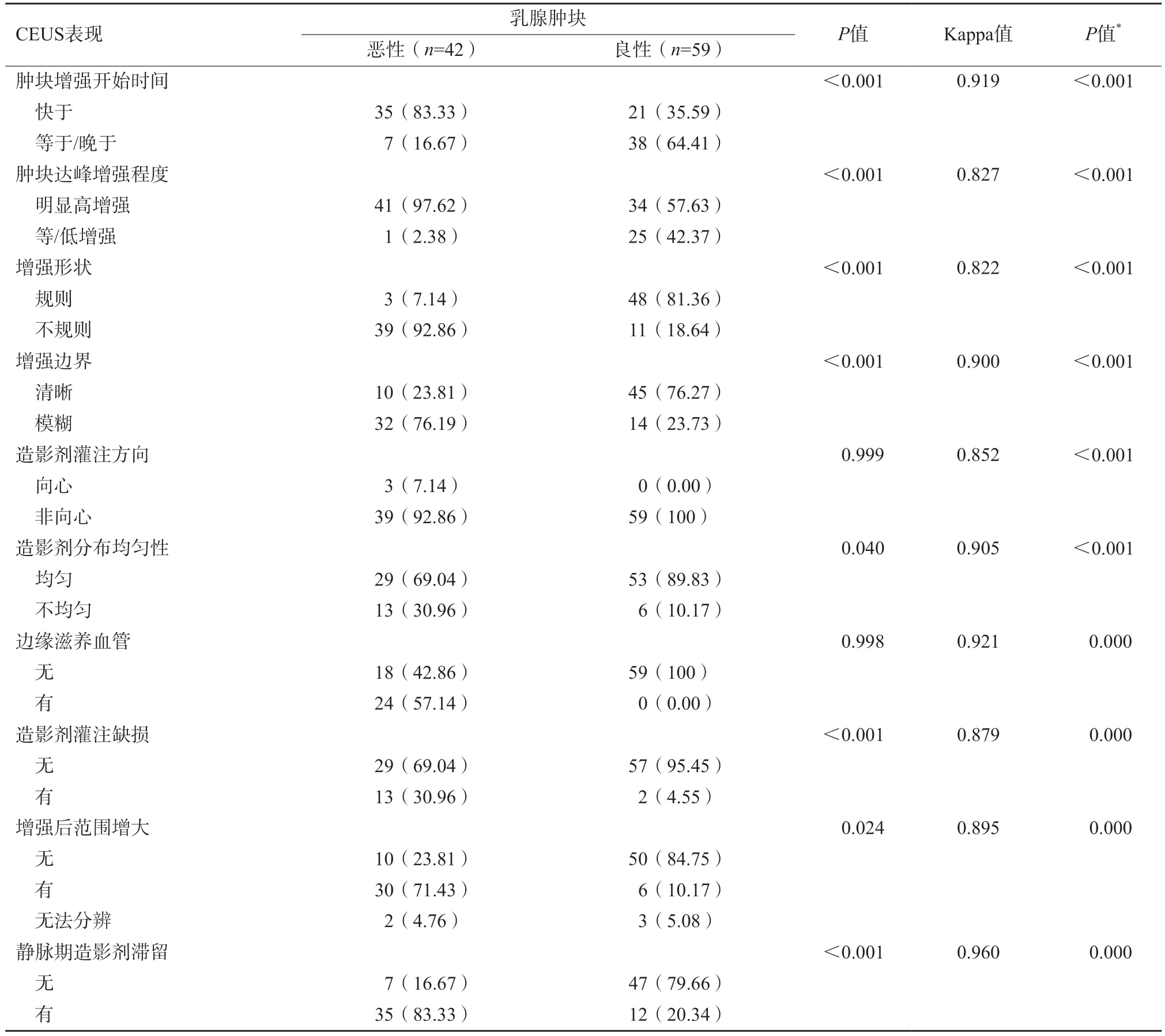
表3 BI-RADS 4类不可触及乳腺肿块的CEUS表现n(%)
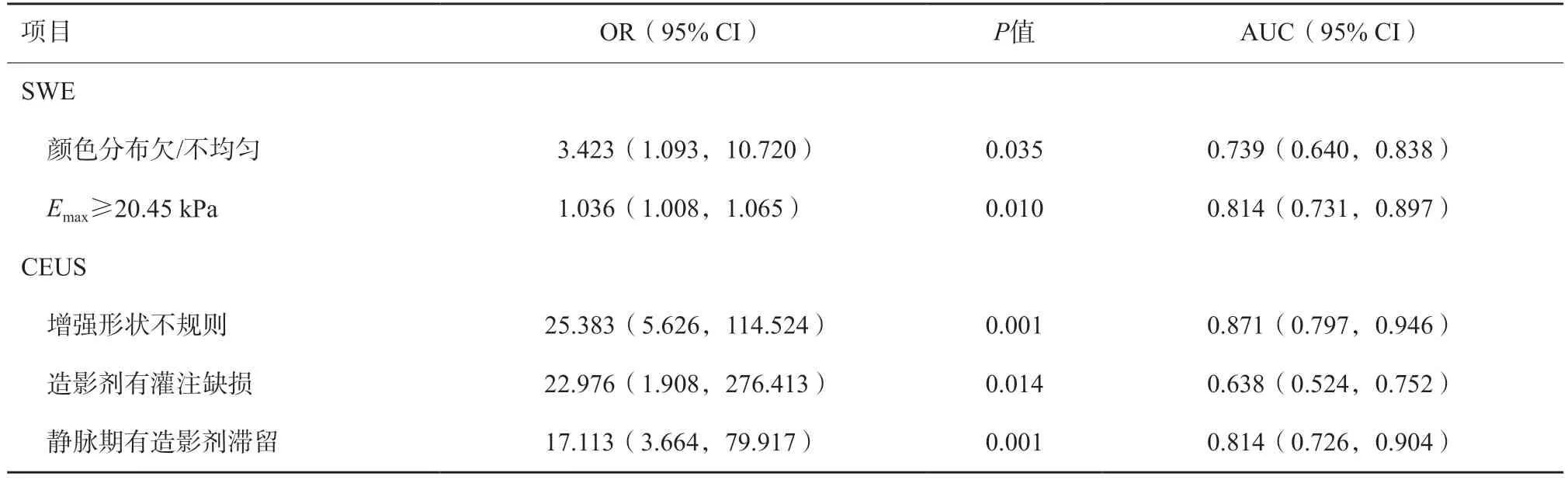
表4 SWE及CEUS成像多因素logistic回归分析结果M(P25,P75)
2.3 CEUS及SWE对不可触及BI-RADS 4类乳腺肿块的附加诊断效能
按照BI-RADS标准,常规超声对BI-RADS 4类及亚分类的不可触及病变的诊断灵敏度、特异度、准确度、阳性预测值(positive predictive value,PPV)及阴性预测值(negative predictive value,NPV)见表5。经多因素logistic逐步回归分析得出独立预测因素后,统计分析常规超声分别联合SWE及CEUS的诊断效能,结果显示,常规超声+SWE及常规超声+CEUS较单独常规超声均能显著提升其诊断效能(P<0.05),AUC分别为0.825、0.961及0.675,且常规超声+CEUS效能高于常规超声+SWE(P=0.0014,图2)。进一步分析4类亚类,其中对4a类效能提升更为显著(P<0.05,图3);对4b类,3种模态诊断效能差异无统计学意义。
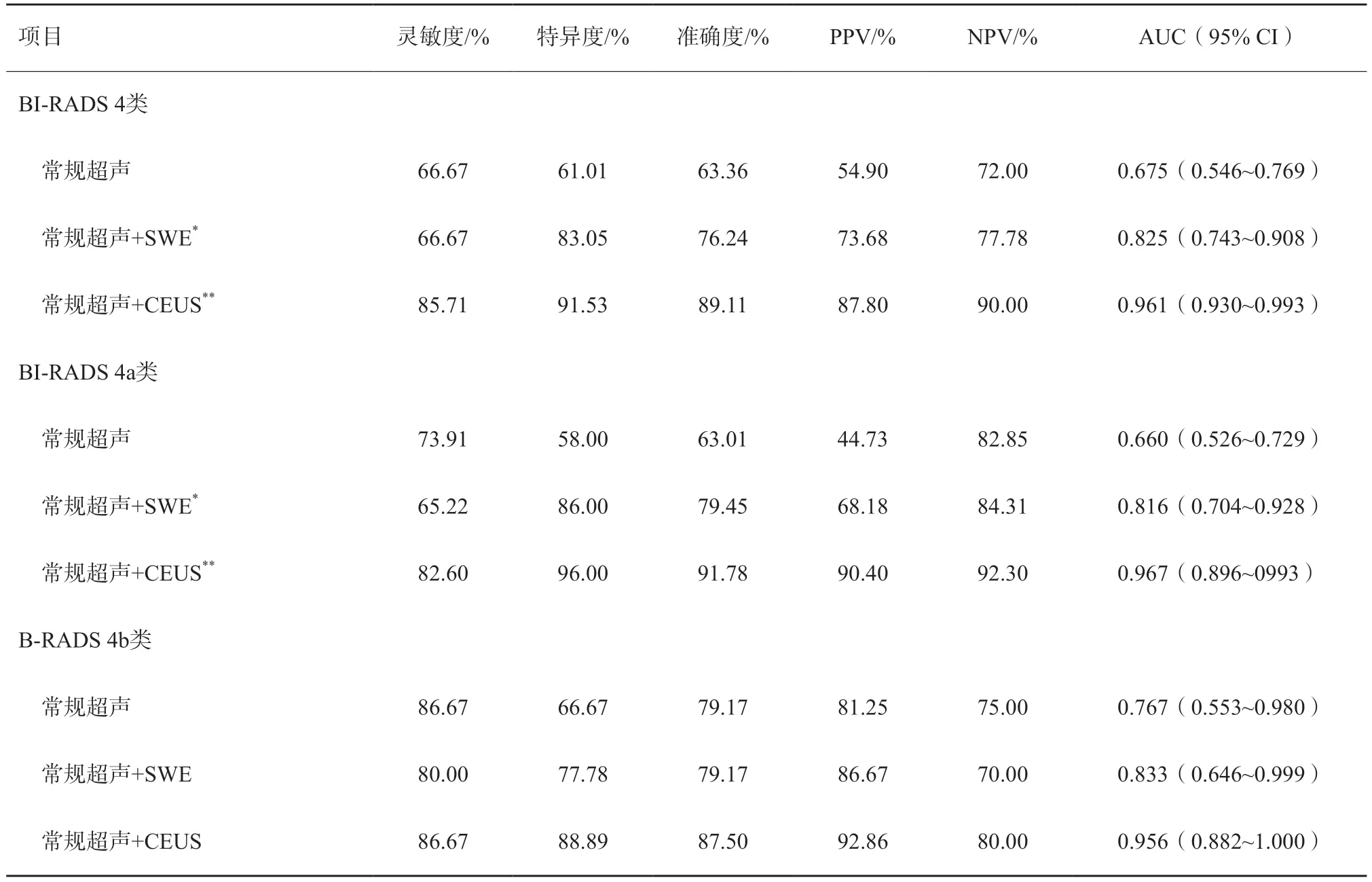
表5 不同模态超声对BI-RADS4类不可触及乳腺病变亚分类的诊断效能
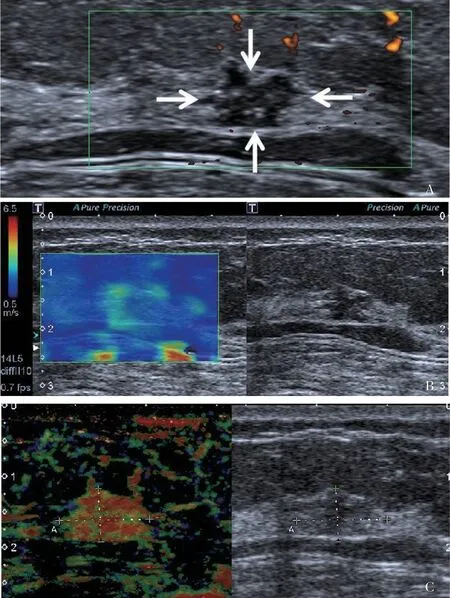
图2 典型病例1(患者,女性,58岁,恶性不可触及乳腺肿块)的多模态超声表现
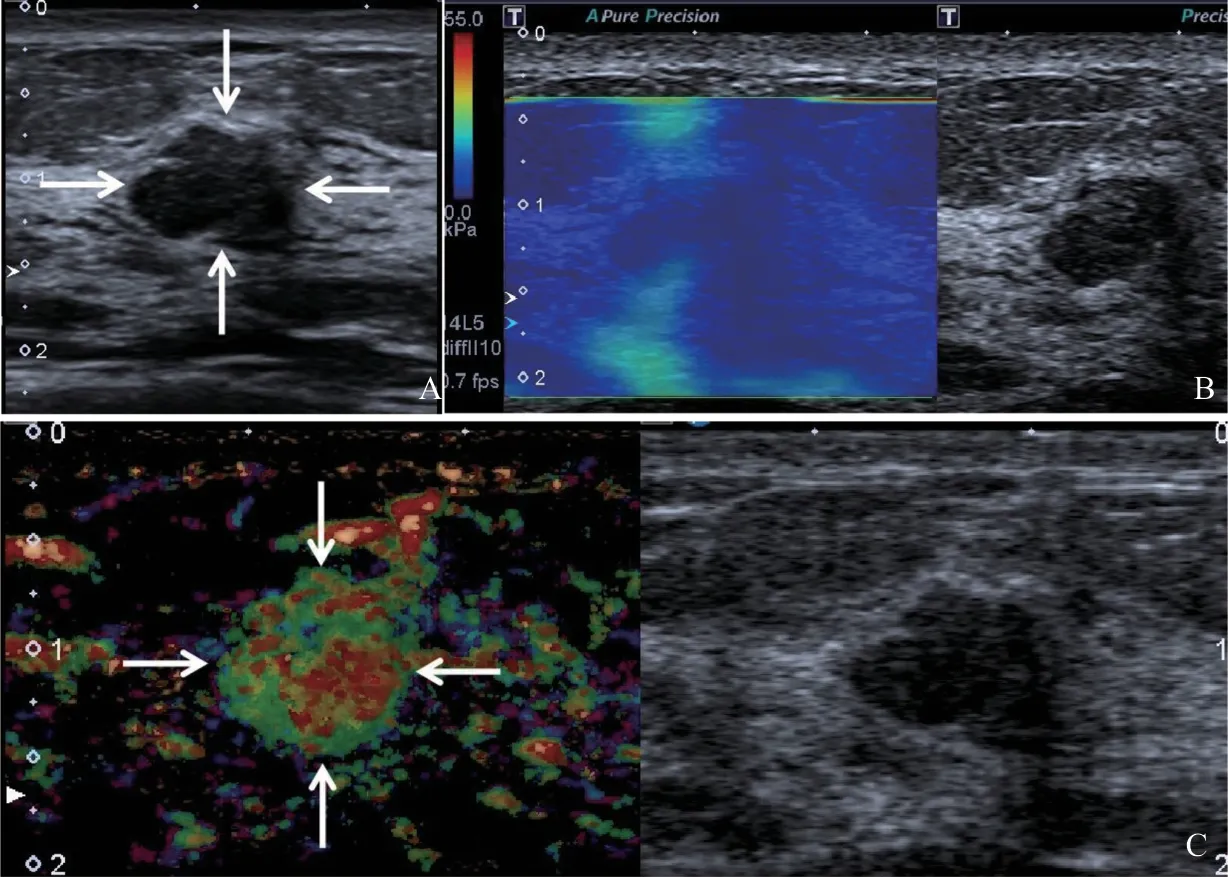
图3 典型病例2(患者,女性,31岁,良性不可触及乳腺肿块)的多模态超声表现
3 讨 论
第5版BI-RADS细化了乳腺病变声像图征象并提出BI-RADS分类标准,其中BI-RAD 4类又细分为3个亚类,其中4a类、4b类及4c类分别指的是恶性风险度2%~10%、10%~50%及50%~95%,此类病变建议进一步检查和/或穿刺活检,为临床决策提供指导。一项多中心研究[13]显示,超声科医师应用此系统能对BI-RADS 4类病变进行适当亚类评估,证实其临床有效性。但需注意,4a类病变恶性风险度较低,如能通过进一步检查来鉴别诊断,可避免不必要的穿刺活检;对于4b类病变,在病灶较小的情况下,如证实为恶性,可直接定位手术切除而无需行穿刺活检。本研究纳入了101例不可触及BI-RADS 4类乳腺病变,其最大径为5.5~13.0 mm,结果显示,常规超声诊断灵敏度、特异度及准确度分别为66.67%、61.01%及63.36%;其中,对4a类的PPV(44.73%)明显高于其推荐风险分级。常规超声将一些良性病变归类为BI-RADS 4a类的可能原因是小体积的纤维腺瘤虽为平行位,但周围伴发腺病组织时其边缘模糊,提升诊断分级;导管内瘤不伴发显著导管扩张时肿块在常规超声上可呈微分叶形态,致使诊断升级;良性增生性病变亦可在常规超声上形成占位效应,且边缘模糊。因此,ACR BI-RADS分类对不可触及的较小的病变诊断存在一定局限性,可能会高估4a类病变,对此类病变亟需有效的鉴别诊断手段。
ES已被世界医学生物学超声联合会推荐为鉴别乳腺良恶性肿块的有效手段,其操作简便无创[14]。相较于应变式弹性成像,SWE可给出定量数据、对操作者依赖性低且数据较为稳定。目前尚未见利用SWE对不可触及乳腺病变的诊断价值研究。本研究发现,对于不可触及的较小乳腺肿块,利用SWE技术较常规超声能提高其诊断效能(AUC:0.825 vs 0. 675),诊断指标为颜色分布欠/不均匀和Emax≥20.45 kPa。本研究中Emax诊断阈值低于既往研究[15-16],考虑纳入的均为体积较小的不可触及的病变,且患者中38.10%(16/42)为导管原位癌,此类病变硬度值明显低于浸润性乳腺癌[15,17]。
CEUS可敏感显示乳腺肿瘤新生血管,但其对乳腺肿瘤的良恶性鉴别诊断效能尚存争议[18]。这是由于乳腺良恶性病变均可在CEUS呈高增强,且不同研究纳入患者病灶类型不同或大小有异。单一CEUS指标已被证实无法有效地鉴别良恶性乳腺肿块,需结合多个指标,这就需要对CEUS图像征象进行详细和明确的识别。为了确保CEUS图像的观察者间一致性,本研究以At-PI模式进行读图。既往研究[19]表明,At-PI模式能提升CEUS征象的辨识度;本研究结果显示,高年资医师及低年资医师在At-PI模式下观察者间一致性较好(0.824~0.921)。CEUS上增强形态不规则、造影剂灌注缺损及静脉期造影剂滞留为独立预测因素,以此建立回归预测模型的诊断效能较常规超声及SWE得到显著提升。本研究纳入了20例浸润癌及16例导管原位癌,虽然病变小,但仍出现增强形状不规则、造影剂灌注缺损、静脉期造影剂滞留的特异性征象,而腺病多表现为动脉期等低增强;纤维腺瘤及导管内瘤虽为动脉期高增强,但多为增强形态规则,边界清晰,增强均匀,无范围增大且无穿支滋养血管。基于CEUS对血流灌注极为敏感,利用CEUS较SWE能进一步提升对不可触及BI-RADS 4类尤其是4a类病变的诊断效能。
本研究存在以下的局限性。首先,本研究为单中心回顾性研究,因此样本量较小,有待于后续进行多中心及前瞻性研究来弥补不足;其次,由于CEUS定量指标诊断效能不及定性指标[5],本研究未纳入相应数据。
综上所述,CEUS和SWE有助于提高BIRADS 4类不可触及乳腺病变的鉴别诊断效能,其中对4a类有显著的提升作用,CEUS较SWE进一步提升对此类病变准确度,从而给予临床更加合理的处理建议。

