磁共振IDEAL-IQ和体素内不相干运动预测子宫内膜癌细胞增殖状态
周凤梅,任继鹏,翟战胜,段金辉,刘旺毅,殷慧佳
新乡医学院第一附属医院磁共振科,河南 新乡 453100
2020年全球新增子宫内膜癌(endometrial carcinoma,EC)患者41.7万例,高居女性生殖系统恶性肿瘤第二位[1]。Ki-67增殖指数反映肿瘤细胞的增殖状态,在EC患者中,较高的Ki-67增殖指数往往意味着肿瘤细胞增殖旺盛,侵袭性较强且预后较差[2-3]。多点非对称回波采集与迭代最小二乘法水脂分离(iterative decomposition of water and fat with echo asymmetry and the least squares estimation quantification sequence,IDEAL-IQ)和体素内不相干运动(intravoxel incoherent motion,IVIM)均属于定量磁共振成像(magnetic resonance imaging,MRI)技术。其中,前者可以实现对生物组织T2弛豫情况及脂肪水平的无创评估[4],后者则可反映生物组织内的弥散、灌注情况[5-6]。目前,已有多项研究证实了IDEAL-IQ和IVIM在脊柱[7]、肝脏[8]和肾脏[9]等疾病评估中的价值,同时亦有部分研究[10-11]将两者用于EC的诊断与鉴别中,并获得了积极的效果。本研究拟将IDEAL-IQ和IVIM同时应用于EC患者细胞增殖状态的评估中,寻找出能够对Ki-67增殖指数高、低组EC进行有效鉴别的参数并进行联合诊断,同时分析各参数与Ki-67增殖指数表达水平的相关性,以期为EC的细胞增殖状态评估提供新的参考。
1 资料和方法
1.1 研究对象
回顾并分析2021年10月—2022年7月因超声或计算机体层成像(computed tomography,CT)检查怀疑为EC而于新乡医学院第一附属医院磁共振科行盆腔MRI检查的患者的影像学资料。排除标准:① MRI扫描序列不完整或成像质量较差,难以满足IDEAL-IQ或IVIM的后处理分析需求;② 无明确的病理学检查结果或病理学检查诊断为非EC病变;③ MRI检查前接受过放化疗或手术治疗;④ 未获得明确的Ki-67检测结果;⑤ 临床资料存在缺失。最终共有43例EC患者被纳入本研究,年龄34~68岁。本研究获得医院伦理委员会批准。
1.2 MRI检查方法
采用美国GE公司的Optima MR360 1.5 T MRI扫描仪,配备有12通道相控阵体线圈。扫描前1 h左右嘱患者饮水,以达到适度充盈膀胱、利于病变显示的目的。首先行矢状位无压脂T2加权成像(T2-weighted imaging,T2WI)扫描(视野40 cm×30 cm,重复时间1 714 ms,回波时间88 ms,层数20);然后以上述图像为参考,对病变部位进行垂直于子宫长轴的斜轴位压脂T2WI扫描(视野40 cm×40 cm,重复时间6 000 ms,回波时间95 ms,层数20,层厚5 mm,层间距1 mm);接着将斜轴位T2WI的视野、位置、层数、层厚和层间距等参数拷贝至IVIM序列并进行扫描,其中回波时间为3 119 ms,重复时间为最小,b分别为0、20、40、80、160、200、400、600、800、1 000 s/mm2。最后,进行3D IDEAL-IQ序列扫描,视野40 cm×40 cm,激励次数为1,重复时间和回波时间分别为17 ms和最小,翻转角为8°。
1.3 图像处理及分析
使用GE AW 4.7工作站处理和分析图像。IVIM各定量参数慢速表观弥散系数(slow apparent diffusion coefficient,ADC-slow)、快速表观弥散系数(fast apparent diffusion coefficient,ADC-fast)和灌注分数(perfusion fraction,f)的伪彩图均由工作站内置的MADC软件依据公式Sb/S0=(1-f)×exp(-bADC-slow)+f×exp[-b×(ADC-fast+ADC-slow)]来生成。
IDEAL-IQ定量参数脂肪分数(fat fraction,FF)和R2*弛豫率参数伪彩图则在扫描后由系统自动生成。在斜轴位T2WI图像上病灶的最大层面勾画感兴趣区(regions of interest,ROI),要求ROI应尽可能包括病变组织且努力避开肉眼可见的囊变、坏死或出血等区域。ROI勾画完成后,将其拷贝至IDEAL-IQ和IVIM各参数伪彩图中,由工作站自动生成相应参数值。上述工作分别由1名具有7年工作经验的主治医师和12年工作经验的副主任医师在不知道彼此结果及临床病理学资料的情况下独立完成。
1.4 组织学分析
所有病变标本均送至本院病理科进行组织学分析。H-E染色被用于确定组织学类型。Ki-67增殖指数检测使用小鼠单克隆抗体M3G4(Celnovte),具体方法为在400倍放大下选择5个热点,每个热点数100个肿瘤细胞,以其中阳性细胞的比例作为Ki-67增殖指数的指标。其中,阳性细胞数<50%的的EC患者被归为低Ki-67增殖指数组,≥50%的EC患者被归为高Ki-67增殖指数组。
1.5 统计学处理
采用SPSS 26.0和MedCalc 15.0软件分析数据,P<0.05为差异有统计学意义。组内相关系数(intraclass correlation coefficient,ICC)被用于评估观察者间一致性,ICC>0.75被视为一致性良好。符合正态分布的计量资料以±s表示,组间对比采用独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间对比采用Mann-Whiney U检验,分类资料的组间对比则采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)确定各参数的诊断效能,logistic回归和DeLong检验分别被用于多参数联合诊断和不同AUC间的差异分析。Spearman相关被用于评估各参数值与Ki-67增殖指数的相关性,其中,|r|<0.5为轻度相关、0.5≤|r|<0.75为中度相关,|r|≥0.75为高度相关。
2 结 果
2.1 临床病理学信息
共43例EC患者被纳入本研究,年龄34~68岁,平均年龄(54.51±7.47)岁;最大径6.4~44.9 mm,平均(18.86±8.72)mm。子宫内膜样腺癌41例,神经内分泌癌2例;Ki-67高表达组19例,低表达组24例(表1)。
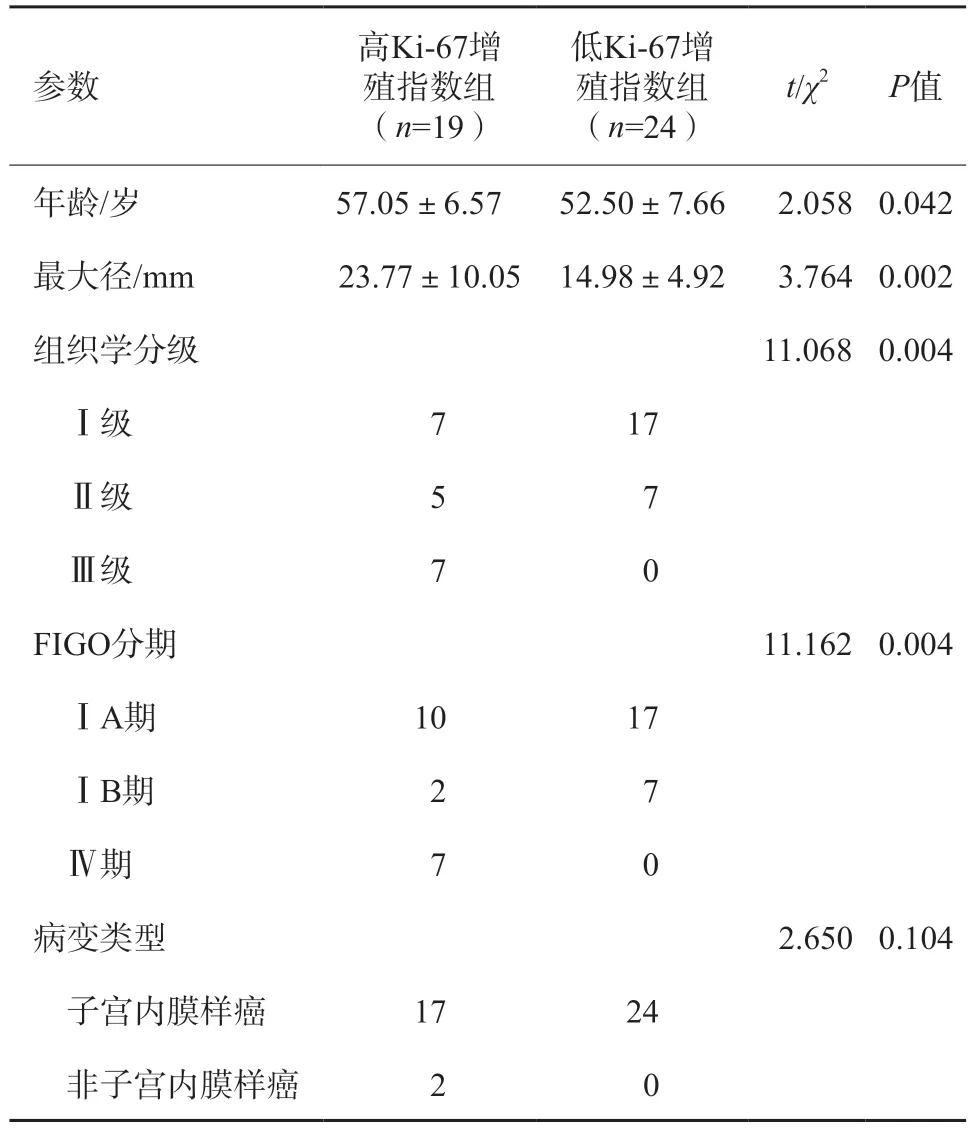
表1 Ki-67增殖指数高、低表达组间临床资料对比
2.2 观察者间一致性
2名放射科医师所测ADC-slow、ADC-fast、f、FF和R2*值具有良好的一致性,ICC分别为0.947、0.973、0.902、0.941和0.964,故将两者的平均值作为最终结果纳入本研究。
2.3 参数对比
高Ki-67增殖指数组的ADC-slow、ADC-fast和R2*值均显著低于低Ki-67增殖指数组(P分别为<0.001、0.004、<0.001),两组间f 和FF值的差异无统计学意义(P分别为0.942、0.723)。不同参数伪彩图及组间参数对比详见图1、表2。

图1 低Ki-67增殖指数(A~H,30%)和高Ki-67增殖指数(I~P,70%)EC患者的MRI图像

表2 高Ki-67增殖指数组和低Ki-67增殖指数组EC间不同参数值对比
2.4 诊断效能
ADC-slow、ADC-fast和R2*值的AUC分别为0.860、0.748和0.862,三者联合诊断的AUC为0.978,灵敏度为87.50%,特异度为94.74%。DeLong分析显示,ADC-slow+ADC-fast+R2*与ADC-slow、ADC-fast和R2*之间的AUC差异均有统计学意义(Z分别为2.109、3.134、2.227;P分别为0.035、0.002、0.023,图2、表3)。

图2 鉴别高、低Ki-67表达EC的ROC曲线
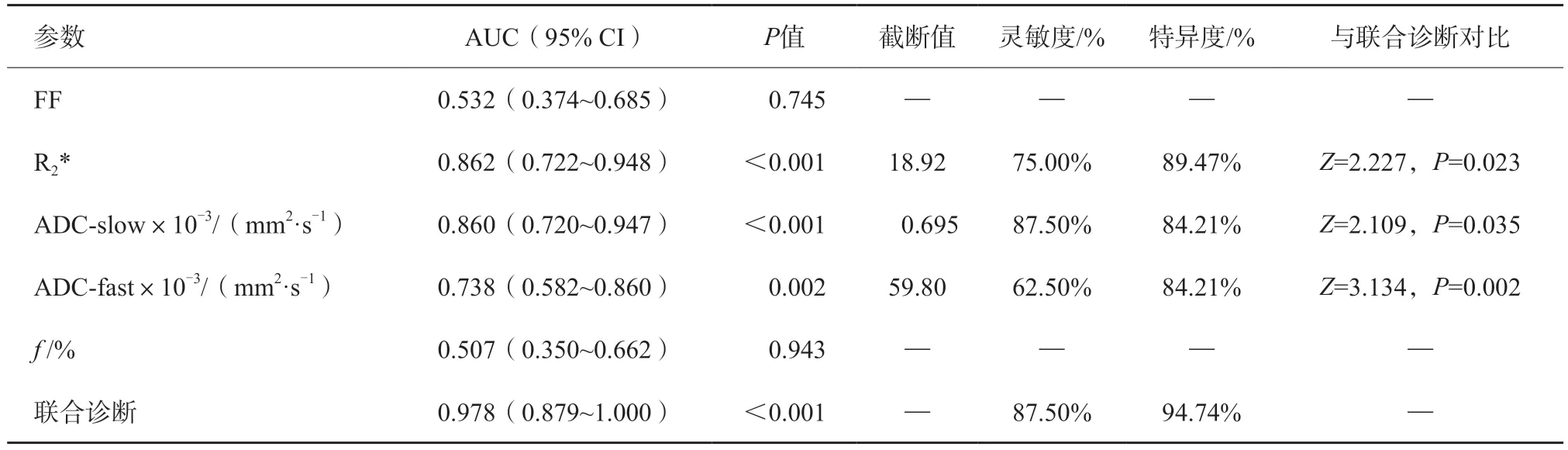
表3 不同参数鉴别高、低Ki-67增殖指数组EC的效能
2.5 不同参数与Ki-67增殖指数的相关性
ADC-slow和R2*值均与Ki-67增殖指数呈中度负相关(r分别为-0.547、-0.711,P<0.001),ADC-fast与Ki-67增殖指数呈轻度负相关(r分别为-0.324,P=0.034),f 和FF均与Ki-67增殖指数无明显相关性(P分别为0.886、0.661,表4)。

表4 不同参数与Ki-67增殖指数的相关性
3 讨 论
在临床工作中,EC患者的Ki-67增殖指数往往需要在获取病变大体标本后经由免疫组织化学检查来确定,这并不利于术前准确判断相关患者的情况[12]。术前MRI扫描虽然已逐渐成为EC患者的常规检查流程,但传统MRI序列仅能反映病变的形态学特征,难以对病变的Ki-67增殖指数进行判定。IDEAL-IQ和IVIM这两种序列能够通过相关参数定量反映病变信息,在评估EC患者的Ki-67增殖指数方面具有优势,故本研究将两者联合应用于Ki-67增殖指数高、低组EC的鉴别中,以期获得更好的诊断效能。
ADC-slow是IVIM用于反映组织内水分子弥散运动状态的参数。以往的研究[11,13]显示,Ki-67增殖指数较高的EC,往往细胞增殖旺盛,组织结构紧密,故内部水分子弥散运动受限显著,ADC-slow值降低。本研究中,高Ki-67增殖指数组EC患者的ADC-slow值显著小于低Ki-67增殖指数组,且ADC-slow与Ki-67表达水平呈中度负相关,这与上述研究结果一致,表明ADCslow值能够在EC患者的细胞增殖状态的评估中发挥作用。ADC-fast是IVIM的灌注定量参数之一,大小与毛细血管内血流速度呈正比[5]。本研究中,高Ki-67增殖指数组的ADC-fast值显著小于低Ki-67增殖指数组,且ADC-fast与Ki-67增殖指数呈轻度负相关。分析其原因,与低Ki-67增殖指数组相比,高Ki-67增殖指数组的EC细胞增殖旺盛,组织结构紧密,因此其内部血管受压显著,走行迂曲,故相应血液流速减小,ADC-fast值降低。然而,亦有部分研究[13-14]认为ADC-fast无法对EC的Ki-67增殖指数进行有效的评价,我们推测这可能与不同研究所纳入的研究对象以及IVIM扫描所使用的b值存在差异有关。f 亦是IVIM的灌注定量参数,大小主要受到组织内微血管密度的影响[5]。既往研究[11,13-14]显示,虽然高Ki-67增殖指数的EC细胞增殖迅速,新生血管较多,但因结构过于紧密,易出现组织坏死,因此病变整体微血管密度较低Ki-67增殖指数的EC无明显变化。本研究中,Ki-67增殖指数高、低组间f 值的差异并无统计学意义,这与上述研究结果一致,进一步证明f值尚难以在EC患者Ki-67增殖指数的评估中发挥作用。
R2*是IDEAL-IQ的重要定量参数之一,其大小主要受到组织横向弛豫时间变化的影响[4]。已有研究显示R2*不仅可以用于鉴别早期EC与子宫内膜息肉[10],而且还可以评估EC患者的微卫星不稳定状态[15]。本研究中,高Ki-67增殖指数组的R2*值较低Ki-67增殖指数组显著降低,且R2*与Ki-67增殖指数之间显示出中度负相关,这表明R2*能够用于EC患者Ki-67增殖指数的评估。我们推测Ki-67增殖指数高、低组EC间在血供、耗氧量、微出血灶和坏死灶等方面存在的差异可能是导致上述结果的主要原因[16-17]。FF值是IDEAL-IQ用于定量评估组织脂肪含量的参数。本研究中,Ki-67增殖指数高低组的FF值均较低,且差异无统计学意义。我们认为这可能与EC属于乏脂肪肿瘤,不同Ki-67增殖指数的EC在脂肪含量上并无明显差异有关[14]。
本研究还显示,多参数联合(A D Cslow+ADC-fast+R2*)诊断效能较单一参数显著提高,我们推测这可能与多参数联合可以多角度反映病变信息,因而能够较单一一种参数更加全面地反映病变的特征有关。因此,在条件允许的情况下,采用多种模态MRI进行扫描,可能会为EC患者带来更大的收益。
本研究存在局限性:① 本研究为单中心研究且样本量较少,可能导致研究结果存在一定的选择偏倚;② IDEAL-IQ和IVIM对于微小病变的显示效果欠佳,这导致一些患者被排除,可能会对实验结果的可靠性产生影响;③ 仅在病变的最大层面勾画ROI,可能无法全面反映病变特征。
综上,IVIM定量参数ADC-slow、ADC-fast和IDEAL-IQ定量参数R2*均可用于评估EC患者的Ki-67增殖指数,且多参数联合能够显著提升诊断效能,具有一定的临床应用前景。

