起搏器囊袋感染伴反复电极赘生物一例∗
任媛 庞雪峰 马春燕 陈昕 王晓冰 邹麓 李学斌 孙英贤 陈艳丽
患者男性,71岁。因“反复抽搐2 月余”,疑诊“癫痫”,用“德巴金”治疗未见好转,再次就诊于本院神经内科,心电监护显示“高度房室传导阻滞”,动态心电图显示间歇性高度房室传导阻滞,全心停搏最长98.7 s(图1A)。既往有脑梗死病史,无后遗症。收入心内科行双腔永久起搏器置入术治疗。患者术中神志略恍惚,配合度差,术后囊袋轻度血肿(术前一直口服阿司匹林),术后观察3 天血肿逐渐减轻出院。患者术后未再出现抽搐,“德巴金”逐渐停药。术后1个月患者开始囊袋局部疼痛,略肿胀,无发红及切口破溃流脓。体温略高,37.2℃~37.5℃,于外院应用抗生素(三代头孢)治疗1周,未见明显缓解,囊袋红胀逐渐加重,再次入院。入院时,囊袋局部可见1~2 mm 破溃,流脓。诊断:高度房室传导阻滞;双腔永久起搏器置入术后;起搏器囊袋感染。入院后抽血培养,囊袋分泌物培养。给予哌拉西林钠他唑巴坦钠4.5 g,每12 h 1次静脉滴注,并局部换药。完善术前检查,拟尽快拔除原感染装置。入院第一天抽血培养结果为阴性,囊袋局部分泌物培养为金黄色葡萄球菌。患者入院后体温37.3℃~38.5℃,无寒战。程控将起搏器频率降至35次/分,仍无自主心电信号,考虑患者起搏器依赖。完善术前检查,经胸心脏超声(TTE)示右房内导线表面附加回声,长约15 mm,有明显摆动,大小约9 mm×2 mm(图2A)。经食管超声心动图(TEE)示:右房导线中段局部可见附加多发条索,大小约7 mm×2 mm,有明显摆动,右房表面略粗糙,未见附壁血栓,右房功能正常。补充诊断:感染性心内膜炎?
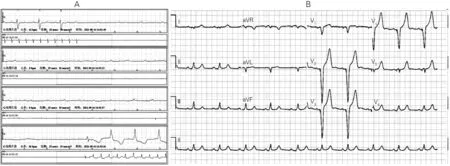
图1 患者动态心电图及心电图

图2 TTE及TEE显示赘生物情况
鉴于患者起搏器依赖,且赘生物<20 mm,行囊袋清创术,取出起搏器及右房电极,保留原心室电极,连接体外起搏器作为临时过渡。将清创组织及右房电极送检培养,清创组织培养结果为金黄色葡萄球菌。右房电极培养阴性。患者术后仍有发热,最高38.5℃,TTE 仍可见电极导线右房段赘生物,大小约10.5 mm×3.8 mm,抗生素升级至美罗培南。结合指南,建议完全拔除感染装置,向患者交代无导线起搏对于减少囊袋感染的优势和单纯心室起搏的弊端,患者和家属拒绝无导线起搏器。入院第12天再次经同侧颈内静脉更换新的心室主动电极,连接体外起搏器,拔除原心室电极并送培养(人葡萄球菌)。术后患者体温降至正常,但复查TTE及TEE,仍可见电极赘生物(入院第18天,图2B),右房壁增厚、回声亦粗糙,回顾患者入院后D-二聚体一直处于高位(图4),不除外血栓的可能。完善18氟-脱氧葡萄糖正电子发射计算机断层显像(18F-FDG-PET/CT)检查,显示:右房导线未见异常局灶性代谢增高(图3)。给予利伐沙班片15 mg,每日1次口服,期间复查TEE,仍有赘生物,有变小趋势,后将利伐沙班加至20 mg每日一次口服。另患者原感染切口已痊愈,抗凝使用后,赘生物变小,D-二聚体亦呈下降趋势,支持赘生物为血栓的诊断。入院第32 天,在对侧(右侧)置入新的起搏电极和起搏器,术后起搏器工作正常(图1B)。将过渡起搏电极送检培养:表皮葡萄球菌,蜡样芽孢杆菌。入院第41 天复查TEE:两条电极导线光滑,未见附加回声(图2C)。入院第46天日停用抗生素(抗生素总疗程44天)出院。出院后继续口服利伐沙班20 mg至术后1个月,后减量至15 mg维持2个月。目前患者术后9个月随访,患者无发热,两侧切口愈合良好。起搏器工作正常,TTE未见导线赘生物(图2D),D-二聚体在正常值范围内。
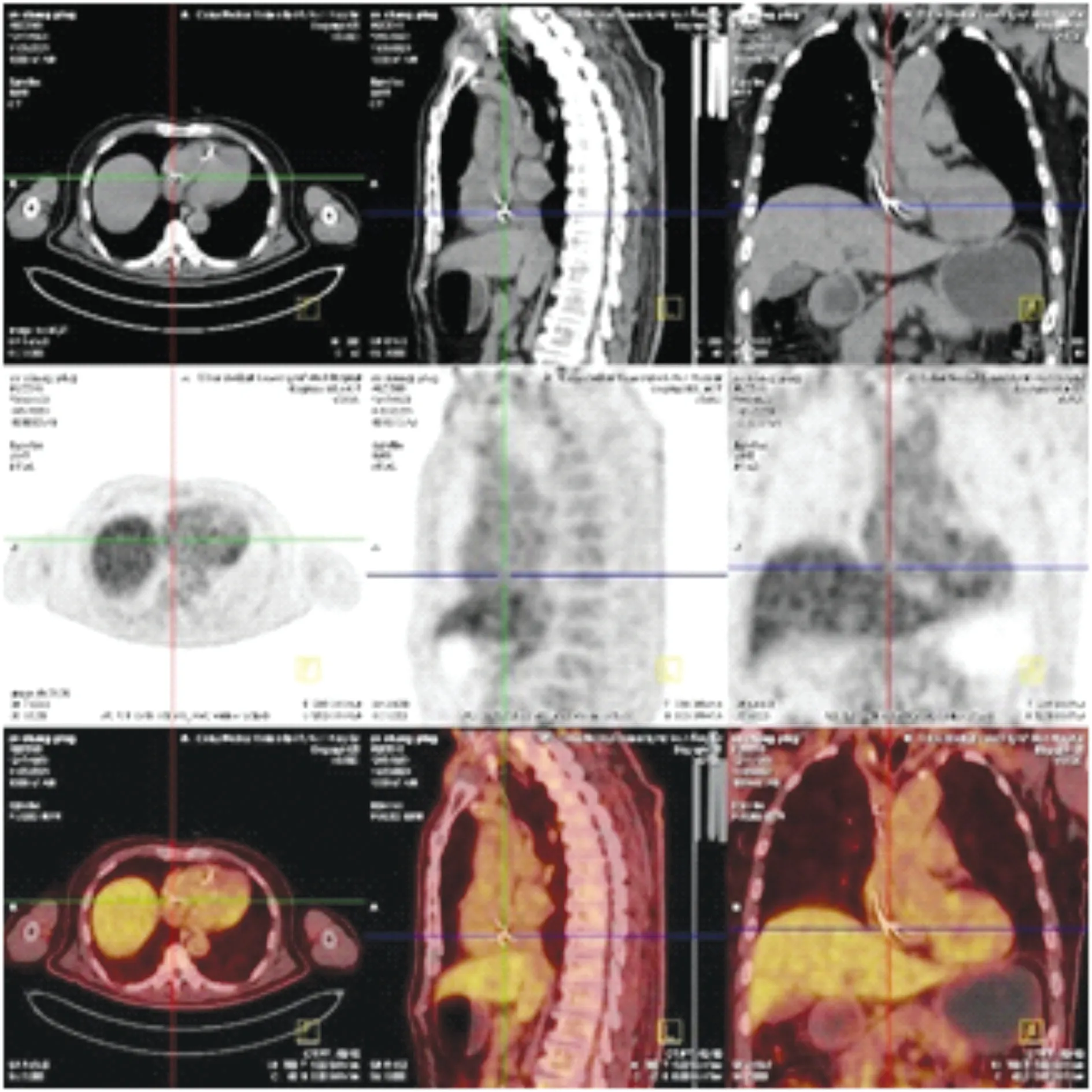
图3 胸部18氟-脱氧葡萄糖正电子发射计算机断层显像
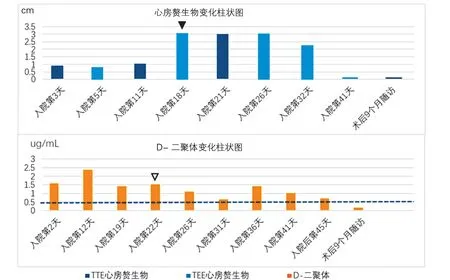
图4 D-二聚体及心房赘生物变化柱状图
讨论 本例间歇性高度房室传导阻滞合并反复晕厥,有进行双腔永久起搏器置入适应证。术后1个月出现囊袋感染,考虑与患者术后囊袋血肿,患者配合度差有一定关系。文献报道,囊袋血肿会明显增加囊袋感染风险,因此,对于术前正在进行抗凝、抗血小板治疗者,心脏植入式电子设备(CIED)置入术后应该酌情延长加压包扎时间,对于神志状态差的患者应该加强护理。
CIED相关感染的年发生率2%~2.5%,并呈逐年增高趋势,是增加CIED 患者致病和致死的重要原因,因此,一旦发生CIED 感染,应积极给予相应治疗。本例在囊袋清创术前评估显示电极赘生物,疑诊感染性心内膜炎。明确赘生物性质,对于后续抗生素使用疗程的确定,是否需要外科开胸手术都至关重要。CIED 相关的赘生物形成后,通过临床症状很难确定赘生物性质,指南推荐结合临床症状、血培养及影像学检查,综合判定囊袋感染、赘生物与感染性心内膜炎的诊断。本例患者有CIED 置入史,有发热、乏力的周身症状,起搏器囊袋红肿热痛,存在CIED 囊袋感染。心脏超声提示电极相关赘生物形成,囊袋坏死组织培养显示“金黄色葡萄球菌”,尽管多次血培养均阴性,亦不能除外感染性心内膜炎的可能。此外,炎症和血栓是两个密切相关的病理过程,感染本身可以通过以下机制促发血栓形成:炎症介导内皮功能障碍,炎症因子释放;促进血小板生成和活化;激活凝血因子,抑制抗凝和纤溶系统。静脉CIED 患者的导线血栓也是比较常见的现象,文献报道其发生率从1.4% 到30%[1],有报道甚至显示46%的CIED 囊袋感染患者发生赘生物[2]。检查方法直接影响赘生物的检出率,一项拟行消融患者使用心腔内超声,检出的导线血栓发生率高达30%,其中仅有4%的患者术前被TTE检测到[1]。TEE对于导线赘生物的随机检出率为14%,但72%的患者事后被证实为非感染性血栓[3]。因此电极赘生物性质的判断非常重要,是感染所致,应该加强抗炎力度,但是如果是血栓所致,即使加强抗炎也未必能够减小赘生物,此时抗凝的及时启动至关重要。对于血栓和感染性赘生物的鉴别,TTE/TEE 的作用有限,18F-FDG PET/CT 起到决定性作用。本例在原装置完全移除后,超声检测仍反复显示赘生物,后采用PET-CT 检查进一步帮助判定赘生物为血栓可能性大,调整治疗方案后,赘生物逐渐缩小,最终消失。
然而PET-CT 对技术和硬件的要求高,并非所有医院都能够进行此项检查。如果临床上能够通过简便、易得的检查,及早提示血栓的可能性并启动抗栓治疗,对于防止赘生物增长,并进而减少拔除导线时肺栓塞等并发症至关重要。
D-二聚体是胶原纤维蛋白降解的产物,标志循环中的凝血水平和纤维蛋白水平,在预测血栓和出血性疾病中发挥重要作用。它也用于评估静脉血栓栓塞症(VTE)复发或者是否停用口服抗凝药,研究表明D-二聚体能够显示感染相关的血凝异常。此外,D-二聚体也是炎症反应的标志物。在感染性心内膜炎的患者中,D-二聚体升高与较高的栓塞事件和住院死亡率相关,可以用于评估感染性心内膜炎的预后。亦有研究表明,经静脉置管相关的反复发生的血行感染,与导管表面的纤维蛋白包裹相关,这也表明部分感染性心内膜炎的治疗,需要抗凝的参与。心腔内电极是心腔赘生物发生的易患因素之一,它可以促发凝血瀑布的激活,心腔内血流方向的改变或者湍流的形成,致使内膜损伤,微血栓形成。电极导线作为异物,可能引起炎性反应,进而导线相关的血栓形成。血栓形成后,伴血小板和纤维蛋白的沉积,并影响凝血瀑布以及D-二聚体的产生。对于CIED 感染患者,是否可以用D-二聚体进行血栓风险评估,目前国内外尚无文献报道。本例患者在感染初期就诊时,D-二聚体较高,后续抗栓治疗有效后,D-二聚体呈现下降趋势,印证了D-二聚体在CIED 感染患者电极赘生物性质判断中的提示作用。对于D-二聚体高的患者,除了感染以外,要重视血栓可能,及早给予抗栓治疗,对于减少CIED 感染相关栓塞事件可能会有帮助。
电极导线相关的赘生物抗栓与否,目前尚不确定,Costa等[4]探索了在血栓高危的经静脉CIED 患者中,应用华法林预防导线相关血栓的必要性,进一步探索D-二聚体在血栓高危患者预测中的价值十分必要。D-二聚体是临床易得、便宜的化验检查之一,如果能够早期通过D-二聚体的检查,指导抗凝的尽早启动,定会减少电极相关血栓事件的发生率。

