人工神经网络和响应面法优化黑曲霉发酵产淀粉酶













摘要:发酵过程的培养基组成及培养条件是影响黑曲霉产淀粉酶产量的关键。为提高黑曲霉F223 的产酶水平,首先通过单因素实验及Plackett-Burman(PB)实验筛选出了显著影响淀粉酶酶活的成分:豆粕、玉米浆及可溶性淀粉。通过最陡爬坡实验以及中心组合实验获取回归建模数据集,以淀粉酶酶活为响应变量,分别利用传统的多项式回归以及人工神经网络回归拟合方法,建立了培养基组成与酶活之间的回归模型,得到了黑曲霉F223 生产淀粉酶的培养基和培养条件的最优解。结果表明,人工神经网络结合遗传算法在数据拟合和预测能力方面优于多项式回归方法,用该算法为基础优化得到的培养基进行摇瓶发酵实验,最终淀粉酶产量达到5 566.79 U/mL,相比于未优化培养方案提升了92.6%。
关键词:黑曲霉;淀粉酶;响应面方法;机器学习;人工神经网络
中图分类号:Q815 文献标志码:A
α-淀粉酶是一种重要的酶制剂,现已在食品加工、饲料、造纸及纺织等工业领域被广泛应用,具有巨大的商业价值和市场需求[1]。据统计,α-淀粉酶作为工业用酶,其产值于2020 年已达到7.5×109 USD,应用前景良好[2]。目前α-淀粉酶主要的生产商有罗氏(瑞士)、诺维信(丹麦)、杜邦(美国)等公司。
工业用α-淀粉酶根据其来源可以分为两类:细菌α-淀粉酶和真菌α-淀粉酶,二者具有不同的酶学特点[3],其中真菌来源的淀粉酶具有直接水解生淀粉的能力,并且在糖化工艺的应用中,真菌来源的α-淀粉酶可以代替β-淀粉酶作为糖化剂,用于生产高麦芽糖浆,成为高麦芽糖浆生产过程中的关键酶制剂。黑曲霉是优良的酶蛋白表达宿主[4],其酶蛋白产物分泌到胞外,易于提取、发酵培养基成本低、对于pH 和温度的稳定性好等优点。目前真菌α-淀粉酶的生产主要采用霉菌固态发酵的方式,存在发酵效率低、过程调控难等问题,如Premalatha 等[5] 以溜曲霉作为生产宿主,通过固态发酵进行α-淀粉酶生产,产量最高达到519.40 u/g;Mahmood 等[6] 通过黑曲霉固态发酵生产α-淀粉酶,通过培养条件及培养基优化,产量达到1 298.12 u/g。少数液态发酵多采用未经改造的原始霉菌菌株,发酵最终酶活较低,低于2 000 U/mL[7-8]。本研究所用菌株为经代谢工程改造的黑曲霉F223 菌株,该菌株通过CRISPR/Cas技术在基因组上定点敲除了糖化酶基因,并整合来源于米曲霉的α-淀粉酶基因表达盒AmyA,可高效表达米曲霉α-淀粉酶。
微生物发酵过程中可变因素与产量之间的关系是复杂非线性的,若仅通过单因素或正交实验进行筛选,则需要花费较大的时间成本,此时生物过程的建模与优化对于高效经济地开发生物发酵工艺非常重要[9-10]。相比于传统的建模方法,通过机器学习方法进行回归建模提供了一种独立于传统模型的灵活处理方法[11]。机器学习算法可分为有监督算法和无监督算法两类[12],其中有监督算法主要用于挖掘特征值与目标值之间的相关性,以实现基于特征值输入来预测对应的目标值。有监督学习算法在发酵工业中得到广泛应用,包括培养基优化、发酵建模过程、控制优化以及发酵分批补料等,已经成为当前研究的热点之一[13-14]。人工神经网络(Artificial NeuralNetwork,ANN)是一种常用的有监督学习算法,其将输入数据集所得到的响应与目标值进行比较,修改内部权值来校正偏离的响应,并通过迭代训练过程模拟变量之间的非线性变化,以此分析复杂系统中存在的非线性关系。
因此,本研究基于ANN 算法搭建了新的黑曲霉产淀粉酶培养方案优化流程,由初始培养基出发,通过单因素实验考察不同组分及条件对于产酶的影响,由Plackett-Burman(PB)实验和最陡爬坡实验初步确定对于淀粉酶生产影响显著的因素及对应浓度范围,最后基于中心组合实验所得数据集,利用多项式回归建模结合最小二乘回归算法寻优和ANN 回归建模结合遗传算法寻优,解析培养基成分、培养条件与产量之间的非线性关系,优化影响淀粉酶产量关键因素的水平,以期确定最优的黑曲霉培养方案,为后续黑曲霉产淀粉酶发酵优化提供数据支持。
1 实验部分
1.1 原料和试剂
1.1.1 实验菌株
黑曲霉(Aspergillus niger) F223 由中国农科院提供。
1.1.2 实验试剂
葡萄糖、木糖、麦芽糖、果糖、甘露糖、半乳糖、阿拉伯糖、大豆蛋白胨、胰蛋白胨、牛肉膏:分析纯,上海阿拉丁生化科技股份有限公司;麦芽糊精、玉米糊精:分析纯,上海源叶生物科技有限公司;酵母粉:分析纯,安琪酵母股份有限公司;培养基用金属离子盐、无机盐:均为分析纯,国药集团化学试剂有限公司;可溶性淀粉:分析纯,凌峰化学试剂有限公司;玉米浆:分析纯,上海麦克林生化科技股份有限公司;豆粕:分析纯,北京索莱宝科技有限公司; 3、5-二硝基水杨酸(DNS) 试剂: Codow氪道-广州和为医药科技有限公司;BCA 蛋白浓度测定试剂盒(增强型):碧云天生物技术公司。
1.1.3 培养基
(1) PDA(Potato Dextrose Agar)培养基(g/L) :马铃薯200,葡萄糖20,琼脂15;
(2)种子培养基及初始发酵培养基(g/L):豆粕30,玉米浆20,蔗糖50,硫酸镁1。
1.2 测试与表征
pH 计(梅特勒-托利多公司),ZHWY-3212 型旋转式摇床(上海智城公司),酶标仪(美国Thermo 公司),AL204 型分析天平(梅特勒-托利多公司),PYXDHS-40*50 型培养箱(中国跃进医疗器械公司) ,BHS-4 型水浴锅(中国群安实验仪器公司),STY-1-ADK 型渗透压仪(中国天大天发科技有限公司公司),GZX-9420MBE 型鼓风烘箱(华连医疗器械公司)
1.3 黑曲霉的活化与培养
将−20 ℃ 冰箱保藏的A.Niger F223 甘油管解冻,无菌接种环蘸取后划线于PDA 平板,于30 ℃ 恒温培养箱培养48 h 得到单菌落,挑取单菌落并接种至液体种子培养基活化培养60 h,待镜检可见完整菌丝,并且离心菌丝体体积(PMV)达到40% 以上,即可接种至发酵培养基。
1.4 单因素实验
微生物培养基主要成分有以下几类:碳源、氮源、无机盐、金属离子等;影响菌株生长及生产的培养条件主要有:渗透压、pH、接种量、接种种龄等。本研究通过单因素实验,在初始培养基的基础上,依次改变一种培养基组分,初步筛选发酵培养基的组成及培养条件[15]。
迟效氮源:豆粕(Soybean meal,SM)、大豆蛋白胨(Soy Peptone,SP)、胰蛋白胨(Tryptone,TRY),添加量均为30 g/L; 速效氮源: 玉米浆(Corn SteepLiquor, CSL) 、牛肉膏(Beef Extract, BE) 、酵母粉(Yeast Extract,YE),添加量均为20 g/L;10 种供试碳源(葡萄糖、木糖、麦芽糖、可溶性淀粉、果糖、甘露糖、半乳糖、阿拉伯糖、麦芽糊精、玉米糊精)添加量均为50 g/L;5 种供试缓冲盐(磷酸二氢钾、磷酸氢二钾、磷酸二氢钠、磷酸氢二钠、碳酸钙),添加量均为1 g/L;6 种供试金属离子(钙、铁、镁、锌、钴、镍离子),添加量均为20 mmol/L。
1.5 PB 实验
研究使用Design expert 10.0.1 设计PB 实验,筛选由OFAT 实验中所获得的8 种培养基成分及培养条件,其中A、B、C、D、E、F、G、H 分别代表磷酸二氢钾、豆粕、玉米浆、可溶性淀粉、渗透压、接种量、氯化钙、初始pH 8 个变量因素,所有因素都在高(+1)、低(−1)两水平上进行12 次实验,实验设计如表1 所示。
1.6 最陡爬坡实验(Steepest Ascent Experiment,SAE)
在PB 实验所构建的一阶模型中,得到显著影响因子的系数,以此计算最陡爬坡实验的步长[16],在最陡爬坡实验(表2)中所得到最高淀粉酶酶活所对应的显著变量水平,即作为后续响应面优化的中心点。
1.7 中心组合实验(Central Composite Design, CCD)
研究中使用Design expert 10.0.1 设计CCD 实验,如表3 所示,其中包括6 组失拟项测试的中心点和14 个非中心点,共20 次实验。20 组完全随机实验进行3 次生物学重复。
1.8 回归拟合建模
(1)多项式回归建模
将CCD 实验所设计的参数以及在实验中得到的不同参数组合所对应的响应值,使用Design expert10.0.1 软件进行二项式回归拟合[17]。
(2)人工神经网络建模
本研究中使用MATLAB 2020a 中的DeepLearningToolbox 14.6 进行神经网络拟合,将CCD 实验所得结果作为数据集进行神经网络训练,训练过程中数据按70%、15%、15% 的比例分为训练集、验证集及测试集,其中输入变量为显著因素豆粕、玉米浆和可溶性淀粉的质量浓度,响应变量为淀粉酶酶活。
1.9 生化参数检测方法
1.9.1 PMV测定
由于培养基中含有不溶性成分,本实验采用PMV 作为菌体生长的监测指标[18],发酵过程中定点取样1 mL,12 000 r/min 离心5 min,将菌丝体与发酵上清分离,将沉淀菌丝体的体积除以取样发酵液总体积来计算PMV。
1.9.2 酶活检测
本实验采用二硝基水杨酸(DNS)法进行淀粉酶酶活检测[1],每分钟生成1 μmol还原糖需要的酶量为一个酶活力单位(1U),单位体积酶活即为1 U/mL。于发酵终点取样1 mL 进行酶活力测定,离心后取上清,稀释一定倍数后与1 mL的10 g/L可溶性淀粉溶液混匀,于50 ℃ 恒温水浴锅反应10 min,反应结束后加入2 mL DNS 试剂,沸水浴5 min 进行显色,显色结束后冷却至室温,用超纯水将反应体系定容至25 mL,使用酶标仪在540 nm波长下读取吸光值,并根据标准曲线计算酶活。
1.9.3 蛋白浓度测定
研究中使用BCA 蛋白浓度测定试剂盒对发酵体系中的蛋白浓度进行测定。
1.9.4 渗透压测定
研究中使用冰点渗透测定压仪对发酵体系的渗透压进行测定。
1.10 数据处理
本研究每个样品分析设置3 次生物学重复,采用Graphpad Prism 8.2.4 进行数据处理及图表绘制;使用Design Expert 10.0.1 进行PB 实验和CCD 实验设计和二项式回归建模分析;使用MATLAB 2021a进行人工神经网络回归建模及遗传算法求解。
2 结果与讨论
2.1 培养基的初筛
2.1.1 不同培养条件及菌株活化方法对产酶的影响
由图1 所示各组单因素实验结果可得,当渗透压为2 060 kPa、初始pH 为7 时分别达到各组实验的最高产酶量。由图1(a)可得,较高的渗透压通过增加黑曲霉胞内外的渗透压差,从而促进淀粉酶的胞外分泌,产量提高,但过高的渗透压又会影响菌株生长,故最适初始渗透压应设为2 060 kPa。pH 是发酵过程调控的关键参数之一[19],由图1(b)和(c)可得,黑曲霉F223 产淀粉酶过程较合适的pH 值为6.5~7.0、接种量为2% 时,可以较好地维持菌株生长代谢,同时对于中性α-淀粉酶可以更好地发挥酶的催化活性。
2.1.2 不同碳氮源对产酶的影响
研究选择了多种碳、氮源进行单因素实验分析,不同成分所对应的发酵终点酶活如图2 所示。
由图2(a)可得,相比于对照碳源蔗糖,葡萄糖、可溶性淀粉、麦芽糖、果糖、麦芽糊精、半乳糖、甘露糖和玉米糊精作为碳源时,发酵终点产量皆有不同程度的提高。其中葡萄糖、麦芽糖及果糖作为还原糖,通过提高菌体生长代谢活力来促进产物合成;可溶性淀粉、玉米糊精及麦芽糊精则对于淀粉酶蛋白表达有诱导作用[20],通过提高淀粉酶的诱导表达效率提高产量。考虑到发酵成本及实际生产过程中经济效益,最终选择了成本较低且诱导表达效果较好的可溶性淀粉作为碳源,其作为碳源进行发酵时酶活最高可达4 567 U/mL。
由图2(b)、图2(c)可得,豆粕和玉米浆分别作为最理想的迟效和速效氮源,且当豆粕与玉米浆质量比为3∶2 时,酶活可达3 524 U/mL(图2(c))。结果表明,优化后的氮源浓度配比对黑曲霉在发酵过程中的前期菌体生长和后期的产物合成有直接影响[21]。
2.1.3 不同缓冲盐及金属离子对产酶的影响
本研究考察在初始培养基的基础上添加缓冲盐和金属离子对发酵终点酶活产量的影响,结果见图3。由图可得,添加磷酸二氢钾、磷酸氢二钾作为缓冲盐时酶活提高了约15%,表明磷酸盐的添加除了pH 调节以外,还可能促进参与辅酶、核酸等多种微生物生长代谢关键元素的合成,以及改善培养环境的pH,优化了菌株生长[22]。此外,钙离子的补充使得终点酶活提高了13%。已有文献[23-24] 表明培养体系中的钙离子可以改善细胞膜通透性,使发酵终点淀粉酶酶活有所提高。综上,本研究选择了磷酸二氢钾以及钙离子作为发酵培养基中的无机盐及金属离子成分。
2.2 PB 实验
结合单因素实验的实验结果进行PB 实验设计,以考察发酵条件中的8 个因素对于黑曲霉产淀粉酶的影响并筛选显著影响因子,具体实验结果及分析如表4 所示,其中*为Plt;0.05,**为Plt;0.01。PB 实验所得模型的P 值为0.024 9,小于0.05,表明该模型显著,具有统计学意义。模型的线性回归方程为Y =2 767.29 + 142.91A + 342.68B + 364.92C + 273.60D −254.93E + 85.37F + 28.01G + 141.38H。其中豆粕、玉米浆及可溶性淀粉的P 值分别为0.010 8、0.009 5、0.016 7,均小于0.05,表明三者对于黑曲霉产淀粉酶的发酵影响显著,重要性顺序为玉米浆gt;豆粕gt;可溶性淀粉。其中渗透压虽然P 值同样小于0.05,但在模型中表现为负效应,结果表明,高渗环境不适用于黑曲霉进行淀粉酶蛋白的生产代谢,故选择豆粕、玉米浆及可溶性淀粉3 个因素进行后续最陡爬坡及优化实验。
2.3 最陡爬坡实验
最陡爬坡实验结果如表5 所示,随着3 个因素水平的逐渐增加,淀粉酶酶活呈现先升高后下降的趋势,其中实验编号4 的淀粉酶酶活达到最高,因此以豆粕48.17 g/L、玉米浆40 g/L 以及可溶性淀粉52.5 g/L 作为后续CCD 实验设计的中心点。
2.4 多项式回归拟合
以最陡爬坡实验所确定的水平中心点,进行中心组合实验并拟合响应曲面,拟合结果如表6所示。经Design Expert 10 软件对CCD 实验结果进行二次多项回归拟合得回归方程为Y = 5 055.44+415.92A+292.44B+407.92C−210.04AB+42.01AC−306.28BC−637.56A2−621.89B2−671.58C2。由表6 的分析(ANOVA)结果所示,模型回归系数R2 = 0.912 1,表示回归模型的预测性能良好,P 值为0.000 3(P lt; 0.01),表明该模型显著且拟合效果好。失拟项的P 值为0.067 4(P gt;0.05),表明所得回归模型与实验结果拟合时,非正常误差占比小,由此表明所得模型可以较好地预测黑曲霉产淀粉酶的最优培养方案。模型中A2、B2 及C2 所对应的P 值均小于0.01,表明所对应的因素对于响应值的单独影响极显著,但各因素的交互作用对于响应值影响不显著。
二维等高线图及三维响应曲面图(图4)可以进一步分析各因素之间的相互作用,以及因素水平变化对于淀粉酶酶活的影响。
由拟合的响应曲面可得,随着各培养基成分浓度的降低,培养过程中可利用的营养成分减少,影响黑曲霉菌株的生长及生产,淀粉酶酶活均呈现下降趋势。淀粉酶酶活随着培养基成分浓度的增加而提高,但进一步增加则会影响淀粉酶产量。其中,不溶性成分豆粕,其浓度过高会影响液体发酵过程的溶氧含量,导致黑曲霉生长受限,影响产酶。可溶性淀粉浓度过高将导致前期碳源利用过度,耗糖产酸导致pH 快速降低。玉米浆作为复合氮源,其主要成分中含有较多有机酸[25],分解代谢释放乳酸会导致发酵环境偏酸性,影响菌体生长和产物合成。
通过二次多项拟合得到回归方程后,以淀粉酶酶活作为响应值,利用最小二乘回归求解使响应值最大的最优解,结果表明:当豆粕38 g/L、玉米浆31 g/L、可溶性淀粉49 g/L 时,模型预测该条件下淀粉酶酶活达到5 196.45 U/mL。
经实验验证,以上述配比的培养基进行黑曲霉菌株的发酵生产,摇瓶发酵7 d 后淀粉酶酶活达到5 084.68 U/mL,略低于预测值,但对比初始培养基的发酵产量(2 889.38 U/mL)提高了75%。
2.5 人工神经网络回归拟合
采用二项式回归拟合虽可以快速建立响应面模型,所得模型具有易理解、所需样本量少等优点,但受限于模型训练算法和寻优算法,二项式回归模型无法在全局范围内寻优,为了更好地拟合培养基成分与产量之间的复杂非线性关系,本研究还采用了人工神经网络方法进行回归拟合。神经网络拟合的过程中通过数据特征提取,与神经网络的权重相互作用,神经元对输入变量组合进行非线性变化后,使得神经网络模型具备针对多变量复杂关系的非线性表征能力,可以更好地拟合非线性关系并在全局范围内寻优[26-27]。
研究将CCD 实验所得到的数据集用于ANN 模型的训练,使用 MATLAB®神经网络工具箱改变输入层中神经元的数量,结果表明当隐藏层节点数为8 时,产生了最佳的学习和泛化性能,表现为最低的均方误差(MSE)和最高的 R2 值(图5)。
以最优神经网络结构进行模型训练,综合所有数据进行评估并得到模型的总体回归拟合效果。模型拟合结果、模型性能验证结果如图6 所示。其中训练集、验证集、测试集以及总体数据的R2 分别达到0.992 1、0.999 8、0.989 9 及0.986 2,表明该模型可以准确描述培养基成分与淀粉酶产量之间的非线性关系。
此外,图7 展示了神经网络模型的训练过程,通过多次迭代优化模型性能,使模型预测结果与实际值之间的均方误差逐步降低。由图可得,经3 次迭代训练后,模型在3 组数据集上的预测误差均降至最低,表明模型的预测性能此时已至最佳状态。
基于构建好的神经网络模型,研究采用遗传算法进行寻优,通过找到最佳的培养基成分配比使产量达到最高。将人工神经网络所拟合的回归方程作为遗传算法寻优的适应度函数,经遗传算法求解后得到的最优培养基条件为(g/L) :豆粕36、玉米浆33、可溶性淀粉56。以该成分配比进行黑曲霉菌株的培养及产物发酵,最终酶活达到5 566.79 U/mL,对比二次多项回归模型所优化发酵培养基的终点酶活(5 084.68 U/mL)提高了9%,对比初始黑曲霉培养基的终点酶活(2 889.38 U/mL)提高了92.6%。
由回归拟合结果来看,人工神经网络算法拟合所得模型总体回归系数R2 为0.986 2,对比响应面法所得回归模型的回归系数R2 为0.912 1,前者拟合效果更佳,基于人工神经网络算法具有收敛速度快、计算时间短以及统计分析能力强等优势,所得模型可以更好描述培养基成分与产量之间的复杂关系,同时利用鲁棒性强、寻优性能更佳的遗传算法在约束内搜索寻优,可以更好地找到使响应值最大的最优解[28],在实验验证中也表现出更好的产酶水平。
2.6 不同拟合模型所得优化配方发酵结果对比
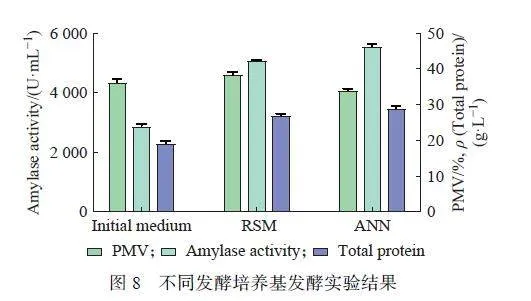
将二次多项回归模型(RSM)与神经网络模型(ANN)求最优解后所得的培养基配方,用于黑曲霉的发酵培养,并结合菌浓(PMV)、淀粉酶酶活及胞外蛋白浓度3 个参数进行对比分析,结果如图8 所示。
由图8 所示,利用初始培养基、二项式回归模型优化培养基以及神经网络模型优化培养所进行黑曲霉发酵培养,可见培养基的成分差异和浓度差异对于黑曲霉的生长及生产都有影响。初始培养基以蔗糖为碳源并且未进行微量元素和培养工艺优化,虽然菌浓可以生长至优化后水平(PMV 约为36%),但淀粉酶酶活及蛋白浓度较低。成分优化后的两种配方更适用于淀粉酶的高效诱导表达,酶活和蛋白浓度显著提高。
相较于二项式回归模型,通过神经网络模型结合遗传算法优化配方发酵效果更佳。具体而言,前者在于减少了豆粕的浓度并且增加了玉米浆浓度,产量提高9%。这是由于豆粕作为不溶性成分,在供氧条件有限的摇瓶培养过程中[29],其浓度过高易导致供氧不足,氧限情况在黑曲霉这种好氧菌株的发酵过程中不利于菌株生长及产酶。此外,人工神经网络模型优化配方中,提高可溶性淀粉的浓度,有利于在摇瓶发酵中维持菌株的生产代谢活性,促进淀粉酶的生产。不同配方培养时,发酵终点的生物量不同,表明底物代谢流倾向于生产而非生长,从而使得产物得率更高。本研究所采用的人工神经网络结合遗传算法适用于黑曲霉产淀粉酶发酵这种高度非线性的生物系统,所建立的模型具有较高的仿真精度。
3 结 论
本研究考察了多种碳氮源、无机盐及金属离子对于黑曲霉产淀粉酶的影响,并通过单因素实验确定了初始发酵培养基组分及发酵条件。由PB 实验确定豆粕、玉米浆及可溶性淀粉为影响淀粉酶产量的显著因素后,进一步构建多项式回归模型以及人工神经网络回归模型以拟合3 个组分的浓度与淀粉酶产量之间的非线性关系,通过寻优得到产量最大的培养基配方,其中,豆粕、玉米浆及可溶性淀粉的浓度分别为(g/L):38,31,49 或者是36,33,56。摇瓶验证实验结果表明,基于人工神经网络模型所得优化配方发酵效果较好,其淀粉酶酶活可达5 566.79 U/mL,比优化前提高了92.6%;蛋白浓度可达29 g/L,比优化前提高了51.5%,具有较好的应用前景。
参考文献:
[ 1 ]SUNDARRAM A, MURTHY T P K. Alpha-amylaseproduction and applications: A review[J]. Applied andEnvironmental Microbiology, 2014, 2(4): 166-175.
[ 2 ]PAUL J S, GUPTA N, BELIYA E, et al. Aspects andrecent trends in microbial α-amylase: A review[J]. AppliedBiochemistry and Biotechnology, 2021, 193(8): 2649-2698.
[ 3 ]FAROOQ M A, ALI S, HASSAN A, et al. Biosynthesis andindustrial applications of α-amylase: A review[J]. Archivesof Microbiology, 2021, 203(4): 1281-1292.
[ 4 ] BHADRA F, GUPTA A, VASUNDHARA M, et al. Endophytic fungi: A potential source of industrial enzyme producers[J]. 3 Biotech, 2022, 12(4): 86.
[ 5 ]PREMALATHA A, VIJAYALAKSHMI K, SHANMUGAVELM, et al. Optimization of culture conditions for enhancedproduction of extracellular α-amylase using solidstateand submerged fermentation from Aspergillus tamariiMTCC5152[J]. Biotechnology and Applied Biochemistry,2023, 70(2): 835-845.
[ 6 ]MAHMOOD S, SHAHID M G, NADEEM M, et al. Productionand optimization of α-amylase from AspergillusNiger using potato peel as substrate[J]. Pakistan Journal ofBiotechnology, 2016, 13(2): 101-109.
[ 7 ]KAMMOUN R, NAILI B, BEJAR S, et al. Application of astatistical design to the optimization of parameters and culturemedium for α-amylase production by Aspergillus oryzaeCBS 819.72 grown on gruel (wheat grindingby-product)[J]. Bioresource Technology, 2008, 99(13):5602-5609.
[ 8 ]朱中南, 郑毅, 章淑妹, 等. α-淀粉酶发酵条件的优化[J].海峡科学, 2011(12): 23-25.
[ 9 ]SALIM N, SANTHIAGU A, JOJI K. Process modeling andoptimization of high yielding L-methioninase from a newlyisolated Trichoderma harzianum using response surfacemethodology and artificial neural network coupled geneticalgorithm[J]. Biocatalysis and Agricultural Biotechnology,2018, 17: 299-308.
[10]江元翔, 高淑红, 陈长华. 响应面设计法优化腺苷发酵培养基[J]. 华东理工大学学报(自然科学版), 2005, 31(3):309-313.
[11]林静远, 刘必林, 王立权. 基于角质颚微结构的剑尖枪乌贼的日龄与生长[J]. 华东理工大学学报(自然科学版),2019, 45(5): 775-782.
[12]陈世伟, 罗嘉伟, 王舸楠, 等. 基于遗传算法进化的人工神经网络(GA-ANN) 对葡萄糖发酵生产普鲁兰多糖的条件优化[J]. 食品与发酵工业, 2023, 49(8): 60-66.
[13]BEIROTI A, AGHASADEGHI M R, HOSSEINI S N, et al.Application of recurrent neural network for online predictionof cell density of recombinant Pichia pastoris producingHBsAg[J]. Preparative Biochemistry amp; Biotechnology,2019, 49(4): 352-359.
[14]TAVASOLI T, ARJMAND S, SIADAT S O R, et al. Arobust feeding control strategy adjusted and optimized by aneural network for enhancing of alpha 1-antitrypsin productionin Pichia pastoris[J]. Biochemical Engineering Journal,2019, 144: 18-27.
[15]尹鹏, 杨芸芸, 赵一凡, 等. 基于BP 人工神经网络的酿酒酵母发酵培养基优化及其水解物对真菌毒素吸附研究[J]. 中国粮油学报, 2023, 38(8): 206-212.
[16]EKPENYONG M, ASITOK A, ANTIGHA R, et al.Bioprocess Optimization of nutritional parameters forenhanced anti-leukemic L-asparaginase production byAspergillus candidus UCCM 00117: A sequential statisticalapproach[J]. International Journal of Peptide Research andTherapeutics, 2021, 27: 1501-1527.
[17]华逸舟, 刘奕辰, 潘伟, 等. 基于改进粒子群算法的无轴承永磁同步电机多目标优化设计[J]. 中国电机工程学报,2023, 43(11): 4443-4452.
[18]WU Q B, ZHANG X Y, CHEN X A, et al. Improvement ofFK506 production via metabolic engineering-guided combinationalstrategies in Streptomyces tsukubaensis[J].Microbial Cell Factories, 2021, 20: 166.
[19]BALAKRISHNAN M, JEEVARATHINAM G, KUMAR SK S, et al. Optimization and scale-up of α-amylase productionby Aspergillus oryzae using solid-state fermentation ofedible oil cakes[J]. BMC Biotechnology, 2021, 21(1): 33.
[20]MOREIRA F G, LENARTOVICZ V, SOUZA C G MD, et al. The use of a-methyl-D-glucoside, a synthetic analogueof maltose, as inducer of amylase by Aspergillus sp insolid-state and submerged fermentations[J]. BrazilianJournal of Microbiology, 2001, 32: 15-19.
[21]陈勇, 李静. 氮源优化及新型补糖工艺提高红霉素效价研究[J]. 粮油食品科技, 2015, 23(3): 101-104.
[22]代真真. 黑曲霉柠檬酸发酵过程研究及其优化[D]. 上海:华东理工大学, 2012.
[23]张文芝, 郭坚华. 微生物发酵工艺优化研究进展[J]. 广东农业科学, 2013, 40(6): 114-117.
[24]GUILLEMETTE T, VAN PEIJ N, GOOSEN T, et al.Genomic analysis of the secretion stress response in the enzyme-producing cell factory Aspergillus niger[J]. BMCGenomics, 2007, 8: 158.
[25]ZHANG J, ZHOU J W, LIU J, et al. Development of chemicallydefined media supporting high cell density growth ofKetogulonicigenium vulgare and Bacillus megaterium[J].Bioresource Technology, 2011, 102(7): 4807-4814.
[26]ZHENG Z Y, GUO X N, ZHU K X, et al. Artificial neuralnetwork: Genetic algorithm to optimize wheat germ fermentationcondition: Application to the production of twoanti-tumor benzoquinones[J]. Food Chemistry, 2017, 227:264-270.
[27]ZHANG X T, ZHANG Q G, LI Y M, et al. Modeling andoptimization of photo-fermentation biohydrogen productionfrom co-substrates basing on response surface methodologyand artificial neural network integrated geneticalgorithm[J]. Bioresource Technology, 2023, 374: 128789.
[28]LAHIRI D, NAG M, DUTTA B, et al. Artificial neural networkand response surface methodology-mediated optimizationof bacteriocin production by Rhizobium leguminosarum[J]. Iranian Journal of Science and Technology, TransactionsA: Science, 2021, 45: 1509-1517.
[29]薛佳韵, 赵明霞, 王泽建, 等. 豆油添加对尼莫克汀发酵的影响[J]. 华东理工大学学报(自然科学版), 2020, 46(4):533-542.
(责任编辑:王晓丽)
基金项目: 国家重点研发计划(2021YFC2100205)

