硼对藜麦抗氧化酶活性的影响
马琦琦 李丽君 王斌 刘平 霍晓兰

摘要為研究硼(B)对藜麦生理特性的影响,进行喷施硼肥盆栽试验。选用3个藜麦品种(晋藜1号、晋藜2号、晋藜3号),在拔节期进行叶面喷施0%(CK)、0.1%(B1)、0.2%(B2)、0.3%(B3)的硼酸溶液50 mL 2次。结果表明,相同生长期内,随着施硼量的增加,藜麦叶片SOD活性逐渐下降,POD活性先升高后降低,CAT活性逐渐升高。相同浓度条件下,随生长期延长,3种酶活性均表现为先升高后降低。在灌浆期,3个藜麦品种SOD活性最高;硼浓度为0.3%时,与对照相比,3个藜麦品种叶片SOD活性分别降低21.24%、15.26%、10.33%。整体来看,3个藜麦品种叶片POD活性在抽穗期最高;硼浓度为0.3%时,与对照相比,3个藜麦品种叶片POD活性分别提高-3.99%、-5.21%、5.28%。3个藜麦品种叶片CAT活性在灌浆期最高;硼浓度为0.3%时,与对照相比,3个藜麦品种叶片CAT活性分别提高25.31%、26.19%、29.48%。说明施硼可以调节藜麦抗氧化酶水平,提高藜麦的抗逆性,缓解缺硼对藜麦生长造成的不利影响。总体来看,当硼浓度为0.3%时,3个藜麦品种生理特性良好。实际生产中,应选用0.3%的硼较合适。
关键词藜麦;硼;超氧化物歧化酶;过氧化物酶活性;过氧化氢酶活性
中图分类号S 143.7+1文献标识码A文章编号0517-6611(2023)24-0139-05
doi:10.3969/j.issn.0517-6611.2023.24.030
Effects of Boron on the Antioxidant Enzymes Activity of Quinoa
MA Qiqi1,2,LI Lijun2,3,WANG Bin2,3 et al
(1. College of Life Science, Shanxi University, Taiyuan, Shanxi 030006;2. College of Resources and Environment, Shanxi Agricultural University, Taiyuan ,Shanxi 030031;3.Key Laboratory of Soil Environment and Nutrient Resources of Shanxi Province, Taiyuan, Shanxi 030031 )
AbstractTo evaluate the impact of boron (B) on the antioxidant enzymes (SOD, POD and CAT) in quinoa leaves, a pot experiment was conducted. In this experiment, three varieties of quinoa (Jinli No.1, Jinli No.2 and Jinli No.3) were selected, and quinoa leaves surfaces were treated with a spray containing 0% (CK), 0.1% (B1), 0.2% (B1), and 0.3% (B3) of B for each variety quinoa for 2 times at elongation period. The results indicated that the stress resistance of quinoa improved with different boron. The variation of SOD, POD and CAT activities were observed in response to different boron levels. At the same growing period, the SOD activity in the quinoa leaves decreased, the POD activity first increased and then decreased, and the CAT activity increased with the increasing boron concentrations. At the same boron concentration, with the extension of the growing period, these antioxidant enzymes first increased and then decreased. The SOD activities in the three varieties of quinoa leaves were the highest in the grouting period, and they were 21.24%,15.26% and 10.33% lower at 0.3% B than that of CK, respectively. On the whole, the POD activities in the three varieties of quinoa leaves were the highest in the heading period, and they increased by -3.99%, -5.21% and 5.28% at 0.3% B than that of CK, respectively. The CAT activity in the three varieties quinoa leaves was the highest in the grouting period, and the CAT activity at 0.3% B were 25.31%, 26.19% and 29.48% higher than that of CK, respectively. At 0.3% B treatment, the SOD and POD activity in the three types of quinoa leaves were lower than those of CK, while CAT activity was higher. Boron was helpful to regulate the antioxidant enzyme level, remove reactive oxygen species and alleviate the adverse effects of boron deficiency on the growth of quinoa. The physiological characteristics in the three types of quinoa leaves at 0.3% B worked best. Above all, in actual production, 0.3% B was the best choice.
Key wordsChenopodium quinoa Willd;Boron;SOD;POD;CAT
藜麦(Chenopodium quinoa Willd)种植源自南美洲,也被称作南美藜[1],是一种苋科藜属植物[2]。藜麦亦被称为假谷类作物[3],其中所含营养物质十分丰富。藜麦中蛋白质含量高,维生素种类丰富,其中的膳食纤维和矿物质(钙、锌、铁)含量也较高[4]。从藜麦种植初始,人们就认识到藜麦优良的营养特性,目前许多国家都意识到其重要的营养价值。联合国粮农组织极其认可藜麦的营养价值,认为藜麦可以满足人体需要的多种营养物质[5],并于2013年定为国际藜麦年。藜麦中多种物质具有抗氧化作用,增强人体免疫力,预防一些疾病的发生[6]。藜麦具有耐瘠、耐旱、耐寒以及适应性强等优良特性[7],可以适应多种气候,因此得到广泛种植。近年来,我国多地(甘肃、山西、青海、吉林、西藏、河南等)陆续广泛推广和种植藜麦[8],2008年山西省静乐县开始大规模种植藜麦。
硼是植物生长不可缺少的微量元素,能有效促进植物代谢,提高植物抗逆性,从而促进植物的生长发育。农作物生长过程中,低硼胁迫可使根伸长受阻、抑制根系对养分的吸收、影响细胞壁结构的完整性、阻碍根瘤的形成[9],农作物正常的生长发育受到影响,导致农作物产量受损、品质降低,造成农户经济利益损失[10]。
在没有外界不利因素存在时,植物细胞正常代谢过程中会产生活性氧(ROS),它是一类具有很强的氧化能力的含氧物质。此时,植物体中ROS的产生速度和清除速度处于动态平衡状态,ROS不会在植物体中过量积累,不会因其浓度变化对植物体造成氧化损伤。当植物体受到不良环境因素胁迫时,ROS产生速度大于被清除速度,这种动态平衡被打破,其体内ROS会过量积累,对植物细胞结构功能造成氧化损伤[11]。在这种情况下,过量累积的ROS必须及时被清除,才能保证植物体进行正常的生命活动。生物体在长期进化过程中,体内形成了活性氧防御系统对抗外界不利因素的胁迫[12]。防御系统包括抗氧化酶与抗氧化剂,通过它们在植物体内的相互协作,清除植物自身正常代谢与在逆境条件下产生的活性氧。植物体内抗氧化酶主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)[13-14]。SOD第一个参与ROS的清除,可将O-2·歧化为H2O2和O2,降低超氧化物对植物的伤害;POD以H2O2为底物进行植物体内的氧化还原反应,CAT将H2O2分解为H2O与O2,二者作用机理不同,均发挥清除H2O2的作用,使植物体免受氧化损伤[15]。缺硼会导致植物体中活性氧的产生[16],对植物生长产生不利影响。SOD、POD、CAT均为植物体内重要的抗氧化酶,可以清除活性氧,保护植物免遭损伤。
由于藜麦的营养价值日益得到关注,不同地区与国家种植藜麦的面积逐渐增多。近年来,山西省藜麦种植面积不断扩大。藜麦作为一种新兴营养功能食品,未来将拥有更广阔的市场,利用硼肥提高藜麦的抗氧化作用至关重要。目前硼对其他农作物的影响研究较多,而对藜麦抗氧化酶方面的影响研究未见报道。笔者研究喷施硼肥对3个品种藜麦生理特性的影响,明确施硼对藜麦抗氧化作用的一般规律,为提高山西藜麦产量与改善品质提供理论依据与技术支撑。
1材料与方法
1.1试验材料
盆栽试验在山西农业大学资源环境学院日光温室内进行。供试土壤取自山西省静乐县,土壤理化性质:全氮量0.75 g/kg,有效磷4.4 mg/kg,速效钾96 mg/kg,pH 8.57,有效硼0.05 mg/kg,有机质12.3 g/kg。根据土壤元素丰缺指标,试验用土为缺硼土壤[17]。藜麦于2021年3月10日播种,2021年7月30日收获。
供试作物藜麦种子为晋藜1号、晋藜2号、晋藜3号,由山西省农业科学院生物中心提供。供试肥料为尿素(N 46%)、过磷酸钙(P2O5 16%)、硫酸钾(K2O 54%)、硼酸(H3BO3)。
1.2试验设计
试验设为CK(不施硼)、B1(0.1%硼酸)、B2(0.2%硼酸)、B3(0.3%硼酸)。
晋藜1号、晋藜2号、晋藜3号均为以上处理。共12个处理,每个处理6次重复,72盆。
盆栽试验用塑料盆,上口直径30 cm,底部直径24 cm,盆高30 cm。每盆装风干土18 kg,将氮(0.54 g/kg)、磷(1.06 g/kg)、钾肥(0.26 g/kg)作为基肥一次性施入[18]。每盆均匀播撒藜麦种子100粒。
试验期间,根据藜麦各生长期的缺水状况确定浇水量,用去离子水浇水。藜麦幼苗长至三叶一心时,挑选长势均匀的幼苗,进行定苗,每盆留15株。待藜麦生长至拔节期,对其叶面喷施0.1%、0.2%、0.3%的硼酸溶液[19-20],每盆噴施50 mL,7 d后喷施第2次。
分别在孕穗期(2021年5月27日)、抽穗期(2021年6月17日)、灌浆期(2021年7月7日)、成熟期(2021年7月27日)进行整株藜麦采样。采样后置于-78 ℃冷冻保存,随后进行抗氧化酶(SOD、CAT、POD)活性的测定。
1.3测定项目与方法
将样品从-78 ℃冰箱中取出,选取叶片部分,加入pH为7的磷酸盐缓冲液,在冰浴条件下研磨、离心,制成10%匀浆液。按照南京建成生物工程研究所试剂盒进行SOD、POD、CAT活性测定。
1.4数据处理与分析
利用Excel 2018进行图表制作,用SPSS 20.0软件进行单因素方差分析,用LSD法和Duncan法检验差异显著性。
2结果与分析
2.1硼对藜麦叶片SOD活性的影响
从图1可以看出,硼可诱导3个藜麦品种叶片SOD活性变化。
试验范围内,晋藜1号叶片SOD活性从孕穗期的465.00~487.03 U/g,到抽穗期的499.11~600.85 U/g,到灌浆期的556.63~706.78 U/g,再到成熟期的548.65~637.11 U/g。同一生长期内,随着施硼量的增加,藜麦叶片SOD活性呈下降趋势。当硼为0.3%时,各生长期的藜麦叶片SOD活性最低,较CK分别降低4.52%、16.95%、21.24%、13.88%;除孕穗期外,其余生长期SOD活性与CK相比均显著降低。
对于晋藜2号,硼浓度在0.1%~0.3%时,藜麦叶片SOD活性为从孕穗期的432.48~479.69 U/g,到抽穗期的527.88~584.44 U/g,到灌浆期的579.53~683.86 U/g,再到成熟期的488.48~607.61 U/g。各生长期内,随着硼浓度的提高,藜麦叶片SOD逐渐降低。当硼为0.3%时,各生长期藜麦叶片SOD活性最低,较CK分别降低9.84%、9.67%、15.25%、19.60%;在灌浆期与成熟期,与CK相比,藜麦叶片SOD活性显著降低。
喷施不同浓度硼条件下,晋藜3号叶片SOD活性从孕穗期479.08~498.17g U/g,到抽穗期518.65~575.42 U/g,到灌浆期617.15~688.23 U/g,再到成熟期 607.52~653.01 U/g。同一生长期内,随着硼浓度的增加,藜麦叶片SOD活性呈下降趋势。当硼浓度为0.3%时,各生长期藜麦叶片SOD活性最低,较CK分别降低3.81%、9.86%、10.33%、6.96%;除孕穗期外,与CK相比,其余生长期藜麦叶片SOD活性显著降低。
以上结果显示,相同生长期内,随着硼浓度的提高,3个藜麦品种叶片SOD活性均表现为降低趋势;当硼为0.3%时,藜麦叶片SOD活性最低。在相同硼浓度条件下,随着生长期的延续,SOD活性表现为先升高后降低趋势,在灌浆期最高;当硼为0.3%时,与对照相比,3个藜麦品种叶片SOD活性分别降低21.24%、15.26%、10.33%。
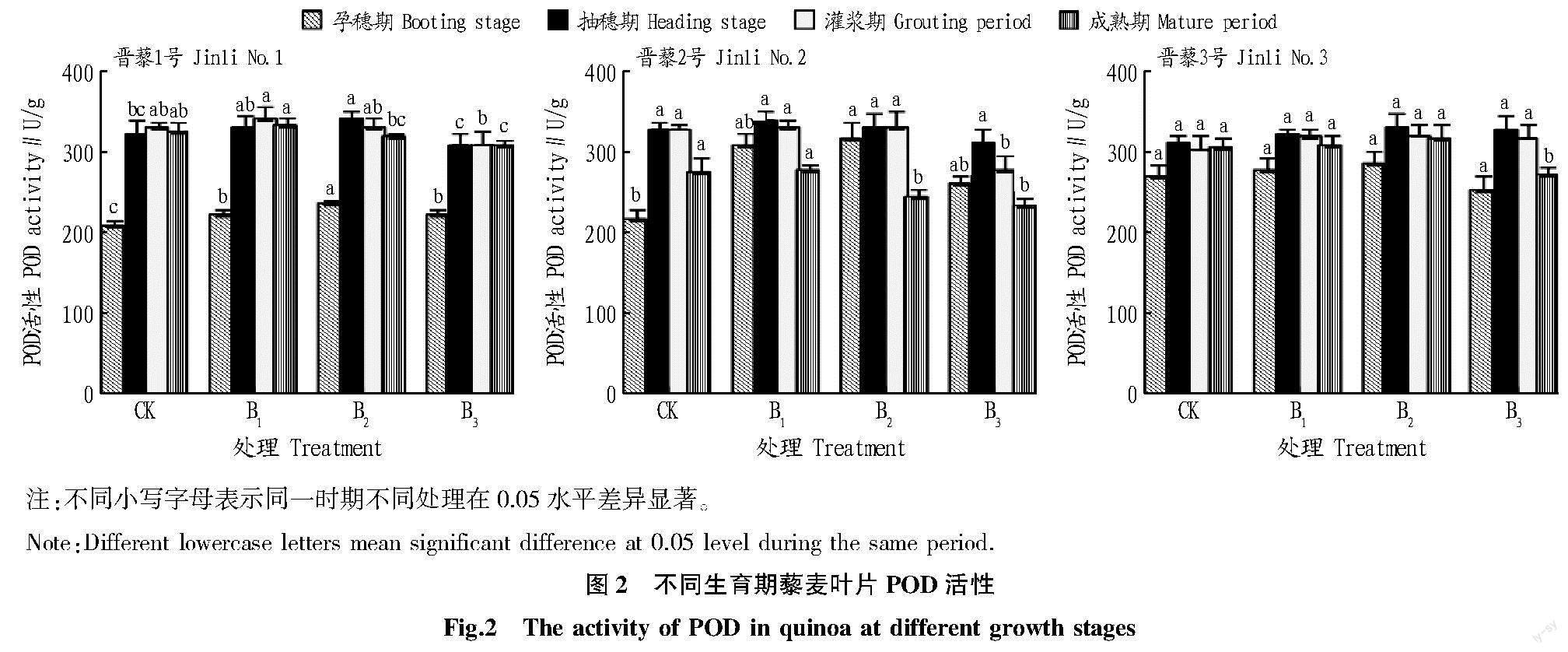
2.2硼对藜麦叶片POD活性的影响
由图2可知,不同硼浓度处理下,晋藜1号叶片POD活性孕穗期206.67~234.47 U/g,抽穗期309.66~342.99 U/g,灌浆期309.62~340.45 U/g,成熟期308.56~332.15 U/g。随着施硼量的增加,同一生长期藜麦叶片POD均呈先上升后降低趋势。当硼水平为0.3%时,与CK相比,孕穗期POD活性提高7.09%,抽穗期、灌浆期、成熟期POD活性分别降低3.99%、6.36%、4.63%。当硼浓度为0.3%时,与CK相比,孕穗期和成熟期的藜麦叶片POD活性差异显著。
对于晋藜2号,喷施不同浓度的硼,藜麦叶片POD活性为孕穗期217.26~316.27 U/g,抽穗期328.59~339.59 U/g,灌浆期78.16~328.35 U/g,成熟期233.48~278.17 U/g。同一生长期内,随着施硼量的增加,藜麦叶片POD活性先升高后降低。当硼浓度为0.3%时,各生长期(除孕穗期外)藜麦叶片POD活性最低,且均低于CK。当硼水平为0.3%时,与CK相比,孕穗期POD活性提高19.33%,抽穗期、灌浆期、成熟期POD活性分别降低5.21%、15.29%、14.94%。当硼为0.3%时,与CK相比,灌浆期、成熟期藜麦叶片POD活性显著降低。
硼浓度在0.1%~0.3%时,晋藜3号叶片POD活性为孕穗期253.13~284.48 U/g,抽穗期310.06~330.31 U/g,灌浆期304.15~320.26 U/g,成熟期270.26~314.56 U/g。各生长期内,随着硼浓度的增加,藜麦叶片POD活性呈先上升后下降趋势。当硼浓度为0.3%时,孕穗期、成熟期的藜麦叶片POD活性最低,且均低于CK;与CK相比,2个生长期藜麦叶片POD活性降低5.69%和11.43%;抽穗期、灌浆期POD活性分别提高5.28%、4.27%;与CK相比,成熟期的藜麦叶片POD活性显著降低。
以上结果显示,相同生长期内,随着硼浓度的提高,3个藜麦品种叶片POD活性均表现为先升高后降低趋势。整体来看,当硼浓度为0.3%时,藜麦叶片POD活性最低。相同硼浓度时,随着生长期的延长,藜麦叶片POD活性表现为先增加后降低趋势,在抽穗期最高;当硼浓度为0.3%时,与对照相比3个藜麦品种叶片POD活性分别提高-3.99%、-5.21%、5.28%。
2.3硼对藜麦叶片CAT的影响
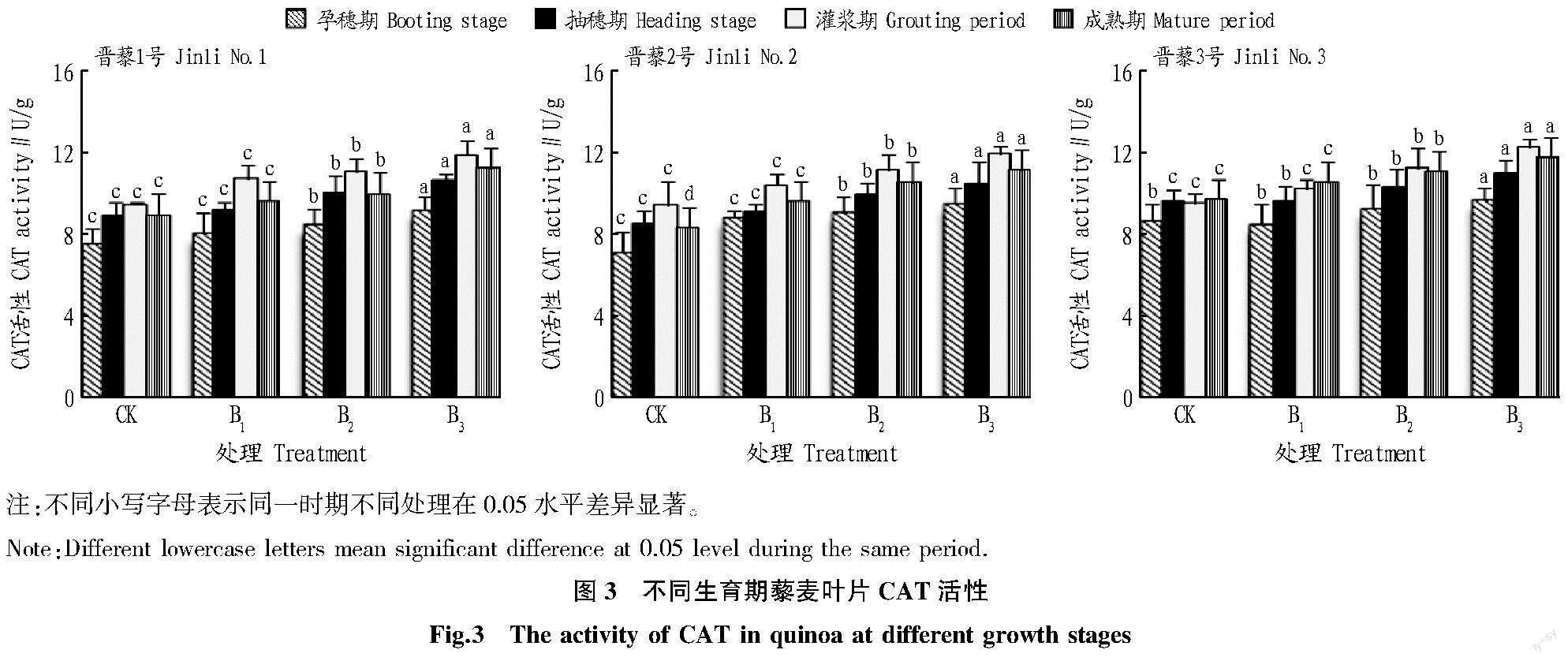
由图3可知,叶片喷施硼可提高3个藜麦品种叶片CAT活性。
试验范围内,晋藜1号叶片CAT活性为孕穗期7.54~9.23 U/g,抽穗期8.97~10.64 U/g,灌浆期9.48~11.88 U/g,成熟期8.99~11.24 U/g。同一生長期内,随着硼浓度的增加,藜麦叶片CAT活性呈上升趋势,CAT活性最高时的施硼水平均为0.3%。当硼浓度为0.3%时,各生长期藜麦叶片CAT活性较CK分别增加22.51%、18.58%、25.31%、25.07%;与CK相比,各生长期CAT活性显著提高。
硼浓度为0.1%~0.3%时,晋藜2号叶片CAT活性为孕穗期7.14~9.56 U/g,抽穗期 8.50~10.52 U/g,灌浆期9.46~11.93 U/g,成熟期8.35~11.18 U/g。同一生长期,随着施硼量的增加,藜麦叶片CAT活性逐渐上升;硼为0.3%时,CAT活性最高,各生长期藜麦叶片CAT活性较CK分别增加33.88%、23.68%、26.19%、33.85%,且各生长期藜麦叶片CAT活性显著高于相应生长期CK。同一硼浓度时,随着生长期的延长,CAT活性表现为先升高后降低趋势,在灌浆期最高。
对于晋藜3号,不同硼肥处理下,藜麦叶片CAT活性为孕穗期8.71~9.68 U/g,抽穗期 9.61~10.98 U/g,灌浆期9.50~12.30 U/g,成熟期9.75~11.78 U/g。同一生长期内,随硼喷施量的增加,藜麦叶片CAT活性逐渐上升。硼浓度为0.3%时,藜麦叶片CAT活性最高;与CK相比,各生长期藜麦叶片CAT活性较CK分别增加11.22%、14.33%、29.48%、20.82%,且各生长期CAT活性显著高于相应生长期CK值。相同硼浓度的CAT活性,随生长期延长表现为先升高后降低,在灌浆期最高。
随着硼浓度的提高,在相同生长期内,3个藜麦品种叶片CAT活性均表现为上升趋势。在相同硼浓度条件下,随着生长期的延长,CAT活性表现为先升高后降低趋势,在灌浆期最高。
3讨论
硼可调节植物体内一些酶活性,对它们产生激活或抑制作用[21]。植物体内缺硼时,其体内ROS产生与清除间的平衡被打破,导致大量ROS在细胞间积累,对植物体造成氧化损伤[22]。适宜补充硼可降低ROS含量,抑制膜质过氧化作用,起到保护植物免受氧化损伤的作用[23]。因此,对生长在缺硼土壤上的植物补充硼至关重要。
随着生育进程的延续,喷施相同硼浓度时,藜麦叶片SOD、CAT、POD活性逐渐提高,SOD、CAT活性在灌浆期达到最大,之后有所下降。说明在不同生长发育阶段,藜麦叶片中3种抗氧化酶活性存在差异,灌浆期藜麦叶片的抗氧化酶活性最高,此时的藜麦抗氧化能力较孕穗期、抽穗期、成熟期强。在植物生长周期中,抗氧化酶活性在营养生长阶段比开花期低。不同生育期叶片对相同环境条件下的氧化应激反应不同。随着叶龄的延长,叶片中ROS浓度表现为先增加后减少趋势,其抗氧化能力也同样表现为先升高后降低趋势[11]。这种现象在其他作物中也可以看到[11,24-25]。
在正常情况时,植物代谢过程中产生活性氧(ROS)速度和清除速度处于一动态平衡状态中,ROS不会对植物体造成氧化损伤。当植物体受到外界不良环境胁迫时,ROS产生速度会大于清除速度,对植物造成氧化损伤[11]。此时,生物体内的SOD可将O-2·歧化为H2O2和O2,降低O-2·对细胞的伤害[26]。对藜麦喷施硼肥后,缺硼对藜麦生长造成的氧化损伤得到缓解,其体内自由基的累积相对减少[22],SOD活性降低,且随着喷施硼量的增加而降低。即随着硼浓度的增加,超氧自由基在藜麦体内的累积逐渐减少,SOD活性也随之减低,缓解了缺硼对藜麦生长的抑制作用。这一现象可在利用H2S缓解硼毒害下星星草试验中观察到[27]。POD、CAT在植物体内的主要作用是将H2O2分解为H2O和O2,降低H2O2浓度,但二者的作用机理不同[15]。當硼浓度为0.1%、0.2%时,由于缺硼导致高浓度H2O2累积在藜麦叶片中还没有及时被清除,POD活性继续保持上升趋势,将过量的H2O2分解为H2O和O2,降低H2O2对藜麦的氧化损伤;硼浓度为0.3%时,由于高浓度硼的喷施,缓解了缺硼对藜麦氧化损伤程度,POD活性开始降低。这与利用H2S缓解硼毒害下星星草的POD活性变化[27],硒对硼胁迫油菜幼苗活性氧伤害POD活性影响[22]以及在严重缺硼土壤上,施用硼对油菜苗期叶片POD活性影响[28]现象类似。在试验范围内,CAT活性呈升高趋势,说明CAT清除H2O2能力不断提高,缓解了缺硼对藜麦叶片的氧化损伤。这一现象在油菜、大豆中也可观察到[24,28]。
以上结果可以看出,喷施硼肥起到了调节藜麦叶片抗氧化酶活性的作用。随着硼肥浓度的提高,抗氧化酶活性表现出不同程度的变化,SOD活性下降较早,POD活性下降较迟,而CAT活性保持升高趋势[29]。俞莉莉等[16]研究表明,在不同硼浓度下,红掌叶片中的SOD和POD活性变化趋势一致。何子平等[28]在严重缺硼土壤上施用硼肥显著降低油菜苗期叶片POD活性,提高CAT活性。区焯林等[30]研究发现,钼肥和硼肥配施显著提高冬季草坪草CAT活性。徐建明等[31]研究表明,小麦幼苗用0.6 mg/kg的硼浓度处理时长势最佳,根系活力加强,SOD和POD的活性提高。这与该研究结果不同,可能是由于不同植物,不同生长阶段,土壤缺硼程度不同,喷施硼肥浓度不同,导致植物中抗氧化酶发生作用的程度不同,酶活性变化也不同[22]。藜麦叶片SOD、POD 和CAT 活性变化趋势是这3种酶彼此协调的结果,3种酶共同作用恢复藜麦体内ROS产生与清除的动态平衡,维持ROS在较低水平,解除ROS的氧化胁迫,使藜麦的机体代偿功能增强,确保藜麦的正常生长和代谢[14,32]。
4结论
该研究结果表明,硼对3个藜麦品种叶片抗氧化酶均有诱导作用。相同生长期内,随着硼浓度提高,藜麦叶片中SOD活性逐渐降低,POD活性先升高后降低,CAT活性逐渐升高;当硼浓度为0.3%时,SOD活性最低,CAT活性最高。相同硼浓度条件下,随生长期延长,3种抗氧化酶活性均表现为先升高后降低趋势,SOD、CAT活性在灌浆期最高。
叶面喷施适宜的硼肥(0.3%),可以优化藜麦的生理特性。0.3%硼肥可以降低藜麦叶片中SOD、POD活性,提高CAT活性。微量元素硼的施用对藜麦氧化酶活性有一定调节作用,缓解缺硼对藜麦生长造成的不利影响,能够促进藜麦生长发育,提高藜麦的抗逆性。
参考文献
[1] TANG Y,TSAO R.Phytochemicals in quinoa and amaranth grains and their antioxidant,antiinflammatory,and potential health beneficial effects:A review[J].Molecular nutrition & food research,2017,61(7):1-39.
[2] 阿图尔·博汗格瓦,希尔皮·斯利瓦斯塔瓦.藜麦生产与应用[M].任贵兴,叶全宝,等译.北京:科学出版社,2013:49-50.
[3] 陈树俊,胡洁,庞震鹏,等.藜麦营养成分及多酚抗氧化活性的研究进展[J].山西农业科学,2016,44(1):110-114,122.
[4] 顾娴,黄杰,魏玉明,等.藜麦研究进展及发展前景[J].中国农学通报,2015,31(30):201-204.
[5] 魏爱春,杨修仕,么杨,等.藜麦营养功能成分及生物活性研究进展[J].食品科学,2015,36(15):272-276.
[6] FILHO A M,PIROZI M R,BORGES J T,et al.Quinoa:Nutritional,functional,and antinutritional aspects[J].Critical reviews in food science and nutrition,2017,57(8):1618-1630.
[7] JACOBSEN S E,LIU F L,JENSEN C R.Does rootsourced ABA play a role for regulation of stomata under drought in quinoa(Chenopodium quinoa Willd.)[J].Scientia horticulturae,2009,122(2):281-287.
[8] 卢宇,张美莉.藜麦生物活性物质研究进展[J].农产品加工,2015(19):58-62.
[9] 董肖昌,姜存仓,刘桂东,等.低硼胁迫对根系调控及生理代谢的影响研究进展[J].华中农业大学学报,2014,33(3):133-137.
[10] 方益华.高硼胁迫对油菜光合作用的影响研究[J].植物营养与肥料学报,2001,7(1):109-112.
[11] 徐松华.逆境条件下植物体内活性氧代谢研究进展[J].安徽农学通报,2021,27(21):29-32.
[12] 马旭俊,朱大海.植物超氧化物歧化酶(SOD)的研究进展[J].遗传,2003,25(2):225-231.
[13] 白英俊,李国瑞,黄凤兰,等.活性氧与植物抗氧化系统研究进展[J].安徽农业科学,2017,45(36):1-3.
[14] 李海峰,王瑞华,韩琛.农药胁迫对植物抗氧化系统的研究现状[J].农产品加工,2018(2):59-62.
[15] 申圣圣.NaCl脅迫对藜麦种子萌发和幼苗生长的影响[D].太原:山西师范大学,2020.
[16] 俞莉莉,周力,何小弟.硼及基质对红掌SOD、POD比活性及MDA含量影响[J].林业科技开发,2012,26(4):120-122.
[17] 许新廷.基于土壤养分丰缺指标的章丘市冬小麦—夏玉米轮作推荐施肥技术的研究[D].泰安:山东农业大学,2016.
[18] 惠薇,王斌,李丽君,等.钾肥对藜麦生长及养分吸收的影响[J].山西农业科学,2021,49(6):734-738.
[19] 樊卫国,叶双全.花期喷硼对刺梨果实产量及品质的影响[J].中国南方果树,2016,45(4):111-113.
[20] 张景全,周同永.叶面喷施硼肥对蓝莓产量及品质的影响[J].云南农业大学学报(自然科学),2021,36(3):553-557.
[21] 黄益宗.植物对硼素不足的反应及其成因探讨[J].土壤与环境,2002,11(4):434-438.
[22] 段碧辉.硒对硼胁迫下油菜幼苗生长、活性氧代谢以及养分吸收的影响[D].武汉:华中农业大学,2014.
[23] 祁寒,孙光明,李绍鹏,等.硼在作物生长过程中的研究现状[J].安徽农业科学,2008,36(16):6649-6650,6652.
[24] 姜佰文,戴建军,王春宏,等.干旱胁迫下硼对大豆植株保护酶活性的影响[J].作物杂志,2009(1):50-53.
[25] 刘鹏,杨玉爱.钼、硼对大豆叶片膜脂过氧化及体内保护系统的影响[J].植物学报,2000,42(5):461-466.
[26] 李妍,张超,王士岭,等.NaCl 胁迫对荞麦生长及抗氧化酶活性的影响[J].现代农业科技,2021(1):9-11,14.
[27] 宫艳超,靳华蕾,郑永丽.硫化氢对硼毒害下星星草幼苗SOD、POD活性的影响[J].天津职业院校联合学报,2019,21(9):96-101.
[28] 何子平,皮美美,刘武定.硼钾营养相互配合对油菜叶片CAT和POD活性及根膜透性的影响[J].华中农业大学学报,1993,12(5):468-471.
[29] 王娟,李德全.逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J].植物学通报,2001,36(4):459-465.
[30] 区焯林,喻敏,王灼明.硼、钼、硅对草坪草海滨雀稗CAT和POD活性的影响[J].韶关学院学报,2009,30(6):57-60.
[31] 徐建明,毛善国,张美圆.硼对小麦幼苗生长及体内SOD、POD活性的影响[J].江苏农业科学,2006,34(6):49-51.
[32] 万春阳,王丹,侯俊玲,等.NaCl 胁迫对甘草生长及抗氧化酶活性的影响[J].现代生物医学进展,2011,11(10):1805-1809.

