QuEChERS方法应用研究进展
邵丽 王晓 张伟 徐淑飞


摘要QuEChERS方法快速、简单、便宜、高效、安全,被认为是很可靠的分析方法,在农药残留分析方面取得了重大进展。QuEChERS方法可有效分析其他化合物,包括各种复杂基质中的药物、真菌毒素等。概述了QuEChERS方法起源及研究过程,及其在农药、药物、毒素等领域的应用及优化,为QuEChERS方法应用发展提供参考。
关键词QuEChERS;食品;提取;农药;药物;毒素;应用
中图分类号S-3 文献标识码A文章编号0517-6611(2023)24-0009-10
doi:10.3969/j.issn.0517-6611.2023.24.003
Research Progress in the Application of the QuEChERS Method
SHAO Li1,WANG Xiao1,ZHANG Wei2 et al
(1.Zaozhuang Custom, Zaozhuang,Shandong 277100;2. Dongying Custom, Dongying,Shandong 257000)
AbstractThe QuEChERS method is fast, simple, inexpensive, efficient, and safe, and is widely regarded as a reliable analytical method, making significant progress in pesticide residue analysis. The QuEChERS method can effectively analyze other compounds, including drugs and fungal toxins in various complex matrices. This paper provides an overview of the origin and research process of the QuEChERS method, as well as its application and optimization in fields such as pesticides, drugs, toxins, etc., providing reference for the application and development of the QuEChERS method.
Key wordsQuEChERS;Food;Extraction;Pesticide;Drug;Toxin;Application
2003年,米開朗基罗、阿纳斯塔西亚德斯等发明了使用乙腈溶剂进行萃取、分配,使用“分散固相萃取”的快速、简便的多农药残留检测法,即QuEChERS法。QuEChERS法因其固有优势引起了各官方实验室的广泛关注,并且在该方法的基础上进行了各种改良和优化。但2003年引入的QuEChERS方法并不是全新的,固相萃取/分配已应用于提取多种分析物和多种基质,吸附剂也在分散固相萃取(d-SPE)步骤中被用于样品净化。然而,该方法中提取溶剂、盐和吸附剂的独特组合对于不同化合物的提取非常灵活、有效,QuEChERS方法应用灵活性表明,该方法经过优化仍然可以得到高回收率,目前已成为水果和蔬菜中农药分析的标准样品制备程序。同时,由于该方法具有“绿色化学”的固有优势,迅速扩展到从环境、农产品和生物基质中提取不同组分的化合物。基于此,概述了QuEChERS方法起源及研究过程,及其在农药、药物、毒素等领域的应用及优化,为QuEChERS方法应用发展提供参考。
1QuEChERS方法的起源及研究过程
最初QuEChERS方法用于水果和蔬菜中多类农药残留的研究[1],采用磷酸三苯酯(TPP)作为内标,GC-MS进行样品分析。样品均质化后,首先对其进行溶剂萃取/分离,然后通过d-SPE消除食品提取物中可能存在的干扰化合物净化提取物。
1.1样本称样和制备
QuEChERS方法中,研究者首先考虑样本称样量和样品制备的重要性。选取一部分样本进行代表性测试对于确保获得重要结果至关重要。同样,样品经过适当粉碎制备以获得最大化表面积,确保在摇动萃取过程中得到更好的提取效率。因此,根据之前的文献中的经验和证据,选择了称取10 g 样品,不同代表性的样品称样量通常为10~15 g。
1.2
QuEChERS方法对提取和净化的评估为了获得最大程度的简便性、快速性、高选择性、高回收率,对样品构成、提取溶剂、样品/溶剂比、萃取过程的类型和时间(混合或摇动)、萃取温度、添加非极性助溶剂/盐、净化剂这些条件进行了评估。
1.2.1
QuEChERS方法中提取溶剂的选择。通常,最常用于农药残留的多残留分析提取溶剂有丙酮、乙腈和甲醇。乙腈比其他2种溶剂具有广泛的极性、更高容量和选择性,此外乙腈与水有适当的混溶性,可以很好地渗透到样品的水性部分中,同时还可以通过添加盐来相对容易地进行相与相之间的分离。与其他溶剂相比,使用乙腈作为溶剂,在萃取过程中亲脂性材料、蜡、脂肪和色素的提取量大大减少。研究指出,乙腈提供了后续液液净化步骤的可能性。出于这种原因,尽管有在气相色谱蒸发过程中溶剂膨胀体积较大、挥发性更低、成本更高、毒性大的缺点,乙腈仍被选择作为QuEChERS方法的萃取溶剂。
1.2.2
QuEChERS方法中盐的选择。测试表明,MgSO4、MgCl2、NaNO3、NaCl、Na2SO4、LiCl和果糖能提高极性化合物的回收率。在研究的盐中,MgSO4提供了最完全的液-液相分离,并且能够更好地与大量的水结合。MgSO4与水结合时由于水合放热反应,萃取液温度能达到40~45 ℃,该温度有利于大部分农药的提取。此外,研究了单独或组合使用MgSO4和NaCl,NaCl单独使用(或与MgSO4结合使用)尽管回收率不令人满意,但通过添加NaCl能使相分离更完全。另外,使用NaCl使共提取的基质成分减少。
1.2.3QuEChERS方法中pH的選择。研究考虑到蔬菜和水果的pH在2~7范围内,基于农业中使用的几种农药在碱性pH下不太稳定,笔者研究了当苹果汁的酸度分别为2.5、3.0、4.0、5.0、6.0和7.0时pH对回收率的影响。研究发现,在低pH条件下农药的回收率不会大大降低,并且在后续研究中使用了酸性pH。固有低pH的样品可以在不调节pH的情况下直接使用,但具有较高pH的样品应调整pH<4,以尽量减少农药降解。此外,pH可能会影响共提取化合物的量,根据得到的结果,发现某些酸(包括脂肪酸)的量随着pH的降低而增加。因此,添加盐的量应谨慎优化以减少这种共提取物。最后,不仅是样品的pH,还有ACN相的pH也会影响农药的稳定性(PSA会增加农药提取物的pH)。
1.2.4QuEChERS方法中吸附剂、干燥剂的选择。乙腈相的净化和干燥是在d-SPE步骤中同时进行的,理想吸附剂的选择基于对所评估吸附剂(N-丙基乙基醚或PSA、GCB、中性氧化铝、强阴离子交换剂、氰丙基、氨基丙基)在乙腈提取物中去除共萃取物能力决定。PSA不保留农药,但会有效去除极性干扰物(包括脂肪酸、有机酸、糖和色素,如花青素),而GCB能有效去除色素(如叶绿素类、胡萝卜素)但对具有平面分子结构的药物显示出很强的亲和力,这明显降低了这些农药的回收率。
因此,QuEChERS的原始方法采用10 mL乙腈提取10 g样品,然后加入4 g无水MgSO4和1 g NaCl,立即通过涡旋混合以防止形成MgSO4团块。研究表明,MgSO4∶NaCl 质量比为4∶1时,在分离水相和有机相的能力方面效果最好,能保持高回收率和低干扰共萃取物。样品在5 000 r/min条件下离心5 min,然后将25 mg PSA和150 mg MgSO4添加到1 mL上清液中,涡旋振荡30 s,在6 000 r/min条件下离心10 min后,取上清液,上机GC-MS分析。
2QuEChERS方法中样品、溶剂、盐或吸附剂的量的优化
最初的QuEChERS方法被证明对各种样品中的数百种分析物都有效,尤其是食品基质中的农药残留[1-4],为了提高方法的性能,进行了后续优化,使该方法更好应用于一些难分析物和特殊样品的分析中。这些优化大多数是基于QuEChERS基本原理,优化了提取溶剂、盐、吸附剂的配方和d-SPE步骤,这些优化都是以在不同复杂性的基质中获得分析物高回收率、避免农药降解和减少基质效应为目的。作为通用QuEChERS方法,主要进行了3种优化。
第一,优化是为了将该方法应用到某些在提取过程中易发生离子化或降解的农药,解决该问题具体取决于基质的pH。因此,最初的无缓冲版本[1]演变为使用柠檬酸盐缓冲的2种官方方法,一种是由Anastassiades开发的缓冲能力相对较低的CEN标准方法EN15662[5],另一种是由Lehotay[6]开发的较高浓度的醋酸盐缓冲以提供更大的缓冲强度的
美国分析化学家协会(AOAC) 官方方法2007.01。2种版本的pH都在5左右,这也是为解决提取在酸性或碱性条件下敏感的农药(如氟哌啶醇、敌百灵、吡蚜酮、百菌清)的折中方案。这些标准方法已在世界各地的许多实验室中被广泛评估并采用,但是,对于基质(如具有高脂质含量的)不建议使用缓冲,因为PSA在这种pH下导致其保留能力降低,共萃取物增加[7]。
第二,关于d-SPE净化,其他优化包括使用不同量的PSA[7]或C18与PSA一起使用以获得更清洁的提取物。使用C18对于相对脂质含量较高的样品特别有效(如谷物)[8-9],并且不会对农药回收率产生不良影响,大量使用PSA会出现某些极性农药的回收率降低[7]的情况。因此,一些改进的方法仅使用C18去除脂肪,因为PSA不是必需的或PSA的加入降低了回收率[10]。
第三,GCB与PSA结合使用目的从绿色基质(例如生菜、菠菜或叶子)中去除叶绿素,从而减少提取物的颜色[9,11]。然而,GCB会使某些具有平面官能团的农药(如六氯苯、噻苯哒唑和特布磷)的回收率降低25%。
通过几个主要QuEChERS方法的比较表明,醋酸盐缓冲液用于提取均质后样品(15 g),通过添加干冰研磨后,加入15 mL 1% HOAc-ACN溶液和6.0 g无水MgSO4,1.5 g NaOAc,并加入150 mg无水MgSO4作为干燥剂以减少提取液含水量,50.0 mg PSA,50.0 mg C18,7.5 mg GCB净化,这些条件对于分析水果和蔬菜中的农药残留,对提取物的净化提供了最有效的样品预处理方法。对于谷物来说,2.5 g或5.0 g 样品中加入10 mL水以减弱分析物和基质之间的相互作用,提高萃取率,加入150 mg PSA,而不是50 mg[7]。
3QuEChERS方法中其他优化
3.1提取液
除了样品、溶剂、盐或吸附剂的量的简单变化之外,提取液也进行了一些优化,Gonzlez-Curbelo等[12]开发评估了3个不同版本的QuEChERS基于使用氯化铵和铵盐、甲酸盐和乙酸盐缓冲液的方法,这些盐被用于替代MgSO4和钠盐,因为MgSO4和钠盐倾向于以固体形式沉积,在MS源的表面以及可能在分析仪器内或在GC进样口衬管中导致仪器性能降低,而铵盐不构成离子源中的问题,因为其在离子源温度下容易分解,此外,铵可以增强分析物的离子化水平。这3种方法的比较验证了AOAC官方方法2007.01中的QuEChERS方法,使用甲酸缓冲液(7.5 g甲酸铵和15 mL 5%甲酸-乙腈溶液用于提取15 g水果、蔬菜样品)确保了合适的pH,以实现基质中大多数农药的高回收率。此外,对使用和不使用d-SPE净化进行了研究,没有观察到显著差异。该版本QuEChERS方法的真正目的是使用铵盐规避钠盐在MS分析中不理想的情况,此外,甲酸缓冲液用于LPGC-MS/MS、LC-MS/MS分析食品中农药的具有广泛适用性。Han等[13]也成功应用了甲酸铵缓冲液提取包括来自虾的42种不同的农药、17种环境污染物、PAHs、多氯联苯(PCBs)和阻燃剂。
3.2溫度
温度对热不稳定性分析物的影响也进行了评估。在加入无水MgSO4时由于其放热性,有些农药发生了降解,在提取前先冷冻样品[14]或加入冰水(<4 ℃)[15]可减少这种负面影响。通过比较发现,无水MgSO4纯度的变化能使温度产生显著差异,但对回收率影响不大[16]。
3.3d-SPE步骤
d-SPE步骤与冻结步骤相结合,冻结目的主要是低温下脂质发生沉淀,能够尽量去除基质中脂质成分[15-18]。它不需要使用额外的吸附剂,但明显增加了样品预处理时间,因为冻结时间一般是1~2 h。此外,试验表明,农药残留分析时在d-SPE步骤之后使用PSA和C18是没有必要的,在这种情况下,获得的共萃取物的量与冻结时获得的量相等[7]。Norli等[19]发现,从鱼类(罗非鱼和鲑鱼)提取22种有机氯农药(OCPS)和7种多氯联苯(PCBS)提取后增加冷冻过程能提高多种化合物回收率。方从容等[18]采用冷冻脂质过滤,结合分散固相萃取净化的QuEChERS方法,对鸡蛋中125种兽药残留的检测方法进行优化,提取液在-20 ℃冷冻处理2 h,再经分散固相萃取法净化,结果显示冷冻过滤后提取液中脂质含量大幅减少,并能显著降低基质效应的影响。毕军等[20]采用QuEChERS法结合冷冻诱导液液萃取(CI-LLE)技术对样品进行处理,以提高方法的富集和净化效果,研究考察了77种农药在不同乙腈-水比例(40%、50%、60%、70%、80%)下的绝对回收率和不同冷冻温度(-80、-30、-20 ℃)下77种农药的CI-LLE分层效果,试验发现77种农药在40%乙腈-水溶液比例时约75%农药的绝对回收率大于60%,不同的冷冻温度下均可达到稳定的冷冻诱导分层效果,其中-80 ℃下处理时间最短(7 min)。与常规的QuEChERS盐析净化相比,该方法增加了CI-LLE处理,约75%农药的富集倍数在3倍以上,通过CI-LLE处理,进一步使得提取液中的残留果胶、糖类和氨基酸等极性干扰物分配于下层水相,达到一定净化效果。
3.4新吸附剂材料的使用Z-Sep(氧化锆键合硅胶)及Z-Sep+(碳十八键合锆胶)是新的固相吸附剂,能有效吸附脂肪,主要用于植物油、鱼肉、玉米和毛豆中农药多残留分析的分散固相萃取。王连珠等[21]评估了PSA/C18混合物、Z-Sep+、Z-Sep+/C18混合物、C18 4种分散净化剂的净化效果,结果表明Z-Sep+/C18的净化效果最佳,6种化合物基质效应最小。另一种新型吸附剂称为ChloroFiltr,用于选择性减少来自绿色植物提取物中的叶绿素[22]。在这种情况下,在提取液中添加50 mg/mL吸附剂,待测化合物回收率没有明显降低。其他吸附剂的优化包括添加多壁碳纳米管(MWCNTS)[23-27]、硅藻土[28-29]、磁性纳米粒子[30]、氧化铝[31-32]、Florisil[33]。
3.5其他版本的净化步骤包括开发SPE小柱代替d-SPE步骤,氨丙基(-NH2)和PSA串联小柱、GBC和PSA串联小柱已被商业化使用。比较发现,尽管SPE程序更有效且具有更好的净化性、简便性,但d-SPE程序在常规分析中更具决定性,因此d-SPE仍然是大多数净化步骤中应用最为广泛的模式。此外,MgSO4对减少最终提取物中的水分的含量极为重要,但常常会堵塞玻璃填料,因此d-SPE的操作仍然比SPE更有效。
51卷24期邵 丽等QuEChERS方法应用研究进展
4QuEChERS方法的应用领域
4.1农药分析中的应用
农药的测定,尤其是食品基质中农药的测定是一个非常重要的话题,农药残留对人体健康有害,许多国家已将这些分析物列为污染物,各个国家为了涵盖已经暴露的污染农药的种类和数量,制定了很多的法规、控制措施。从这个意义上来说,各组织已经在水果、蔬菜、谷物、动物源性食品和水中建立了农药最大残留限量(MRL)。例如欧盟(EU)规定成人食品的MRL值在0.01~10.00 mg/kg,婴幼儿食品的MRL值在0.003~0.010 mg/kg,这就要求有更好的样品前处理方法,对复杂样品中的农药进行测定。多年来,传统检测方法需要使用大量的有毒有机溶剂,QuEChERS方法的引入,提供了一种快速有效的替代方案,特别是因为其有着显著的消除基质成分并获得农药高回收率的特点,很快取代了以前的大部分方法。水果和蔬菜中的广泛应用很快导致QuEChERS方法在其他食品基质中的应用,近年来多类农药残留分析有所增加。综上所述,美国分析化学家协会(AOAC)官方方法2007.01[15]和欧洲标准化委员会(CEN)标准方法BS EN15662-2018植物源性食品乙腈萃取/分配和分散式SPE-模块化QuEChERS法后用GC和LC分析测定农药残留量的多种方法[14]毫无疑问是该领域的先驱。
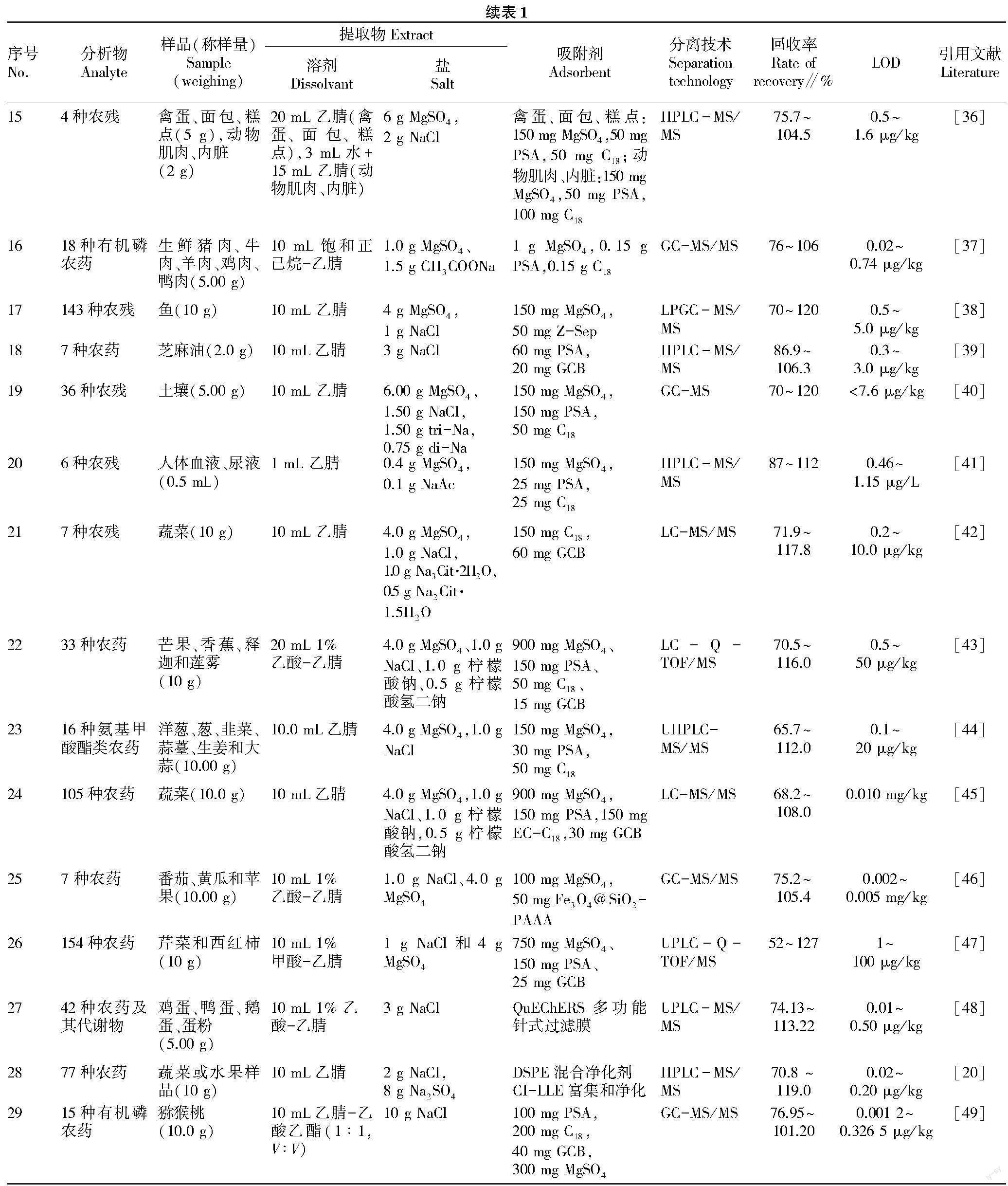
关于其他食品基质(表1),谷物[7,12,34]、茶叶[23]、药材[28]、乳制品[35]、肉类[36-37]、鱼[26,38]、油脂[39]、禽蛋[29,36,50]、果蔬[51]都有研究。赵暮雨等[26]使用基于MWCNTs的新型QuEChERS前处理方法对淡水产品中145种农药残留进行快速筛查,与传统QuEChERS方法进行了对比,比较了PSA-C18,PSA-C18-GCB与MWCNTs的净化效果。结果显示,经MWCNTs净化后的农药平均回收率为82%,而 PSA-C18和PSA-C18-GCB仅为69%和61%,并且大大降低了基质效应。张权等[27]利用Sin-QuEChERS Nano净化柱,建立了石斛基质中84种农药残留的检测方法,通过比较几种经典样品前处理方法的净化效果和回收差异,发现Sin-QuEChERS Nano法、M-PFC法、dSPE法和SPE法的平均回收率分别为90.5%、82.8%、71.2%和65.3%。石斛基质经Sin-QuEChERS Nano法及dSPE法净化后的效果较好,但dSPE法的平均回收率远低于Sin-QuEChERS Nano法,而且前处理操作中dSPE法比Sin-QuEChERS Nano法多了一步纯化管净化步骤,单个样品前处理时间需多耗时10 min,不适于批量样品的“萃取净化一体式”检测。Sapozhnikova[38]使用原始QuEChERS方法来检测鱼类中143种不同的农药,方法中用50 mg Z-Sep/10 g鱼代替PSA作为净化吸附剂,阿特拉津-d5和倍硫磷-d6被作为内标。结果表明,LOD为0.5~5.0 μg/kg,回收率为70%~120%,几乎所有分析物通过减少基质效应使共萃取物质显著减少。
QuEChERS方法也已被用于测定生物体液、非食用植物和环境基质(例如,水、土壤或沉积物)中的农药[40-41]。关于沉积物基质中的应用,这种使用构成了一个非常新的方法,因为这个复杂的基质还涉及生物、物理和化学过程。
QuEChERS原始方法在环境基质中的应用已有报道,但在大多数情况下对其进行了优化。Fernandes 等[40]研究了QuEChERS不同版本的应用,基于柠檬酸盐缓冲法测定有机农业和害虫综合治理土壤中的36种杀虫剂。通过调整样本称样量、吸附剂的调整和在提取时水的添加量来提高回收率。此外,在提取步骤中应用超声辅助,也使回收率有了显著提高。这些优化的QuEChERS方法曾多次用于对土壤中农药的测定,在5.00 g土壤中加入3 mL水,再加入10 mL乙腈、6.00 g MgSO4、1.50 g NaCl、1.50 g 三钠和0.75 g二钠,加入盐后,超声提取5 min,然后离心。用150 mg MgSO4、150 mg PSA和50 mg C18进行样品净化,涡旋1 min,离心。最后取500 μL上清液,上GC-MS测定。结果表明,LOD为7.6 μg/kg,回收率为70%~120%。在这种情况下,d-SPE净化效率与一次性移液器提取在相同的过程中进行了比较,这两个过程的结果类似。
关于在生物分析样品中的应用很少,只有少量用于杀虫剂测定的研究[24,41]。王丹等[24]使用2 mL乙酸乙酯,振荡10 min,离心,经过Simple-QuEChERS Nano 净化柱内含5 mg MWCNTs、150 mg PSA、900 mg MgSO4,净化后,从0.5 mL人体血液中提取97种农药。Usui等[41]使用1.0 mL乙腈和0.5 g SampliQ QuEChERS试剂盒(AOAC),其中包含6.0 g MgSO4和1.5 g醋酸钠(NaOAc)。手摇30 s,离心,从0.5 mL人体血液中提取双磺胺及其5种代谢物。d-SPE程序使用含150 mg MgSO4、25 mg PSA和25 mg C18商业试剂盒,结果表明,该方法的LOD为0.46~1.15 μg/L,回收率为87%~112%。
4.2药物分析中的应用
药物在兽医治疗动物过程中为控制疾病和促进牲畜的生长药物被滥用,如果没有得到适当地控制,会对人类健康和环境构成重大风险。为此,许多药理活性物质被认为是污染物,并且其使用已经受到广泛关注与控制,不同的组织为药物的使用建立了最大残留限量(MRL)。例如,欧盟制定了动物源性食品中的药理活性物质中的MRL为0.050~20.000 μg/kg的标准[52]。因此,药物分析也是一个活跃的分析领域,需要那些快速可行的分析方法,尤其是在食品质量控制和安全方面。对于单独确定某些药物家族,例如,磺胺类药物[18,53-57]、喹诺酮类药物[58]、兴奋剂[59-60]、抗生素[61]、抗真菌药物[62-63]、硝基咪唑[64]进行对残留分析QuEChERS方法被证明是可行的,见表2。
QuEChERS方法与HPLC[53,55,57,61,65-66]、UPLC[58-60,62,64]
和LC相结合是最广泛的应用于药物的分离技术,根据需要这些技术已与MS检测器相结合[18,53-67]。李婧妍等[57]利用QuEChERS方法结合高效液相色谱-串联质谱技术同时测定原料乳中β-激动剂、喹诺酮和磺胺类30种兽药残留,样品经酸化乙腈溶液和乙二胺四乙酸-Mcllvaine缓冲液提取,经NaCl和Na2SO4盐析,C18和PSA净化,注入HPLC-MS/MS,该方法回收率为71.1%~94.8%。冯月超等[59] 研究了QuEChERS方法在检测鸡肉、猪肉、牛肉和羊肉中44種兴奋剂和6种孕激素的应用,样品粉碎均质后加入内标,依次加入水和含0.5%乙酸的乙腈溶液振荡提取后,加入氯化钠和无水硫酸镁脱水离心,上清液采用PSA、C18、中性氧化铝和无水硫酸镁分散固相萃取材料进行净化,净化液经氮气吹干,该方法回收率范围为50.3%~119.9%。MartínezVillalba等[67]结合QuEChERS方法对牛奶中的20种苯并咪唑和饲料中的4种球虫抑制剂检测进行了确认,该研究中饲料样品用10 mL乙腈作为提取溶剂,4 g MgSO4盐析,牛奶用10 mL 0.1%NH3-乙腈(V/V)溶液作为提取溶剂,添加1 g NaCl混合物,净化剂均选用MgSO4、PSA和C18。研究表明,该方法回收率为65.0%~95.0%,并为欧盟立法量化各种兽药残留水平提供了依据。
经常分析的样本是动物样本,动物组织中积累这些污染物的风险很大,并且对人类健康造成重大影响,这些样本包括不同的动物组织[10,53-56,58-59,62,65]、乳[10,57,60,67]、沉积物[61]、蛋[18,60]。同时,动物饲料也进行了分析研究,以防止动物通过食物摄取污染物。如表2所示,不同版本的QuEChERS方法通过调整pH来实现目标分析物的有效提取。一些研究根据目标分析物的性质,通过添加酸(例如,甲酸[55-56,62-63]、HOAc[53,65]、乙酸[58-59,66])、碱基(例如NH3[64,67])或添加缓冲盐类(例如,磷酸[61]或EDTA[18,57])。
关于净化步骤,文献中提到C18已被用于去除脂肪、肌肉组织、乳[10,54,56-57,59,64-65]、饲料[67]和蛋[18]中的疏水性化合物。在其他情况下,PSA已在某些鱼肉提取中单独使用[54]。在大多数情况下2种吸附剂都与MgSO4混合使用,当然也有一些不添加MgSO4的研究[56-57,64-66]。同时,商业化的QuEChERS Lipid净化管[60,63]也得到广泛使用。
4.3真菌毒素分析中的应用
真菌毒素是许多物种产生的次级代谢产物,和真菌构成重要的一组污染物,尤其是在食物中,这些化合物会引起不良雌激素、肾毒性、肝毒性、神经毒性或免疫抑制作用甚至致癌[68]。因此,对真菌毒素分析来说,找到有效的样品预处理方法并对其进行有效监控,避免人类健康受到威胁是非常有必要的。
QuEChERS方法是谷类真菌毒素提取最常应用领域的其中一种,研究对象主要针对大米[69-71]、小麦[69,72-73]、玉米[69,72]、大豆[69]、燕麦[69]、小米[72]等。表3显示了一组具有代表性的QuEChERS方法应用,其中样本称样量2~15 g,而且,因为谷物中含水率较低,需要在提取之前加入适当的水[69-70,72-74]。
谷物构成了QuEChERS方法提取真菌毒素的最主要的基质,其他基质中的真菌毒素(例如,乳制品[68,75-76]、花生酱[71]、花生油[71,74]、面制品[71,77-78]、肉制品[79]、蔬菜[80]、水产品[81])也有研究。JIA等[68]对乳制品中58种真菌毒素进行了广泛研究,称取样品(例如,牛奶、牛奶饮料和酸奶)15 g,加入10 mL 1%乙酸-乙腈溶液(16∶84,V∶V),涡旋1 min,再加入6.00 g MgSO4、1.45 g NaOAc,然后,振摇混合物,在4 ℃下离心分离。醋酸盐缓冲液的使用提高了某些对pH依赖性化合物的稳定性和回收率(例如棒曲霉素)。净化过程中将1.2 g MgSO4、108.0 mg PSA和405.0 mg C18添加到8 mL上清提取液中,涡旋并再次在4 ℃下离心,过滤后,在200 μL提取物用甲醇和8 mmol/L甲酸铵缓冲液稀释后,注入UHPLC-ESI Q(四级)-Orbitrap系统,回收率为87%~114%(RSD<6.2%),LOD为0.001 ~ 0.920 μg/kg,该方法与传统方法相比极大地提高了灵敏度和准确性。该研究在食品中霉菌毒素的检测中显示了一种简单、快速筛查分析方法。熊欣等[71]对大米、饼干、曲奇、花生油、花生酱中的7种真菌毒素进行了研究,称取4 g 样品,加入10 mL水,振荡1 min,加入10 mL甲酸-乙腈(10∶90,V∶V),超声10 min,加入4.0 g MgSO4、1.0 g NaCl、1.0 g柠檬酸钠二水合物、0.5 g柠檬酸氢二钠倍半水合物,手摇1 min,4 500 r/min离心10 min,用乙腈定容至10 mL,取8 mL 上清液加入1.20 g MgSO4、0.25 g C18、0.25 mg Al-N、0.40 g PSA,手摇1 min,4 500 r/min离心5 min,取5 mL上清液,氮吹至尽干。加入1 mL 0.1%甲酸-乙腈(1∶1,V∶V)复溶,注入LC-MS/MS系统,回收率为71.5%~119.0%,LOD为0.25~5.00 μg/kg。凌阿茹等[79]对畜肉组织中6种黄曲霉毒素和杂色曲霉素进行了研究,称取2 g 样品(猪肉、鸡肉、猪肝脏),加入20 μL β-葡萄糖苷酶缓冲液和1.6 mL 水,酶解12 h,加入8.4 mL乙腈,涡旋混匀,超声40 min,加入1 g MgSO4、1 g NaCl,最后加入5 mL正己烷脱脂,5 000 r/min离心10 min,取5 mL中层清液,氮吹,加入1 mL 5 mmoL/L 乙酸铵-乙腈(80∶20)溶液复溶后,注入HPLC-MS/MS系统,回收率为77.3%~118.5%,LOD为0.007~0.300 μg/kg,该研究为畜禽产品中黄曲霉毒素和杂色曲霉素检测提供了简单、快速、高灵敏度的分析方法。
其他一些真菌、毒素分析研究,目的是将QuEChERS方法与其他萃取方法进行比较。Koesukwiwat等[70]从大米样品中提取14种霉菌毒素,用UHPLC-MS/MS与使用IAC(免疫亲和层析)的SPE进行比较,获得了相似的提取效率(74%~118%),发现大部分目标分析物缺乏敏感性,LOD高于使用QuEChERS方法。与QuEChERS方法比较,IAC缺点包括方法的复杂性更高、成本较高,并且由于IAC的高特异性,无法同时对多类分析物进行分析。
Rodríguez-Carrasco等[82]对基质固相分散(MSPD)和QuEChERS方法提取来自小麦面包中的8种单端孢霉烯霉菌毒素进行比较,然后进行GC-MS/MS分析。研究发现,QuEChERS方法提取速度更快、更省力,提取效率(在大多数情况下回收率高于80%)比MSPD(回收率为46%~89%)更高,重现性也更好。
关于分离技术的使用,HPLC-MS/MS[75,77,79]、UPLC-MS/MS[68,70,73-74,76,78]、GC-MS/MS[69,82]、LC-MS/MS[71,81]被用于分離分析。在d-SPE程序后使用三甲基氯硅烷(TMCS)、N-三甲基甲硅烷基咪唑(TMSI)进行衍生化,是检测真菌、毒素所必需的,除此之外,其他分析方法,如使用流动注射分析(FIA)、FD或DART(实时直接分析)-Orbitrap-Ms对于少量分析物的效果较好。
5结语
QuEChERS方法解决了现代实验室的需求,如减少溶剂和试剂的使用量、大大降低了分析的时间和成本等,得到广泛普及。QuEChERS方法无疑为食品中农药和药物残留分析提供了最常用的预处理技术,同时,在处理各种其他分析物方面也显示了自身的高效性[31,34],证明自己有能力适应新的挑战。
QuEChERS方法操作容易和高效,既满足了在常规分析中样品处理批次的大幅增加,又保持了良好的提取效率,但该方法仍然依靠人工手动操作,虽然该方法提高了试验过程中自动化水平、满足最小化样本操作和增加了样本处理量,但在试验过程中仍然需要使用振动装置和商业试剂包,仍然无法减少分析操作人员的工作量。
自2003年推出QuEChERS方法,使用QuEChERS方法發表的文章数量非常多,并且还在不断大量增加。在许多研究中,大多数研究者不管检测的分析物或基质类型,而是直接使用已经公布的优化条件。在这种情况下,尤其是当QuEChERS方法应用到除农药以外的分析物或新的基质中时,很难评估QuEChERS方法对于该研究的最终结果是否真的适用,所以在研究过程中应该参考QuEChERS用于农药的分析方法来证明该方法应用于其他分析物中的适用性。
自QuEChERS方法使用以来,新的吸附剂也被不断提出并进行了测试。预计在不久的将来,用来消除基质效应的合适的、新的吸附剂,保持分析物的高回收率,操作程序自动化方面的尝试是接下来QuEChERS方法研究的重点领域。
参考文献
[1] ANASTASSIADES M,LEHOTAY S J,TAJNBAHER D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solidphase extraction” for the determination of pesticide residues in produce[J].J AOAC Int,2003,86(2):412-431.
[2] BRUZZONITI M C,CHECCHINI L,DE CARLO R M,et al.QuEChERS sample preparation for the determination of pesticides and other organic residues in environmental matrices:A critical review[J].Anal Bioanal Chem,2014,406(17):4089-4116.
[3] MARTNEZDOMNGUEZ G,PLAZABOLAOS P,ROMEROGONZLEZ R,et al.Analytical approaches for the determination of pesticide residues in nutraceutical products and related matrices by chromatographic techniques coupled to mass spectrometry[J].Talanta,2014,118:277-291.
[4] LEHOTAY S J,DE KOK A,HIEMSTRA M,et al.Validation of a fast and easy method for the determination of residues from 229 pesticides in fruits and vegetables using gas and liquid chromatography and mass spectrometric detection[J].J AOAC Int,2005,88(2):595-614.
[5] CEN.Food of plant origindetermination of pesticide residues using GCMS and/or LCMS/MS following acetonitrile extraction/partitioning and cleanup by dispersive SPEQuEChERS method:BS EN 15662:2008[S].European Committee for Standardization(CEN),2008.
[6] LEHOTAY S J.Determination of pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate:Collaborative study[J].J AOAC Int,2007,90(2):485-520.
[7] MASTOVSKA K,DORWEILER K J,LEHOTAY S J,et al.Pesticide multiresidue analysis in cereal grains using modified QuEChERS method combined with automated direct sample introduction GCTOFMS and UPLCMS/MS techniques[J].Agric Food Chem,2010,58(10):5959-5972.
[8] GONZLEZCURBELO M ,HERRERAHERRERA A V,RAVELOPREZ L M,et al.Samplepreparation methods for pesticideresidue analysis in cereals and derivatives[J].TrAC Trends Anal Chem,2012,38:32-51.
[9] WILKOWSKA A,BIZIUK M.Determination of pesticide residues in food matrices using the QuEChERS methodology[J].Food Chem,2011,125(3):803-812.
[10] KINSELLA B,LEHOTAY S J,MASTOVSKA K,et al.Danaher,New method for the analysis of flukicide and other anthelmintic residues in bovine milk and liver using liquid chromatographytandem mass spectrometry[J].Anal Chim Acta,2009,637(1/2):196-207.
[11] GONZLEZCURBELO M ,HERNNDEZBORGES J,RAVELOPREZ L M,et al.Insecticides extraction from banana leaves using a modified QuEChERS method[J].Food Chem,2011,125(3):1083-1090.
[12] GONZLEZCURBELO M ,LEHOTAY S J,HERNNDEZBORGES J,et al.Use of ammonium formate in QuEChERS for highthroughput analysis of pesticides in food by fast,lowpressure gas chromatography and liquid chromatography tandem mass spectrometry[J].J Chromatogr A,2014,1358:75-84.
[13] HAN L J,SAPOZHNIKOVA Y,LEHOTAY S J.Streamlined sample cleanup using combined dispersive solidphase extraction and invial filtration for analysis of pesticides and environmental pollutants in shrimp[J].Anal Chim Acta,2014,827:40-46.
[14] NGUYEN T D,LEE B S,LEE B R,et al.A multiresidue method for the determination of 109 pesticides in rice using the Quick Easy Cheap Effective Rugged and Safe(QuEChERS)sample preparation method and gas chromatography/mass spectrometry with temperature control and vacuum concentration[J].Rapid Commun Mass Spectrom,2007,21(18):3115-3122.
[15] PAY P,ANASTASSIADES M,MACK D,et al.Analysis of pesticide residues using the Quick Easy Cheap Effective Rugged and Safe(QuEChERS)pesticide multiresidue method in combination with gas and liquid chromatography and tandem mass spectrometric detection[J].Anal Bioanal Chem,2007,389(6):1697-1714.
[16] GEISASTEGGIANTE L,LEHOTAY S J,HEINZEN H.Effects of temperature and purity of magnesium sulfate during extraction of pesticide residues using the QuEChERS method[J].J AOAC Int,2012,95(5):1311-1318.
[17] WALORCZYK S.Development of a multiresidue method for the determination of pesticides in cereals and dry animal feed using gas chromatographytandem quadrupole mass spectrometry:II.Improvement and extension to new analytes[J].J Chromatogr A,2008,1208(1/2):202-214.
[18] 方從容,高洁,王雨昕,等.QuEChERS-超高效液相色谱-串联质谱法测定鸡蛋中125种兽药残留[J].色谱,2018,36(11):1119-1131.
[19] NORLI H R,CHRISTIANSEN A,DERIBE E.Application of QuEChERS method for extraction of selected persisten organic pollutants in fish tissue and analysis by gas chromatography mass spectrometry[J].J Chromatogr A,2011,1218(41):7234-7241.
[20] 毕军,任君,赵云峰,等.QuEChERS-冷冻诱导液液萃取/液相色谱-高分辨质谱法测定蔬菜水果中77种农药残留[J].分析测试学报,2021,40(9):1318-1327.
[21] 王连珠,李晓莲,方恩华,等.QuEChERS-液相色谱-串联质谱法测定棕榈原油中敌草快等6种农药残留[J].色谱,2016,34(7):686-691.
[22] WALORCZYK S,DRODYN'SKI D,KIERZEK R.Determination of pesticide residues in samples of green minor crops by gas chromatography and ultra performance liquid chromatography coupled to tandem quadrupole mass spectrometry[J].Talanta,2015,132:197-204.
[23] 许芮菡,谢倩文,李旭军,等.基于多壁碳纳米管改进QuEChERS法结合气相色谱-串联质谱检测茶叶中10种拟除虫菊酯类农药残留[J].色谱,2022,40(5):469-476.
[24] 王丹,董林沛,任昕昕,等.Simple-QuEChERS Nano结合GC-MS/MS同时检测全血中的97种农药[J].分析测试学报,2021,40(3):347-355.
[25] 李浩林,李桐桐,董玉英,等.優化的QuEChERS-超高效液相色谱-串联质谱法测定韭菜中31种农药残留[J].农药学学报,2021,23(3):603-606.
[26] 赵暮雨,韩芳,孙锦文,等.多壁碳纳米管作为吸附剂的QuEChERS-气相色谱-四极杆飞行时间质谱快速筛查淡水产品中145种农药残留[J].分析测试学报,2016,35(12):1513-1520.
[27] 张权,毕珊,吴玉田,等.Sin-QuEChERS Nano净化柱结合气相色谱-串联质谱法快速筛查石斛中84种农药残留[J].色谱,2022,40(6):565-575.
[28] 梁秀美,张维一,张微,等.QuEChERS-HPLC-MS/MS法同时测定水果中38 种农药的残留量[J].食品科学,2020,41(8):288-296.
[29] 梁秀美,张井,林定鹏,等.基于改良QuEChERS-气相色谱-串联质谱法测定禽蛋中53 种农药残留[J].农药学学报,2021,23(5):973-985.
[30] 刘俊,杨飞,粟有志,等.QuEChERS-气相色谱-串联质谱法测定葡萄干中的80种农药残留[J].分析科学学报,2020,36(1):88-94.
[31] 万译文,黄向荣,陈湘艺,等.QuEChERS/高效液相色谱法同时测定水产品中16种多环芳烃[J].湖南师范大学自然科学学报,2014,37(1):42-47.
[32] 陈晓鹏,顾采琴,綦艳,等.QuEChERS-UPLC-MS/MS同时测定牛奶和奶粉中42 种类固醇激素[J].食品科学,2018,39(8):314-321.
[33] 吕爱娟,沈小明,时磊,等.优化QuEChERS结合HPLC测定沉积物中14种多环芳烃[J].中国环境监测,2017,33(1):115-120.
[34] 蒋康丽,扈斌,吴兴强,等.自动QuEChERS结合气相色谱-串联质谱法测定花生中297种农药残留[J].分析测试学报,2021,40(9):1257-1270.
[35] 王帅,赵海涛,闫艳华,等.自动QuEChERS前处理方法结合HPLC-MS/MS测定生牛乳中112种农药残留[J].中国乳品工业,2021,49(6):51-55,59.
[36] 宁霄,金绍明,高文超,等.QuEChERS-超高效液相色谱-串联质谱法测定动物源性食品中氟虫腈及其代谢物残留[J].分析化学,2018,46(8):1297-1305.
[37] 王莎莎,沈习习,李曼曼,等.QuEChERS-气相色谱-三重四级杆串联质谱法高通量检测生鲜肉中有机磷农药残留[J].食品与发酵工业,2022,48(5):262-271.
[38] SAPOZHNIKOVA Y.Evaluation of lowpressure gas chromatographytandem mass spectrometry method for the analysis of >140 pesticides in fish[J].J Agric Food Chem,2014,62(17):3684-3689.
[39] 徐芷怡,陈梦婷,侯锡爱,等.QuEChERS-高效液相色谱-串联质谱法同时测定芝麻油中7种农药残留[J].分析化学,2020,48(7):928-936.
[40] FERNANDES V C,DOMINGUES V F,MATEUS N,et al.Multiresidue pesticides analysis in soils using modified QuEChERS with disposable pipette extraction and dispersive solidphase extraction[J].J Sep Sci,2013,36(2):376-382.
[41] USUI K,HAYASHIZAKI Y,MINAGAWA T,et al.Rapid determination of disulfoton and its oxidative metabolites in human whole blood and urine using QuEChERS extraction and liquid chromatographytandem mass spectrometry[J].Leg Med,2012,14(6):309-316.
[42] 王建华,葛敏敏,张慧丽,等.QuEChERS法-液相色谱-串联质谱法测定蔬菜中7种农药及其代谢物的残留量[J].食品科学,2017,38(20):235-241.
[43] 门雪,吴兴强,仝凯旋,等.改进的QuEChERS法结合液相色谱-高分辨质谱筛查热带水果中33种新烟碱类杀虫剂及杀菌剂[J].分析测试学报,2022,41(6):820-826.
[44] 杨坤,张建炀,周斌.QuEChERS前处理结合超高液相色谱-串联质谱法测定高硫蔬菜中16种氨基甲酸酯类农药残留[J].理化检验(化学分册),2021,57(1):45-51.
[45] 邓慧芬,张建莹,黄科,等.QuEChERS-液相色谱-串联质谱法测定蔬菜中105种农药残留[J].色谱,2018,36(12):1211-1222.
[46] 连玉晶,周一冉,孙欣,等.基于胺基功能化磁性纳米粒子改进QuEChERS方法结合GC-MS/MS检测果蔬中7种农药残留[J].食品科学,2021,42(4):297-304.
[47] 李建勋,范蓓,周杰,等.QuEChERS-超高效液相色谱-飛行时间质谱法快速筛查蔬菜中154种农药残留[J].食品与发酵工业,2019,45(19):239-250.
[48] 吕青骎,王玮,梁丽姣,等.QuEChERS结合超高效液相色谱质谱法测定禽蛋及其制品中42种农药及其代谢物[J].食品与发酵工业,2020,46(5):255-262.
[49] 韩世明,李志,王月霞,等.基于QuEChERS-GC-MS/MS法同时测定猕猴桃中15种有机磷农药残留[J].中国酿造,2022,41(5):223-228.
[50] 谭建林,彭珍华,赵秀琳,等.QuEChERS-UPLC-MS/MS法测定鸡蛋中19种氨基甲酸酯类农药及其代谢物残留量[J].食品工业科技,2022,43(1):320-325.
[51] 龚蕾,黄徽,韩智,等.QuEChERS-UPLC-MS/MS测定果蔬中18 种琥珀酸脱氢酶抑制剂类杀菌剂[J].食品科学,2021,42(18):261-268.
[52] Official Journal of the European Union.Commission Regulation(EU)No 37/2010 of 22 December 2009 on pharmacologically active substances and their classification regarding maximum residue limits in food stuffs of animal origin[R].Brussels Official Journal of the European Union,2009.
[53] ABDALLAH H,ARNAUDGUILHEM C,JABER F,et al.Multiresidue analysis of 22 sulfonamides and their metabolites in animal tissues using quick,easy,cheap,effective,rugged,and safe extraction and high resolution mass spectrometry(hybrid linear ion trapOrbitrap)[J].J Chromatogr A,2014,1355:61-72.
[54] 李朔,张璨,马玲,等.QuEChERS结合超高效液相色谱-串联质谱法同步测定鱼肉制品中24种磺胺类抗生素[J].食品工业科技,2022,43(9):301-308.
[55] 黄泽玮,闵宇航,杜钢,等.QuEChERS EMR-Lipid技术结合LC/MS/MS快速筛查与确证猪肉中55种兽药残留[J].食品工业科技,2019,40(11):270-276,283.
[56] 李红丽,吴晓琴,赵博,等.QuEChERS-UPLC-MS/MS同时测定动物性食品中24种残留兽药的基质效应[J].食品与发酵工业,2021,47(20):253-259.
[57] 李婧妍,韩波,安乐,等.QuEChERS前处理结合HPLC-MS/MS同时测定原料乳中30种兽药残留[J].食品研究与开发,2022,43(9):176-185.
[58] 杨贤丰,王波,张欢,等.Sin-QuEChERS净化-超高效液相色谱-串联质谱法测定鱼肉中8种喹诺酮类药物残留量[J].理化检验-化学分册,2022,58(3):304-311.
[59] 冯月超,王建凤,侯帆,等.QuEChERS结合超高效液相色谱-串联质谱法同时测定畜禽肉中44种食源性兴奋剂和6种孕激素[J].色谱,2022,40(5):409-422.
[60] 刘学芝,赵英莲,马跃,等.超高效液相色谱-串联质谱法测定猪肉、鸡蛋、牛奶中9种食源性兴奋剂类药物残留[J].色谱,2022,40(2):148-155.
[61] 钱卓真,汤水粉,梁焱,等.QuEChERS-高效液相色谱-串联质谱法同时测定水产养殖环境沉积物中磺胺类、喹诺酮类、大环内酯类抗生素[J].质谱学报,2019,40(4):356-368.
[62] 黄永桥,宋光林,毛敏霞,等.QuEChERS结合UPLC-MS/MS法测定畜肉中8种抗真菌药物残留[J].食品科学,2022,43(12):334-340.
[63] 张凯,秦宇,卞华,等.QuEChERS-超高效液相色谱-串联质谱法检测羊肉中8种抗真菌药[J].色谱,2018,36(10):999-1004.
[64] 杨霄,万译文,黄华伟,等.分散固相萃取-超高效液相色谱-串联质谱法测定水产品中5种硝基咪唑类和6种苯二氮卓类药物[J].色谱,2022,40(7):625-633.
[65] KANG J,FAN C L,CHANG Q Y,et al.Simultaneous determination of multiclass veterinary drug residues in different muscle tissues by modified QuEChERS combined with HPLCMS/MS[J].Anal Methods,2014,6(16):6285-6293.
[66] 金慧,赵城,郑光明,等.QuEChERS技术结合高效液相色谱-串联质谱法测定鱼肉中6种替考拉宁残留量[J].分析测试学报,2022,41(6):835-842.
[67] MARTNEZVILLALBA A,VACLAVIK L,MOYANO E,et al.Direct analysis in real time highresolution mass spectrometry for highthroughput analysis of antiparasitic veterinary drugs in feed and food[J].Rapid Commun Mass Spectrom,2013,27(3):467-475.
[68] JIA W,CHU X G,LING Y,et al.Multimycotoxin analysis in dairy products by liquid chromatography coupled to quadrupole orbitrap mass spectrometry[J].J Chromatogr A,2014,1345:107-114.
[69] RODRGUEZCARRASCO Y,MOLT J C,BERRADA H,et al.A survey of trichothecenes,zearalenone and patulin in milled grainbased products using GC-MS/MS[J].Food Chem,2014,146:212-219.
[70] KOESUKWIWAT U,SANGUANKAEW K,LEEPIPATPIBOON N.Evaluation of a modified QuEChERS method for analysis of mycotoxins in rice[J].Food Chem,2014,153:44-51.
[71] 熊欣,劉青,张广文,等.QuEChERS/LC-MS/MS法测定食品中7种真菌毒素[J].分析测试学报,2018,37(9):1008-1013.
[72] VACLAVIK L,ZACHAIRASOVA M,HRBEK V,et al.Analysis of multiple mycotoxins in cereals under ambient conditions using direct analysis in real time(DART)ionization coupled to high resolution mass spectrometry[J].Talanta,2010,82(5):1950-1957.
[73] 齐春艳,许秀丽,国伟,等.QuEChERS结合UPLC-Q/Orbitrap HRMS法测定小麦粉中9种真菌毒素[J].食品科学,2022,43(4):315-320.
[74] LIU Y,HAN S,LU M L,et al.Modified QuEChERS method combined with ultrahigh performance liquid chromatography tandem mass spectrometry for the simultaneous determination of 26 mycotoxins in sesame butter[J].J Chromatogr B,2014,970:68-76.
[75] 谢瑜杰,陈辉,彭涛,等.QuEChERS-高效液相色谱-串联质谱测定牛奶中6 种玉米赤霉烯酮类毒素[J].食品科学,2019,40(10):304-310.
[76] ZHAO Y,YUAN Y C,BAI X L,et al.Multimycotoxins analysis in liquid milk by UHPLCQExactive HRMS after magnetic solidphase extraction based on PEGylated multiwalled carbon nanotubes[J].Food Chem,2020,305:1-8.
[77] 徐子婷,郝莉花,马静,等.QuEChERS-SPE-超高效液相色谱-串联质谱法测定调味面制品中的12种真菌毒素[J].食品工业科技,2022,43(6):311-319.
[78] 梁明,陈杰锋,冼燕萍,等.QuEChERS-UPLC-MS/MS测定焙烤食品中4种链格孢菌毒素[J].现代食品科技,2019,35(6):280-286,313.
[79] 凌阿茹,郭文博,杨俊花,等.QuEChERS-超高效液相色谱-串联质谱法同时测定畜禽组织中6种黄曲霉毒素和杂色曲霉素[J].色谱,2018,36(5):439-445.
[80] 周贻兵,李磊,吴玉田,等.QuEChERS净化-超高效液相色谱-串联质谱法测定番茄中5种链格孢霉毒素的含量[J].理化检验-化学分册,2019,55(9):1036-1041.
[81] 杨姝丽,余焘,吴明媛,等.QuEChERS-液相色谱-高分辨质谱法测定贝类中6种亲脂性贝类毒素[J].理化检验-化学分册,2020,56(5):596-600.
[82] RODRGUEZCARRASCO Y,FONT G,MOLT J C,et al.Quantitative determination of trichothecenes in breadsticks by gas chromatographytriple quadrupole tandem mass spectrometry[J].Food Addit Contam Part A Chem Anal Control Expo Risk Assess,2014,31(8):1422-1430.

